英文名称 :glucocorticoid-induced osteoporosis
生理情况下,由肾上腺皮质分泌的皮质醇(cortisol)是成骨性谱系细胞和破骨性谱系细胞分化和功能调节的必需激素。但是,超生理量的皮质醇及其类似物则对骨组织的发育、生长与代谢有明显不利影响。1932年,Cushing等在报道Cushing综合征时就对糖皮质激素(glucocorticoids,GC)所致的骨质疏松(glucocorticoid-induced osteoporosis,GIOP)有了详细描述。GIOP是临床上常见的一种继发性骨质疏松,随着糖皮质激素应用的日益广泛,GIOP越来越常见。近年来,人们在努力开发新的糖皮质激素类药物,其目的是进一步减少蛋白分解和骨质疏松的不良反应。泼尼松、泼尼松龙、甲泼尼龙和地塞米松仍是广泛应用的主要口服糖皮质激素制剂,必须加强这些药物所致GIOP的防治。
GIOP在药物导致的骨质疏松中最为常见。糖皮质激素被广泛用于慢性非感染性炎性疾病(包括结缔组织病)、过敏性疾病及器官移植,骨质疏松为其最严重的副作用之一,即使是生理剂量的糖皮质激素也可引起骨丢失,绝经后妇女及50岁以上男性为高危人群。其中以关节疾病的患者接受长期、持续糖皮质激素治疗的可能性最高。多项纵向研究显示,糖皮质激素在治疗数周后,其骨量开始流失,最初数月内的骨量丢失迅速,可达5%~15%/年,而长期接受糖皮质激素治疗(1年以上)的患者骨质疏松发生率高达30%~50%。
糖皮质激素通过多个途径引起骨丢失(表1和图1):①对抗Wnt/β-catenin信号,激活糖原合酶激酶β3(GSK-β3),抑制成骨细胞的分化,抑制成骨细胞增殖,同时促进成骨细胞凋亡;②活化CCAAT扩增结合蛋白家族核因子,激活过氧化物酶体活性增殖γ2(PPARγ2),减少骨髓间质细胞向成骨细胞转化,诱导骨髓间质细胞向脂肪细胞转化;③促进破骨细胞的聚集和分化,破骨细胞凋亡减少,并增强其骨吸收活性;④降低肠钙吸收,尿钙排泄增加,血清甲状旁腺激素升高,尿钙排泄增加,导致骨量丢失;⑤骨保护素(OPG)下降,RANKL活性增加;⑥抑制胰岛素样生长因子生成和成熟成骨细胞功能;⑦降低垂体促性腺激素水平,抑制肾上腺雄激素的合成。
表1 糖皮质激素所致的骨质疏松发病机制

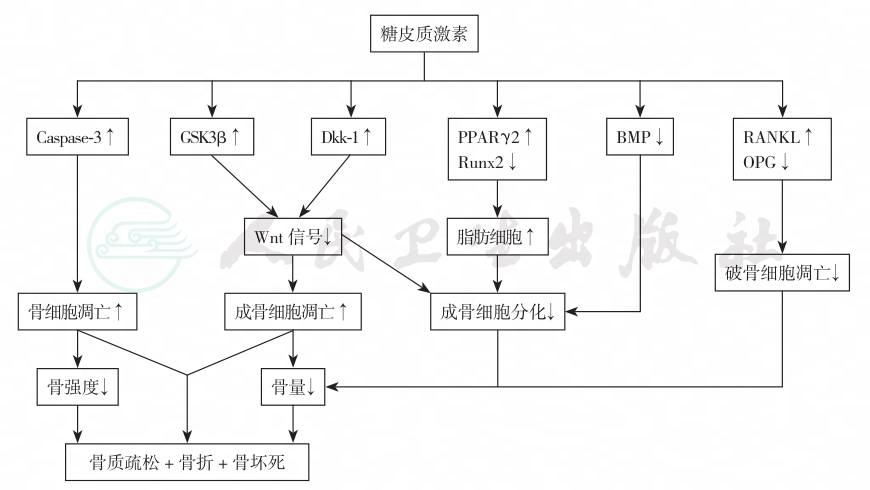
图1 糖皮质激素所致的骨质疏松发病机制
注:Caspase-3:半胱天冬酶-3;BMP:bone morphogenetic protein,骨形态生成蛋白;Dkk-1:dickkopf-1;GSK3β:glycogen synthase kinase 3β,糖原合酶激酶3β;OPG:osteoprotegerin,护骨素;PPAR:peroxisome proliferator-activated receptor,过氧化物酶体活化受体;RANKL:receptor activator for nuclear factor-κB ligand,核因子-κB 配体活化素受体;Runx2:runtrelated protein 2,runt 相关蛋白2
(一)低骨量/骨质疏松是Cushing综合征的重要并发症
高皮质醇血症的病因有下列几种可能:①Cushing综合征,如垂体ACTH瘤、垂体ACTH细胞癌、垂体ACTH细胞增生或肾上腺皮质肿瘤(分泌皮质醇的腺瘤或腺癌)、增生及原发性色素性结节性肾上腺结节等;②异源性CRH/ACTH分泌综合征;③糖皮质激素过敏感综合征,主要见于获得性免疫缺陷综合征(AIDS)患者。
糖皮质激素引起的BMD降低和骨质量下降呈糖皮质激素日剂量依赖性和糖皮质激素总剂量依赖性。糖皮质激素的用量在相当于泼尼松2.5~5.0mg/d即能增加骨折风险,而骨质量下降是骨折风险增加更重要的原因。
(二)糖皮质激素引起骨吸收增强伴骨形成下降
高糖皮质激素血症引起骨丢失(糖皮质激素引起的骨质疏松,GIOP),其发病机制十分复杂,涉及许多激素、细胞因子和炎症因子的表达,如护骨素(osteoprotegerin,OPG)、RANKL(receptor activator for nuclear factor-κB ligand)、Runx2(runtrelated protein 2)、BMP、Dkk-1(dickkopf-1)、GSK3β(glycogen synthase kinase 3β)、PPAR(peroxisome proliferator-activated receptor)等。此外,糖皮质激素激活骨硬化素(osteosclerosis),使成骨细胞失活,从而抑制骨形成,而PTH和物理刺激(如负重)抑制骨硬化素表达,故可促进骨形成。
长期使用糖皮质激素后,松质骨出现过多脂肪细胞,成骨细胞缺乏伴骨吸收增强,骨小梁退化断裂;孔腔扩大、增多而缺乏破骨细胞,骨形成过程延长或缺陷。股骨头骨坏死区可见骨细胞和骨膜细胞大量凋亡。
GIOP的临床特征包括:①糖皮质激素制剂有一定差别;②接受治疗人群的敏感性有明显差别;③性别和年龄有明显差别;④使用途径和方法有一定差别;⑤剂量和疗程与骨丢失程度相关;⑥大剂量应用容易合并骨坏死。但是,从临床防治的角度看,做到以下几点可显著降低GIOP风险:①尽量避免滥用糖皮质激素;②必须使用时选择最佳剂量、用法和疗程;③尽可能采用局部制剂;④隔日疗法保存下丘脑-垂体-肾上腺轴反馈功能;⑤病情控制即停用或使用最低有效剂量;⑥定期测量BMD,计划使用糖皮质激素时即采取措施预防;⑦具有循证依据的二膦酸盐为首选药物,普通VD有效,而活性VD对GIOP的治疗作用更强。
临床上常用的糖皮质激素类药物主要是泼尼松(强的松)、泼尼松龙(强的松龙)、甲泼尼龙和地塞米松。糖皮质激素通过其受体(GR、核受体和膜受体)而发挥作用。在体外实验中,糖皮质激素也可与盐皮质激素受体结合。成骨细胞可同时表达盐皮质激素受体(MR)、糖皮质激素受体GRα和GRαβ;破骨细胞可同时表达MR、GRβ和GRαβ;骨细胞可同时表达MR、GRα和GRαβ,但表达的量明显低于成骨细胞;肥厚性软骨细胞、增殖型软骨细胞和成熟软骨细胞也表达GRα、GRαβ和MR。这说明,骨组织细胞的功能均受糖皮质激素和盐皮质激素的双重影响。在糖皮质激素的作用下,骨重建每经历一次循环后,骨小梁的形成都被抑制而使骨小梁逐步变薄。过量的糖皮质激素抑制成骨细胞和破骨细胞蛋白、RNA和DNA合成。骨组织的分解代谢增强而合成代谢下降,导致骨量丢失和骨质疏松。
骨组织c-fos基因的启动子中含有糖皮质激素反应元件(GRE),糖皮质激素诱导成骨细胞c-fos、c-myc、骨涎蛋白(BSP)和骨连蛋白(osteonectin)基因表达。Id为细胞分化的抑制因子,地塞米松可使MC3T3-E1细胞的Id表达上调。糖皮质激素亦使成纤维细胞和成骨细胞Ⅰ型胶原α链、骨钙素、纤连蛋白、胶原酶、IGF-1、IGFBP-3、IGFBP-4、IGFBP-5和整合素β1、α2与α4表达下调,其最终后果是抑制成骨细胞的活性,促进破骨细胞生成和功能,故GIOP是一种以细胞因子表达紊乱为特征的代谢性骨病。
糖皮质激素通过促进破骨细胞介导的骨吸收及抑制成骨细胞介导的骨形成而引起骨质疏松,其作用机制包括:①影响钙稳态:糖皮质激素抑制小肠对钙、磷的吸收,增加尿钙排泄,引起继发性甲状旁腺功能亢进症,持续的甲状旁腺素(PTH)水平增高可促进骨吸收;②对性激素的作用:糖皮质激素可降低内源性垂体促性腺激素水平并抑制肾上腺雄激素合成,LH降低引起雌激素及睾酮合成减少;③抑制骨形成:长期应用糖皮质激素可抑制成骨细胞增殖,基质胶原和非胶原蛋白质的合成减少;④其他作用:糖皮质激素引起的肌病及肌力下降也可导致骨丢失。此外,患者本身的炎性疾病及合并用药(如环孢素)可导致骨质疏松。
1.骨形成和成骨细胞分化
在体内,糖皮质激素抑制骨形成;但在体外,糖皮质激素具有促进骨形成和成骨细胞分化作用,糖皮质激素可促进成骨细胞分化和矿化结节形成,但必须同时存在维生素C和β-甘油磷酸。低浓度糖皮质激素时促进矿化结节形成,但高浓度时无此作用。一般认为,生理浓度的糖皮质激素发挥的是一种允许作用(permissive role),它能促进骨生成,促进骨髓干细胞分化为成骨细胞,并且促进成骨细胞表型分子的表达,同时抑制单核细胞转化为破骨细胞。糖皮质激素亦促进骨髓基质细胞表达ALP、骨钙素、Ⅰ型胶原、骨桥素和骨涎蛋白。糖皮质激素对基质细胞上述作用的机制与BMP表达有关,BMP-2、BMP-4和BMP-6和糖皮质激素有协同作用。
过量糖皮质激素通过抑制成骨细胞的作用而诱发骨质疏松:①成骨细胞的生成减少,并通过MKP-1抑制成骨细胞增殖;②抑制成骨细胞前身细胞的分化和成熟成骨细胞,促进成骨细胞和骨细胞凋亡;③抑制Ⅰ型胶原合成;④血清骨钙素明显下降,昼夜节律性消失。
2.骨吸收和破骨细胞功能
药理浓度的糖皮质激素促进破骨细胞生成和RANKL表达,抑制OPG表达,RANKL/OPG比值升高,血清OPG明显降低,故破骨细胞的骨吸收功能增强。糖皮质激素抑制成骨细胞IGF-1表达。应用糖皮质激素后,由于骨吸收增加,迅速出现骨量丢失(骨量丢失的急性相),在松质骨中的破骨细胞数目增多,寿命延长。但在体外实验中,地塞米松使破骨细胞前身细胞增殖和分化受抑,故在一般情况下,GIOP的破骨细胞活性不高。
3.糖皮质激素代谢
糖皮质激素受体数目与细胞中的11β-HSD2表达水平直接相关。因此,11β-HSD1和11β-HSD2调节了成骨细胞对糖皮质激素的敏感性。而GH、IGF-1、TNF-α等可抑制11β-HSD1活性,增强了骨组织对糖皮质激素的敏感性。
靶细胞的糖皮质激素由两种酶催化其代谢。在2型11β-羟甾体脱氢酶(11β-HSD2)的催化下,糖皮质激素转化为无生物活性的糖皮质激素代谢产物(单向催化);1型11β-HSD(11β-HSD1)为一种双向催化酶,可使地塞米松与11-脱氢地塞米松之间的反应双向进行,而两种形式的地塞米松均有生物活性。11β-HSD1具有氧化还原酶特点,因此在一定条件下,使无活性的糖皮质激素重新获得生物活性。11β-HSD2主要在肾脏和胎盘中表达,使盐皮质激素受体不被糖皮质激素激活。在组织中,皮质醇/促皮质素(cortisone)通过上述的两种11β-HSD的催化作用,进行着循环性的双向反应。由于GH和IGF-1对11β-HSD1表达有抑制作用,当GH和(或)IGF-1缺乏(如GIOP)时,肾、肝、脂肪细胞及骨骼中的内源性皮质醇生成增多。
4.维生素D代谢
长期使用糖皮质激素后,24-羟化酶表达上调,同时1α-羟化酶表达下调,血1,25(OH)2D减低,这可能是患者肠钙吸收减低,尿钙排出增加的重要原因。
5.骨坏死
糖皮质激素引起的骨坏死表现为无血管性骨坏死或无菌性骨坏死,为长期应用糖皮质激素或多次使用特大剂量的糖皮质激素的重要并发症之一,占全部骨坏死病例的16%~34%;股骨头、肱骨头和肱骨远端为好发部位,但也可见于四肢的其他长骨。骨坏死发生率和严重程度与糖皮质激素的疗效和剂量有关,但短期应用或关节内应用也可发生。骨坏死的发生机制未明,有如下几种可能:①糖皮质激素使骨骺变性,骨疲劳损伤致骨小梁微破裂(microcracks);②缺血性坏死可能与脂肪栓栓塞血管有关;③骨内脂肪堆积,骨内压升高(Cushing综合征的表现之一),血管床损伤,血流减少;④股骨颈的成骨细胞和骨细胞凋亡增加。
在动物实验中,GIOP家兔的骨小梁骨损害严重,在激光显微镜下可见新生的编织骨吸附四环素荧光。新生的编织骨深入骨小梁内部。关节骨膜下的骨小梁基质明显受损(与成骨细胞和骨细胞凋亡有关),护骨素/破骨细胞形成抑制因子(OPG/OCIF)的表达明显降低。
(三)糖皮质激素间接导致骨丢失
1.GH
泼尼松可抑制垂体GH分泌。用生物分析测定IGF-1的活性发现,IGF-1的促细胞生长发育作用下降,可能是因为长期应用糖皮质激素后,血清中出现了IGF-1的抑制物,这些抑制物很可能就是IGFBPs(如IGFBP-1)。
2.LH/FSH
在糖皮质激素的作用下,垂体分泌的LH和FSH减少,分泌反应迟钝。GnRH细胞的糖皮质激素受体与地塞米松结合,抑制其合成和分泌。此外,糖皮质激素对卵巢、睾丸和肾上腺的性腺甾体类激素合成也有抑制作用,因此长期应用糖皮质激素者(女性)的血清雌二醇、雌酮、DHEA、雄烯二酮和孕酮均下降(男性患者则有DHEA和睾酮下降),腰椎BMD与血清雌二醇呈正相关,同时肾上腺皮质的雄激素合成被抑制,血清DHEAS和雄烯二酮明显下降。
3.PTH和维生素D
长期应用糖皮质激素治疗的患者胃肠钙的吸收障碍,出现高钙血症和高尿钙症,血钙、尿钙与血1,25-(OH)2D呈正相关;肾小管磷重吸收率下降,负钙平衡及继发性甲旁亢。糖皮质激素直接抑制Na+依赖性磷的重吸收。在糖皮质激素的作用下,成骨细胞对PTH的敏感性增高。
4.其他因素
糖皮质激素增加尿钙排出,抑制肠道吸收,增加蛋白质分解,严重时引起肌肉消耗和糖皮质激素所致的肌病(glucocorticoid-induced myopathy),这些因素均可引起骨盐丢失和骨质疏松。
到目前为止,GIOP的病因与发病机制可总结为如下6点:①直接损害成骨细胞、骨细胞和破骨细胞功能,骨形成减少,骨吸收增多;但与一般骨质疏松不同的是GIOP以骨形成缺陷为主;②骨重建功能减退,骨微损伤后修复能力下降,骨脆性增加,易发生骨折和骨坏死;③PTH分泌过多,引起继发性甲旁亢;④糖皮质激素直接或通过间接途径(如非昼夜节律性作用)拮抗性腺功能,抑制性腺激素、GH和IGF-1的骨形成作用;⑤糖皮质激素引起肌肉萎缩和肌无力,骨骼的应力负荷降低;⑥肠吸收和肾小管重吸收钙减少,负钙平衡促进继发性甲旁亢的进一步发展。
(一)一般治疗与基础治疗与PMOP相同
1.一般治疗
主要包括补充适量的营养,食物中要富含蛋白质、VD和钙盐、热量的摄入以维持患者的标准体重为原则。限制食盐摄入,补充足够钾盐。如需要使用利尿剂,最好选用噻嗪类制剂(减少尿钙排泄)。保证营养和足够的饮食钙摄入,适当的负重体育活动,戒烟,避免酗酒。要鼓励患者多做负重活动,防止肌萎缩。必要时可酌情使用促进蛋白质合成类制剂。
2.基础药物治疗
钙剂加VD制剂对于长期应用相当于泼尼松15mg/d以下剂量的糖皮质激素患者可以保持骨量。治疗过程中需监测血钙、尿钙水平,调整剂量。补充钙剂和VD的主要理由是:①糖皮质激素抑制肠钙吸收和肾小管钙的重吸收,患者呈相对钙缺乏状况;②补充钙剂可抑制PTH分泌,拮抗糖皮质激素所致的继发性甲旁亢;③抑制骨的代谢转换率。VD的补充依具体情况而定,原则是使血清25-(OH)D维持在正常水平,一般补充600~800U/d。如用量大于1000U/d,必须定期监测血清25-(OH)D水平。钙三醇的日用量为0.25~0.5μg。VD和钙剂补充仅作为基础治疗或作为轻型病例的治疗,对长期大剂量应用糖皮质激素者(如心脏移植后者)的防治作用较弱,不能完全防止GIOP的发生。
(二)特殊药物治疗
多数主张在一般治疗的基础上首选二膦酸盐,而活性VD可作为二线药物或辅助药物,其他药物对GIOP的疗效仍有待进一步研究和证实。
1.骨形成促进剂
甲状旁腺素氨基端片段(PTH1-34)可刺激成骨,降低骨折风险。由于老年患者的骨代谢转换率降低,骨形成促进剂的应用有其合理性。但是,如果患者的骨代谢转换率正常或升高,应该更注重抗骨吸收药物的应用。目前有关抗骨吸收与促进骨形成药物的联合应用研究较少,疗效仍不明确。必要时,二膦酸盐亦可与雌激素、降钙素等联合应用,可能取得更好疗效。
2.性激素补充治疗
长期接受糖皮质激素治疗的患者应评价性腺功能。有证据表明,对于长期服用低、中等剂量糖皮质激素的绝经后妇女,HRT可阻止骨丢失,增加脊柱和髋部的BMD。小规模的临床试验发现,男性患者补充睾酮可增加脊柱BMD,但需要充分评价前列腺癌的危险性。如女性患者原有性腺功能减退症,或为绝经后妇女,一般主张早期应用雌激素补充疗法;男性患者则应用雄激素制剂,选择性雄激素受体调节剂(selective androgen receptor modulator,SARM),可望应用于男性GIOP伴性腺功能减退的治疗。如果患者在接受糖皮质激素治疗前的性腺功能正常,是否同时给予性激素补充仍有争议。
3.二膦酸盐
为防治GIOP的首选药物,这类药物可抑制骨吸收,降低骨的代谢转换率,促进破骨细胞凋亡。由于在应用糖皮质激素的极早期即出现骨量丢失(骨量丢失急性相),其发生机制主要是成熟破骨细胞数目增多,功能增强和破骨细胞寿命延长,所以早期应用二膦酸盐制剂可能逆转这些病变。Alendronate的常规用量为10mg/d或70mg/周,帕米膦酸盐(pamidronate)每3个月静脉注射60mg(或每年静脉应用90mg/次,或首先应用90mg静脉注射,以后每3个月静注30mg)。唑来膦酸盐的常规用量为5mg/年;临床对照研究结果表明,唑来膦酸对GIOP的预防和治疗效果是肯定的。
4.降钙素
可增加脊柱BMD,但不减少影像诊断的髋部和外周骨折危险性,一般不作为GIOP的推荐药物或首选药物。
5.其他治疗
特立帕肽(PTH1-34)也可用于GIOP的治疗。总结1966~2002年间PTH治疗骨质疏松疗效的文献资料(PTH皮下注射,用量50~100μg/d),总的意见是疗效与用量有关,临床试验(1637例)结果显示,PTH可增加PMOP、GIOP和特发性骨质疏松患者的脊椎BMD。PTH也可能对GnRH激动剂相关性骨丢失有保护作用,减少脊椎骨折发生率。但PTH可降低桡骨BMD。西伯利亚人参的提取物对GIOP有一定的防治作用,其作用与依普黄酮(ipriflavone)相当。Denosumab是抗RANKL的抗体,有可能成为新的治疗选择。
使用相当于泼尼松5mg/d的糖皮质激素3~6个月后,BMD迅速下降而骨折风险急剧增加(RR值:任何骨折1.33~1.91,髋部骨折1.61~2.01,脊椎骨折2.60~2.86,前臂骨折1.09~1.13);糖皮质激素引起的骨折有3个特点:①骨折的危险性与年龄、性别和基础疾病无关;②即使在BMD正常时,仍可发生髋部骨折和肋骨骨折,因而引起骨丢失和骨折的糖皮质激素似乎没有安全剂量;③肌无力和肌病降低平衡能力,容易发生摔倒和骨折。
中国GIOP诊治指南指出,对于长期应用糖皮质激素治疗的患者应每6~12个月检测BMD;糖皮质激素的疗程定义是:小于3个月为短期,3~6个月为中短期,超过6个月为长期。美国风湿病学会(ACR)建议正在应用糖皮质激素(相当于泼尼松≥5mg/d的剂量)治疗的患者,如果治疗≥3个月应采取以下治疗措施:①改善生活方式(禁烟、减少饮酒量);②适当负重体育运动;③补充钙剂和维生素D(VD);④口服二膦酸盐(绝经前妇女慎用)。如果患者需要长期使用糖皮质激素或已经存在多种骨质疏松风险,则防治需要更为积极。除了改善生活方式、适当负重体育运动、补充钙剂和VD外,应及时采用性激素替代治疗(存在性腺功能障碍或有其他临床使用指征时),并定期检测腰椎和(或)髋部BMD,当BMD的T值<-1时,应给予二膦酸盐(绝经前妇女慎用);禁忌或不耐受二膦酸盐者采用降钙素治疗。如果BMD正常,应该每1~2年随访并检测BMD。
目前,各国对GIOP的防治意见尚未统一,但所有指南都指出长期服用者需检测BMD;多数主张应用双磷酸盐作为一线用药,同时补充钙和VD,并将钙和VD作为一级预防和二级预防的基础用药。2010年,美国风湿病学院(American College of Rheumatology)更新了GIOP的防治指南(American College of Rheumatology 2010 Recommendation for the Prevention and Treatment of Glucocorticoid-induced Osteoporosis),重点强调了以下几点:①在计划使用糖皮质激素时,即需要采取措施对GIOP进行预防和治疗,尤其是应及时补充钙剂和维生素D;②具有循证依据的二膦酸盐为首选药物(如唑来膦酸钠);③活性维生素D对GIOP有一定的防治作用,普通VD对小剂量和中等剂量糖皮质激素引起的骨丢失也有一定作用,但后者对大剂量糖皮质激素引起的骨质疏松不具备防治效果。
GIOP与糖皮质激素的剂量有关,发病机制涉及继发性甲旁亢,隔日疗法不能阻止骨质丢失,补充钙剂、VD有预防治疗作用。
预防GIOP的发生主要从5个方面来进行:①尽量避免滥用糖皮质激素,对可用可不用的患者要首先采用非糖皮质激素药物治疗。②选择最佳的剂量、用法和疗程;对于必须应用糖皮质激素的患者来说,要尽可能采用局部制剂,以减少用量和副作用;必须口服者采用隔日疗法(alternative day therapy),以尽可能保存正常的下丘脑-垂体-肾上腺皮质轴反馈功能。③一旦病情控制,即应减量或停用,必须长期应用时使用最低的有效剂量。以往认为,7.5mg/d泼尼松(早上5mg,下午2.5mg)是“生理”需要量,但不少患者同样发生GIOP。多因素分析发现,患者24小时尿中的皮质醇/肌酐排出量是判断皮质醇是否过量和预测BMD的良好指标。④同时加用抗骨质疏松药物,一般主张先用二膦酸盐,继而用活性VD制剂或性激素方案预防。⑤定期测量BMD。













