英文名称 :male primary osteoporosis
老年男性骨质疏松(aging male osteoporosis,MOP)主要见于65岁以上的老年男性,增龄和钙调节激素异常是引致老年男性骨质疏松的重要原因之一。原发性(特发性)男性骨质疏松症(male primary osteoporosis)是指病因不明的男性骨质疏松症。男性继发性骨质疏松症(male secondary osteoporosis)的病因与原发疾病和女性基本相同,主要的原发疾病和临床情况是长期应用糖皮质激素、性腺功能减退、慢性酒精中毒、长期吸烟、慢性胃肠疾病、肾石病、甲亢、制动和肝肾疾病等。
尽管近年来MOP的研究有显著进展,但其发病机制和治疗仍存在许多悬而未决的关键问题。一是FRAX评分采用股骨颈BMD和女性T值参考标准,但应用于男性仍有争议;二是调查MOP的真实发病率和性激素和非性激素因素对骨丢失的作用机制,特别是年轻人群骨小梁丢失的机制;三是临床应用质谱法测定血清雌二醇和睾酮;四是研究选择性雌激素受体调节剂和选择性雄激素受体调节剂的临床应用、骨骼和非骨骼效应,以及总睾酮和游离睾酮降低男性使用睾酮的益处与副作用。
(一)增龄性与加速性骨丢失导致男性骨质疏松症
一般认为,增龄性与加速性骨丢失属于一种不均一性临床综合征,包括许多病因不一、临床表现各异的疾病或综合征,其中较常见的有老年性骨质疏松和MOP,发病机制依病因不同而异。骨丢失速度和程度一般低于女性,但有些老年男性骨量丢失的速度也相当快,在65~70岁前即出现明显骨质疏松(伴或不伴骨折)。
(二)雄激素缺乏引起骨形成不足和骨丢失加速
一些资料显示,成骨细胞功能降低,骨组织计量学表现为骨形成缺陷,但大多数病例表现为骨吸收增加,骨形成表面与无骨质疏松的老年人相似,但骨吸收表面明显增加。
雄激素缺乏的临床表现为性欲下降,阴茎勃起不能或不足,易疲乏、精神抑郁或变态、肥胖、毛发脱落和男性骨质疏松等。血清睾酮、去氢异雄酮 (DHEA)、DHEA硫酸盐(DHEAS)水平下降。由于SHBG升高,血清游离雄激素进一步下降,引起骨质疏松。骨吸收增加是老年男性骨代谢的重要特点。甲睾酮虽为口服片剂,但对肝脏的毒副作用大,而且单用雄激素有加重前列腺肥大的可能,选用具有雄激素作用而毒副作用较低的达那唑片获得了满意效果。雄激素缺乏也对男性的情绪和精神状态有明显影响。有人提出,在男性骨质疏松中,雌激素水平下降比雄激素水平下降更加多见。老年男性患者常常伴有营养不良、胃肠吸收功能减退、VD缺乏、肝肾功能减退、体力活动过少和吸烟等临床情况,这些都可促进骨质疏松的发生。
(一)男性骨质疏松发病率与年龄相关
男性低骨量/骨质疏松症的发病率低于女性而骨折率和致残率高于女性。MOP的发病率低于女性,但并非少见,50岁以上男性约有20%存在髋部、腰椎或者腕部骨质疏松,大约30%的髋骨骨折发生在男性,已成为突出的公共卫生问题之一。
Johnell和Kanis对全球骨质疏松性骨折进行了总结。全球每年有9百万例骨质疏松患者发生骨折,其中39%为男性。男性骨折的30%为髋骨骨折,20%为前臂骨折,42%为脊椎骨折,25%为肱骨骨折。与女性相似,曾发生过轻微外伤性骨折的男性再骨折率显著增加。Dubbo骨质疏松流行病研究对60岁以上的男性和女性社区居民进行了为期16年的追踪调查,发现曾发生任何部位轻微外伤性骨折(自站立高度或低于站立高度的位置跌倒)的患者,再次骨折的相对危险性为3.47(95%可信区间2.68~4.48)。Dubbo研究组还发现,所有的轻微创伤性骨折与5~10年的死亡风险增加相关。
Riggs等通过横断面研究发现,随着增龄,脊椎体积骨密度(vBMD)显著下降,与股骨颈、桡骨远端、股骨远端的小梁骨变化模式类似,不论是男性或女性,这些部位的体积骨密度(vBMD)自30岁以后逐渐下降。而桡骨远端、股骨远端和股骨颈的皮质骨vBMD在中年期以前无明显变化,中年后显著下降,脊椎、桡骨远端和股骨远端的小梁骨骨丢失显著增加,随着继续增龄,皮质骨出现骨丢失。
轻微或严重外伤性骨折与BMD相关。在Mackey等的研究中,髋部总体BMD每降低1SD,男性严重外伤性骨折的多变量相对风险为1.54(95%可信区间,1.20~1.96),轻微外伤性骨折的多变量相对风险为1.69(95%可信区间1.49~1.91)。因此,从临床角度看,严重创伤性骨折患者也应考虑伴有脆性骨折可能。
(二)雌激素缺乏与男性骨密度和骨丢失相关
Orwoll等在骨质疏松性骨折研究(Osteoporotic Fractures in Men Study,MrOS)中发现,≥65岁男性的雌二醇、睾酮及游离雌二醇和睾酮随增龄而降低。Amin等根据血清雌二醇和睾酮水平将研究对象分为雌二醇降低(2.0~18.1pg/ml)、中等(18.2~34.2pg/ml)和升高(≥34.3pg/ml)3组,其髋骨骨折发生率(每1000人年)分别为11.0、3.4和3.9。校正年龄、BMI、身高和吸烟后,雌二醇降低和雌二醇中等组的校正危险率分别为3.1(95%可信区间1.4~6.9)和0.9(95%可信区间0.4~2.0),并发现男性骨折的血清雌二醇阈值为18pg/ml,低于此阈值则骨折风险率明显增加。
用多元比例风险回归模型分析发现,游离雌二醇和性激素结合蛋白与骨折风险独立相关,而游离睾酮与骨折风险无相关。游离雌二醇与临床脊椎骨折[BMD每降低1SD,骨折风险率增加1.57(95%可信区间1.36~1.80)]、非脊椎骨折(BMD每降低1SD,风险率增加1.42;95%可信区间1.23~1.65)和髋骨骨折(BMD每降低1SD,风险率增加1.44;95%可信区间1.18~1.76)呈负相关,并且证实雌激素水平对骨折风险有阈值效应,每年的骨折发生率与血清雌二醇水平(低于16pg/ ml)呈负相关。LeBlanc等发现,游离雌二醇最低4分位数或最高性激素结合蛋白组的非脊椎骨折风险率最大,而校正游离雌二醇后,游离睾酮最低组的骨折风险并未增加。低游离睾酮/高性激素结合蛋白组的骨折风险增加,而低游离雌二醇/低游离睾酮和性激素结合蛋白组的骨折风险最高。因此,老年男性雌二醇水平是影响骨折风险的关键因素,并且存在骨折风险显著增加的雌二醇阈值。
雌激素对男性的骨保护作用表现在:①低浓度的血清E2时,皮质骨体积BMD(vBMD)与血E2呈正相关,高浓度时两者无相关,此拐点为E2的作用阈值,低于该值导致骨丢失;②小梁骨的vBMD与低浓度和高难度E2均呈正相关,说明小梁骨缺乏E2作用阈值现象。
(三)雄激素不足引起BMD降低
1.雄激素不足
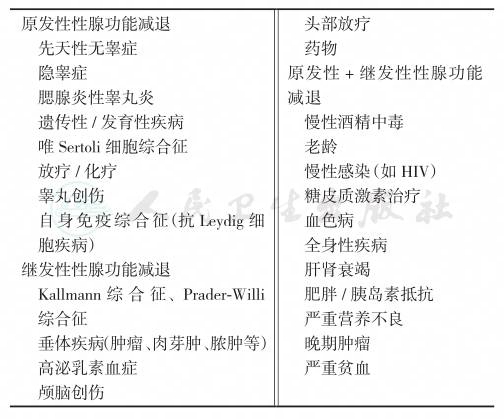
男性血清雄激素水平是骨折风险的重要预测因子,男性性腺功能减退的病因见表1。
骨质疏松性骨折阈值(osteoporotic fracture threshold)是预测骨折的重要指标。Meier等对609例>60岁的男性进行研究后发现,虽然血清雄激素与腰椎或股骨颈BMD无相关,但低雄激素血症较雌激素对轻微外伤性骨折是更为有力的预测指标,雄激素降低的老年男性可能通过骨骼肌强度和(或)跌倒等非骨骼因素而使骨折风险增高,睾酮可能通过非骨骼因素(如肌肉量、平衡能力和跌倒风险)而影响骨折风险。该项研究的意义在于:①骨质疏松男性测量血清性激素(特别是雌二醇)有重要意义。②男性使用选择性雌激素受体调节剂防止骨丢失的理念得以证实。③对男性使用非芳香化雄激素受体调节剂的观点提出了质疑,因为通过雌激素影响骨骼,选择性雄激素受体调节剂可能仅通过增强肌肉力量、降低跌倒风险等非骨骼作用而发挥抗骨折效应。
表1 男性性腺功能减退的病因
男性更年期(male andropause)发生的年龄差异很大,有的早在50岁左右即已发生,有的可晚至60岁以后。男性更年期的原因是原发性睾丸功能减退,雄激素的合成和分泌减少,但由于男性血清性激素结合球蛋白(SHBG)水平随增龄而升高,故测定血清总睾酮水平不一定能反映游离睾酮水平。由于更年期男性的下丘脑-垂体也出现相应变化,所以往往同时伴有FSH和LH升高,GH和IGF-1下降。一些人还伴有褪黑素(melatonin)和TSH下降,而皮质醇相对升高。此外,一些老年男性由于前列腺增生、前列腺癌而长期接受抗雄激素制剂治疗,更加加重和加速了骨质疏松的发生与发展。
老年男性血睾酮下降不但影响骨代谢,还可通过肌力下降而间接减少其对骨的机械负荷作用,一些MOP者与过早出现男性更年期综合征有关。在抗雄激素治疗的开始数年内,BMD下降速度为3%~5%/年,明显高于老年所致的BMD下降速度,骨折风险急剧增加。同样,男性因前列腺癌接受GnRH治疗和睾丸切除后,也极易发生骨质疏松。Meta分析表明,糖皮质激素应用的累积剂量与BMD降低、每日剂量与骨折风险的关系最密切,一般在应用3~6个月后,MOP性骨折的风险即开始明显增加。
睾酮降低使脂肪组织增加,而脂肪组织的高水平芳香化酶活性将睾酮转换为雌二醇,睾酮浓度进一步下降;雌二醇还负反馈抑制下丘脑-垂体-性腺轴,降低睾丸Leydig细胞的睾酮合成与分娩。另一方面,脂肪组织增多通过脂肪因子增加胰岛素抵抗,抑制LH释放和Leydig细胞功能。因而,肥胖和胰岛素抵抗是性腺功能减退的另一个重要原因。
2.BMD降低
骨折阈值与BMD的关系密切。其原因是:①不论男女,BMD下降越多,骨折风险越高,BMD和骨折危险性之间存在负相关关系。②在同一BMD和同一外力作用下,男女的脊椎和四肢骨骨折风险相似。③BMD下降伴骨脆性明显升高。④男女性骨折风险的其他主要影响因素(如老龄、缺乏体力活动、制动、糖皮质激素使用、性腺功能减退、高钙尿症等)相同,因而MOP和骨折阈值的判断标准可借用女性标准,同时在实践中验证其可行性,进一步探讨男性人群的骨折阈值标准。
宜多晒太阳,多从事户外活动,并养成每日坚持1~2小时体力锻炼的良好习惯,防止摔倒。在基础治疗和一般治疗的基础上可给予必要的药物治疗。继发性者要强调原发症的治疗,同时针对需要给予抗骨质疏松药物治疗。男性骨质疏松症的处理程序见图2,治疗药物见表5和表6。
(一)恢复肌力和BMD
老年人要加强肌力锻炼,提高耐力和机体抵抗力,降低血压和胰岛素抵抗,消除腹部脂肪和肥胖,减少摔倒和骨折风险。进食富含钙、低盐和适量蛋白质的均衡膳食,同时注意适当户外活动,避免嗜烟、酗酒和慎用影响骨代谢的药物。必要时采取防止跌倒的各种措施。每日钙摄入推荐量800mg元素钙量可减缓骨的丢失,改善骨矿化。VD有利于钙在胃肠道的吸收,推荐剂量为400~600U/d,老年人因缺乏日照以及摄入和吸收障碍常有VD缺乏,推荐剂量为600~800U/d(15~20μg/d)。
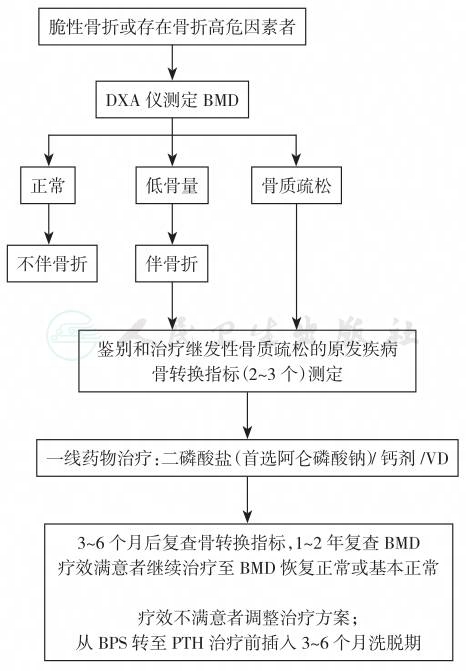
图2 男性骨质疏松症的处理程序
表5 男性骨质疏松的治疗药物

注:A:randomised controlled trials,随机对照研究(RCT);B:other well designed studies,非RCT的良好涉及研究;C:expert opinion/reports,专家意见或报道。(-):无作用
表6 抗骨质疏松药物对雄激素剥夺治疗者的疗效观察
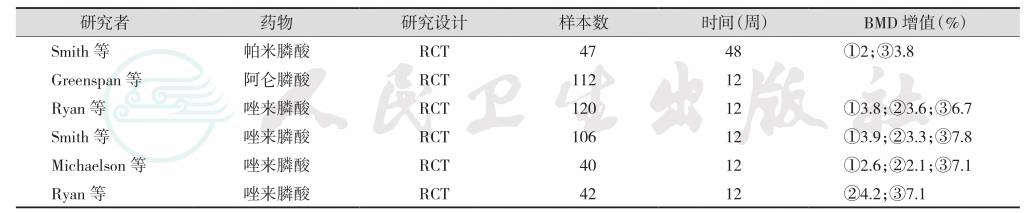
注:RCT:randomized controlled trial,随机对照研究;表中比较(P值)均<0.05;①总体髋部;②股骨颈;③腰椎
(二)药物治疗
二膦酸盐是治疗男性骨质疏松的首选药物,与对照组相比,使用唑来膦酸4mg者的骨骼相关事件的累积发病率下降35.3%。由于zoledronate对溶骨性和成骨性病变都有作用,而且其使用方便,副作用少,还可用于骨肿瘤性骨病变的治疗。
1.二膦酸盐
目前美国FDA已经批准阿仑膦酸盐、利塞膦酸钠和唑来膦酸钠用于MOP的治疗。此外,FDA还批准特立帕肽治疗高危骨折风险患者。男性患者的3种膦酸盐使用方法与女性相似,伴有认知功能障碍、活动受限和消化系统疾病者可能特别适合于静脉使用唑来膦酸钠(zoledronate,5mg/年)。FDA正在讨论狄诺塞麦(denosumab)用于男性骨质疏松的治疗,狄诺塞麦为高亲和力的RANKL单克隆抗体,Smith等的多中心双盲研究发现,接受前列腺癌去势治疗的患者给予每6个月60mg的狄诺塞麦皮下注射或安慰剂对照(每组734例)。24个月后,狄诺塞麦组的腰椎BMD增加5.6%,而安慰剂组降低1.0%,同时狄诺塞麦组的髋部总体、股骨颈和桡骨远端BMD也显著增加。在36个月时,狄诺塞麦组的新发脊椎骨折降低62%。但是,狄诺塞麦可增加严重感染的风险,值得特别注意。
2.睾酮和/或脱氢表雄酮
用睾酮和/或脱氢表雄酮(DHEA)维持老年男性骨量、肌肉量和提高生活质量是目前争议的热点。最近,Nair进行了1项为期2年的随机对照双盲研究,共纳入87例硫酸DHEA和游离睾酮降低的患者。通过2年治疗,睾酮轻度升高,接受经皮吸收睾酮者的非脂肪体质轻度增加,所有治疗组的股骨颈BMD增加(2%),而脊椎、髋部总体、桡骨BMD、非脂肪体质、肌肉强度、胰岛素敏感性、生活质量和前列腺特异抗原无变化。肌注睾酮可明显增加骨量、肌肉强度和非脂肪体质。睾酮用于老年男性的疗效尚不肯定,建议进行临床研究以明确睾酮与临床疗效的关系。
3.SARM和SERM
选择性雄激素受体调节剂(selective androgen receptor modulator,SARM)无致前列腺增生和前列腺癌的不良反应,可能会成为男性骨质疏松的重要治疗药物(表7和表8)。虽然临床前的动物实验数据支持该类药物对骨骼和肌肉有益,并且对前列腺无副作用,但目前没有该类药物对骨骼和非骨骼效应和安全性资料。SERM通过雌激素与骨代谢关系的讨论可以假设,男性采用低剂量SERM是合理有效的治疗手段。虽然雷洛昔芬尚未批准用于男性,但前期的研究证实,接受性腺抑制治疗的前列腺癌患者应用雷洛昔芬可降低骨转换,增加骨密度。采用去势治疗的前列腺癌患者(1389例)使用托瑞米芬(toremifene)可显著降低椎骨骨折率。因此,前列腺癌患者使用SERM治疗骨丢失的疗效确切,而且男性使用SERM预防骨丢失的理念也得以证实,但是否可用于无性腺功能减退的老年男性尚待进一步研究。
此外,SARM还可用于需要增加合成代谢,降低分解代谢的其他临床情况的治疗,如虚弱、恶病质等。
表7 甾体类SARMs结构-生物活性关系

表8 非甾体类SARMs

4.锶盐和PTH
可促进VD的合成和骨矿化,刺激骨形成。一般可口服雷奈酸锶2g/d。注意防治超敏反应。PTH间歇性小剂量应用可促进骨形成,增加骨量。
5.PTH
PTH具有促进骨合成作用,能提供BMD,减低骨折发生率,常用的制剂为PTH1-34(特立帕肽,teriparatide)。
6.降钙素
据报道,每天应用100U鲑鱼降钙素,治疗2年有一定疗效,但需同时补充钙剂和VD。Stepan等报道,降钙素可使性腺功能减退的男性患者骨转换率下降、生长指标改善。
7.其他药物
GH可促进老年人的骨代谢;IGF-1对特发性男性骨质疏松有效,除可提高BMD外,还可增加骨骼肌容量,提高肌力。噻嗪类利尿药对男、女两性的骨量均有保护作用,可降低骨丢失率和骨折发生率,升高BMD。其他利尿剂无此作用,所以需长期应用利尿药者(如高血压)可首选噻嗪类利尿药。RANKL调节剂(RANKL modulator)正在开发与研究中。
继发性男性骨质疏松的治疗尚无统一意见。长期应用糖皮质激素者宜用二膦酸盐和降钙素治疗。伴性腺功能减退应加用雄激素,如疗效不佳或出现明显的不良反应,可改用SARM,但目前仍缺乏足够的临床依据。抗雄激素药物引起的男性骨质疏松宜用二膦酸盐治疗,但要避免滥用。













