系统性淀粉样蛋白变性(systemic amyloidosis)和阿尔茨海默病以及其他一些疾病的病因与致病性蛋白聚合物(pathogenic protein aggregation)不适当沉积有关。系统性淀粉样蛋白变性是由于淀粉样蛋白(amyloid)在全身细胞外组织间隙、细胞质甚至细胞核中沉积,从而导致细胞和器官功能受损的一种临床现象。Picken等给出的本病最新定义是:淀粉样蛋白变性是一组由遗传、变性和感染等不同因素引起的蛋白质分子折叠异常所致的淀粉样物质的沉积症,因此系统性淀粉样蛋白变性是一种蛋白质代谢障碍性综合征。由于沉积的淀粉样蛋白和受累器官有所不同,因此临床表现不均一。常见受累器官有肝、肾、神经、心脏、胃肠道等,受累组织则以皮肤、舌、淋巴结等较常见。全身所有组织和器官均可受累,但不一定有临床表现。
系统性淀粉样变有遗传性和后天性(或称继发性),也可分为原发性和继发性。原发性者是由于蛋白的代谢障碍,形成不溶解的淀粉样复合物所致;继发性淀粉样变只是许多疾病的一种并发症。现已经查明,至少有20多种蛋白质可以成为淀粉样物质的前体[2]。根据淀粉样蛋白沉积的部位可分为系统性与局限性。临床上,多根据沉积的淀粉样蛋白变性的种类而把系统性淀粉样变分为5型。淀粉样蛋白形成反向平行的折叠构象和无分支的线性丝状物,其长度不一,直径7.5~10nm[3]。淀粉样蛋白长期覆盖在组成组织和器官的细胞表面、组织间隙和细胞内,加之血管壁也有淀粉样蛋白沉积使血管狭窄而影响细胞的血液供应,从而使细胞功能逐渐衰竭而死亡,导致器官功能衰竭。AL淀粉样蛋白变性可能是由巨噬细胞使免疫球蛋白降解而产生;AA蛋白则可能是由内毒素刺激肝细胞产生血清淀粉样蛋白(SAP);后者再由白细胞和单核细胞表面蛋白分解酶降解而来。
系统性淀粉样蛋白变性包括轻链型伴血清淀粉样蛋白A、遗传性/家族性、透析相关性和器官特异性等亚型[4],见表1和表2,其中TTR变异体对肾脏的损害最明显(表3)。
表1 系统性淀粉样变性的类型与受累组织
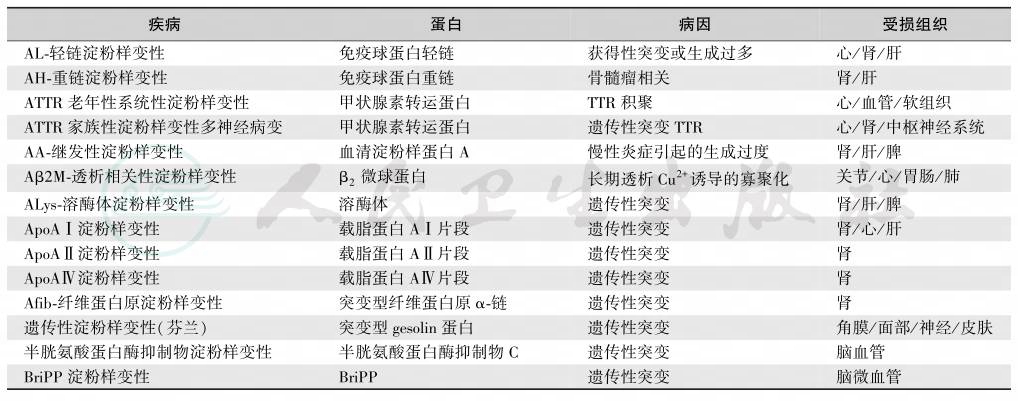
表2 常见的系统性淀粉样变性类型
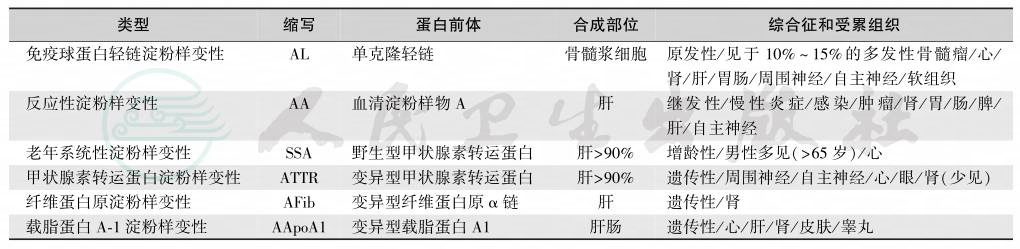
表3 TTR变异体的肾脏损害
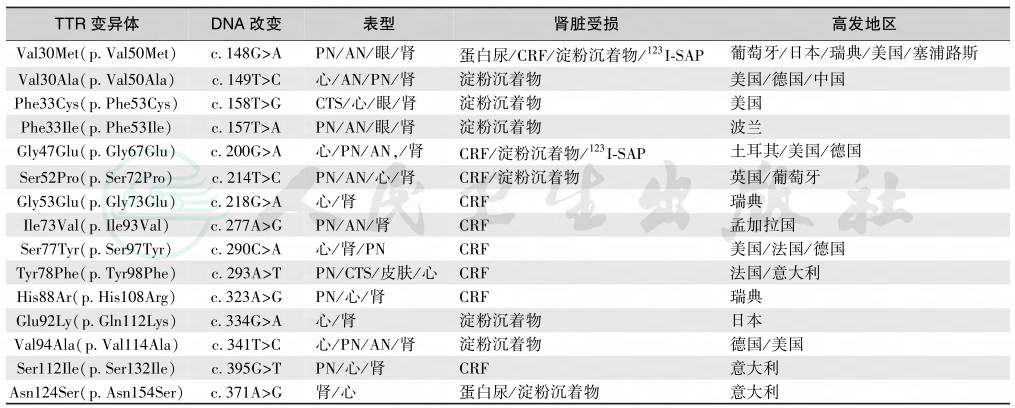
注:PN:peripheral neuropathy,周围神经病变;AN:autonomic neuropathy,自主神经病变;123I-SAP:deposits in scintigraphy with123I-labeled serum amyloid P component,肾脏123I标记的血清淀粉样P沉着物;CTS:carpal tunnel syndrome,腕管综合征:CRF:chronic renal failure,慢性肾衰
(一)淀粉样物沉积
1.浆细胞恶病质(AL型)
是由恶变前或恶性浆细胞分泌的单克隆免疫球蛋白所致。与骨髓瘤相关的淀粉样蛋白变性为多种免疫球蛋白的N-末端的轻链,可以是完整的免疫球蛋白,以IgG多见,也可以是免疫球蛋白的κ和λ轻链,统称为本周蛋白(Bence-Jones protein)。此型又可称为系统性轻链淀粉样蛋白变性(AL型)。慢性Gaucher病合并AL系统性淀粉样蛋白变性为极少见的病例。AL型淀粉样蛋白变性是由于蛋白错误折叠引起的病变,从1例由骨髓瘤引起的淀粉样蛋白变性患者所得到的K-1型本周蛋白原一级结构,发现有8个氨基酸被取代,这是此患者所特有,也是已知的κ轻链中很少见的一种突变类型。这些被取代的氨基酸都是骨架之内的氨基酸,结果使结构变得不稳定而促进淀粉样蛋白外形的改变。用质量分光计检查患者沉积在组织间隙中的淀粉样蛋白小纤维均有恒定区域被截短,相差的氨基酸恒定为1~125、1~444和1~210,这些小片段是特异性碱性氨基酸酶作用于κ轻链的N-末端而被截短的。由此正常κ轻链中高度保守的氨基酸被取代而转变为致淀粉样蛋白的免疫球蛋白轻链。
2.继发性淀粉样变(AA型)
是由于肝脏对炎症反应产生的淀粉样蛋白A沉积所致,沉积蛋白从血清淀粉样蛋白(SAP)转变而来,又可称为淀粉蛋白A(AA)系统性淀粉样变。因为它可继发于多种疾病,故又称继发性淀粉样变。常见的原发性疾病有慢性类风湿关节炎、风湿性多肌痛、炎症性肠病、由MEF基因突变引起的家族性地中海热(呈家族性发病)、慢性结核病、化脓性骨髓炎、脓胸和“湿性”支气管扩张症等。如果身体中长期存在慢性炎症,在炎症急性期肝脏有血清淀粉样蛋白(SAP)产生增多反应。其沉积的蛋白就是从SAP转变而来,在全身广泛沉积而导致系统性淀粉样变。常见的慢性炎症性疾病有类风湿关节炎、炎症性肠病(包括克罗恩病和溃疡性结肠炎)、慢性骨髓炎、慢性脓胸、支气管扩张症、家族性地中海热和结核病等。
3.家族性淀粉样变(AF型)
呈家族性发病,为常染色体显性遗传;FA淀粉样由多种突变蛋白而来,所表达的突变蛋白有致淀粉样变作用。沉积的淀粉样蛋白是由于一些蛋白质基因突变产生的突变蛋白质,形成淀粉样蛋白小纤维沉积于组织间隙中而致淀粉样变。如由肝和脉络膜丛产生的甲状腺素运载蛋白基因突变而表达突变的TTR蛋白,后者是与甲状腺激素转运有关和视网膜醇(retinol)结合的蛋白。载脂蛋白-1基因突变、肌动蛋白基因突变、纤维蛋白Aα和溶酶基因突变等都可发病。
(1)TTR:
此种蛋白是正常的甲状腺素转运蛋白和与视网膜醇结合的蛋白质,其基因可发生突变。文献中已报道的TTR基因有 50多种突变,但常见的只有两种:一种为Val30Met,另一种为Leu55Phe变异性蛋白。多见于家族性淀粉样蛋白变性的多发性神经病中,亦可见于老年性系统性淀粉样变中。在正常情况下,由野生型TTR基因所表达的TTR蛋白以四聚体形式存在,不能形成小纤维状蛋白沉积。在pH 5~3.9时,则形成折叠的第三种结构。在正常浓度下可自身同化为第四种结构的网格状中间产物,分子量进一步增加。这种中间产物可以形成淀粉样蛋白小纤维。变异性TTR有与正常的TTR蛋白的酸变通路。因此,无论是正常的或变异性的TTR蛋白经酸化变构和同化后所产生的中间产物是致淀粉样变的关键步骤。也有人认为野生型和变异性TTR的磺酸化有高度致淀粉样变作用。用质量分析计分析野生型和变异性TTR制备物中发现有游离的、与硫结合的和几种小的TTR蛋白。TTR122位被异亮氨酸取代也可引起心脏淀粉样蛋白变性。在巴西报道TTR Val30Met变异引起家族性淀粉样蛋白变性的多发性神经病。
(2)肌动蛋白:
肌动蛋白是一种正常的肌动朊调节蛋白,其基因有两种突变。因此,产生两种突变的肌动蛋白,即Gly654Ala和Gly654Thr。突变所引起的系统性淀粉样变呈家族性。与肌动蛋白相关的淀粉样蛋白主要沉积于中枢神经系统中,包括大脑,脊髓,软、硬脑膜,脊神经根和感觉神经节的血管中,从而引起神经功能不全,肌动蛋白Asp187Asn也可引起淀粉样变,同时可有血小板形状变化。
(3)载脂蛋白A-1(ApoA1)变异:
ApoA1是正常血液中存在的一种脂质转运蛋白。这种蛋白基因发生突变所表达的Leu174Ser的ApoA1可引起家族性系统性淀粉样变。主要表现为遗传性心脏淀粉样变,用氨基酸测序和光谱计分析,其沉积于心脏中的淀粉样蛋白为正常ApoA1氨基末端第93位的多肽,即在第93位的缬氨酸被蛋白酶裂解。这种裂解出来的片段聚集而引起淀粉样变。
(4)变异性溶酶:
英国一大家族中因溶酶有Asp67His点突变而引起遗传性系统性淀粉样变。以前还报道过的突变有Ile56Thr。有相同溶酶突变的家族其表型可不相同。Gillonore等报道的家族中几代人中均有肾脏受累,而另一家族则表现为自发性肝破裂。Ile56Thr突变者开始只有皮肤瘀斑,以后则进展为致命的内脏淀粉样变。
(5)与Gaucher病相关性AL淀粉样变:
Gaucher病与系统性AL淀粉样变合并在一起极为少见。Katolerakis等报道一例46岁的希腊男性成纤维细胞中葡萄糖脑苷脂酶(glucocerebrosidase)活性低,证实为慢性Gaucher病,这种酶基因有Asp370Ser/Ile444Phe突变。骨髓中有弥漫性浆细胞增多,血清中有单克隆IgGλ,肝脏、脾、肾和骨髓中均有淀粉样蛋白沉积。
4.透析相关性系统性淀粉样变(AH型)
见于终末期肾病透析治疗者,与透析相关沉积的淀粉样蛋白为β2微球蛋白。一般透析时间在10~15年以上才可发生系统性淀粉样变。在组织间隙中沉积的淀粉样蛋白为β2微球蛋白,此种蛋白95%从肾脏排泄。此种蛋白是人白细胞抗原(HLA)一类复合物的轻链,不能通过透析膜,因此在体内堆积而引起系统性淀粉样变。导致β2微球蛋白沉积的其他全身和局部的因素:①转变为进展性糖基化终产物和进展性氧化蛋白产物;②抗蛋白酶和蛋白酶;③血清蛋白成分;④钙结晶;⑤激肽;⑥免疫球蛋白轻链;⑦修饰过的葡胺聚糖;⑧泛素。
5.老年性系统性淀粉样变(AS型)
沉积的淀粉样蛋白有多种来源。独特的老年性心脏淀粉样变沉积的蛋白为TTR蛋白。老年性淀粉样变是指发生于老年人的系统性淀粉样变,其淀粉样蛋白来源有多种。独特的老年心脏淀粉样蛋白变性是由于TTR的磺酰化使TTR变性,但目前仍不清楚为什么患者的TTR会发生磺酰化。
6.局灶性免疫球蛋白轻链淀粉样变性
局灶性免疫球蛋白轻链淀粉样变性罕见。分析英国淀粉样中心1980年1月—2011年12月的606例(全部病例5050例)局灶性淀粉样变性的数据发现,这些患者没有心脏、肾、肝或自主神经损伤,局灶性淀粉样变性(轻链型占98%)患者的中位年龄为59.5(50.2~74.5)岁,最常见的病变位于膀胱(16%)、咽喉或扁桃体(15%)、皮肤(14%)和肺(8%)。 其中20%的患者存在单克隆免疫球蛋白或血清游离轻链。局灶型免疫球蛋白轻链淀粉样变性的预后良好,对预期寿命无显著影响,进展至全身免疫球蛋白轻链淀粉样变性的情况罕见。
(二)淀粉样蛋白
系统性淀粉样变的病理改变有:无论是哪种类型的淀粉样蛋白均沉积于细胞外,身体所有部位均可有淀粉样蛋白沉积。淀粉样蛋白为无定形、嗜伊红的透明蛋白。受累器官以肝、脾、肾、心最为突出。受累器官肿大,触之有坚实感,表面呈蜡样淡红色或灰色外观。用苏木精-伊红染色呈红色,可表现为异染性而呈结晶紫或甲基紫色。用刚果红染色后,在极光灯下用显微镜观察则呈独特的苹果绿色的双折射(birefringence)外观。这些变异的蛋白统称淀粉样蛋白,其特性是:①具侧面聚集性;②不被蛋白酶分解;③不溶解。
电镜下大多数淀粉样蛋白结构单位为三角形,外经约90Å,内经约40Å。整个淀粉样蛋白呈不分支的小纤维丝,大约为70Å,有侧面聚集倾向。不同类型的淀粉样变在组织中所沉积的淀粉样蛋白分子量不同,如AL型淀粉样蛋白的分子量约5000~25 000Da,AA型淀粉样蛋白约为8500Da。前者氨基酸序列含有与各种轻链相同的氨基酸残基;后者则由血清中淀粉样蛋白(SAP)的氨基末端经蛋白酶分解而来。SAP是由肝细胞产生,白细胞介素-1(IL-1)可刺激 SAP释放。
系统性淀粉样变的级联分子事件与治疗靶点,见图1。由于致淀粉样变的前体物质结构异常(突变),分子折叠错误或不能折叠,此外,有些蛋白质存在内源性致淀粉样变趋向,也可发生淀粉样变,如甲状腺激素转运蛋白引起的老年性系统性淀粉样变性。蛋白溶解性裂解产物与细胞外基质相互作用后产生葡糖氨基聚糖(GAG),胶原蛋白促进蛋白质淀粉样变;细胞外蛋白伴侣分子清除容易聚集的细胞外液基质蛋白,而导致免疫球蛋白轻链淀粉样变(immunoglobulin light chain amyloidosis,AL)和甲状腺激素转运蛋白性系统性淀粉样变性(ATTR)。寡聚体为细胞毒性物质,血清淀粉样蛋白P与淀粉样纤维结合,避免被重吸收。淀粉样蛋白与刚果红呈特异性结合,在偏振光下染成亮绿色,宽10~12nm,纤维无分支。
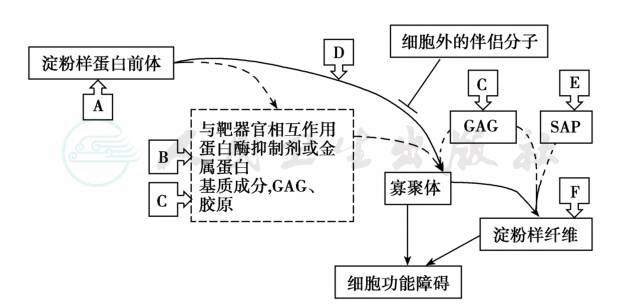
图1 系统性淀粉样变的信号分子事件与治疗靶点
A:化疗、肝移植或RNA干扰可清除淀粉样蛋白前体;B:蛋白酶抑制剂或金属蛋白衰减化合物清除淀粉样蛋白;C:干扰GAG与淀粉样蛋白结合的化合物可成功治疗继发性淀粉样变性;D:稳定淀粉样蛋白前体的小分子物质可防止淀粉样蛋白的错误折叠与凝聚,用于ATTR淀粉样变性的治疗;E:药物清除SAP;F:特异性抗体清除淀粉样蛋白或加速其分解
下列表现有助于早期发现本病病例:①40岁以上的男性,有巨舌和眼眶周围皮肤紫癜。②不明原因的心脏扩大和心功能衰竭。③肝脏肿大伴蛋白尿和顽固性胸腔积液。④全身淋巴结肿大伴全血细胞减少。⑤皮肤结节性淀粉样蛋白沉积症。系统性淀粉样变性病例常因免疫球蛋白轻链病或单克隆γ病就诊于肿瘤科或血液科;如果患者的病情较轻或脂肪抽吸无特殊发现,唇下唾液腺活检可明确50%系统性淀粉样变性患者的诊断;如果仍为阴性,应做受累组织(肾脏、心肌、胃肠等)的病理活检;发现系统性淀粉样变性纤维而缺乏克隆性轻链时,需要进行免疫组化、生化检查,必要时还需要应用分子生物学方法确定其他类型的系统性淀粉样变性(图2)。
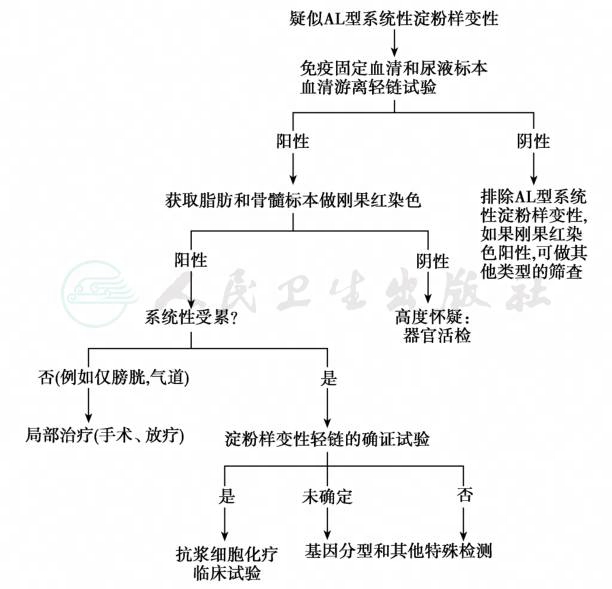
图2 AL型系统性淀粉样变性的诊断流程
系统性淀粉样变目前无根治方法,可根据不同类型采取不同的治疗方法。例如,化疗、肝移植或RNA干扰可清除淀粉样蛋白前体,蛋白酶抑制剂或金属蛋白衰减化合物清除淀粉样蛋白,干扰GAG与淀粉样蛋白结合的化合物可成功治疗继发性淀粉样变性,而稳定淀粉样蛋白前体的小分子物质可防止淀粉样蛋白的错误折叠与凝聚,用于ATTR淀粉样变性的治疗。血液学(免疫化学)治疗反应标准,见表10。免疫球蛋白轻链淀粉样变性的治疗流程,见图4。HDM/SCT治疗AL淀粉样变性的研究结果,见表11,常规治疗AL淀粉样变性的研究结果,见表12。
表10 血液免疫化学治疗反应标准

注:IFE:immunofixation electrophoresis,免疫固定电泳;dFLC:difference in concentration between involved and uninvolved free light chains,相关性和非相关性游离轻链差异
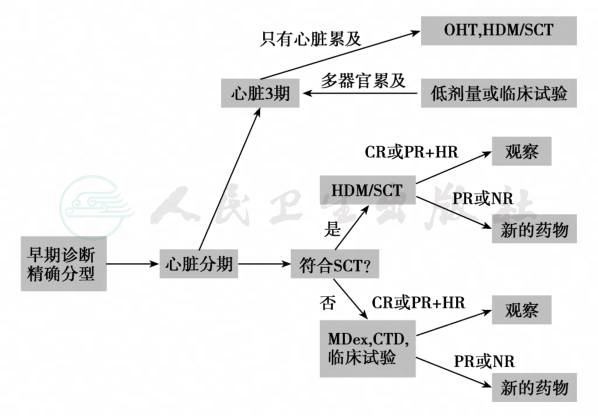
图4 免疫球蛋白轻链淀粉样变性的治疗流程
表11 HDM/SCT治疗AL淀粉样变性的研究结果
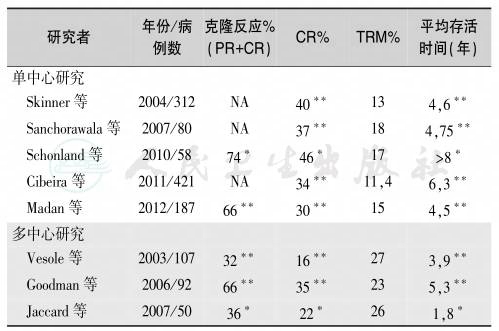
∗P≤0.05;∗∗P≤0.01
免疫球蛋白轻链淀粉样变性患者伴有晚期心脏病不能耐受大剂量糖皮质激素治疗或多种药物联合治疗,如果患者仅患有心脏病应先进行心脏移植,继而采用大剂量美法仑(melphalan)加干细胞移植,以防止被移植的心脏淀粉样物质沉着,否则应用低剂量美法仑加地塞米松治疗,或美法仑-泼尼松-沙利度胺(thalidomide)治疗;年龄小于65岁且器官功能较正常者宜采用干细胞移植,另一种选择是美法仑-地塞米松或沙利度胺-环磷酰胺-地塞米松方案;获得完全缓解者可停药观察,部分缓解者和不能缓解者应改用其他药物治疗(见图4)。
(一)药物治疗
AL型淀粉样变经典的治疗方法为联合应用美法仑(左旋苯丙酸氮芥)和泼尼松。前者剂量为 10mg/(m2·d);后者剂量为 2mg/(kg·d),连服 4天,每4~6周重复1次,持续1年。也可用多种抗癌药物联合化疗。Gertz等随机用美法仑、泼尼松联合和多种烷化制剂和泼尼松联合治疗[包括长春新碱、卡莫司汀(carmustine)、美法仑、环磷酰胺和泼尼松]进行了前瞻性治疗观察,结果表明:后种方法在反应率和存活时间方面并不优于前种方法。该学者同时试用大剂量的地塞米松治疗了25例未曾治疗过的AL型淀粉样变患者,也未能延长患者的生存期。
表12 常规治疗AL淀粉样变性的研究结果
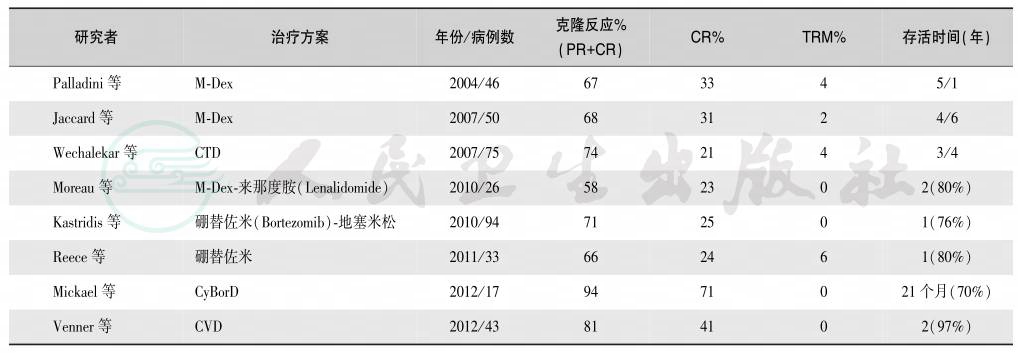
注:M-Dex:melphalan+dexamethasone,美法仑+地塞米松;CTD:cyclophosphamide+thalidomide+dexamethasone,环磷酰胺+沙利度胺+地塞米松;CyborD+CVD:cyclophosphamide+bortezomib+dexamethasone,环磷酰胺+硼替佐米+地塞米松
其他常用的药物有:①亚硫酸:可使TTR四聚体与二聚体的比值减少,对延迟TTR淀粉样变发生或延缓病情进展有效,必须长期服用,其副作用和安全性尚未确定。②3价铬离子:体外试验证明,可增加正常和突变TTR蛋白的稳定性,抑制四聚体形成,从而抑制TTR淀粉样变,但只有在pH低的情况下才起作用。体内难以达到这种条件,故难以用于临床。③非甾体类消炎药:具有很强的特异性抑制TTR蛋白纤维形成的作用,尚需进行长期疗效及安全性观察。④刚果红衍生物:体外试验可抑制TTR淀粉样蛋白沉着,还需临床试验证实。⑤纯化人的正常TTR:将正常TTR注射给患家族性淀粉样蛋白变性的多发性神经病患者,可使变异性TTR明显减少,但维持时间短,注射1周后变异性TTR产量又恢复到注射前水平。⑥thalidomide、bortezomib和 lenalidomide对系统性免疫球蛋白轻链型淀粉样蛋白变性有效(图5)。
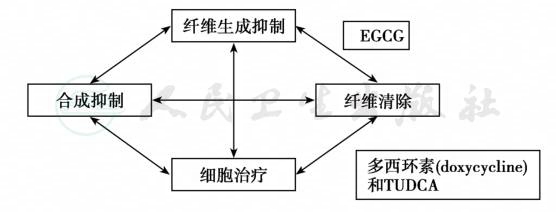
图5 TTR淀粉样蛋白变性的联合治疗
应用选择性复合物多西环素(doxycycline)和TUDCA及 EGCG,降低TTR的稳定性,抑制其聚集及形成TTR淀粉样蛋白,拮抗TTR淀粉样蛋白的毒性
(二)透析治疗
与透析相关的淀粉样蛋白变性可通过改进透析膜和改用高纯度的透析液而使病情得到改善,高流出血透机比低流出血透机清除β2微球蛋白及高分子量毒物的效果好。
(三)肝肾移植和骨髓移植
骨髓移植可与大剂量化疗联合应用(即用大剂量化疗消除患者骨髓成分,再作干细胞移植)。目前只试用于少数患者,尚未见成功的经验。这些治疗病死率很高,患者常死于胃肠道出血和穿孔、心脏停搏和肾衰竭。选择作移植的患者最好是只有单个重要器官受累,年龄小于55岁且无肾功能不全。Fush等对1例68岁由TTR衍生而来的老年性淀粉样变患者作了心脏移植,术后随访第1年,心脏无淀粉样蛋白沉着;随访第2年,患者身体和智力均健康良好。Herlenins等认为肝移植可消除变异性TTR的来源。1995年起开始对TTR淀粉样变患者进行原位肝移植观察(FAPWTR),共16个国家54个中心,在近10年有539例患者作了原位肝移植,患者术后5年存活率为77%,与因其他慢性病做肝移植的结果相似,死亡主要原因与心脏相关,占39%,从这一结果来看,肝移植对TTR淀粉样变是一种最有效的治疗方法。自体造血干细胞移植可能有效,但尚未得到充分验证。













