英文名称 :protein-energy malnutrition
蛋白-热能营养不良症(protein-energy malnutrition,PEM)是一种以机体组织不断消耗、免疫功能低下、器官萎缩、生长发育停滞为特征的多种营养素缺乏症,而蛋白质-能量消耗(protein-energy wasting,PEW)综合征是PEM的一种特殊类型。本病多见于生长发育阶段的儿童及青少年,但各年龄阶段均可发病。临床表现为体重明显减轻、皮下脂肪减少、皮下水肿,常伴有各种器官功能损害。临床上,PEM分为以能量供应不足为主的消瘦型(kwashiorkor)、以蛋白质供应不足为主的水肿型(marasmus)和介于两者之间的混合型(mixed)。但是,国际上没有一个有关PEM的统一工作定义和诊断标准,PEM应该定义为临床疾病或疾病谱(disease spectrum)而非单纯的营养状态评估结果。
PEM与营养不良症(malnutrition)有联系而不同义。营养不良症是一种含糊而笼统的营养学概念,临床上一般根据患者的实际体重与理想体重之差进行判断。但是,体重只能反映营养状态的某些方面,而非全面。生活上的温饱是指不发生蛋白质-热能缺乏症的最低界线,但当人们解决温饱后,由于缺乏必需的营养知识及偏食、挑食等不良饮食生活习惯,或因患有某些慢性消耗性疾病等原因,同样可以导致PEM的发生。因此,PEM不仅是发展中国家而且也是发达国家的一种常见疾病状态。
PEM可分为原发性与继发性两类。
(一)食物缺乏与不良饮食习惯导致原发性PEM
在一些经济落后的贫穷国家或地区,原发性PEM成为影响健康与威胁生命的重要因素。Goetghebure报道,在扎伊尔Kivu地区,地方性PEM的流行导致该地区每年有5%的儿童死亡。原发性PEM在某些地区的中、小学生中的发病率较高,对生长发育极为不利。如马来西亚雪兰莪州的轻度和中-重度消瘦发生率分别为32.1%和56.5%;轻度和中-重度发育不良的发生率分别为25.6%和61.3%。西班牙加利西亚省的1项研究横断面研究随机调查了376例住院患者(其中包括189例女性、210例年龄大于65岁的老年人),营养不良的发生率为47%,而且营养不良与年龄和代谢应激(metabolic stress)的程度相关。
1.食物缺乏
自然灾害如严重的水、旱、虫灾导致的粮食欠收,战争带来的耕地荒芜或交通阻碍造成的食物短缺,或生产力水平低下、经济不发达等因素均可引发PEM流行。
2.食物摄取不足
因医疗诊断或其他需要而频繁禁食、精神心理异常的神经性厌食、低体重儿、禁食或其他原因所致的绝食,不良饮食行为中的挑食、偏食,及宗教信仰或其他原因引起的不合理素食(plant food,vegetable food)均可造成食物摄取不足或不合理而引起PEM。
3.蛋白质-热能需要量增加
在妊娠、哺乳、儿童生长发育等特殊时期,需要消耗大量营养物质,特别是蛋白质。如此时饮食营养的补充不足,则造成PEM。
4.消化吸收障碍或吸收能力低下
主要见于慢性胃肠疾病、药物或手术后,例如肥胖糖尿病经消化道旁路手术后,往往发生不被认识的营养素缺乏或PEM。
(二)躯体疾病并发PEM
继发性PEM是其他原发疾病的并发症。继发性PEM的患病率可能很高,据报道,约50%的住院患者伴有PEM。由于味蕾萎缩(萎缩性舌炎)、食欲减退及代谢减缓等原因,5%~13.2%的老年人患有PEM,而因各种疾病住院的老年人PEM患病率为30%~61%,长期住敬老院者的PEM患病率则高达40%~85%。在我国,边远地区学龄前儿童的原发性PEM患病率为18.9%,其中伴生长发育迟滞者51%,致残者1.4%;在综合性医院住院的老年患者中,营养不良患病率为36.1%,潜在营养不良为46.5%。2005年,中国疾病预防控制中心营养与食品安全所利用“1992全国营养调查”和“2002年中国居民营养与健康调查”中的体格测量资料,分析了我国5岁以下儿童营养不良状况及1992~2002年10年间的变化趋势,发现城市5岁以下儿童生长迟缓率由1992年的19.1%降为2002年的4.9%,农村由35.0%降为14.3%;城市低体重率由18.0%降为7.8%,农村由10.1%降为3.8%,说明我国的儿童营养状况已经有了根本改善,PEM的发病率大幅下降。
继发性PEM通常并非上述某种单一原因所致,有时可能是多种原因共同作用的结果,故继发性PEM的病因极为复杂。绝大多数慢性病患者多伴有不同程度的PEM。对我国百岁老人住院病因和转归情况的分析显示,76%患者存在低蛋白血症。社区医院的卒中恢复期患者低蛋白血症的检出率为38%,营养不良的检出率达41%。
1.食欲下降和厌食
人的食欲受许多因素的影响,发热、疼痛、器官功能及物质代谢紊乱、药物不良反应等均使患者食欲减退而不能摄取足够的食物。
2.分解代谢亢进
消耗增加而合成代谢障碍常见于甲状腺功能亢进症、糖尿病、脓毒血症、结核病及癌症等患者。HIV感染者特别容易发生PEM,其主要原因是分解代谢亢进和厌食。长期透析和髋部骨折的老年人常因分解代谢亢进而发生严重的PEM。
3.吸收不良
一些消化器官疾病不仅影响食物的消化,同时还伴有吸收不良。这些疾病包括慢性胃肠炎、短肠综合征、胃肠瘘,慢性肝胆与胰腺疾病等。由于消化液和消化酶分泌减少、酶活力降低,肠蠕动减弱,菌群失调,易致消化功能低下和PEM。
4.丢失过多
大出血、手术创伤或肾病综合征患者可因急性或慢性营养物质丢失而诱发PEM。此种PEM又称为蛋白质-能量消耗(protein-energy wasting,PEW)综合征。
5.慢性肾衰竭
常伴有继发性PEM,通常认为与下列因素有关:①蛋白质-热能摄入减少。患者食欲差且常伴有恶心、呕吐。非透析患者主要由于代谢废物对消化道直接作用所致。Aguilera等认为,接受腹透的患者其厌食、恶心、呕吐与TNF-α和神经肽Y有关。②透析促进分解代谢。③透析丢失营养素(氨基酸、多肽、蛋白质、葡萄糖、水溶性维生素等)。④禁食、糖皮质激素导致蛋白质摄入减少而分解增强。⑤慢性失血。⑥胰岛素、IGF-1和生长激素抵抗。⑦有害代谢产物积蓄。此外,医疗处置不当也是住院患者继发PEM的原因之一。
6.其他系统疾病
包括慢性肝病、慢性肺病、慢性心脏病、慢性消化系统疾病、血液系统疾病,等等。
7.恶性肿瘤
见于恶性肿瘤广泛转移、大手术后或放疗、化疗后等。
8.医源性因素
根据Butterworth等对多所医院住院患者的调查,医疗处置不当可引起营养缺乏状态或PEM,通常有3种主要原因。
(1)住院医疗处置不当
可引起营养缺乏状态或PEM的医疗行为主要包括:①长期使用5%葡萄糖与生理盐水静脉滴注;②没有常规记录患者身高、体重或记录结果不可靠;③频繁的诊断性禁食或禁食时间过长;④创伤、感染或发热引起的代谢亢进而处理不力;⑤手术前未对患者营养情况进行评价和处理或手术后未及时补充营养素;⑥营养素补充不合理;⑦过度使用抗生素或对营养与免疫系统功能的重要性认识不足;⑧不了解临床营养评价方法。
(2)药物滥用
引起医源性PEM的另一个重要因素是药物。个体对药物的耐受性与反应性由许多因素决定,但个体的营养状态(肥胖和PEM)可能是最主要和最常见的原因。例如,许多药物的剂量按体重或BMI给予,但是在肥胖和PEM患者中,这样做仍然因为药物的组织亲和性、体质成分(body composition)或药物清除(drug elimination)差异而导致明显的药物不耐受或药物失效。如果为了追求疗效而一味增大剂量(尤其是消化道反应较重的药物,如双胍类、抗生素类、生长抑素类),则常引起药物相关性PEM。
(3)减肥手术不当或术后处置不当
减肥手术可使重度肥胖者体重很快减轻,代谢状况明显改善。但术后可出现维生素、叶酸和微量元素缺乏,如果处理不当,个别可导致PEM。同样,大型的胃肠、胰腺或肝脏手术、肿瘤化疗或放疗后亦可出现营养不良症或PEM。
(一)消瘦型和水肿型PEM的表现重叠
临床上,常将以蛋白质缺乏为主的PEM称为水肿型PEM,而将能量缺乏为主者列为消瘦型PEM,两者兼有者则为混合型PEM。但事实上,消瘦型和水肿型PEM的病因、发病机制和临床表现均是重叠的,消瘦型和水肿型PEM的临床体征见表1。
表1 PEM的临床体征

1.消瘦型PEM
常有全身性肌肉消瘦,皮下脂肪减少,大多数体重降至标准体重的60%或更低,即恶性营养不良症(marasmic kwashiorkor)。儿童伴生长迟缓,头发稀少、无光泽、易脱落,皮肤干燥、无弹性、多皱纹,患者表情淡漠,易激惹,儿童出现“猴样面型”,有明显饥饿感但又同时厌食,一次不能耐受较多食物,否则引起呕吐甚至出现腹泻。体质虚弱,易感冒,易疲倦。心率、体温及血压均有不同程度下降。严重PEM常伴有多种维生素(尤其是维生素A和维生素D)缺乏症,并有相应的临床体征(表1)。并发感染、失水、酸中毒及电解质紊乱为死亡的重要原因。
病情较轻的老年患者主要表现为虚弱(frailty)和营养不良(malnutrition)。引起虚弱和准虚弱(pre-frailty)的因素很多,但以营养不良最常见,严重PEM的根本原因可能在食物的“质”而非“量”上。
PEM的发生是一个复杂的病理生理过程。恶病质(cachexia)是指肌肉丢失伴或不伴脂肪丢失与厌食,以及炎症和胰岛素抵抗的一种临床状态,常见于恶性肿瘤患者。脂肪分解使体内的贮存脂肪大量消耗,而骨骼肌的蛋白激酶磷酸化和真核启动因子2(eukaryotic initiation factor 2)表达增强,蛋白合成减少;癌症所致的恶病质可能与各种细胞因子特别是TNF-α、IL-6、IL-1和IFNγ等有关,而ghrelin可促进食欲,增加摄食,可用于恶病质的治疗。
2.水肿型PEM
为严重PEM的少见类型,全身水肿、常伴有感染,病死率高,发病机制未明,以前认为PEM主要与蛋白质严重缺乏有关,但研究发现水肿型PEM和消瘦型PEM动物的蛋白质供应量并无显著差别,前者的抗利尿激素(或其他抗利尿物质)分泌增多,当给予低热卡低蛋白饮食后,发生水潴留;此外,自由基和抗氧化剂消耗也与水肿的形成有关。死亡病例的尸检发现周身水肿,内脏及肌肉萎缩,并伴有严重的脂肪肝及骨髓衰竭(marrow failure)。水肿最先出现在下肢,呈凹陷性。随着病情的加重,水肿向上延至腹部、上肢及面部,儿童患者身高不受影响,皮下仍有一定量的脂肪,但肌肉松弛、脸圆、眼睑肿胀、皮肤薄而发亮。周身软弱无力,表情淡漠。严重病例呆板无表情,无食欲或厌食。常有腹泻或大量水样便及A族和B族维生素缺乏,或伴有肝大、心动过速等;低体温和低血糖亦较常见。其他并发症与消瘦型相同。
(二)机体适应性反应引起能量代谢和器官功能低下
PEM患者的能量代谢低下,这是机体对低蛋白质、低热能环境的一种适应性反应。有人比较了PEM儿童与正常儿童的基础代谢率(BMR),正常儿童每平方米体表面积的代谢率为(1180±23)kcal,而PEM儿童则为(837±16)kcal,后者较前者降低29%。但在成人继发性PEM病例中,因原发病不同,能量消耗与BMR的关系更为复杂。例如,癌症患者继发PEM时,能量消耗可降低、正常或增高。
循环系统表现为心脏收缩力减弱,心搏出量减少,血压偏低,脉细弱。肾小管重吸收功能降低,尿量增多而比重下降。神经系统症状包括精神抑制、表情淡漠、反应迟钝、记忆力减退等,头颅磁共振显像表现为脑萎缩和脑室扩张。
(三)蛋白质分解大于合成伴氨基酸谱异常
最初为肌肉组织的蛋白质含量减少,以后同时有内脏蛋白质消耗,随着体重明显下降及低蛋白血症,血浆总氨基酸显著下降。水肿型患者的必需氨基酸(特别是支链氨基酸和苏氨酸)下降更明显,缬氨酸、亮氨酸、异亮氨酸、蛋氨酸亦降低。正常儿童血液中缬氨酸浓度为250μmol/L,而水肿型PEM患儿可降低至30μmol/L。典型消瘦和水肿患儿血清谷氨酸显著增高,谷氨酸盐/丙氨酸比值增加。胰腺萎缩影响胰腺外分泌功能,患者不能耐受脂肪和高蛋白饮食。
(四)血糖降低伴脂代谢异常和维生素缺乏
PEM患者的血糖常降低,但其波动范围较大。严重消瘦型患者的空腹血糖常比水肿型更低。由于胰岛素水平下降,患者可能出现葡萄糖耐量减低,或因为糖原贮存减少、糖异生障碍等原因而导致低血糖症。但这些改变一般是可逆的。大约经过6周治疗,患者血糖及胰岛素基本恢复正常,糖耐量明显改善,但胰岛素抵抗的恢复可能需要更长时间。营养不良时,钾与铬缺乏对胰腺功能及糖代谢障碍亦有一定影响,如在营养不良的治疗过程中,补钾后随着体内钾总量的增加,胰岛素及胰岛素/葡萄糖比值亦明显增加。补充铬能改善葡萄糖耐量和增加空腹血糖水平。低血糖昏迷是严重消瘦型和水肿型PEM的一种表现,多见于因食物严重缺乏而导致慢性PEM患者长时间未进食时,患者常伴有低体温、心率减慢、血压偏低,如不进行及时抢救,常导致死亡。
PEM患者常有脂质代谢异常,其主要变化为必需脂肪酸缺乏和血脂成分改变。Franco等发现,Ⅲ度PEM儿童血浆必需脂肪酸降低,其中水肿型儿童血浆20碳四烯酸(C20:4)较对照组儿童低,而消瘦患儿血浆18碳二烯酸(C18:2)较水肿型儿童更低。Houssaini报道严重PEM患儿血浆apoAⅠ、总胆固醇、LDL-胆固醇降低,而血甘油三酯增高。这些儿童多存在不饱和脂肪酸和必需脂肪酸缺乏。尸检发现,水肿型PEM患者常有严重的肝脏脂肪浸润,肝脏脂肪可占体脂的20%~40%,肝内脂肪约占肝重的40%。脂肪肝是由于甘油三酯的积累所致。在治疗过程中,肝脏的甘油三酯转移至血液中可使血浆含量明显增高。肝大和脂肪肝在消瘦型患者中较少见,但血浆甘油三酯、胆固醇含量可增高。水肿型患者血浆甘油三酯、胆固醇、磷脂常降低。
PEM常伴有一种或多种脂溶性和/或水溶维生素缺乏,一般以脂溶性维生素缺乏多见,其主要原因是脂溶性维生素缺乏导致器官功能异常,且伴有典型的临床症状或体征,易引起医师的注意。如维生素A缺乏常有夜盲、干眼症;儿童患者伴有维生素D缺乏时常出现佝偻病体征。事实上,PEM患者更易发生水溶性维生素缺乏,但水溶性维生素缺乏临床上常没有特异性症状和体征。严重患者有脚气病、舌炎、阴囊炎、周围神经病变或视神经病变等表现。
(五)PEM导致免疫功能紊乱与内分泌功能异常
PEM对免疫系统各环节均有显著影响(表2),其非特异性(如皮肤黏膜屏障功能、白细胞吞噬功能、补体功能)和特异性免疫功能明显降低,Kwashiorkor患者免疫功能受损尤为明显。
表2 蛋白质-热能营养不良症(PEM)对免疫系统的影响

PEM患者血浆皮质醇增加,水肿型患者血浆皮质醇和尿17-羟皮质类固醇增高较消瘦型更为明显,并伴有昼夜分泌节律改变和外源性皮质醇清除障碍,可能是由于蛋白质-能量缺乏激活下丘脑-垂体-肾上腺轴,或是对感染和低血糖的一种慢性应激反应。此外,血浆皮质醇增高可引起胸腺萎缩,并进而引起免疫功能障碍。
血甲状腺激素降低,并可进一步影响其他营养素在体内的代谢。儿童患有PEM时,血T3降低,核黄素增高,FAD减少,这是因为甲状腺激素降低后,肝内黄素激酶和FAD合酶活性降低,体内核黄素转化为FMN和FAD代谢速率减缓所致。中、重度营养不良者常伴有甲状腺摄碘能力下降,蛋白结合碘减少,血清T4下降,但患者甲状腺本身无病变;随着PEM改善,甲状腺功能亦逐渐恢复正常。机体对营养不良这一应激应视为适应性调整;临床上将此种现象称为甲状腺病态综合征。
PEM对男、女性腺激素的分泌均有影响。64.9%的PEM男性血清睾酮低于正常,36.6%游离睾酮低于正常。低BMI男性患者血LH升高;女性则相反,低BMI者血FSH降低。营养指标与这些性腺激素水平有相关关系。慢性营养不良患儿成年后易发生月经紊乱、骨质疏松和代谢综合征。
(六)PEM并发水与电解质平衡紊乱
无论是水肿型还是消瘦型PEM患者,体内水分按体重百分率计算均有增加。水肿型和混合型患者的水肿与低蛋白血症有关,但醛固酮分泌增加及肝脏灭活抗利尿激素能力减弱亦是重要因素。此外,失水亦是PEM患者常见的并发症。
PEM患者总体钾含量降低,其中主要是肌肉组织中钾丢失所致。但血浆钾浓度不能反映组织缺钾情况。总体钠含量增加,肌肉、脑、红细胞中钠均比正常人高。此外,肌肉中的镁含量减少20%~30%,而脑、心、肝、肾组织中的镁/氮比值正常,红细胞内镁明显降低,甚至在临床症状消失后仍不能恢复至正常水平。血镁浓度对镁缺乏的诊断意义不大,镁负荷试验可反映镁缺乏情况。镁缺乏常与钾缺乏同时存在,故治疗时同时补给这两种元素制剂可降低PEM的死亡率。约12%的水肿患儿伴有严重的低磷血症,这些患儿在入院48小时内死亡率为63%,较无低磷血症者高出近2倍。故PEM伴有低磷血症时应引起高度重视。皮肤病变、失水与严重低磷血症有关,但这些临床改变并非导致低磷血症患儿死亡的最根本原因。
在多数情况下,PEM患者病情较危重,故应尽早采取处理措施,其主要目的是:①立即改善威胁生命的PEM指标;②有步骤地恢复和补充营养物质;③确保机体在营养复原中预防并发症;④除了在医学处置中注意药物的不良反应外,还需要根据个体的具体情况,避免药物引起或加重PEM。一般根据病情可分为急救期和恢复期2个治疗阶段。
(一)优先处理严重并发症
1.低血糖症
低血糖是PEM常见的并发症,消瘦型PEM患者血糖常低于2mmol/L,且伴有低血糖的临床症状。一经确定,应迅速给予50%葡萄糖60~100ml静脉注射,缺糖症状可迅速得以纠正。患者清醒后,不宜用5%~10%葡萄糖液静脉滴注来维持血糖,因患者血浆蛋白低,呈低渗状态,输入大量液体易发生脑水肿而危及生命。正确的方法应给予米汤、稀薄的米或面糊经口摄入,每次用量不宜过多,宜少食多餐,但1天可给6~8次或更多,此时切勿给予普通饮食或摄食过量,因患者肠壁已很薄,无法消化、吸收普通食物、粗糙食物或过量的食物,稍一过量即可导致消化道功能紊乱甚至引起肠穿孔。正确的方法应从流质、半流质饮食逐渐过渡至软食、普通饮食。
2.低体温状态
严重消瘦型患者伴有低体温时,死亡率较高。低体温主要由于能量不足,甲状腺激素降低,体温调节功能障碍,环境温度低以及合并败血症等原因所致。有时肛温可低于35℃。治疗要保持环境温度恒定在30~33℃。以电热毯、暖水袋等方法防止体温散失。每2小时摄取含糖饮食1次,促进患者主动产热。
3.水与电解质平衡紊乱
失水是PEM患者常见的危重表现之一。与正常人的失水不同,PEM患者的水与电解质平衡紊乱为低渗性且伴中度的低钠症及轻至中等度的酸中毒,如给患者适当的能量和电解质,酸中毒即可纠正。水分的补充要保证患者有足够的尿量排出。补液速度不宜太快,多数情况下可采用口服。WHO推荐的口服补盐液处方即氯化钠3.5g、氯化钾1.5g、葡萄糖40g加水溶解配成1L。中等度失水的儿童,12小时内可补充70~100ml/kg。电解质的补充着重注意钾、钙和镁平衡紊乱的纠正。当排出尿量正常时,每天可补钾6~8mmol/kg。钠的补充量宜适中,以每天3~5mmol/kg为宜。补钠过量可使血容量骤增,易引起心力衰竭。
一般每次静脉滴注葡萄糖酸钙0.5~1g。若患者有手足搐搦、震颤、神经异常等,必须重视镁的补充,可给予50%硫酸镁注射液肌内注射。
4.心力衰竭
简称心衰,多见于水肿型患者,主要由于心脏功能障碍和水肿消退时血容量增加,加重心脏负荷所致。心衰发生前,患者常有体循环系统淤血的表现如肝脏大、颈静脉充盈等。治疗时可采用利尿剂、吸氧及其他支持疗法。洋地黄类强心药物只能作为纠正心衰的辅助手段。儿童患者对洋地黄类药物较敏感,要慎用。
5.血液透析并发症
每周3次的血液透析疗法不能维持原有自身功能,并可能引起新的并发症。腹膜透析患者的生活质量比血透者好,但丢失的蛋白可能更多,白天和夜间的慢速血透(daily and slow nocturnal hemodialysis)具有一定的优越性,但仍需防治应用不良等并发症,主要的措施有营养补充、合成类类固醇激素、GH、雄激素受体调节剂、食欲促进剂、蛋白酶体抑制剂(proteasome inhibitors)等。
6.感染
PEM患者抵抗力下降,易并发各种感染。肺部感染和败血症较为常见,根据致病菌的药敏试验选用合理的抗生素控制感染是减少PEM死亡的重要措施。
(二)根据病情确定营养治疗方案
营养治疗(nutritional therapy)是PEM的根本治疗,但此时患者各器官功能障碍、代谢水平低下,营养治疗特别是饮食的摄入应从小量开始,随着生理功能的适应和恢复,有计划、有步骤地增加。
1.能量和蛋白质
可按以下方案进行治疗:①儿童患者,开始时蛋白质的供给量为每天每公斤体重1g,能量为80~100kcal,以后逐渐增加至3~4g,能量为120~160kcal,为减少食物的容积,由植物油脂所提供的热能的比例可占全日总热量的30%~40%。②成人患者,开始时蛋白质的摄取量为每天0.6g/kg,能量为50kcal,以后可逐渐增至2~3g,能量达80~100kcal。蛋白质食物来源以牛奶、酪蛋白、蛋类和鱼类等优质蛋白质为宜,较大儿童和成人可适当加入豆类蛋白质。一般每日给予氨基酸0.8~1.5g/kg,碳水化合物占非蛋白能量(non-protein energy)的60%,脂肪40%及足够的电解质和微量元素。初始阶段饮食给予易消化、无刺激的食物,根据病情也可采用流质、半流质或软食等。
值得注意的是,继发性PEM的住院患者因为受原发性疾病等因素的影响,患者的热能、蛋白质等营养素的代谢及需要量应视具体情况而定。测算患者的能量消耗有许多方法,例如间接能量测定仪,代谢计算法等,然而这些方法应用时却难度较大。常用的能量需要量计算方法多沿用Harris-Benedict公式:男性:BEE(kcal)=66.5+13.8W+5H-6.8A;女性:BEE(kcal)=655+9.6W+1.8H-4.7A;婴儿:BEE (Kcal)= 22.1+31W+1.16A。
上式所得结果为患者24小时基础热能消耗(basal energy expenditure,BEE),公式中W=体重(kg),H=身高(cm),A=年龄。BEE并不能代表患者的实际热能消耗,实际热能消耗还受活动因素(activity factor,AF)、损伤因素(injury factor,IF)和体温因素(temperature factor,TF)的影响。有人研究了这些因素对热能需要的影响,并将不同程度的因素赋予不同系数(表6)。
表6 影响热能消耗的因素
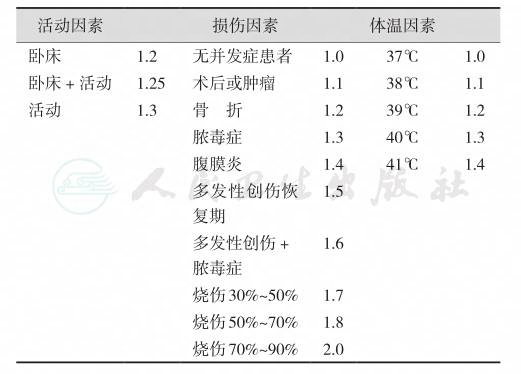
患者实际热能消耗(AEE)可以下列公式表示:AEE=BEE× AF×IF×TF。除BEE外,临床上更多地使用静息能量消耗(resting energy expenditure,REE)。REE系指进餐后2小时以上,在合适温度下,安静平卧或静坐30分钟以上所测得的人体能量消耗。与BEE相比,REE约增高10%,但测定较BEE简单。复旦大学附属中山医院根据我国人体测量结果,提出计算住院患者REE的公式为:男性:REE(kcal/24h)=5.48H(cm)+11.51W(kg)-3.47A(岁)-189;女性:REE(kcal/24h)=2.95H(cm)+8.73W(kg)-1.94A(岁)+252。
2.胃肠外营养
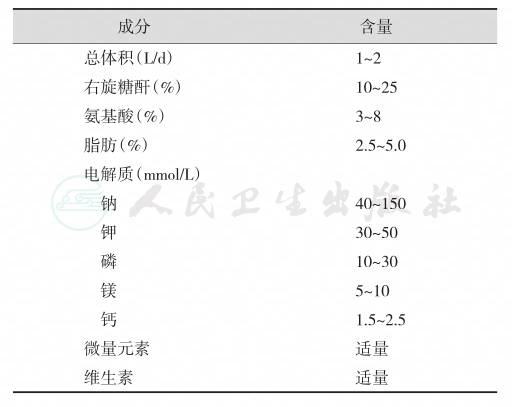
严重的PEM病情常较为复杂,有时可能影响进食或根本不能进食,或即使进食也很难达到营养治疗的要求,此时可考虑给予肠外营养治疗。德国营养学会特别指出,除不能进食者,ICU的危重患者不应该随便使用胃肠外营养(parenteral nutrition,PPN)。通常可将葡萄糖液、脂肪乳剂、氨基酸液、矿物质和维生素制剂混合配制由外周静脉或中心静脉输入(表7)。用量由少量开始,逐渐增加。严重PEM患者常有代谢低下或紊乱,如糖耐量减低、蛋白质合成能力不足等,超负荷的营养治疗往往导致严重的代谢并发症,如高渗性脱水昏迷、高血糖症或加重原有的水、电解质平衡紊乱。
表7 中心静脉营养支持处方
有时也可根据病情由外周静脉输入单一的某种营养制剂,如复方氨基酸液、脂肪乳剂等,作为营养治疗的辅助治疗。肠外营养通常不作为PEM的常规治疗,只有当病情严重而又有肠道吸收功能障碍时才考虑使用。静脉注射用脂肪乳剂(intravenous fat emulsions,IVFEs)的使用应格外小心。脂肪乳剂中的脂肪颗粒利用需要脂蛋白酯酶(lipoprotein lipase),如果使用的时间或速度超过脂蛋白酯酶对其的清除能力,即可能发生不良事件(adverse events)。如果使用10%的脂肪乳剂过多,因其所含的游离磷脂(free phospholipid)高于20%的脂肪乳剂,而游离磷脂可干扰脂蛋白酯酶活性。如果剂量在每天2.5g/kg内,速度不高于每小时0.1g/kg,不良事件的发生率很低。此外,在10%脂肪乳剂中加入的麻醉剂异丙酚(propofol)可能增加升高血清甘油三酯和胰腺炎风险;而在20%的脂肪乳剂中加入氯维地平(clevidipine)使不良事件率降低。
中心静脉营养支持主要适用于危重病例和严重营养不良患者的急性期治疗,一般使用5~7天。
(1)碳水化合物选择
在所供给的碳水化合物中,一般使用葡萄糖,不再应用果糖和山梨醇,因为一旦出现遗传性不相容反应,其后果将相当严重。小样本研究发现,木糖醇(xylit)可降低高血糖,减轻肝糖输出和肝糖异生,但这一结果未被以后的大样本研究证实,不推荐应用,尤其是草酸盐沉着症患者不宜使用木糖醇。此外,果糖和山梨醇还是诱发D-乳酸性酸中毒(D-lactic acidosis)和骨质疏松及骨质软化的重要原因。
(2)中心静脉营养支持引起的高血糖症
如果患者在营养支持治疗前的血糖正常,中心静脉营养支持治疗后血糖>110mg/dl,应减少碳水化合物的用量,并加用胰岛素。如果应用的胰岛素量≥20U/h而不能使血糖降至145mg/dl(最好<110mg/dl)以下,应进一步减少碳水化合物的供给量,直到血糖正常。相反,如果血糖已经降至80mg/dl以下,则在增加碳水化合物用量的同时,适当减少胰岛素的用量。
如果患者在营养支持治疗前的血糖>110mg/dl,那么静脉营养支持必然使血糖进一步升高,因此必须及时使用胰岛素持续静脉滴注,尽在以≤4U/h可以维持目标血糖的前提下,开始供给葡萄糖。
3.要素膳
要素膳(elemental diet)系一种营养素种类较齐、比例恰当,且不需消化或经轻微水解即可在小肠上端吸收的经肠营养配方膳。该膳分营养支持及特殊治疗两类。PEM患者可选用营养支持型要素膳,根据病情不同时期,可选用低脂型或高蛋白型。严重PEM患者、治疗早期消化与吸收功能较差、食欲不强、食量较少时,可辅以要素膳。开始时可将要素膳配制成10%~15%的浓度,少量试喂(管饲或经口饮用),每次100~200ml,每3~4小时1次,观察一两天如无腹泻、腹痛等反应,可逐渐将浓度增加至20%~25%(不宜超过25%),每次用量200ml左右,每2~3小时1次。要素膳用于营养支持常能收到较好的治疗效果。要素膳是一种粉末状配方膳,国内有多个生产要素膳的厂家,产品均大同小异。如果危重症患者不能口服,可给予肠道营养(enteral nutrition,EN)。
4.维生素
PEM常伴有维生素缺乏,开始时应补给维生素A、维生素D、维生素B族及维生素C等制剂。如有典型缺乏表现,一般应给予较大剂量治疗。
5.无机盐
钾的补给量可根据血钾监测结果随时调整。钠的补给宜少,以防心衰,3~5mmol/(kg·d)即可。补钙0.5~1g/d;铁16~32mg/d;镁2~3mmol/(kg·d)。
(三)恢复体质并去除病因
此时以经胃肠营养治疗为主。患者靠摄取食物获得各种营养素以满足身体恢复期的需要。蛋白质和能量的摄入维持急救后期时的较高水平。患者全身状况好转,食欲改善,体重逐渐增加,水肿消退,6~8周后血浆白蛋白可达30g/L以上。大约经过12周的持续营养治疗,并辅以体力锻炼,体内蛋白质和能量可恢复正常。
1.IGF-1
是近年来辅助治疗PEM,特别是继发性PEM的有效方法。IGF-1的分子结构与前胰岛素相似,有类似胰岛素促使葡萄糖运转,增加肌肉糖的分解与糖原合成的作用,同样也可促进体内脂肪的合成。并促进DNA和RNA合成,使成纤维细胞、软骨细胞中蛋白质增多,还有促细胞分裂增殖作用。研究证实,PEM儿童血清IGF-1是降低的,其降低程度与PEM程度平行。Hatton等认为,在保证能量与蛋白质供给充足的条件下,给予中、重度脑损伤患者IGF-1有预防蛋白质热量营养不良发生及促进患者蛋白质热能营养不良恢复的作用,能改善患者的预后及氮的利用率。Fouque给予能活动、持续腹膜透析并有营养不良的肾衰竭患者重组IGF-1(rhIGF-1),剂量为每12小时100μg/kg,20天后血IGF-1增高100%,氮平衡为+2g/d,血尿素氮减低,合成代谢增强。
Pichard等报告用重组GH(rhGH)成功地治疗1例肺功能不全伴严重营养不良(恶病质)的患者。这位38岁的女性患者,因阻塞性毛细支气管炎10年,需要持续性机械通气,患者曾接受了泼尼松口服,BMI为15.2kg/m2。经用rhGH 16U(35天为1疗程,间断35天后开始第2个疗程),在为期3.5个月的治疗期间,患者体重增加14.7%,氮的排出由治疗前每天的23.7g降至8g,至第2个疗程后出院时肺功能明显改善。2个月后,患者成功地接受了肺移植手术,6个月后体重增至48.8kg。作者认为,rhGH可能成为治疗等待肺移植患者营养不良的重要手段,rhGH能改善营养状况和呼吸肌功能,有预防呼吸道感染和减少术后并发症的作用。从以上临床研究结果可以看到,IGF-1(或rhIGF-1)和rhGH是治疗蛋白质-热能营养不良特别是继发性蛋白质热能营养不良的主要措施之一。但IGF-1治疗PEM只有在保证营养供给充分的条件下才能发挥其作用。
2.GH和葛瑞林
GH替代治疗可使PEM患者的肌肉含量增加5%~10%,但部分是由于体液潴留所致,而且GH可导致胰岛素抵抗和糖耐量减退。因此,使用者在禁食状态时,可能因糖异生而减少蛋白质分解,但在餐后则引起糖代谢障碍。葛瑞林(ghrelin)可促进食欲,增加体重,与GH合用于急性与亚急性疾病伴营养不良者。Dong等对合并PEM的透析患者使用促合成治疗方案的效果进行了综述,发现生长激素、雄激素、葛瑞林对于改善这部分患者的营养状态有较大益处。
(四)处理合并症与并发症
PEM患者可能存在多种并发症,如心衰、感染、性腺功能减退等,其处理原则和方法与其他疾病所致者相同。在处理这些临床情况时,有两点值得特别提出,即药物的剂量与药物效应。
1.药物剂量
机内总的水量(total body water,TBW)随着营养不良的程度而增加,而脂肪和体重瘦随着营养不良的程度而降低;脂溶性药物的体内表观分布容量(apparent volume of distribution)明显减少,是靶组织的药物浓度升高,药物作用时间延长。例如,氨基糖苷类抗生素的靶组织的药物浓度升高足以引起肾脏毒性和耳毒性,而青霉素、妥布霉素、氨基糖苷类中的链霉素和头孢西丁(cefoxitin)似乎较安全。
2.药物效应
酸性药物进入体内后,常与白蛋白结合,而艰辛药物多与α1-酸性糖蛋白(α1-acid glycoprotein)结合,PEM时结合的药物降低,流离的药物浓度升高,毒性增大。所以建议适当减少药物的用量或延长药物的给药时间。













