英文名称 :hyperlipidemia
中文别名 :高脂血症
血脂谱异常症(dyslipidemia)又称为高脂血症(hyperlipidemia),是指血浆中的脂蛋白谱异常,一般特指甘油三酯和LDL-C升高伴或不伴HDL-C降低。人群中的血脂水平呈钟形正态分布,正常与异常之间并不存在明确的界限。血脂谱异常症、高血压、肥胖和代谢综合征的关系密切,重型肥胖与血脂谱异常症已经成为许多国家的严重社会问题。长期以来,一直是将人群血脂分布中最高的5%~10%部分,即第90~95百分位数以上的水平定义为血脂谱异常症。
临床上,通常根据引起血脂谱异常症的原因将其分为原发性和继发性两类(表5-33-7)。原发性血脂谱异常症是由于遗传基因缺陷所致,原因不明的血脂谱异常症称为散发性或多基因性血脂谱异常症。因全身系统性疾病所致者称为继发性血脂谱异常症。引起血脂升高的系统性疾病主要有糖尿病、甲状腺功能减退症、肝肾疾病、糖原贮积症、系统性红斑狼疮、骨髓瘤、脂肪萎缩症、急性卟啉病等。此外,某些药物如利尿剂、β受体阻滞剂、糖皮质激素等也引起继发性血脂升高。临床所见的血脂谱异常症,多数同时存在两种以上情况。
表5-33-7 血脂谱异常症的病因分类

(一) 脂代谢相关基因缺陷导致原发性血脂谱异常
与脂代谢有关的基因发生突变可导致脂蛋白降解酶活性降低,脂蛋白结构或受体缺陷使脂蛋白在体内的清除减少或分解代谢减慢;或增加脂蛋白的合成、影响饮食中脂肪的吸收等,引起各种类型的原发性血脂谱异常症,如家族性脂蛋白脂酶缺陷症、家族性载脂蛋白CⅡ缺陷症、家族性高胆固醇血症、家族性载脂蛋白B100缺陷症、家族性异常β脂蛋白血症、家族性混合型血脂谱异常症、家族性高TG血症等。其中,家族性高胆固醇血症又可分为家族性单基因高胆固醇血症(familial monogenic hypercholesterolemia)和家族性多基因高胆固醇血症(familial polygenic hypercholesterolemia)两种。家族性单基因高胆固醇血症还可分为杂合子型和纯合子型两个亚类。各型原发性血脂谱异常症的基因突变情况见表5-33-8。
(二) 获得性因素引起继发性血脂谱异常
引起血浆脂蛋白水平升高的获得性因素很多,无论是脂蛋白的产生或由组织排泌入血浆过多,还是清除或从血浆中移去减少,均可导致一种或多种脂蛋白在血浆中过度堆积。获得性因素主要包括高脂肪饮食与高热量饮食、肥胖、增龄和不良生活习惯和某些疾病等。
1. 饮食脂肪过多
是常见的引起血脂谱异常症的非病理性因素。每日饮食中的胆固醇从200mg增至400mg时,可使血浆胆固醇上升0.13mmol/L(5mg/dl)。如果饱和脂肪酸的热卡达到饮食总热卡的14%,血浆胆固醇亦因此而升高0.52mmol/L(20mg/dl)左右。大量摄入单糖引起血糖升高,进而导致胰岛素分泌增多,后者促进肝脏合成TG和VLDL,引起血浆TG浓度升高;单糖还可改变VLDL的结构,使其清除速度减慢。此外,高糖膳食可诱导脂蛋白脂酶抑制因子ApoC Ⅲ基因表达增加,血浆ApoC Ⅲ浓度升高又可抑制脂蛋白脂酶活性,从而减慢乳糜微粒和VLDL中TG的水解,引起高甘油三酯血症。
2. 肥胖
肥胖是血浆胆固醇升高的另一个重要因素。体重增加一方面促进肝脏合成载脂蛋白B,使LDL产生增加;另一方面可增加体内胆固醇合成,使肝内胆固醇池扩大,并抑制LDL受体合成。肥胖患者容易发生异位脂肪储积(ectopic fat storage),异位脂肪可储积于肝脏、肌肉、脾脏、胰腺和其他内脏器官,大量的皮下脂肪和异位储积的脂肪在脂肪细胞因子和内分泌激素的作用下,脂解增加,血甘油三酯升高,肝游离脂肪酸释放增多,引起胰岛素抵抗、T2DM、代谢综合征、脂代谢紊乱和高血压。
表5-33-8 原发性血脂谱异常症的遗传特点

3. 增龄
血浆胆固醇水平随年龄的增长而轻度升高。这是因为老年人的LDL受体活性降低,导致其分解代谢减慢。由于体内的胆酸合成随年龄增加而减少,使肝内胆固醇含量增加,进一步抑制LDL受体活性。此外,体重也随着增龄而有所增加,但排除体重因素以后,增龄本身亦使血浆胆固醇水平上升。
4. 长期大量饮酒
可抑制肝内脂肪酸氧化,脂肪酸合成增多,导致TG与VLDL产生增多,血浆TG升高。吸烟也使血浆中TG升高,可能主要与脂肪组织中脂蛋白脂酶活性降低有关。
5. 药物
雌激素增加VLDL的生成而引起血浆TG升高,常与用药剂量有关。糖皮质激素既增加VLDL的合成,可使VLDL转化为LDL增多,最终使血浆胆固醇和TG均升高。此外,噻嗪类利尿剂和β受体阻滞剂亦可引起血脂谱异常症。
6. 疾病状态
引起血脂谱异常症的疾病很多,常见于糖尿病、肝胆疾病、肾脏疾病、雌激素缺乏症、甲状腺功能减退症、神经性厌食、急性间歇性卟啉病、系统性红斑狼疮、异常丙种球蛋白血症、多发性骨髓瘤、糖原累积病和脂肪营养不良等。
(1) 糖尿病:
胰岛素缺乏可抑制脂蛋白脂酶的活性,使乳糜微粒在血浆中聚积。血脂谱异常是糖尿病的重要生化表现和心血管不良事件危险因素之一,但1型和T2DM的血脂谱异常有所不同。血糖控制欠佳的T1DM患者血TG和VLDL明显升高,但血胆固醇和LDL可正常或降低,而HDL多为正常或升高;经用胰岛素控制血糖后,血脂谱一般可转为正常,少数患者的血脂谱异常仍持续存在。因而,T1DM所伴的血脂谱异常多属于继发性血脂谱异常。
(2) 肝胆疾病:
胆道结石、肝脏肿瘤、胆汁性肝硬化、胆道闭锁等所致的胆道阻塞,使胆酸、胆固醇排入胆道发生障碍,引起游离胆固醇和TG升高。
(3) 肾脏疾病:
可引起VLDL和LDL合成增加,同时可伴有脂蛋白分解代谢减慢,肾病综合征时胆固醇和TG均升高。临床上最明显的例子是肾病综合征,患者的TG、血清胆固醇均显著升高,并与低蛋白血症密切相关;透析治疗的尿毒症患者以TG升高为主,接受肾移植的患者主要为胆固醇升高。
(4) 雌激素缺乏:
由于雌激素可通过增加LDL受体的表达而增强LDL的分解代谢,故45~50岁女性的血浆胆固醇常低于同龄男性。绝经后,女性的胆固醇逐渐升高,最终达到并可超过男性水平。
(5) 甲状腺功能减退:
肝脏的TG脂酶减少,导致VLDL清除减慢,同时可合并IDL生成过多。
(6) 其他系统性疾病:
许多全身系统性疾病可通过各种途径引起血浆胆固醇和(或) TG水平升高。多发性骨髓瘤的异型蛋白可抑制血浆中乳糜微粒和VLDL的清除。脂肪营养不良的脂肪组织中脂蛋白脂酶减少,可伴有肝脏合成VLDL增多等。银屑病(psoriasis)患者的心血管病、脑血管病和外周血管病发病率增高,其原因未明,一般认为与银屑病的慢性炎症和血脂谱异常有关,因此可用他汀类药物治疗。
血脂谱异常症的病理生理复杂,而血脂谱异常症本身没有特殊的临床表现。肥胖、皮肤黄色瘤、动脉粥样硬化和非酒精性脂肪肝是血脂谱异常症的间接表现。
(一) 血脂谱异常导致动脉粥样硬化和心脑血管事件
血脂谱异常症对心血管病的3个主要决定因素是LDL颗粒的数目、大小以与HDL水平。肥胖、高血压和代谢综合征是血脂谱异常症的主要危险因素。此外,血脂谱异常患者的后代(即使无肥胖和高血压)也易发生血脂谱异常症。脂质在血管内皮沉积是血脂谱异常症的最主要后果,动脉粥样硬化的发生和发展又是一种缓慢渐进的过程,如能抑制和延缓动脉硬化的发生,就可达到本症的预防和治疗目的。
1. LDL-C升高
LDL质的异常主要体现在小而密低密度脂蛋白(sLDL)增多上。这种LDL容易在动脉壁沉积和被单核巨噬细胞吞噬。sLDL主要与高TG血症有关,高TG和高VLDL刺激CETP活性,促进TG向LDL转移,形成小而密的LDL。sLDL与LDL受体亲和力下降,分解代谢减少伴巨噬细胞摄取增多。对氧化反应敏感性增强,因此更具有致动脉粥样硬化作用。家族性高胆固醇血症的血浆胆固醇常高于7.8mmol/L(300mg/dl),LDL-C高于6.5mmol/L(250mg/dl),家族性载脂蛋白B100缺陷症的血浆LDL-C升高。同一家族性混合血脂谱异常症家族中的不同患者,其血脂变化多端,可以是胆固醇、TG或两者均中度升高,并常伴有HDL-C降低。甚至同1个患者的不同时期其血脂情况亦可发生变化。
2. 高TG血症
血中非酯化脂肪酸(FFA)升高,进入肝脏的FFA增多,肝脏合成和释放极低密度脂蛋白(VLDL)及胆固醇酯(FFA与胆固醇分子联合形成胆固醇酯),胆固醇酯浓度调节VLDL的产生,其浓度升高时VLDL合成增加,同时富含TG的脂蛋白产生增多。高TG血症与冠心病的危险性增高独立相关。
Ⅲ型高脂蛋白血症的血浆胆固醇和TG中度升高,HDL-C正常而LDL-C降低。家族性脂蛋白脂酶缺陷症和家族性载脂蛋白CⅡ缺陷症均可导致严重的高甘油三酯血症,血浆TG高达11.3~22.6mmol/L(1000~2000mg/dl)或更高。家族性高甘油三酯血症的血浆TG一般为2.3~5.6mmol/L(200~500mg/dl),当合并甲状腺功能减退、雌激素治疗或大量饮酒等情况时,可使TG升至11.3mmol/L(1000mg/dl)或更高。
高TG血症(10mmol/L以上时)是胰腺炎的重要发病病因(约7%),称为高TG血症所致的胰腺炎(hypertriglyceridemiainduced pancreatitis),死亡率在20%以上。发病机制可能是:①乳糜微粒(chylomicrons)堵塞胰腺的毛细血管床,局部缺血;②胰腺腺泡中的脂肪酶与乳糜微粒直接接触,诱发前炎症因子释放、胰腺坏死、炎症和水肿。
3. HDL-C下降
TG增高时,胆固醇酯酰基转运蛋白(CETP)将HDL-C中的胆固醇转到VLDL的交换增加,促进HDL-C分解。另外,VLDL清除障碍和LPL活性降低也使HDL3向HDL2转换减少。
4. 载脂蛋白异常
ApoAⅠ糖化使HDL-C与HDL受体亲和力下降而影响细胞内胆固醇流动。由于新生态的HDL-C主要由肝脏产生,进入血液循环后主要功能为清除胆固醇,与之结合后转运入肝脏而代谢,部分经胆汁排出,故可使总胆固醇下降,为动脉粥样硬化和冠心病的保护因子。糖基化低密度脂蛋白(Gly-LDL)和氧化型低密度脂蛋白(ox-LDL)促进早期动脉粥样硬化形成,引发免疫反应,使吞噬细胞释放白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)等,导致血管病变。
(二) 脂质沉积形成黄色瘤
血脂谱异常症患者可因过多的脂质沉积在局部组织而形成黄色瘤(xanthoma)。通常表现为局限性皮肤隆凸,颜色可为黄色、橘黄色或棕红色,多呈结节、斑块或丘疹等形状,质地柔软。根据黄色瘤的形态与发生部位不同,可分为扁平黄色瘤、掌皱纹黄色瘤、结节性黄色瘤、疹性黄色瘤、结节疹性黄色瘤及肌腱黄色瘤等。
各种黄色瘤的病理改变基本相似。真皮内有大量吞噬脂质的巨噬细胞(称为泡沫细胞),又称为黄色瘤细胞。早期常伴有炎性细胞,晚期可发生成纤维细胞增生。有时可见核呈环状排列的多核巨细胞。用猩红或苏丹红进行冷冻切片染色,可显示泡沫细胞内含有胆固醇和胆固醇酯。一种黄色瘤可见于不同类型的血脂谱异常症,同一类型的血脂谱异常症又可出现多种形态的黄色瘤,经有效降脂治疗后多数黄色瘤可逐渐消退。
1. 扁平黄色瘤
主要见于眼睑周围,故又称为眼睑黄色瘤,较为常见。一般表现为上睑内眦处的扁平丘疹,呈橘黄色,米粒至黄豆大小,椭圆形,边界清楚,质地柔软。通常发展缓慢,数目可逐渐增多。少数可累及面、颈、躯干和肢体。主要见于家族性高胆固醇血症、家族性载脂蛋白B100缺陷症和Ⅲ型高脂蛋白血症;亦可见于血脂正常者,可能是由于组织中的巨噬细胞过多摄取被氧化或修饰的脂蛋白所致。
2. 掌皱纹黄色瘤
分布于手掌及手指的皱纹处,呈橘黄色的线条状扁平轻度凸起。此乃Ⅲ型高脂蛋白血症的特征性表现,约有50%的患者可出现掌皱纹黄色瘤。
3. 结节性黄色瘤
好发于肘、膝、指节的伸侧,以及踝、髋、臀部,早期散在分布,为黄豆至鸡蛋大小的圆形结节,呈黄色、橘黄色或棕红色,边界清楚,质地柔软。一般进展缓慢。后期结节增多,并融合成大小不等的分叶状斑块,由于有纤维化形成,质地逐渐变硬,不易消退。如损伤或合并感染,可形成溃疡。此种黄色瘤具有诊断特异性,主要见于Ⅲ型高脂蛋白血症。
4. 疹性黄色瘤
表现为橘黄或棕黄色的小丘疹,其中心发白,伴有炎性基底,类似于痤疮,好发于腹壁、背部、臀部及其他容易受压的部位,有时口腔黏膜也可受累。主要见于家族性脂蛋白脂酶缺陷症和家族性载脂蛋白CⅡ缺陷症所致的严重高TG血症。
5. 结节疹性黄色瘤
多见于四肢伸侧,如肘部和臀部,呈橘黄色结节状,可在短期内成批出现,有融合趋势,周围有疹状黄色瘤包绕,常伴有炎性基底。主要见于Ⅲ型高脂蛋白血症。
6. 肌腱黄色瘤
这是一种特殊类型的结节状黄色瘤,发生在肌腱部位,常见于跟腱、手或足背伸肌腱、膝部股直肌和肩三角肌腱等处。为圆或卵圆形,质硬的皮下结节,与皮肤黏连,边界清楚。约有58%的家族性高胆固醇血症患者可出现肌腱黄色瘤,家族性载脂蛋白B100患者有38%发生肌腱黄色瘤,亦见于部分Ⅲ型高脂蛋白血症患者。如果不仔细检查,一些小的肌腱黄色瘤很容易被遗漏。X线照片可显示跟腱黄色瘤的情况。
(三) 血脂谱异常引起器官脂质沉积与浸润
异常增多的脂质沉积在肝脏和脾脏,导致其体积增大,镜下可见大量的泡沫细胞。此外,骨髓中可见类泡沫细胞。此外,少数患者还可因乳糜微粒栓子阻塞胰腺的毛细血管导致胰腺炎发生。
家族性脂蛋白脂酶缺陷症患者可因乳糜微粒栓子阻塞胰腺的毛细血管,引起局限性胰腺细胞坏死而导致复发性胰腺炎。约有1/3至1/2的患者可发生急性胰腺炎,常于进食高脂饮食或饱餐后发生,腹痛程度与血浆TG水平呈正相关。家族性载脂蛋白CⅡ缺陷症患者亦可发生胰腺炎,但其血浆VLDL-C水平相对较高,而乳糜微粒浓度较低,所以病情相对较轻,发生于20岁以前者的症状多不明显。
氧化型脂质(oxidized lipids)启动并调节细胞的炎症过程,氧化型LDL(ox-LDL)被肾动脉壁和肾小球间质摄取,CXCL16是足细胞(podocyte)摄取ox-LDL的主要受体,而在肾小管发挥同样作用的主要是CD36细胞,Ox-LDL和FFA的脂毒性损害细胞功能,刺激其他细胞因子(如TGF-β)表达,诱发肾损害和肾小管间质纤维化(tubulointerstitial fibrosis)。出现不同程度的肾小球肥大、基底膜增厚和细胞外基质积聚。
非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)是内脏器官脂质沉积与浸润特殊形式,类似于特殊化的棕色脂肪与白色脂肪组织的混合体,可发生微管性脂质淤积(microvesicular steatosis,通常见于棕色脂肪)、大血管性脂质淤积(macrovesicular steatosis,通常见于白色脂肪)和脂质小滴(fatty droplet)。这些病理改变引起脂肪细胞因子的大量生成,导致脂肪堆积和细胞氧化应激反应。患者表现为肝大、肝功能异常、脂肪变性、脂性肝炎、肝硬化和肝酶学指标升高。同时,脂肪组织脂解增加,血甘油三酯升高,肝游离脂肪酸释放增多。
(四) 血脂谱异常引起其他组织损害
血脂谱异常是一种全身性代谢紊乱,除上述病理变化外,还可以引起下列病变:①早发性老年环:40岁以下出现老年环者多伴有血脂谱异常,早发性老年环多见于家族性高胆固醇血症,但特异性不强;②早发性角膜弓:约有28%的家族性载脂蛋白B100缺陷症患者可有角膜弓;③角膜混浊:④可见于家族性高TG血症和家族性LCAT缺陷症;⑤脂血症眼底:严重的高TG血症(>22.6mmol/L或2000mg/dl)使富含TG的大颗粒脂蛋白沉积于眼底小动脉而产生脂血症眼底;脂肪颗粒沉积于网状内皮细胞还可引起实质性器官(如肝、脾、心、肾、脑、网膜等)肿大和慢性炎症反应;⑥其他病变:乳糜微粒血症尚可导致呼吸困难和神经系统症状;纯合子家族性高胆固醇血症可出现游走性多关节炎,但具有自限性;家族性混合型血脂谱异常和家族性高甘油三酯血症的患者多有肥胖。Ⅲ型高脂蛋白血症常伴有肥胖、糖尿病和甲状腺功能减退等其他代谢紊乱,又可使患者的血脂进一步升高。
(一) 根据干预目的和危险度分层制订治疗方案
降脂治疗过程中一般应遵循以下原则:①原发性血脂谱异常症是一种终身性的代谢紊乱,因此所有采取的降脂措施都必须持之以恒。②根据不同的病因选择合适的治疗方案,经济有效地控制血脂水平。③健康生活方式和合理饮食是最基础、最经济、最安全和疗效可靠的降脂方法。④使用降脂药物时,应坚持健康的生活方式和合理的饮食控制,并定期检查肝、肾功能。⑤采取降脂措施后,要定期监测血脂水平,并根据血脂水平适当调整降脂药物的剂量和种类。⑥经生活方式调整、饮食控制和降脂药物治疗后,血脂水平仍控制不理想者可进一步考虑采用血液净化治疗或外科手术治疗。
1. 原发性血脂谱异常症
通过调节血脂水平,以进一步降低冠心病的患病率以及心血管事件的发生率。脂代谢紊乱特别是血浆总胆固醇、TG、LDL、VLDL升高和(或) HDL降低与冠心病及其他动脉硬化性血管病变的患病率和病死率之间有密切关系。NCEP的建议包括:①所有20岁以上的成年人每5年检查1次血浆总胆固醇;②所有胰腺炎患者均应测定血浆TG;③降脂治疗的目标取决于患者的冠心病危险因素,一般危险因素越多,对降脂的要求就越高(目标血脂水平越低)。
表5-33-14 继发性血脂谱异常症的病因及发病机制
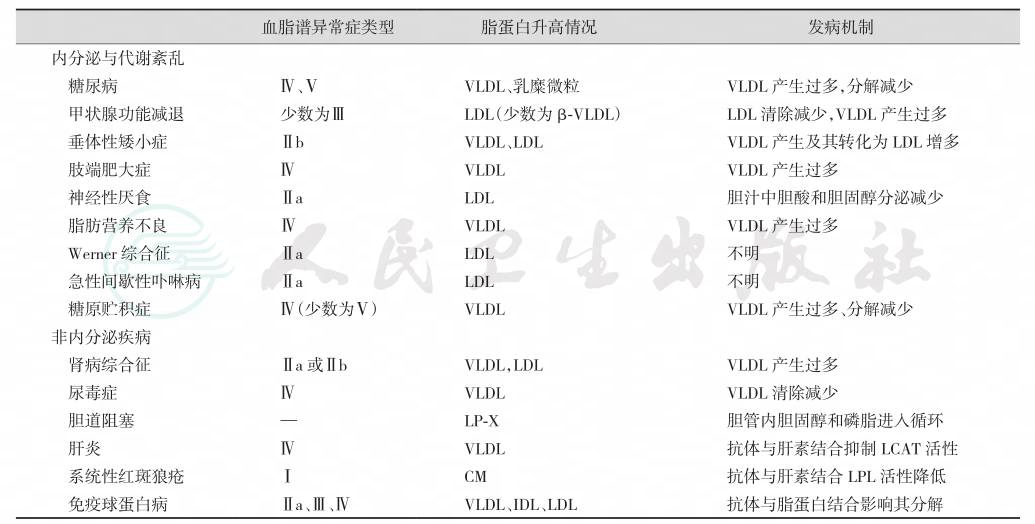
注:LP:脂蛋白;CM:乳糜微粒;LPL:脂蛋白脂酶;VLDL:极低密度脂蛋白;HDL:高密度脂蛋白;LDL:低密度脂蛋白;IDL:中密度脂蛋白;LCAT:磷脂酰胆碱胆固醇酰基转移酶
原发性血脂谱异常症的治疗方案与控制目标见表5-33-15;治疗途径是调整生活方式与饮食结构、降脂药物治疗、血浆净化治疗、外科治疗和基因治疗;治疗方案应根据患者的血浆LDL-C水平和冠心病的危险因素情况而决定。降脂治疗在降低冠心病患者血浆胆固醇水平的同时,还可降低其5年主要心脏事件发生率、冠状动脉重建率及脑卒中的发生率,并可减少由此所致的死亡率;因此已有冠心病的血脂谱异常症者应采取积极措施使其血脂调整到较为安全的水平。
表5-33-15 原发性血脂谱异常症的治疗方案与控制目标
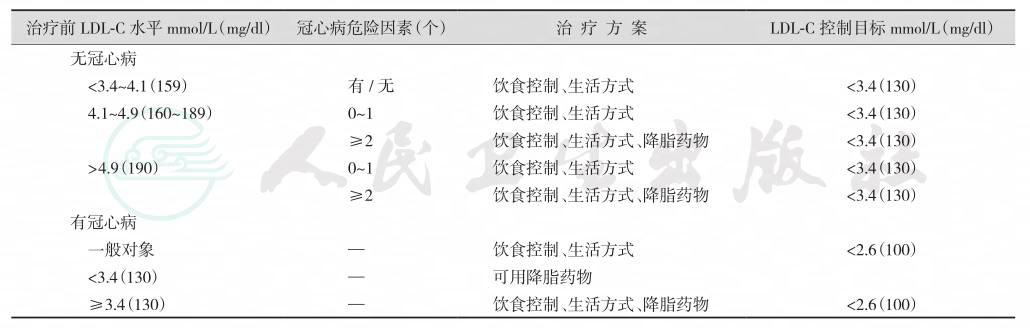
目前对无冠心病的血脂谱异常症的降脂治疗尚存争议。有人观察到,虽然此类患者经过降脂治疗可使其心脏事件和冠心病的发生率和死亡率减少,但其总的死亡率并没有因此而降低。不过研究显示,中年男性高胆固醇血症患者在接受为期5年的降脂治疗以后,其冠心病死亡率和总死亡率均有降低。
2. 继发性血脂谱异常症
继发性血脂谱异常症的治疗主要是积极治疗原发病,并可适当地结合饮食控制和降脂药物治疗。
(二) 生活方式和饮食干预治疗血脂谱异常症
生活方式干预包括降低饮食中的饱和脂肪酸、反式脂肪(trans fat)和胆固醇含量,增加ω3脂肪酸,黏稠纤维(viscous fiber)和植物类固醇的摄入量。不管血脂谱如何,糖尿病(以及伴心血管病或伴1个以上的心血管病风险因素的40岁以上)患者均需用他汀类药物治疗。如果40岁以下者的LDLC>100mg/dl,或有多个危险因素亦应加用他汀类调脂药物治疗LDL-C目标值<100mg/dl(2.6mmol/L),伴有明显心血管病者的LDL-C目标值<70mg/dl(1.8mmol/L)。男性的甘油三酯<150mg/dl(1.7mmol/L),HDL-C>40mg/dl(1.0mmol/L);女性>50mg/dl(1.3mmol/L)。
1. 生活方式干预
流行病学及临床实验研究表明,生活方式可通过多种环节影响血脂水平。通过改变生活方式(低脂饮食、运动锻炼、戒烟、行为矫正等),可使血清总胆固醇和LDL-C分别降低24.3%和37.4%;低脂低热卡与高纤维素饮食还具有抗感染和抗代谢综合征作用。保持理想体重的措施主要是控制热量的摄入和增加体力活动,但应持之以恒才能获得长久收益。
(1) 控制理想体重:
流行病学资料显示,肥胖人群的平均血浆胆固醇和TG显著高于同龄的非肥胖者。除了体重指数(BMI)与血脂水平呈正相关外,身体脂肪的分布也与血浆脂蛋白水平关系密切。一般来说,中心型肥胖者更容易发生血脂谱异常症。肥胖者的体重减轻后,血脂紊乱亦可恢复正常。
(2) 运动锻炼:
长期静坐者的血浆TG通常高于坚持体育锻炼者。体育运动不但可以增强心肺功能、改善胰岛素抵抗和葡萄糖耐量,而且还可减轻体重,降低血浆TG和胆固醇,升高HDL-C。运动可增加脂蛋白脂酶活性,升高HDL水平特别是HDL2水平。长期锻炼还可增加血浆TG的清除。进行运动锻炼时应注意以下事项:①运动强度:运动量如果不适当,则可能达不到预期效果,或容易发生意外情况。通常以运动后的心率水平来衡量运动量的大小,适宜的运动强度一般是运动后的心率控制在个人最大心率的80%左右。运动形式以中速步行、慢跑、游泳、跳绳、做健身操、骑自行车等有氧活动为宜。②运动持续时间:每次运动开始前应先进行5~10分钟的预备活动,使心率逐渐达到上述水平,然后维持20~30分钟。运动后再进行5~10分钟的放松活动。每周至少活动3~4次。③运动时应注意安全保护,避免发生各种意外情况。
(3) 戒烟:
吸烟可升高血浆胆固醇和TG水平,降低HDL-C。停止吸烟1年,血浆HDL-C可上升至不吸烟者的水平,冠心病的危险程度可降低50%,甚至接近于不吸烟者。
2. 饮食治疗
血浆脂质主要来源于食物,通过控制饮食,可使血浆胆固醇降低5%~10%,同时有助于减肥,增强降脂药物的疗效。多数Ⅲ型高脂蛋白血症患者通过饮食治疗,同时纠正其他共存的代谢紊乱,常可使血脂降至正常。
(1) 时机和对象:
开始饮食治疗的时间取决于患者的冠心病危险程度和血浆LDL-C水平。冠心病的危险程度越高,则血浆LDL-C越低时就需要进行饮食治疗(表5-33-16)。
表5-33-16 决定进行饮食治疗的LDL-C目标值
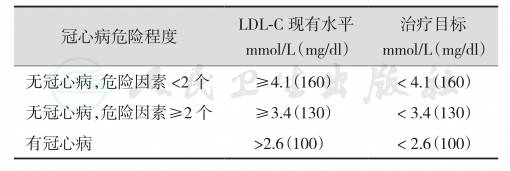
(2) 饮食结构:
饮食结构可直接影响血脂水平的高低,因此必须强调饮食结构的合理性:①血浆胆固醇水平易受饮食中胆固醇摄入量的影响,进食大量的饱和脂肪酸也可增加胆固醇的合成。尽管单不饱和脂肪酸和多不饱和脂肪酸具有降低血浆胆固醇、LDL-C水平和升高HDL-C水平的作用,但是两者所含热量都较高,如果摄入过多同样可引起超重或肥胖。因此,饮食中不饱和脂肪酸也不宜过多。通常,肉食、蛋及乳制品等食物(特别是蛋黄和动物内脏)中的胆固醇和饱和脂肪酸含量较多,应限量进食。食用油应以植物油为主,每人每日用量以25~30g为宜。家族性高胆固醇血症患者应严格限制食物中的胆固醇和脂肪酸摄入。②进食大量高糖(即富含蔗糖、葡萄糖及果糖)类食物,可使脂肪酸的合成增加,导致血浆VLDL-C、LDL-C和TG升高,HDL-C下降。所以,饮食中的糖类应以谷类为主,并适当控制纯糖类食品的摄入。③高纤维饮食可增加肠道中胆固醇排泄,减少胆固醇吸收,并增加LDL-C清除,减少脂蛋白合成,因而可以降低血浆胆固醇尤其是LDL-C的水平。蔬菜、水果、豆类、燕麦麸、玉米皮、海藻类等含有较丰富的植物纤维,可在主食中适量增加玉米、燕麦、小麦、荞麦等成分,每人每日应摄入400g以上蔬菜及新鲜水果。有研究表明,增加豆类食物的摄入有利于改善血中胆固醇水平。一般豆类食品摄入量可增加至每日30g干豆或50g豆腐干或75~150g水豆腐。④酒精可升高血浆HDL-C水平,但同时也可增加TG的合成。一般认为,酒精摄入量低于30g/d(或白酒不超过50g/d)的少量饮酒可能对身体无害,但并不提倡通过饮酒以提高血浆HDL-C水平来进行冠心病的预防。
(3) 高胆固醇血症饮食方案:
血脂谱异常症的饮食治疗是通过控制饮食的方法,在保持理想体重的同时,降低血浆中的LDL-C水平。饮食治疗通常可分两步进行。如果在为期3个月的第一步饮食治疗中,血浆LDL-C水平未能达到控制目标(表5-33-17),则需按照第二步方案进行更为严格的饮食控制。对于冠心病患者,应直接采用第二步饮食治疗方案。
表5-33-17 高胆固醇血症的饮食治疗方案
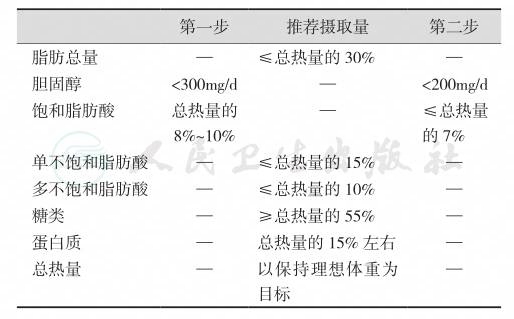
(三) 降脂药物纠正血脂谱异常
降脂药物对血脂谱异常症具有十分重要的防治意义。无冠心病者经过3~6个月的生活方式调整及饮食控制,或有冠心病者再进行1~2个月的非药物性基础治疗后,其血脂水平仍未达到控制标准(表5-33-18),均应合理地选用降脂药物治疗。根据调脂治疗的首要目标和不同危险度患者的LDL-C目标值,确立药物治疗方案。降脂药物治疗的一般原则是:①以他汀类降脂药作为原发性和继发性血脂谱异常症的一级和二级预防时,可使患者的心脑血管事件发生率降低约1/3。②贝特类药物亦可降低患者心脑血管事件发生率,但疗效不及他汀类降脂药。③治疗的目标血脂水平应依患者的心脑血管事件风险因素多少和严重性而定,一般的原则是风险因素越多,程度越重,治疗的目标血脂水平越严。④用ApoB和ApoB/ApoAⅠ比值作为降脂的疗效观察指标较LDL为优。冠心病者应将血浆总胆固醇水平控制在4.1mmol/L(160mg/dl)以下,血浆TG水平应低于1.8mmol/L(160mg/dl)。
表5-33-18 降脂药物治疗的LDL-C目标值

目前,临床应用较多的是HMG-CoA还原酶抑制剂(他汀类降脂药)和纤维酸衍生物类(苯氧芳酸类或贝特类,fibrates)药物。非他汀类降脂药物可分为4类,即降低胆固醇吸收类、抑制致病性脂蛋白释放(atherogenic lipoprotein release)类、提升HDL类和加快胆固醇从胆道清除类。
1. HMG-CoA还原酶抑制剂
大部分血浆脂蛋白中的胆固醇是在体内合成的。在体内胆固醇的生物合成过程中,HMG-CoA转变成甲基二羟戊酸需要HMG-CoA还原酶进行催化。HMG-CoA还原酶是体内胆固醇合成的重要限速酶,细胞内的胆固醇排空时,可激活此酶的活性增加,使胆固醇的合成增加;当细胞内胆固醇增多时,此酶活性下降,胆固醇的合成因此而减少。
HMG-CoA还原酶抑制剂(他汀类降脂药)均为人工合成的化学制剂,其结构中的开放部分与HMG-CoA极为相似,因而可与HMG-CoA竞争性地与HMG-CoA还原酶进行结合,抑制体内胆固醇的生物合成。首先,细胞内胆固醇水平降低可刺激细胞膜LDL受体的数目增多、活性增强,血浆中VLDL残粒及LDL的清除增加;其次,胆固醇的合成受到抑制后,可进一步使脂蛋白的产生减少。HMG-CoA还原酶抑制剂的降脂效果与药物剂量有关。一般常规剂量的药物可使血浆总胆固醇下降30%~40%,LDL-C下降25%~50%,TG中等度下降,HDL-C轻度上升。此类药物是治疗家族性高胆固醇血症的首选药物,与其他降脂药物如胆酸螯合剂合用可使70%杂合子患者的血浆LDL-C降至正常,但对纯合子患者无效。亦可用于其他以胆固醇升高为主的血脂谱异常症。他汀类降脂药很多,如普伐他汀(pravastatin)、氟伐他汀(fluvastatin)、伊伐他汀(itavastatin)、阿托伐他汀(atorvastatin)、辛伐他汀(simvastatin)、瑞舒伐他汀(rosuvastatin)等。匹伐他汀(pitavastatin)分子具有独特的环丙基(cyclopropyl group),其抑制HMG-CoA还原酶活性的作用增强5倍以上,同时也使LDL受体的转录与活性增加,而其肝脏的代谢途径细胞色素P4503A4酶避免了与许多药物的相互作用,升高HDL-C作用较强,同时能降低LDL-C。
通常,将此类药物每日的总量分作2次口服,其降脂效果比一次顿服更好。若日服1次,则以每日睡前服用为好,因为绝大多数的胆固醇合成都是在夜间进行的。2%~3%的患者服药后可出现恶心、腹胀、腹泻或便秘、头痛、失眠、乏力、皮疹、肌病及肝功能异常等不良反应。儿童、孕妇及哺乳期妇女不宜使用此类药物。HMG-CoA还原酶抑制剂与胆酸螯合剂合用,可使LDL-C降低50%~60%,其用药剂量亦可因此而减少。如与烟酸、吉非贝齐、环孢素、环磷酰胺及雷公藤等联合使用,则可引起严重的肌病和肝肾损害。他汀类的肝毒性虽然少见,但一旦发生,其后果严重。绝大多数表现为急性肝细胞损害,偶尔伴有胆汁淤积、非特异性自身抗体阳性和自身免疫样肝炎(autoimmune-like hepatitis)。肌病的程度不一,轻者无肌肉疼痛,仅有血清肌酸激酶升高,严重者出现横纹肌肉溶解症。
2. 纤维酸衍生物类(苯氧芳酸类或贝特类)
主要是增强脂蛋白脂酶的活性,使TG的水解增加,对治疗高甘油三酯血症有显著疗效。
(1) 氯贝丁酯:
氯贝丁酯(clofibrate,又称安妥明,冠心平)是最早应用于临床的贝特类药物,主要通过增强脂蛋白脂酶活性,增加VLDL和TG的分解,可抑制腺苷酸环化酶而抑制脂肪组织分解,进而减少肝脏VLDL的合成与分泌。此外,尚可抑制肝内胆固醇的合成和增加肠道胆固醇的排泄,使血浆总胆固醇降低。氯贝丁酯可降低血浆TG 22%~50%,降低胆固醇6%~20%,并可升高HDL-C水平。主要用于治疗高TG血症及以TG升高为主的混合型血脂谱异常症。常用剂量为每次0.25~0.5g,每日3次。主要不良反应有恶心、腹胀和腹泻等胃肠道反应和肝功能异常,偶见头痛、乏力、皮疹、脱发、阳痿、性功能减退等,长期使用可增加胆结石发病率和非冠心病死亡率。
该药可通过胎盘和乳汁排出,故孕妇和哺乳期妇女禁用。肾功能不全时容易引起肌病。氯贝丁酯能增强抗凝剂的作用,增加尿酸排泄。由于不良反应较多,并可使死亡率增加,因此被淘汰。氯贝丁酯的衍生物,如非诺贝特、苯扎贝特、吉非贝齐和益多酯等,同样具有降脂作用,但不良反应减少。
(2) 非诺贝特:
非诺贝特(fenofibrate,力平之)可增加载脂蛋白AⅠ、载脂蛋白AⅡ及脂蛋白脂酶的基因表达,减少载脂蛋白AⅢ的基因表达,使乳糜微粒和VLDL降解加速,从而降低血浆中TG和LDL-C水平。其降脂作用具体表现为血浆TG降低40%~60%,总胆固醇降低5%~20%,LDL-C降低5%~25%,VLDL-C降低63%,并可升高HDL-C水平。降脂适应证同氯贝丁酯。常用剂量为每次0.1g,每日3次。微粒化的非诺贝特胶囊只需每晚服1次,每次0.2g,其降脂效果与常规剂型相似。不良反应主要有口干、食欲减退、大便次数增多、湿疹等。偶见血清转氨酶、尿素氮或肌酐升高,但停药后即可恢复正常。长期服用者应定期进行肝、肾功能检查。严重肝、肾功能不全者及儿童禁用此药,孕妇、哺乳期妇女应慎用。非诺贝特可降低血尿酸和纤维蛋白原水平,增强抗凝剂的作用。故联合用药者需注意抗凝药剂量的调整。
(3) 苯扎贝特:
苯扎贝特(bezafibrate,又称必降脂)可增强脂蛋白脂酶和肝脂酶的活性,促进VLDL的分解代谢,并对HMG-CoA还原酶和乙酰辅酶A胆固醇酰基移换酶(ACAT)有抑制作用,增加LDL受体活性,升高载脂蛋白AⅠ和载脂蛋白AⅡ水平,因此可有效降低血浆TG和胆固醇水平,升高HDL-C水平。通常,苯扎贝特可使血浆TG降低20%~60%,总胆固醇下降10%~30%,HDL-C升高10%~30%。临床适应证与氯贝丁酯相同。一般治疗剂量为每次0.2g,每日3次。有一种苯扎贝特的缓释片,只需每晚服0.4g。常见不良反应有食欲不振、恶心和上腹部不适等胃肠道症状,亦可见皮肤瘙痒、荨麻疹、皮疹、脱发、头痛、头晕、失眠、性欲减退等。以上反应大多较轻微,一般可自行消失。偶可发生肌炎样肌痛和抽搐,引起血清肌酸磷酸激酶增高。
由于94%的药物经肾脏排泄,故肾功能不全时容易引起药物在体内积蓄,并加重肾功能损害。因此肾功能不全者应慎用此药,且剂量宜小。有肝脏及胆囊疾患者禁用此药,孕妇、哺乳期妇女及儿童均不宜服用。长期应用者需定期检查肝、肾功能及血清肌酸磷酸激酶水平。苯扎贝特抑制血小板凝集,降低纤维蛋白水平及血液黏度,增强双香豆类、磺脲类及胰岛素等药物的作用,但不会引起低血糖。
(4) 吉非贝齐:
吉非贝齐(gemfibrozil,又称诺衡,康利脂,洁脂)主要是通过增加脂蛋白脂酶的活性,促进TG和VLDL的降解,并能抑制脂肪组织的脂肪分解,从而减少TG和VLDL的生成。吉非贝齐可使血TG下降40%~60%,总胆固醇降低10%~20%,HDL-C升高10%~20%。适应证与氯贝丁酯相同。常用剂量为每次0.9g,每日1次或每日上午服0.6g,下午服0.3g;亦可每次0.6g,每日2次。一般起效较快,用药后4周即可达到稳定疗效。约5%的患者用药后可出现恶心、呕吐、上腹不适、食欲不振、腹痛和腹泻等胃肠道症状,部分患者可有一过性血清转氨酶及肌酸磷酸激酶增高。偶见嗜酸性细胞减少、皮肤红斑、皮疹、肌肉疼痛、视力模糊及轻度贫血。胆结石的发生率约为1%~1.5%。严重肝肾功能不全及胆结石患者、孕妇、哺乳期妇女和儿童禁用此药。吉非贝齐有增强抗凝剂药效及升高血糖的作用,服药时应注意调整抗凝药物及降血糖药物的剂量。
3. 胆酸螯合剂
此类药物主要是通过在肠道内与胆酸结合后形成不易吸收的螯合物,干扰胆酸的肝肠循环。粪便中胆酸排出增多,可减少肠道内的胆固醇吸收,并增加肝细胞对胆固醇的利用,进而使血浆中的胆固醇降低。通常,治疗剂量的胆酸螯合剂可使血浆总胆固醇降低10%~20%,LDL-C下降15%~25%,TG水平变化不大或稍有升高,HDL-C可有中度升高。此类药物适用于除纯合子家族性高胆固醇血症以外任何类型的高胆固醇血症,亦可与其他的降脂药物联合,用于混合型血脂谱异常症的治疗。临床上用于血脂谱异常症治疗的胆酸螯合剂包括树脂类、新霉素类、β-谷固醇、活性炭等。其中,新霉素类、β-谷固醇及活性炭因不良反应较大或疗效不理想而被淘汰。目前临床上应用较多的为碱性阴离子树脂类制剂。考来烯胺(cholestyramine,又称消胆胺)可降低血浆总胆固醇水平,升高HDL-C水平。常规剂量为每次4~5g,每日1~3次。服药时宜从小剂量开始,可根据血脂水平逐渐加大剂量,一般每日总量不超过24g。考来替泊(colestipol,又称降胆宁)的降脂效果及不良反应与考来烯胺大致相似,但便秘发生较少,价格相对较为便宜。常用剂量为每日12~15g,分3~4次口服。地维烯胺(divistyramine)降脂效果及不良反应均与考来烯胺相似,常用剂量为每日6~12g,分2次饭前服。
4. 普罗布考:
普罗布考(probucol,又称丙丁酚) 促进LDL的分解和胆酸的排泄,抑制胆固醇和载脂蛋白AⅠ的合成,使血浆总胆固醇降低9%~29%,LDL-C降低5%~15%,但对TG作用不大。由于其可改变脂蛋白的结构,使之不依赖于LDL受体而直接被细胞摄取,因此适用于包括纯合子家族性高胆固醇血症在内的所有高胆固醇血症。此外,普罗布考具有抗氧化的作用,可抑制动脉粥样硬化的形成与发展。常用剂量为每次0.5g,每日2次。不良反应以恶心、腹痛、腹泻等较为常见,少见的不良反应可有多汗、头痛、头晕、感觉异常、血管神经性水肿和嗜伊红细胞增多。偶见血清转氨酶、碱性磷酸酶、肌酸磷酸激酶及胆红素、尿酸、尿素氮、血糖等一过性升高,长期使用可引起心电图的Q-T间期延长。因此,室性心律失常、心电图Q-T间期延长、孕妇、哺乳期妇女和儿童禁用此药。服药女性需停药6个月以上才能怀孕。
此类药物有异味感,约有2%的患者可出现恶心、腹胀、腹痛、便秘等胃肠道反应,通常与用药剂量大小有关。长期用药者可引起脂肪吸收不良,应适当补充维生素A、维生素D、维生素K等脂溶性维生素及钙盐。考来烯胺干扰氯噻嗪、地高辛、苯巴比妥、甲状腺素、双香豆类抗凝剂的吸收,因此前述药物应在服用考来烯胺前1小时或服考来烯胺后4小时服用。
5. 胆固醇酯转运蛋白激活剂
胆固醇酯转运蛋白(cholesteryl ester transfer protein,CETP) anacetrapib和dalcetrapib可用于血脂谱异常症的治疗。尤其可升高HDL-C,但其心血管不良反应仍需进一步观察。
6. 烟酸及其衍生物
(1) 烟酸:
烟酸(nicotinic acid,niacin)抑制cAMP形成,使TG脂肪酶活性降低;并可减慢脂肪组织中的脂肪分解,使血浆中非酯化脂肪酸(NEFA)减少,进而减少VLDL在肝脏的合成。此外,烟酸在辅酶A的作用下与甘氨酸合成烟尿酸,可影响肝细胞利用辅酶A合成胆固醇。烟酸还可升高血浆HDL-C水平,其作用机制尚不清楚。一般服药后1~4日血浆TG水平即出现下降,LDL-C的下降于服药后5~7日才开始。常用剂量可使总胆固醇和LDL-C均降低15%~30%,TG降低20%~80%,Lp(a)下降40%,HDL-C升高15%~25%。除家族性高胆固醇血症的纯合子及Ⅰ型高脂蛋白血症以外,烟酸可用于其他任何类型血脂谱异常症的治疗。常用剂量为每次1~2g,每日3次。宜从小剂量开始,每次100mg,每日3~4次,以后每隔3~7日增加1次剂量。
服药后的第1~2周内,可出现面部潮红、皮肤灼热或瘙痒等不良反应,并可有食欲不振、恶心、呕吐、胃肠胀气、腹痛、腹泻等消化道反应。大多随继续服药而逐渐减轻,以至消失。饭后服药以及服药时减少饮水,可减轻服药后的不良反应。服药前1小时服用小剂量阿司匹林可减轻面部潮红。此外,大剂量烟酸可引起消化性溃疡、糖耐量减低、血尿酸升高及肝功能损害,甚至黄疸。因此,有溃疡病、糖尿病、肝功能不全的患者应慎用本药,并应注意定期复查肝功能、血糖及尿酸等。由于烟酸可增强降压药的扩血管作用,引起直立性低血压,故高血压患者使用该药时应予以适当注意。孕妇及哺乳期妇女均不宜服用此药。
烟酸与树脂类降脂药合用可增强LDL-C降低的效果,并可减轻胃肠道的不良反应。
(2) 阿昔莫司:
阿昔莫司(acipimox,又称氧甲吡嗪,乐脂平)是一种人工合成的烟酸衍生物。主要抑制脂肪组织释放非酯化脂肪酸,使TG、VLDL及LDL的生成减少;同时可激活脂蛋白脂酶,加速VLDL降解;并可抑制肝脂酶而升高HDL-C水平。阿昔莫司可使血浆TG下降50%,总胆固醇降低25%,HDL-C升高20%。其降脂适应证与烟酸相似,并可用于治疗糖尿病所致的继发性血脂谱异常症。常用剂量为每晚睡前服用0.25~0.5g,病情需要时可于早餐后加服0.25g。患者服药后可有面部潮红、皮肤瘙痒、胃部灼热感或上腹部不适、轻微头痛等不良反应,但多数可在服药后数日内逐渐减轻或消失。此外,该药的肝、肾功能损害极少见,亦不会引起糖耐量减低和高尿酸血症。
7. 其他药物
(1) 阿司匹林 :
1型和2型糖尿病存在心血管风险(10年风险>10%)或有该病史的患者需要用阿司匹林(75~162mg/d)作为一级预防干预,对其过敏时改用氯吡格雷(clopidogrel,75mg/d);急性冠状动脉事件1年后,应采用阿司匹林(75~162mg/d)加氯吡格雷(75 mg/d)治疗。但不建议用于低危者(10年风险<5%)。已经诊断为冠心病者用ACEI、阿司匹林治疗,以前发生过心肌梗死者应加以β受体阻滞剂治疗指数2年,如果能够耐受,没有高血压者也可长期服用。症状性心力衰竭者不用噻唑烷二酮类药物,但充血性心力衰竭而肾功能正常者可服用二甲双胍。
(2) 甲状腺激素类似物:
甲状腺激素可延缓心血管并发症的病情,经过结构改造的甲状腺激素类似物,如KB2115(3-[3,5-dibromo-4-[4-hydroxy-3-(1-methylethyl)-phenoxy]-phenyl] -amino]-3-oxopropanoic acid)为一种选择性促产热剂(selective thyromimetic)具有产热作用,降低体重和血胆固醇水平,有可能成为新的降脂药物。另一种制剂属于选择性肝脏甲状腺素受体的类似物(selective liver thyroid hormone receptor analogs) sobetirome (GC1),据报道该药可以诱导肝脏的LDL受体生成,逆转胆固醇的转运,促进胆汁形成和胆汁固醇的分泌与排泄。
(3) 泛硫乙胺:
泛硫乙胺(pantethine,又称潘特生)能促进血脂正常代谢,改善脂肪肝及酒精中毒性肝损害,能抑制过氧化脂质的形成及血小板聚集,还能防止胆固醇在血管壁沉积。该药可使血浆总胆固醇降低5.2%~15.2%,TG下降23.6%~31.7%,HDL-C升高10%~20.5%。常用剂量为每次0.2g,每日3次。泛硫乙胺的最大特点是不良反应少而轻,对肝、肾功能基本无损害。此外,药物作用时间较长,停药后1个月仍能保持明显的调节血脂的效果。
(4) omega-3脂肪酸:
包括20碳五烯酸(EPA)和22碳六烯酸(DHA),以海鱼油中含量最为丰富。能抑制肝内脂质及脂蛋白合成,促进胆固醇从粪便中排出,使血浆总胆固醇降低12%,TG降低40%,HDL-C升高5%。此外,鱼油制剂还有抑制血小板聚集及减少血栓形成的作用,可延缓动脉粥样硬化的进程,减低冠心病的发病率。目前的鱼油制剂品种较多,可分为天然鱼油型、酯型及非酯化脂肪酸型3种剂型。不同鱼油制剂中的ω-3脂肪酸含量各不相同,酯型约为28%,天然鱼油为57%,非酯化脂肪酸制剂为98%。国内可正式用于临床的浓缩鱼油制剂主要有以下3种:①多烯康:属于酯型制剂,其中加有少量的维生素E,以防氧化。常用剂量为每次1.8g,每日3次。②脉乐康:为天然鱼油制剂,含EPA和DHA>65%,常用剂量为每次0.45~0.9g,每日3次。③鱼油烯康:为天然鱼油制剂,每粒0.25g,含EPA和DHA>67.5mg。常用剂量为每次1g,每日3次。鱼腥味所致的恶心是鱼油制剂的常见不良反应。此外,长期服用非酯化脂肪酸型鱼油制剂可诱发胃肠道出血,酯型鱼油制剂可引起视力下降。天然海鱼油制剂的不良反应较少。有出血倾向的患者禁用鱼油制剂。
(5) 前蛋白转换酶抑制剂和甘油三酯转运蛋白抑制剂:
前蛋白转换酶——枯草杆菌蛋白酶(proprotein convertase subtilisin)kexin 9(PCSK9)发现于2003年,主要用于常染色体显性遗传性高胆固醇血症(autosomal dominant hypercholesterolemia)。初步的研究表明,kexin 9降解LDL受体的作用不依赖于酶的催化活性(catalytic activity),因而通过反义RNA或DNA抗体可降低或抑制kexin 9活性,达到降低LDL的目的。微粒体甘油三酯转运蛋白抑制剂(microsomal triglyceride transfer protein inhibitors)可降低血清LDL-C,但因胃肠和不良反应和肝脏损害重而禁用。
(四) 基因治疗原发性血脂谱异常症
基因治疗是通过多种方法利用特定的重组DNA,影响靶细胞中的基因表达、替换突变基因、抑制突变基因的表达或在靶细胞中增加可以对抗突变基因作用的特殊基因,以达到治疗血脂谱异常症的目的。原发性血脂谱异常症通过基因疗法有望获得根本解决。目前开展较多的主要是家族性高胆固醇血症的基因治疗。基因治疗的方法主要有以下4种:①基因表达:将正常基因导入靶细胞并使之表达,以治疗内源性基因所致的异常;②基因置换:通过同源重组方法,用外源性正常基因代替突变的基因或序列;③基因添加:在特定靶细胞中加入该细胞不具有的能产生特殊功能的基因,用以对抗异常基因的病理影响;④基因抑制:利用反义核酸技术和(或)RNA干扰技术降低变异基因的表达。动物实验研究表明,将降脂基因转入肝脏可使血脂紊乱的情况得以恢复正常。基因治疗的关键步骤在于基因的转移,即将外源性基因准确地导入靶细胞中,并能正确地进行表达。根据具体实施的方法不同,基因治疗又可分为离体法和体内法。
1. 离体基因治疗
亦称间接法,是取出患者的某种组织或细胞(如成纤维细胞、骨髓、肝细胞、外周血干细胞,甚至肿瘤细胞),在体外培养时转入目的基因,或在体外筛选和富集含有外源性基因的细胞,然后再回输到患者体内。
具体的方法:通过手术切除患者的一小部分肝叶(约为肝脏的10%~15%),并留置下腔静脉导管。用胶原酶灌注切下的肝组织以分离肝细胞,将肝细胞置于平皿中培养2天,并与重组LDL受体基因的反转录病毒共同孵育12~16小时。经洗脱病毒后,肝细胞用胰蛋白酶进行分离,并由下腔静脉导管输入患者体内。此方法可使肝细胞的LDL受体获得部分重建,且无明显并发症。离体基因治疗的缺点是需要进行外科手术,而且获得转基因的细胞数目较少,使治疗效果受到很大影响。由于反转录病毒载体只能转染增殖细胞,不能转染非增殖的细胞,而腺病毒载体可转染非生长期的肝细胞,因此近年来人们发现腺病毒可能是更理想的载体,这样可避免进行肝切除术或静脉注射四氯化碳损伤肝细胞。已报道在兔身上静脉注射含有LDL受体cDNA的重组腺病毒6天后,血浆胆固醇下降75%,HDL-C和Apo AⅠ升高3~4倍。
2. 体内基因治疗
又称直接法,是采用一种可溶性DNA携带系统,在体内将LDL受体基因定向转移至患者的肝细胞,使肝脏能表达出LDL受体。这是一种非常有前途的基因治疗方法。动物实验显示,直接输入DNA蛋白质复合物后12~72小时,重组基因即可在肝细胞上表达,血清胆固醇下降达20%~30%。目前存在的问题主要是转基因持续表达时间较短和基因表达的效率不够高。通过方法的改进,预计在不久的将来体内基因治疗法即可应用于临床。
(五) 特殊病例和极重型血脂谱异常症的治疗
原发性血脂谱异常症需终身治疗。为了确保药物降脂治疗的有效性和安全性,应每隔1~3个月复查血脂,并根据血脂水平适当调整降脂药物的使用;定期复查肝肾功能、肌酸磷酸激酶、血糖及血尿酸以及心电图等。
1. 血脂谱异常症并代谢综合征治疗
代谢综合征并血脂谱异常症主要表现为TG升高或高TG血症、HDL-C降低、LDL-C升高(有时)、小而密LDL升高、LDL/HDL比率升高、非酯化脂肪酸(FFA)和Apo-B100升高,Apo-AⅠ/Apo-B100的比值较小。一般空腹TG浓度越高者的餐后脂血症的程度越严重。其治疗原则是综合性的,主要包括控制饮食总热量摄入、调整饮食结构、减少脂肪摄入,并控制饮食总热量摄入。同时要增加运动(持续的有氧运动)。在饮食和运动治疗减肥不理想的情况下,可考虑加用奥利司他、利莫那班或西布曲明等。除减肥和运动外,首选噻唑烷二酮类药物。
在降脂治疗方面,贝特类能调整脂代谢紊乱,增强抗动脉粥样硬化的作用。但贝特类与他汀类合用要慎重,以免发生横纹肌溶解和肾衰竭等副作用。
2. 血脂谱异常症并冠心病治疗
从某种意义上讲,降脂治疗是多数冠心病患者的病因治疗。因此,降脂治疗既有预防意义,又有治疗意义。但首先要预防心肌梗死和猝死,并控制心肌缺血性发作。应用抗心绞痛和抗心肌缺血药物(如硝酸酯类、β肾上腺素受体阻滞剂、钙离子拮抗剂),一般同时加用抗血小板和降脂治疗。亦可试用ACEI(肾衰竭、肾动脉狭窄慎用)。降脂治疗的原则与一般血脂谱异常症相同,他汀类药物有改善内皮细胞功能,抑制血管炎症,稳定斑块,减少不良心血管事件等作用。建议的治疗目标是LDL-C降到<2.6mmol/L(100mg/dl)。
3. 血脂谱异常症并糖尿病治疗
血脂谱异常症并糖尿病存在两种情况,一是糖尿病糖代谢紊乱引起血脂谱异常症,这些患者在适当的饮食干预和糖尿病治疗后,血脂谱异常症随着血糖控制,一般可恢复正常。另一种情况是糖尿病合并有遗传性血脂谱异常症,其血脂紊乱较严重,控制较困难。即使血糖和HbA1c已经正常,但血脂仍不能达标。在糖尿病的综合治疗中,糖尿病的治疗的目标不能仅以血糖控制为目标。临床研究表明,良好血糖控制并不能防止大血管并发症的发生和发展。糖尿病并血脂谱异常症可分为两种情况,血糖未控制前的血脂谱异常症和血糖控制后的血脂谱异常症。血糖未控制前的血脂谱异常症与血糖升高和胰岛素缺乏相关,经治疗使血糖正常后,血脂谱可转为正常,因而这部分患者不需要特殊的降脂治疗;如血糖正常后血脂谱仍异常,应加用降脂药物治疗。
糖尿病患者的降脂治疗要特别强调饮食治疗。伴血脂谱异常症者要严格控制油脂的摄入量。以谷类为主食者要尽可能选择粗制品,不宜直接食用单糖和双糖。T2DM患者长期饮酒常是血脂谱异常症的重要原因,饮酒还易发生低血糖,加重高血糖,因而应禁酒。
继发于糖尿病的混合型血脂谱异常症患者多表现为TG升高,可选择有利于空腹血糖控制的阿昔莫司和苯扎贝特,亦可选用非诺贝特。不同种类的降脂药联合使用,不但可以增强降脂的效果,而且还可减少所用药物的剂量。当血浆胆固醇>7.8mmol/L(300mg/dl)时,常常需要采用联合用药的方式进行治疗。联合用药可有多种方式,如:胆酸螯合剂与烟酸类或苯氧芳酸类合用,可有效降低LDL-C和TG,升高HDL-C;HMG-CoA还原酶抑制剂与胆酸螯合剂或烟酸合用可使血浆胆固醇下降50%以上等。在联合用药过程中,应注意药物之间的相互作用,尤其是可能出现的不良反应。如:HMG-CoA还原酶抑制剂与烟酸合用易致转氨酶升高,HMGCoA还原酶抑制剂与纤维酸衍生物类或环孢素等合用,或他汀-贝特类联合治疗(statin-fibrate combination regimens)可能增加肌病的发病风险。
4. 血脂谱异常症并多囊卵巢综合征治疗
多囊卵巢综合征(PCOS)患者常伴有轻至中度的血脂谱异常症,但在使用口服避孕药物(一般为PCOS的一线治疗药物)后,有的患者血脂紊乱加剧,表现为甘油三酯和HDL明显升高,而血糖、胰岛素与胰岛素抵抗的变化主要由BMI、年龄、病情等决定。因此,不管治疗前的血脂是否异常,多囊卵巢综合征用口服避孕药物治疗时,均需要检测血脂变化,必要时可加用调脂药物。
5. 极重型血脂谱异常症的治疗
(1) 多种降脂药物联合治疗:
应在生活方式干预、运动和饮食治疗的基础上,联合应用多种降脂药物治疗。由于降脂药的种类较多,在临床应用中主要是根据血脂谱异常症的病因和血脂特点以及降脂药的作用机制,选择适当的药物进行治疗。通常,轻、中度高胆固醇血症,可选用小剂量的HMGCoA还原酶抑制剂,也可试用弹性酶、泛硫乙胺、烟酸类及苯氧芳酸类药物;较严重的高胆固醇血症,如杂合子家族性高胆固醇血症及继发于肾病综合征的高胆固醇血症,可选用树脂类胆酸螯合剂或HMG-CoA还原酶抑制剂,或两者联合使用;纯合子家族性高胆固醇血症应首选普罗布考。一般的高TG血症可根据不同的血浆TG水平,分别选用非诺贝特、吉非贝齐、益多酯、阿昔莫司、苯扎贝特、烟酸、鱼油制剂等;伴有高凝血状态、不稳定心绞痛以及曾行冠心病手术的高TG血症患者,选择非诺贝特或苯扎贝特,既可有效降低血浆的TG水平,又能减低血液黏度、改善冠状动脉的供血情况。在美国,他汀类药物由于其具有降脂效果确切、不良反应小、易于服用等优点而应用最广;贝特类降低TG的作用最显著,但由于作用较为单一使其应用受到一定的限制。
对于混合型血脂谱异常症,如以胆固醇水平升高为主,可根据血浆总胆固醇水平的高低,分别选用烟酸类或HMGCoA还原酶抑制剂;如以TG升高为主,可选择非诺贝特、吉非贝齐、益多酯、苯扎贝特、烟酸及阿昔莫司等;依泽替米贝(ezetimibe)与辛伐他汀联合应用的作用可能更强。
(2) 血浆净化治疗:
血浆净化(plasma purification)主要用于极端严重病例的临时性处理,能显著降低胰腺炎的复发率。目前的血浆净化技术仍存在许多缺点,不良反应亦较多,临床较少应用。血浆净化疗法又称血浆分离法、血浆清除法或血浆置换法,是通过各种物理方法去除血浆中过多的脂蛋白。临床上可用于治疗血脂谱异常症的血浆净化疗法包括单纯血浆分离法、膜滤过法、灌流法、吸附法、沉淀法等,以上方法主要用以去除血浆中的LDL。
滤过法主要有两种方法。常规双重滤过法是利用两个不同孔径的过滤器,孔径较大的膜是分离血浆与血细胞的血浆分离器,主要是滤除血浆中的抗体、免疫复合物、LDL等病原性大分子物质。经过净化后的血浆再与血细胞混合,重新回输入体内。一般每次分离血浆3~4L,其中滤除血浆500~600ml,同时补入等量的置换液。此法可使LDL降低48%,最大的优点是无需补充血浆。加热双重滤过法则是在上述双重滤过中,将经第一次膜滤过的血浆加温至39℃再通过第二个滤过器,可减少血浆中清蛋白、抗凝血酶Ⅲ和HDL的丢失,并可提高血浆滤过的速度。热滤过后的血浆LDL/ HDL-C比值明显降低,降脂效果可维持2周以上。
灌流法亦有两种方法。活性炭灌注法是通过装有活性炭的吸附柱,去除血浆中的LDL-C、VLDL-C和TG,其中以TG降低最为显著,HDL-C的降低较少。少数患者应用此法无效。珠形琼脂糖灌注法是用表氯醇与琼脂糖进行交联,再加入肝素和(或)乙醇胺而制备出珠形琼脂糖。以珠形琼脂糖作为吸附剂可选择性地去除LDL。由于血细胞直接与吸附剂接触而被破坏,灌注法可导致溶血,是灌注法的主要缺陷。
血浆吸附法以每分钟50ml的速度从肘静脉抽取血液,通过离心的方法将血细胞分离出来,并立即回输到患者体内,而血浆通过装有吸附剂的柱子后再输入患者体内。其突出的优点是血细胞不与吸附剂接触,可使血细胞免遭破坏。
肝素沉淀法利用过滤器分离出患者静脉血中的血细胞成分,并回输入患者体内。在血浆中加入等量的肝素(10万U/L) -醋酸缓冲液,使LDL产生沉淀,再经聚碳酸膜过滤器将其去除。无LDL的血浆经去除肝素与过多的盐和水,并恢复生理pH值后再给患者回输。严重高胆固醇血症特别是纯合子家族性高胆固醇血症,应用药物治疗降脂的效果常常不理想。只有采用血浆净化治疗,才能有效地降低其血浆中的胆固醇水平。
(3) 手术治疗:
大多数的血脂谱异常症通过调整生活方式、饮食控制和药物治疗均可将其血脂水平控制在较为理想的范围之内。仅有少数严重的血脂谱异常症如纯合子型家族性高胆固醇血症,用药物治疗降脂效果不理想。此外,还有少数患者对药物过敏,或用药后出现严重的不良反应,或合并有2型糖尿病与显著肥胖,对此类患者可考虑采用手术治疗,但手术适应证应严格控制,术后仍需要终生接受医学观察与综合治疗。虽然通过手术的方法可以有效地降低血脂水平,但是外科治疗并不是血脂谱异常症的首选治疗方案。临床上用于治疗血脂谱异常症的外科治疗包括回肠末端部分切除术、门-腔静脉分流吻合术和肝脏移植术。
部分回肠切除术主要是切除回肠末端约2m长的部分。切除部分回肠后即干扰了胆酸的肠肝循环,其降脂原理类似于胆汁酸螯合剂,主要降低血浆胆固醇。术后肠道胆固醇吸收可减少60%,使体内胆固醇的分解代谢增加,胆固醇减少35%。由此可使血浆胆固醇降低20%~25%,并可减少软组织、器官中以及动脉壁内的非游离胆固醇,有助于黄色瘤和动脉粥样斑块的消退。但对纯合子家族性高胆固醇血症的疗效欠佳。该手术操作简单,但术后可引起一些并发症,如腹泻、肾结石、胆结石、肠梗阻等。
门-腔静脉分流术可减少体内总胆固醇、胆酸及LDL的合成,并可降低HMG-CoA还原酶的活性,使血浆总胆固醇下降20%~35%。这是一种姑息性手术,因为术后患者血脂谱异常症可能依然存在。在这种情况下,应适当给予降脂药物治疗。门-腔静脉分流术可引起肝萎缩,从而导致某些激素代谢发生障碍。例如,可使女性雄性激素升高,出现男性化表现。并发症还有分流通道血栓性闭塞引起脾大,诱发肝性脑病等。
肝脏移植术可增加患者体内的LDL受体数量,使LDL的分解代谢增加,合成代谢减少。血浆总胆固醇可因此而下降72%,LDL-C下降81%。但术后高胆固醇血症可能继续存在。此时给予洛伐他汀治疗,可使血浆总胆固醇进一步降低43%,LDL-C降低42%。但需注意该药与环孢素或其他免疫抑制剂合用,可引起横纹肌溶解。由于肝脏移植术的死亡率、致残率以及相关的医疗费用均较高,术后需终生使用免疫抑制剂,因此该手术仅限用于治疗家族性高胆固醇血症,而且应当特别慎重。只有在各种保守治疗均无效的情况下,才考虑肝脏移植术。
1. Hensrud DD,Klein S. Extreme obesity:a new medical crisis in the United States. Mayo Clin Proc. 2006;81(10 Suppl):S5-S10.
2. Mehta NN,Azfar RS,Shin DB,et al. Patients with severe psoriasis are at increased risk of cardiovascular mortality:cohort study using the General Practice Research Database. Eur Heart J. 2010;31(8):1000-1006.
3. Rajpara AN,Goldner R,Gaspari A. Psoriasis:can statins play a dual role?Dermatol Online J. 2010;16(2):2.
4. Wierzbicki AS,Viljoen A. Hyperlipidaemia in paediatric patients:the role of lipid-lowering therapy in clinical practice. Drug Saf. 2010;33(2):115-125.
5. Ceung AK. Is lipid control necessary in hemodialysis patients?Clin J Am Soc Nephrol. 2009;4 Suppl 1:S95-101.
6. Im JA,Kim SH,Lee JW,et al. Association between hypoadiponectinemia and cardiovascular risk factors in nonobese healthy adults. Metabolism. 2006;55(11):1546-1550.
7. Matsuzawa Y. Establishment of a concept of visceral fat syndrome and discovery of adiponectin. Proc Jpn Acad Ser B Phys Biol Sci. 2010;86(2):131-141.
8. Nosadini R,Tonolo G. Role of oxidized low density lipoproteins and free fatty acids in the pathogenesis of glomerulopathy and tubulointerstitial lesions in type 2 diabetes. Nutr Metab Cardiovasc Dis. 2011;21(2):79-85.
9. Willcox DC,Willcox BJ,Todoriki H,et al. The Okinawan diet:health implications of a low-calorie,nutrient-dense,antioxidant-rich dietary pattern low in glycemic load. J Am Coll Nutr. 2009;28 Suppl:S500-516.
10. Talati R,Sobieraj DM,Makanji SS,et al. The comparative efficacy of plant sterols and stanols on serum lipids:a systematic review and meta-analysis. J Am Diet Assoc. 2010;110(5):719-726.
11. Kelly RB. Diet and exercise in the management of hyperlipidemia. Am Fam Physician. 2010;81(9):1097-1102.
12. Klein S,Burke LE,Bray GA,et al. Clinical implications of obesity with specific focus on cardiovascular disease:a statement for professionals from the American Heart Association Council on Nutrition,Physical Activity,and Metabolism:endorsed by the American College of Cardiology Foundation.Circulation.2004;110(18):2952-2967.
13. Teramoto T,Shimano H,Yokote K,et al. New evidence on pitavastatin:efficacy and safety in clinical studies. Expert Opin Pharmacother. 2010;11(5):817-828.
14. Gotto AM Jr,Moon J. Pitavastatin for the treatment of primary hyperlipidemia and mixed dyslipidemia. Expert Rev Cardiovasc Ther. 2010;8(8):1079-1090.
15. Gray J,Edwards SJ,Lip GY. Comparison of sequential rosuvastatin doses in hypercholesterolaemia:a meta-analysis of randomised controlled trials. Curr Med Res Opin. 2010;26(3):537-547.
16. Russo MW,Scobey M,Bonkovsky HL. Drug-induced liver injury associated with statins. Semin Liver Dis. 2009;29(4):412-422.
17. Meador BM,Huey KA. Statin-associated myopathy and its exacerbation with exercise.Muscle Nerve. 2010;42(4):469-479.
18. Miyares MA. Anacetrapib and dalcetrapib:two novel cholesteryl ester transfer protein inhibitors. Ann Pharmacother. 2011;45(1):84-94.
19. Tancevski I,Demetz E,Eller P. Sobetirome:a selective thyromimetic for the treatment of dyslipidemia.Recent Pat Cardiovasc Drug Discov. 2011;6(1):16-19.
20. Abifadel M,Pakradouni J,Collin M,et al.Strategies for proprotein convertase subtilisin kexin 9 modulation:a perspective on recent patents.Expert Opin Ther Pat. 2010;20(11):1547-1571.
21. Rizzo M. Lomitapide,a microsomal triglyceride transfer protein inhibitor for the treatment of hypercholesterolemia. Drugs. 2010;13(2):103-111.
22. Halperin IJ,Kumar SS,Stroup DF,et al. The association between the combined oral contraceptive pill and insulin resistance,dysglycemia and dyslipidemia in women with polycystic ovary syndrome:a systematic review and meta-analysis of observational studies. Hum Reprod. 2011;26(1):191-201.
23. Oka K,Davis AR,Chan L. Recent advances in liver-directed gene therapy:implications for the treatment of dyslipidemia. Curr Opin Lipidol. 2000;11:179-186.
24. Ma KW,Dai XZ,Feng SY,et al. Heparinized polyvinyl alcohol to specifically adsorb low-density lipoprotein from plasma.Transfus Apher Sci. 2011;44(1):3-9.













