糖尿病心血管病属于糖尿病慢性大血管病变的范畴,主要涉及糖尿病性心脏病(diabetic cardiopathy,DCP)、脑血管病(cerebrovascular disorder,CVD)及外周血管病(peripheral vascular disorder,PVD)三个领域。糖尿病性心脏病(diabetic cardiopathy)是指由于糖尿病所引起的,在糖和脂肪等多代谢紊乱长期得不到纠正的基础上发生的心脏大血管病变、微血管病变以及自主神经病变。其中,大血管病变主要位于心脏表面的冠状动脉,即糖尿病性冠心病;微血管病变是指心肌内的微小血管病变,即糖尿病心肌病(diabetic cardiomyopathy);支配并调控心脏活动的自主神经形态与功能异常主要引起心律失常。糖尿病心脏病与非糖尿病患者相比,其起病更早,糖尿病患者伴冠心病常表现为无痛性心肌梗死,梗死面积比较大,穿壁梗死多,病情更严重,预后更差,病死率更高。男性糖尿病心脑血管病的发生率约为非糖尿病患者群的2.5倍,女性则高达3.5~4.5倍。如冠状动脉造影和临床排除冠状动脉病变,糖尿病患者出现严重的心律失常、心脏肥大、肺淤血和充血性心力衰竭,尤其是难治性心力衰竭,临床可考虑糖尿病心肌病变。流行病学资料表明,约50%的初诊2型糖尿病患者已有冠脉病变;70%以上的糖尿病患者死于心血管并发症或伴随症,心肌梗死是2型糖尿病的首要致死病因。
糖尿病是脑血管病的独立危险因素,糖尿病者脑血管病发生率较非糖尿病者明显增高,女性尤甚。Framingham研究发现,45~74岁糖尿病脑梗死发生率较非糖尿病者男性高2.5倍,女性高3.7倍。而且,糖尿病者各年龄段缺血性脑卒中的发生率均高于非糖尿病者。糖尿病脑血管病以脑动脉粥样硬化所致缺血性脑病最常见,如短暂性脑缺血发作(transient ischemic attack,TIA)、腔隙性脑梗死、多发性脑梗死和脑血栓形成等。脑血栓形成多发生于大脑中动脉,而腔隙性脑梗死则多见于脑内深穿支的供血区,如壳核、内囊、丘脑及脑桥基底等。由于糖尿病高血压发生率甚高(20%~60%),出血性脑病亦很常见。
糖尿病患者有易发血管闭塞性疾病的倾向,外周血管病变(PVD)的发生率至少是非糖尿病患者的4倍,且随年龄增长和病程延长而增加。多中心流行病学调查显示,我国50岁以上的糖尿病人群中有近1/5患有PAD,糖尿病患者是否容易患PAD与年龄、吸烟、糖尿病病程、血糖升高水平及收缩期血压有关,但与性别无关。糖尿病患者的PVD具有发病年龄早、进展快和病情重等特点。据报道,糖尿病患者中,62%的足部难治性溃疡和46%的截肢与动脉缺血有关。
本文主要讨论糖尿病心血管病。
糖尿病患者发生动脉粥样硬化的机制不仅包括传统的危险因素如高龄、女性、遗传、高血糖、血脂紊乱、高血压、吸烟和肥胖等,还包括胰岛素抵抗(IR)、内皮细胞功能受损、纤溶系统异常、氧化应激反应增强、慢性炎症反应、细胞因子增高和白蛋白尿等非传统危险因素。传统的和非传统的危险因子相互联系与共同作用,导致动脉粥样硬化的发生与发展(图1,图2)。许多因素促进动脉粥样硬化的进展,最初是其中的一种危险因素参与,从改善内皮细胞功能或者是改变脂质氧化到巨噬细胞和血管平滑肌增生,其共同途径是因内皮细胞损伤而形成动脉硬化斑块。
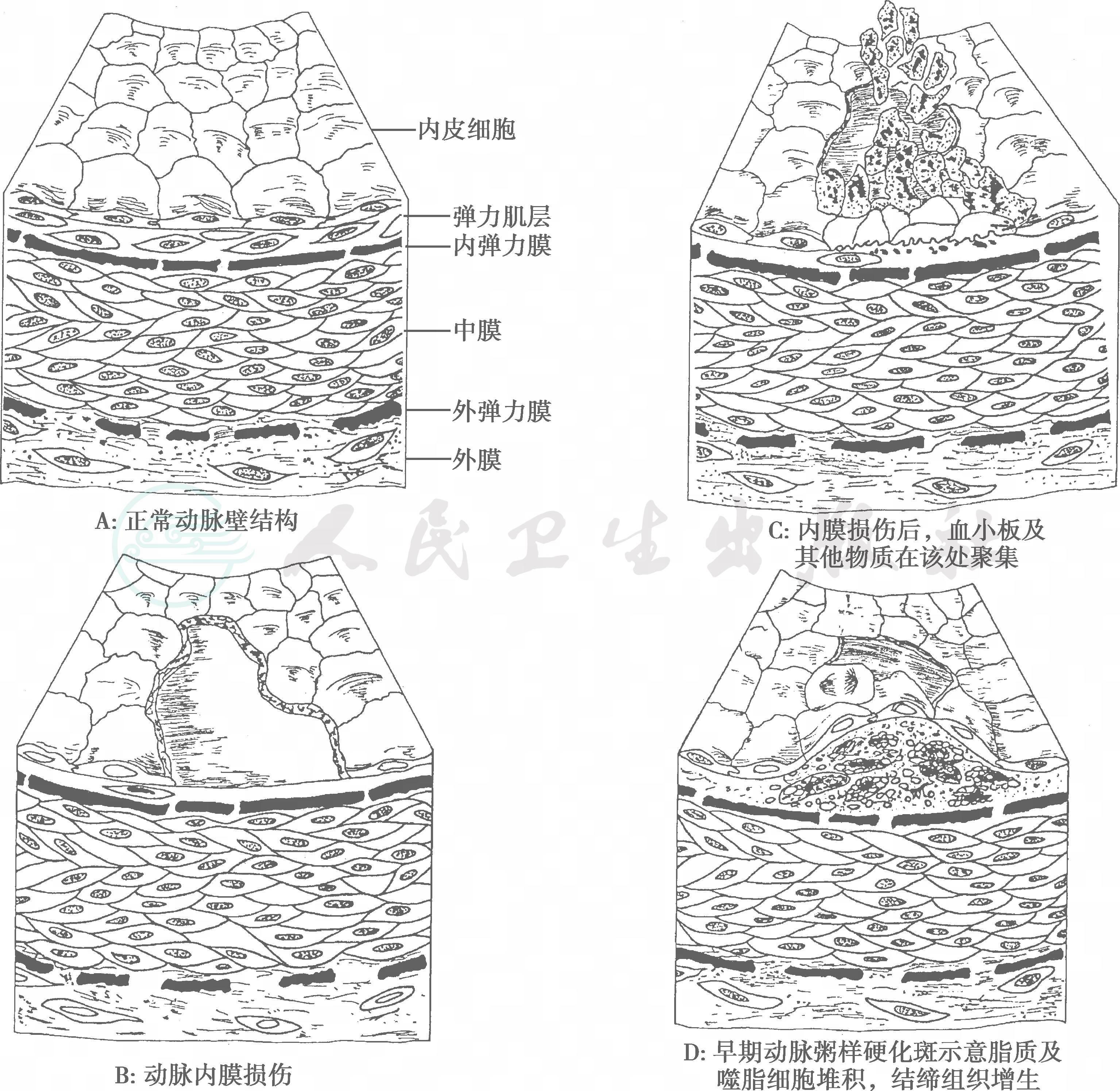
图1 动脉粥样硬化斑的形成过程
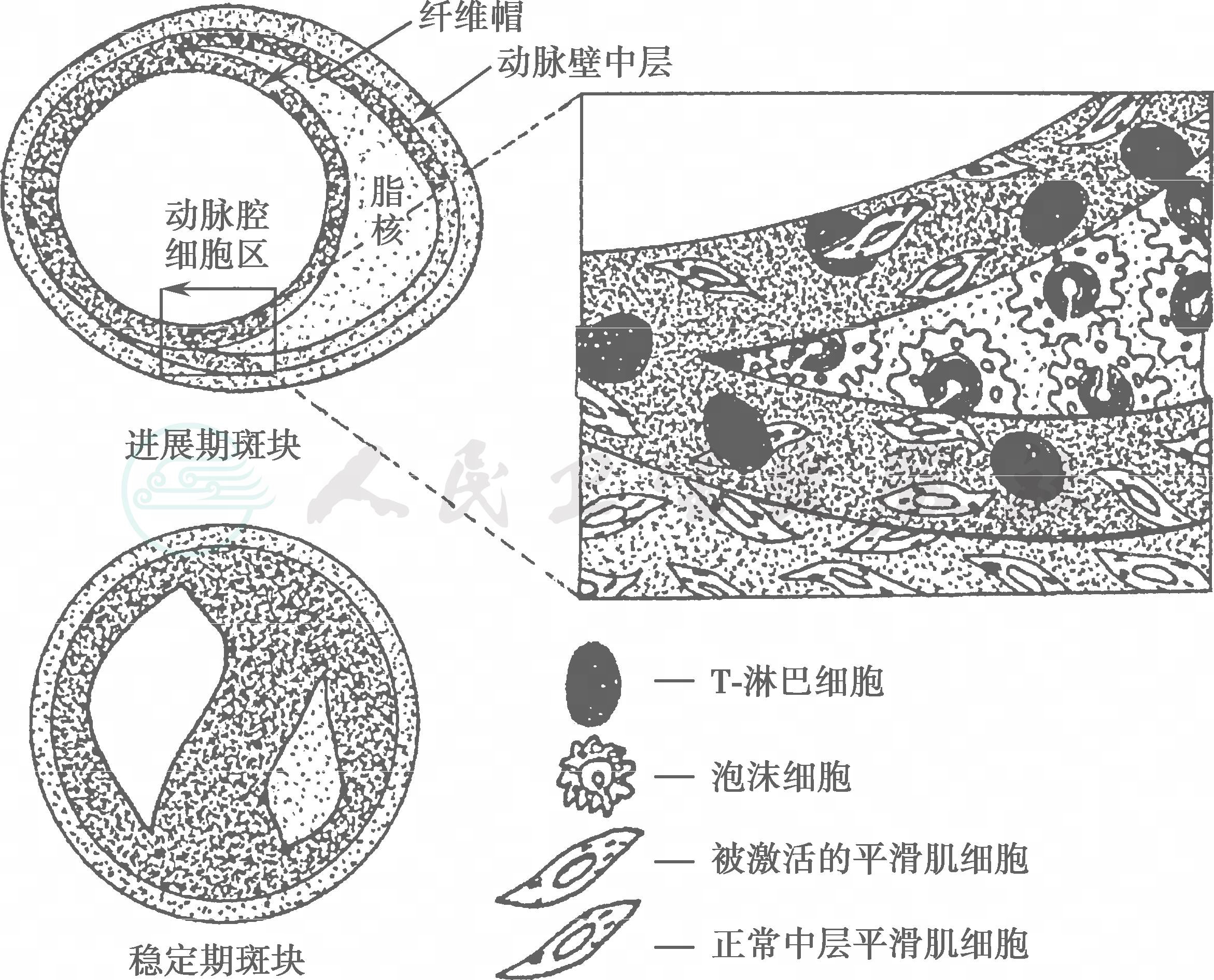
图2 脆性斑块和动脉硬化性血栓的形成
注:脆性斑块破裂导致动脉血栓形成,后果由动脉壁损伤或缺血所诱发。在一般情况下,脆性斑块并非动脉狭窄的原因,当斑块的纤维帽破裂时,平滑肌细胞、巨噬细胞和淋巴细胞被激活,与纤维帽作用,合成的金属蛋白酶等降解基质蛋白(胶原纤维),使不稳定的斑块纤维帽破裂
(一) 传统危险因素引起动脉粥样硬化和心血管病
1.遗传因素
2型糖尿病、高血压、高脂血症、冠心病和肥胖症均被发现有家族聚集现象,尤其与红细胞膜钠-锂逆转换(sodium lithium countertransport,SLC)、血管紧张素转换酶基因、瘦素基因和载脂蛋白E基因的多态性等有关。
2.高血糖
高血糖时,血红蛋白与葡萄糖结合成糖化血红蛋白(HbA1c),其输氧功能下降,尤其在葡萄糖酵解中,2,3-二磷酸甘油酸(2,3-DPG)下降,氧分离困难,组织缺氧;高血糖还通过醛糖还原酶(aldose reductase)生成更多的山梨醇,刺激动脉平滑肌细胞及成纤维细胞增生。英国前瞻性糖尿病研究(UKPDS)表明,HbA1c可以预测缺血性心肌病,HbA1c每增加1%,冠心病的危险性增加10%。
餐后高血糖与糖尿病大血管并发症的关系更密切。目前认为,即使是餐后血糖一过性波动也可通过以下的机制产生心血管损害:①葡萄糖毒性作用:过高的餐后血糖加速蛋白非酶促糖化(早期产物由HbA1c表示,晚期产物由蛋白糖化终产物AGEs表示),并可通过众多机制影响血管,如红细胞膜糖化后,红细胞变形能力下降;糖化低密度脂蛋白(LDL)很难被LDL受体识别,吞噬细胞通过清除途径增加对LDL的摄取,并形成泡沫细胞;LDL更易氧化,并刺激血小板聚集;AGEs通过细胞因子的增殖作用,促进血管基质增生。②餐后高血糖增强氧化应激反应,加剧血管病变发展。③餐后高血糖使D-二聚体和凝血酶原片段释放入血,凝血酶形成增加,继而导致纤溶增加和反复的凝血机制激活。④高血糖激活内皮细胞蛋白激酶C(PKC),刺激黏附因子表达。
3.肥胖
中心性肥胖和高胰岛素血症、胰岛素抵抗、脂代谢紊乱、前炎症/前血栓状态关联。脂肪组织合成和分泌许多生物活性物质(如脂联素、抵抗素、瘦素、纤溶酶原激活物抑制物、TNF-α和IL-6等),促进心血管损害。脂联素通过各种途径发挥其抗动脉粥样硬化作用:①抑制TNF-α诱导的单核细胞黏附和E-选择素(E-selectin)、VCAM-1及ICAM-1等在内皮细胞表达;②激活环一磷酸腺苷(cAMP)-蛋白激酶A,抑制核因子-κB(NF-κB)的信号传导,抑制内皮细胞黏附;③直接与血小板衍生生长因子(platelet-derived growth factor,PDGF)-BB结合并间接抑制PDGF-BB刺激的平滑肌细胞(P42/44)细胞外信号相关酶表达,从而抑制PDGF-BB诱导的血管平滑肌增殖与迁移;④通过磷脂酰-肌醇3激酶(PI3K)途径间接刺激内皮细胞产生NO,改善内皮细胞的舒张功能。研究发现,冠心病患者的血浆脂联素明显降低,糖尿病伴冠心病者脂联素更低,因而特别容易发生动脉粥样硬化。
心脏外脂肪覆盖了80%的心脏表面,紧靠心脏的脂肪组织沿冠状动脉分布,几乎覆盖了全部右心室。从生理上看,心外脂肪垫起了保护和缓冲冠状动脉和心脏作用,并为冠状动脉和心肌的微循环提供能量(脂肪酸)。但肥胖引起的心脏外脂肪堆积是冠状动脉粥样硬化独立危险因素。
4.脂质代谢紊乱
美国国家胆固醇教育计划成人治疗方案第3次指南(NECP-ATPⅢ)把糖尿病从冠心病危险因素中删除,而将糖尿病视为冠心病的等危症,因为无冠心病史的糖尿病患者发生主要冠脉事件的危险与冠心病患者等同,其在10年内发生初次心肌梗死的危险>20%,等同于患过心肌梗死的非糖尿病患者10年内再发心肌梗死的危险度。UKPDS研究发现,血脂谱异常是冠心病的独立危险因素,糖尿病合并血脂谱异常显著增加心血管事件的发生率。在糖尿病中,以LDL-C升高者冠心病风险最大,其次是HDL-C降低、HbA1c、高血压和吸烟。2型糖尿病的血脂谱特点是:①LDL-C升高或正常,但是即使LDL-C正常,也常伴有小而密LDL颗粒增加,而后者的致动脉粥样硬化作用更强;②HDL-C降低;③TG升高。
(1)HDL-C下降
是糖尿病患者血脂紊乱的特点之一。在糖尿病患者中,血浆HDL-C低于正常,其降低程度与TG增高相关,提示在T2DM中血浆HDL-C可能与病情控制有关。TG增高时,胆固醇酯酰基转运蛋白(cholesterolestertransf erprotein,CETP)将HDL-C中的胆固醇转到VLDL的交换增加,促进了HDL-C的分解。另外,VLDL清除障碍和LPL活性降低也使HDL3向HDL2转换减少。所以,有冠心病的糖尿病患者更常出现血浆TG升高和HDL-C低下。血浆HDL浓度受下列3个因素的调节:①新生态HDL合成与进入血循环的速度;②周围毛细血管壁脂蛋白脂酶的活力;③肝内脂肪酶活性。此三者均受胰岛素调节,故HDL浓度与血浆胰岛素浓度亦有关系,糖尿病经胰岛素控制后HDL可恢复正常。
(2)小而密低密度脂蛋白增多
由于每个小而密低密度脂蛋白颗粒中的胆固醇含量较低,所以糖尿病患者血浆LDL-C正常或轻度升高,其重要特点是LDL质的异常,即小而密低密度脂蛋白(sLDL)增多。sLDL容易在动脉壁沉积和被单核巨噬细胞吞噬。高TG和高VLDL刺激CETP活性,促进TG向LDL转移,从而形成sLDL。因此,sLDL较大而疏的LDL更具致动脉粥样硬化危险。许多横断面研究提示,T2DM患者sLDL明显占优势,肝脂酶(HL)活性增高,HL使富含TG的LDL脂解,形成更多的sLDL,血浆TG、CETP和HL的改变可分别解释sLDL变异的10%、5%和3%。sLDL有以下特点:①较大而轻的LDL易被氧化修饰,容易被巨噬细胞氧化和促进细胞因子的级联反应,进一步引起血管内皮和平滑肌的损伤;②与糖蛋白亲和力增加,更易与糖蛋白结合并进一步沉积在血管内膜中;③sLDL与LDL受体(apoB/ E受体)亲和力下降,使血浆LDL清除延迟,水平增加。
(3)高TG血症
IR是导致脂代谢紊乱的中心环节。IR时,血中非酯化脂肪酸(FFA)增多,进入肝脏的FFA使肝脏合成极低密度脂蛋白(VLDL)及胆固醇酯。胆固醇酯浓度调节VLDL的产生,其浓度高时VLDL合成增加,富含TG的脂蛋白增多,脂蛋白脂酶(lipoprotein lipase,LPL)活性下降使VLDL和TG清除率降低。糖尿病患者高TG血症与冠心病的危险性增高相关。
(4)载脂蛋白异常
载脂蛋白A1(apoA1)的糖化与血糖直接相关。研究表明,apoA1糖化使HDL-C与HDL受体亲和力下降。由于新生态的HDL-C主要由肝脏产生,进入血液循环后的主要功能是清除胆固醇,使总胆固醇水平下降,故为动脉粥样硬化和冠心病的保护因子。研究显示,血浆HDL-C升高1mg/dl(0.026mmol/L)使冠心病的危险性下降2%~3%。
apoB糖化可能对LDL代谢起重要作用。资料显示,2%~5%的LDL糖化可以减少5%~25%的LDL分解代谢,而且apoB糖化使巨噬细胞摄取糖化型LDL增多,刺激泡沫细胞形成和LDL氧化。另外,糖化型低密度脂蛋白(Gly-LDL)和氧化型低密度脂蛋白(ox-LDL)与糖尿病血管并发症的关系密切,其可能机制是:①ox-LDL被巨噬细胞识别并吞噬,使细胞内胆固醇酯聚集,形成泡沫细胞,促进早期动脉粥样硬化。Gly-LDL直接与血管基质蛋白结合,使基底膜增厚,血管壁弹性降低,两者均直接损伤血管内皮细胞,增加凝血酶原活性,刺激血小板聚集;②引发免疫反应,使吞噬细胞释放IL-1β和TNF-α等,进而导致血管病变;③T2DM患者体内自动氧化-糖基化过程增强,自由基增多,抗氧化防御作用降低。群体研究发现,HDL-C水平与冠心病的危险性呈负相关,说明HDL-C具有心脏保护作用。
5.性激素异常
行经期妇女较少发生动脉粥样硬化与冠心病,提示雌激素有保护作用。雌激素提高血HDL水平,故育龄期女性血HDL高于男性;但给男性患者用雌激素反使冠心病恶化。
6. 脂联素和网膜素-1
脂联素抗动脉硬化的机制见图3。脂联素(adiponectin)有三聚体、六聚体和更大的高分子量结构(high molecular weight,HMW)等多种同型异构体,其中三聚体主要介导其在心脏、骨骼肌和下丘脑的效应。脂联素具有抗糖尿病、抗炎和抗动脉粥样硬化作用。血浆脂联素水平往往先于肥胖和胰岛素抵抗而下降。脂联素表达增加可增强胰岛素的敏感性。血浆PAI-1增加和脂联素降低共同导致肥胖患者心血管病变的发生。网膜素-1是联系骨质疏松和动脉钙化的共同因子,网膜素-1(omentin-1)通过降低RANKL/OPG比值而抑制血管钙化,但对动脉粥样硬化是否有效仍需进一步研究。
7. 其他危险因子
其他的传统危险因子有高龄和吸烟等。
(二) 非传统危险因素引起动脉粥样硬化和心血管病
大动脉病变可能以动脉粥样硬化为主,因为血管的管腔大,除了引起血压升高、局部性血管狭窄和血栓栓塞事件外,一般不会导致血管完全闭塞。但在小动脉,高血糖、高血压和血脂紊乱可导致小动脉粥样硬化、血管壁钙化与高凝状态,这些病变可能是糖尿病冠脉病变的早期特征型表现,而代谢紊乱使内皮细胞介导的冠状小动脉扩张障碍可能是小动脉病变的启动步骤(图4)。除了上述因素外,下列病理生理改变也是引起小动脉病变的重要因素。
1. 高胰岛素血症和胰岛素抵抗
高胰岛素血症使血压升高的作用机制是:①增加肾脏对钠及水的重吸收;②增加对食盐摄入的血压敏感性(盐敏感型高血压);③加强AT-2的升压作用和对醛固酮的反应性;④降低Na+/K+-ATP酶的活性,增加Na+/H+泵的活性;⑤增加细胞内Ca2+潴留;⑥刺激血管平滑肌移行,胰岛素及IGF-1促进血管病变的发展。
体脂分布较体重指数(BMI)能更好地预测胰岛素抵抗(IR)及心血管危险性。研究发现,腰围是预测IR的独立指标,可解释50%以上的IR变异。高胰岛素血症促进动脉壁脂质合成与摄取,阻止胆固醇清除,促进动脉壁平滑肌细胞增殖,形成高脂血症和高脂蛋白血症,诱发和加剧动脉粥样硬化。IR及其伴随的高胰岛素血症是冠心病的独立危险因子,但胰岛素本身对心血管疾病的作用不明。一方面,胰岛素有舒张血管和抗炎作用,可延缓动脉粥样硬化的形成。另一方面,胰岛素能刺激血管细胞生长及合成细胞外基质。胰岛素信号通路在糖代谢失调时,可反应性地增加NO的生成,而当细胞外通路失调时,即丧失其抗动脉粥样硬化作用。
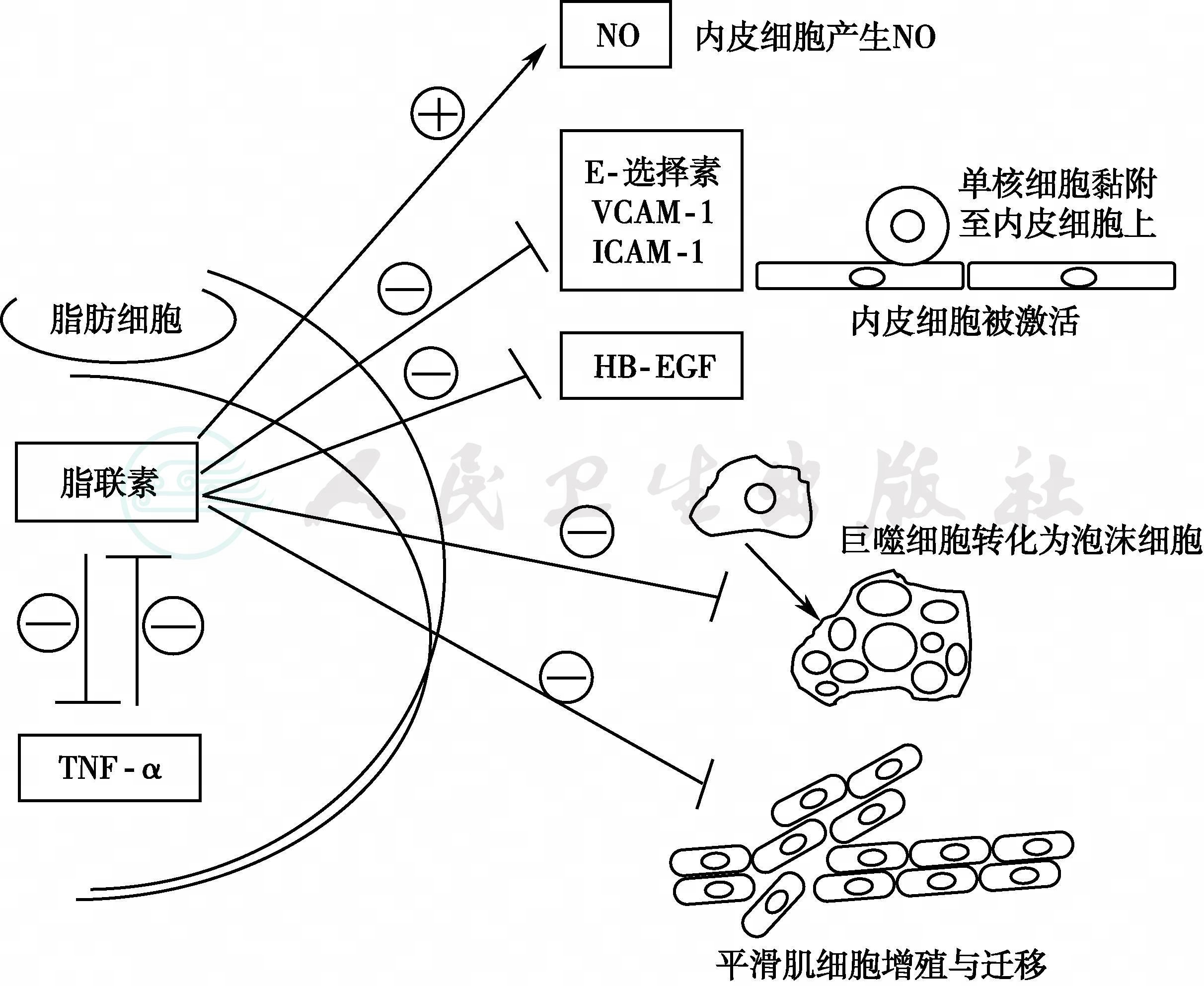
图3 脂联素抗动脉硬化的机制
注:○+:激活;○-:抑制;NO:一氧化氮;TNF-α:肿瘤坏死因子-α;E-selection:E-选择素;VCAM-1:血管细胞黏附分子-1;ICAM-1:细胞间黏附分子-1;HB-EGF:肝素结合表皮生长因子样生长因子
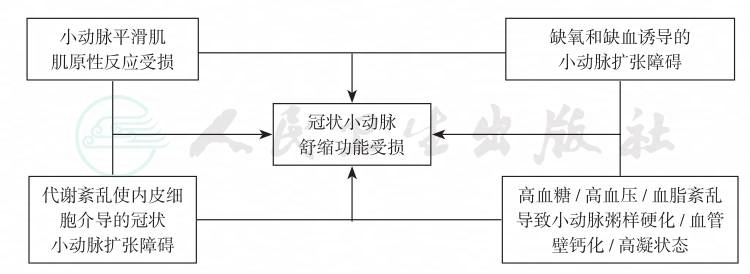
图4 冠状小动脉病变的发病机制
注:在引起冠状小动脉病变的四条途径中,高血糖、高血压和血脂紊乱导致小动脉粥样硬化、血管壁钙化与高凝状态可能是糖尿病冠脉病变的早期特征,而代谢紊乱使内皮细胞介导的冠状小动脉扩张障碍是发病的启动步骤
2.醛固酮与激肽
心肌局部的醛固酮参与了动脉粥样硬化的发病过程,主要与心肌重构(cardiac muscular remodeling)有关,而螺内酯具有某种保护作用。糖尿病容易导致弥漫性、迅速进展性动脉粥样硬化,这种病变更易诱发血管重建(vascular remodeling)。激肽释放酶-激肽系统(kallikrein-kinin system,KKS)是一种血管活性肽系统,激肽通过其受体B1R和B2R参与心肌与血管重建。其中B2R有保护心肌的作用,而B1R有诱发和促进心肌病变的效应。
3.内皮细胞功能受损
血管内皮(vascular endothelium)对动脉粥样硬化的发生起了“第一道防线”的防御作用。研究表明,血管内皮细胞(vascular endothelial cells,EC)功能异常在糖尿病前期就已存在,随着血糖升高,血管EC功能受损逐渐加重,高血糖、高FFA血症、IR、氧化应激及慢性炎症等多种因素相互影响与累加,使动脉粥样硬化的病理改变不断进展和恶化,最终导致心血管事件的发生。
4.纤溶凝血机制异常
纤维蛋白溶解系统(fibrinolytic system)稳定代表着纤溶酶原激活物与其抑制物(PAI-1)间的正常平衡。过度的抑制纤溶将导致凝血和血栓形成(心血管事件)。糖尿病患者存在着纤溶和凝血机制异常,其中最重要的改变是组织型纤溶酶原激活物(tissue-type plasminogen activator,t-PA)与PAI-1间的平衡。胰岛素、胰岛素原、VLDL-C及各种细胞因子均可调节PAI-1的合成和释放。当存在高胰岛素血症、高血糖、IR及FFA升高时,肝脏合成PAI-1增加,导致纤溶抑制,促进糖尿病患者高凝、低纤溶活性和高血黏度的发生和发展,增加心血管事件的危险性。糖尿病患者的凝血异常还包括血浆纤维蛋白原、Ⅴ因子、Ⅱ因子和Ⅶ因子的改变,以及升高的D-二聚体、血管性血友病因子抗原(vWF抗原)、抗血纤维蛋白溶素和降低的抗凝血酶Ⅲ。
5.慢性炎症状态
许多炎症因子与糖尿病及其并发症关联。糖尿病动脉粥样硬化其实也是一种慢性炎症性病变。在糖尿病状态下,许多炎症因子(如C反应蛋白、TNF-α和IL-6等)增高。动脉粥样硬化的形成包括一系列病理性序贯过程,即内皮损伤及功能不良→黏附分子表达增加→趋化因子释放→单核细胞募集→白细胞黏附与迁移→巨噬细胞摄取ox-LDL→泡沫细胞形成→活化型单核细胞释放细胞因子→平滑肌细胞增殖与迁移→动脉粥样斑块形成。而在T2DM患者中,IR和慢性高血糖均参与并加速这一炎症过程。CRP与动脉粥样硬化的发生、发展及预后密切相关。血CRP水平在肥胖、IR、糖耐量减低及糖尿病患者群中升高。作为独立于其他危险因素的炎症标志物,CRP与糖尿病的发生直接相关,并随病情进展而逐步升高。
6.其他危险因子
其他危险因子还包括微量蛋白尿、高同型半胱氨酸血症和血管壁异常等。
以冠状动脉、脑动脉、肾动脉和下肢动脉受累多见,基本病理变化为动脉粥样硬化、微血管基底膜增厚、糖原沉积、脂肪样变性和透明样变性。在动脉内膜损伤的最早期,血小板及其他物质在损伤处聚集,可见内膜下有1~2mm大小的黄色粒块状突起物,并逐渐融合和增大,形成粥样斑块。斑块内有含有大量脂质的巨噬细胞、胆固醇、TG、LDL-C、磷脂和钙盐的沉积。血管平滑肌细胞和成纤维细胞大量增殖,内膜向管腔面伸出,使管腔变窄。病变严重时,斑块上出现溃疡、出血和血栓形成。血栓呈不规则的半月形,并有程度不等的、层次分明的机化或钙化。管腔狭窄、闭塞。动脉中层不规则增厚,中层及外膜均有纤维化和钙化(图5)。
心肌细胞内含有大量糖原、脂滴和糖蛋白沉积,严重者可有局灶性坏死,心肌间质有灶性纤维化。心肌微血管内皮细胞增生,PAS染色阳性的糖蛋白类物质和玻璃样物质沉积在血管壁内,血管壁增厚。肌原纤维收缩蛋白明显减少,肌浆网横管系统扩张,心肌有收缩带形成、线粒体肿胀以及闰盘黏合膜处细胞间隙增宽等改变。冠状动脉受累病变范围广,多数累及多支血管,病变严重,Ⅲ~Ⅳ级病变多见。可伴发心肌梗死灶。
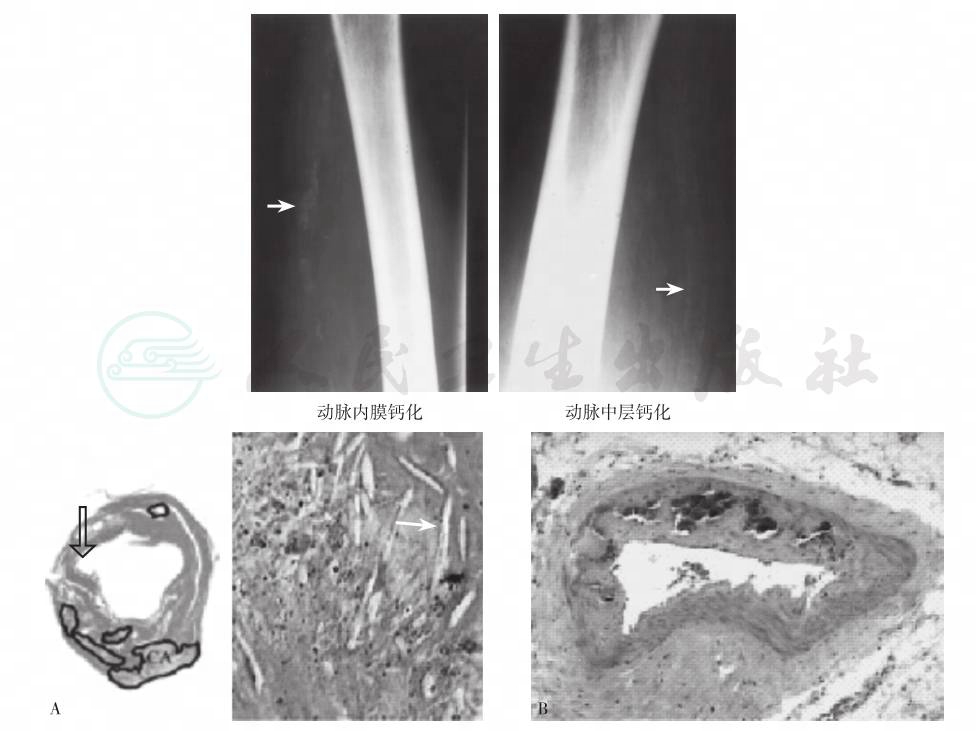
图5 动脉粥样硬化和动脉中层钙化
注:股动脉内膜钙化呈斑块状(左上图,X线片箭头处,),显微镜下(左下图)见钙盐沉着和结缔组织增生;动脉中层钙化呈条索状(右上图,X线片箭头处),显微镜下(右下图)见不规则的增厚。中层及外膜均有纤维化和钙化
钙化性小动脉病(calcific arteriolopathy,CAP)是动脉钙化的严重并发症。早期表现为关节周围的髋部或大腿中部皮肤星状紫癜(stellate purpura)、网状青斑(livedo reticularis)、皮肤钙盐沉着与下肢近端硬性溃疡,亦可见于大腿和下腹部,偶见于心、肺、肾、胃黏膜和乳腺。动脉钙化进展为全层血管钙化与闭塞时,出现组织缺血、局部淤血、血管扩张、钙化结节形成、局部溃疡和组织坏死。
如病史中曾出现过心绞痛、心肌梗死或心力衰竭(隐匿型冠心病可无症状),心电图、心脏彩超和SPECT等有相应的心肌缺血或梗死表现,或冠脉造影和血管内超声检查(intravascular ultrasonography)有管腔狭窄(≥50%)者,可诊断为冠心病。心肌缺血者可参考图6所示程序进行诊断。
糖尿病患者进行冠状动脉检查的指征是:①典型或不典型心肌缺血症状;②休息时ECG提示心肌缺血或有心肌梗死大Q波者常预示将出现心脏突发事件;③外周动脉或颈动脉阻塞性疾病;④糖尿病患者伴有以下两条或更多冠心病危险因素者,如总胆固醇≥240mg/dl(6.24mmol/L)、LDLC≥160mg/dl(4.16mmol/L),或HDL-C<35mg/dl(0.91mmol/L);或血压>140/90mmHg,或吸烟;家族中有中年发生的冠心病者;或尿白蛋白≥20μg/min。以上任意两项阳性者的心血管病死亡率由30人/1万人年剧增至90人/1万人年。脂蛋白α和同型半胱氨酸浓度升高也是冠心病的危险因素,至少需要每年评估1次。
虽然无高血压或冠心病表现,但有糖尿病史并伴心脏增大(尤其女性左心室后壁和室间隔增厚)、左心房扩大、左心功能减低、心率变异性减低、MIBG断层心肌显像异常或心脏自主神经病变检查异常者,应诊断为糖尿病心肌病。
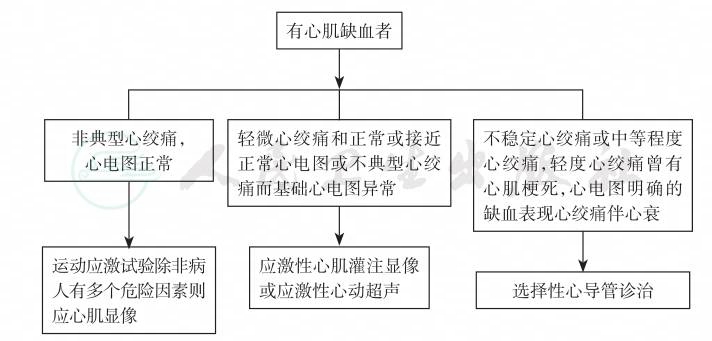
图6 有心肌缺血的诊断程序
(一)心电图/心脏超声/动脉内膜中层厚度/心脏自主神经功能检查有助于早期诊断
糖尿病和心血管病相互影响,互为因果。因此凡遇有其中之一,即需对另一疾病进行检查。
2004年,法国SFC/ALFEDIAM建议对T2DM患者具有以下心血管高危因素、无症状的个体进行筛查:①>60岁或已知病程超过10年和有以下至少2个其他心血管危险因素:A:总胆固醇>2.5g/L,低密度脂蛋白胆固醇>1.6g/L,或高密度脂蛋白胆固醇<0.35g/L,甘油三酯>2g/L或调脂治疗;B:血压>140/90mmHg或降血压治疗;当前或近3年吸烟者;C:在一级亲属中有过早的CAD家族史(在60岁前)。②周围动脉疾病或颈动脉疾病。③蛋白尿。④微量白蛋白尿和除年龄以外的至少2个心血管危险因素。⑤久坐的生活方式,年龄≥45岁者。
1.心电图
无特异性。运动心电图和24小时动态心电图对无症状心肌缺血的检出有一定帮助。
2.超声心动图
超声心动图(echocardiography)和MRI是诊断糖尿病性心肌病的最佳方法,表现为局限性或广泛性心肌壁收缩幅度降低;由于心肌慢性缺血,心肌纤维组织增生,心内膜处于冠状血管的末梢部更易因缺血而形成纤维性变。心肌和心内膜纤维组织增生在超声上表现为回声增强;还可有二尖瓣反流,因左心室受累使二尖瓣失去正常子弹头形态而呈葫芦形;左室舒张功能减退表现为心室早期充盈血流峰速/心室晚期充盈血流峰速比下降等。
3.颈动脉/股动脉内膜中层厚度
在动脉粥样硬化发生发展的过程中,动脉内膜是最早受累及的部位,血管壁内膜中层增厚是动脉粥样硬化的早期标志,而斑块形成是动脉粥样硬化的特征,可以反映动脉粥样硬化的程度。颈动脉粥样硬化程度与冠状动脉粥样硬化程度密切相关,以颈动脉/股动脉内膜中层厚度>0.85mm和(或)出现粥样斑块来预测冠心病,其特异性为71.6%,敏感性为85%,阳性预测率89.8%。
4.心脏自主神经功能
主要有:①静息心率:有糖尿病心脏自主神经病变者静息心率常大于90次/分;②深呼吸时心率变化:平均每分钟做深呼吸6次,同时描记心电图,计算深呼吸时最大与最小心率之差,正常应≥15次/分,心脏自主神经病变时<10次/分;③瓦氏试验心电图R-R变异:深吸气后尽量屏气,然后以15秒内吹气达40mmHg压力的速度吹气,同时描记心电图,正常人最大与最小心率之比应>1.21,心脏自主神经病变者<1.1;④体位性低血压:先测量安静时卧位血压,然后嘱患者立即站立,于3分钟内快速测量血压,如收缩压下降≥30mmHg(正常人≤10mmHg)可以确诊有体位性低血压,下降>11~29mmHg为早期病变;⑤握拳试验:持续用力握拳5分钟后立即测血压,正常人收缩压升高≥16mmHg,如收缩压升高≤10mmHg,可诊断有心血管自主神经病变。
5.其他检查
主要包括:①指压试验:正常时用手指压迫甲床,表现为局部苍白,松开后迅速恢复粉红色,如解除压迫后局部充盈减慢或局部苍白,则提示局部动脉血供障碍;②肢体抬高试验:患者仰卧,显露双小腿,双下肢伸直,足根部抬高使双下肢达80° 1分钟,如肢体苍白,提示肢体缺血。苍白程度与动脉狭窄严重程度呈正比;③皮肤温度测定:温度觉测定可分为定性测定和定量测定两种。定性测定简单,如将音叉或细的不锈钢小棍置于温热水杯中,取出后测定患者不同部位的皮肤感觉,同时与正常人(检查者)比较。利用红外线皮肤温度测定仪(infrared dermal thermometry)定量测定的准确度和重复性较好。
(二)疑难病例接受特殊检查
1.血管内超声和彩色多普勒超声
血管内超声(intravascular ultrasound,IVUS)是利用安装在心导管尖端的微型超声探头由血管内探测管腔大小和管壁结构的介入性超声诊断技术,已成为冠心病诊断和治疗的重要影像手段,它可以判断粥样硬化斑块的稳定性,准确测定冠状动脉狭窄的程度,指导经皮冠脉介入治疗,评价介入治疗效果以及阐明再狭窄机制等。彩色多普勒超声(color Doppler ultrasound)可检测颅内和下肢血管血流动力学情况。经颅超声波(transcranial Doppler,TCD)可诊断颅内血管痉挛、狭窄和闭塞。局部狭窄血流及异常增高的峰值流速(VS),提示该血管供血区可能有梗死灶。下肢彩色多普勒可发现血管壁增厚、内膜回声不均、动脉管腔狭窄与扭曲,其频谱呈单相波,血管内径及血流量降低,血流峰值流速及加速度/减速度高于正常。
2.多普勒踝动脉压/踝肱指数/经皮氧分压
踝肱指数即踝动脉-肱动脉血压比值(ankle/brachial index,ABI),反映下肢血压与血管状态,正常值1.0~1.4;<0.9为轻度缺血,0.5~0.7为中度缺血,<0.5为重度缺血。重度缺血患者容易发生下肢(趾)坏疽。正常情况下,踝动脉收缩压稍高于或相等于肱动脉,但如果踝动脉收缩压高于200mmHg应高度怀疑下肢动脉粥样硬化性闭塞。此时应测定足趾血压。足趾动脉较少发生钙化,测定踝动脉或足趾动脉需要多普勒超声听诊器或特殊仪器(仅能测定收缩压)。如果用多普勒超声仍不能测得足趾收缩压,则需采用激光测定。
经皮氧分压(transcutaneous oxygen tension,TcPO2)通过测量皮肤组织中的氧含量以了解皮肤组织的血流灌注量,反映微循环状态和周围动脉的供血状况。正常人足背皮肤氧张力(TcPO2)大于40mmHg,TcPO2小于30mmHg提示周围血液供应不足,足部易发生溃疡或已有溃疡形成。TcPO2小于20mmHg,足溃疡愈合的可能性很小,需要进行血管手术。如吸入100%氧气后,TcPO2提高10mmHg,提示溃疡预后较好。
3.CT/MRI和PET-CT
可确定病灶部位、大小和性质(出血或缺血)。脑梗死多在24小时后显示,3~7天最佳,呈底向外的扇形或三角形低密度灶,边界清楚。MRI可更早、更好显示病灶,T1呈低信号,T2呈高信号。螺旋CT血管造影对血管病变,尤对Willis环显影敏感,颅内有磁性物质者也可应用。磁共振血管显像(magnetic resonance angiography,MRA)可发现闭塞血管及侧支循环情况。PET可计算脑代谢、血流和氧耗量并成像,用于早期诊断。
4.放射性核素检查
可较早地提示亚临床期病变。核素显像(nuclear imaging)和99mTc-门控单光子发射电脑断层扫描(gated-single photon emission computed tomography)可早期诊断糖尿病性心肌病。无创性去甲肾上腺素类似物标记的核素扫描可用于评价心交感神经功能,最常使用的是123IMIBG。
5.冠脉造影
可发现受累部位管腔狭窄或闭塞,常累及多处血管,同一血管常多处受累。冠状动脉造影是诊断冠心病的金标准,但有一定危险性,应合理选择。一般先应用非创伤性的冠心病诊断试验,如24小时心电图监测ST段偏移、冠状动脉钙化积分、平板(treadmill)运动心电图、应激性心肌灌注显像和应激性心动超声等。
由于糖尿病高血糖对于心血管系统的毒性作用与其对其他脏器的作用一样是一个缓慢而隐匿的过程,在出现症状前已有一定的功能损害,因而一旦T2DM确诊,就应着手防治心血管病。糖尿病性心肌病与冠心病的治疗重点应放在预防心血管事件的第一次发作上,因为多数糖尿病伴急性冠脉综合征者均死于入院以前或医院内,而急性冠脉综合征(acute coronary syndrome)发作后,多数在1年内死亡。
(一)合理饮食和运动有利于控制血糖和心血管病
通过平衡膳食,配合运动和药物治疗,将血糖控制在理想范围,维持理想体重。饮食治疗应个体化,制订饮食计划时,除了要考虑到饮食治疗的一般原则外,还要考虑糖尿病心血管病变的类型、生活方式和是否伴有肥胖等情况。
运动治疗的目的是与饮食治疗配合,维持标准体重,改善IR状态,改善心肺功能。高强度运动还可诱发酮症或酮症酸中毒;运动中可有血压升高、尿蛋白增加、神经病变进展、退行性关节病加重以及低血糖等。大强度运动可加重心脏负担,使血容量减少,血管收缩,有诱发心绞痛、心肌梗死及心律失常等危险,潜在的冠状动脉疾患可导致猝死;因此心功能不全、严重心律失常、不稳定型心绞痛和近期发生心肌梗死者不宜过度运动。大强度运动还可使收缩压增高,增加脑血管意外的潜在危险,故当收缩压>180mmHg时,应停止运动。
以HbA1c达标为目标,积极而理性地控制糖尿病,血糖改善能降低心血管事件的发生率。血糖控制差将导致心血管死亡率危险增加。STOP-NIDDM的研究证实了阿卡波糖通过降低餐后高血糖从而降低了糖耐量低减(IGT)人群心血管疾病事件及新发高血压的危险。其中,阿卡波糖可使IGT人群心肌梗死的危险下降91%,任何心血管事件的发病率降低49%,新诊断高血压的发病率降低34%。伴有严重心衰和其他心血管并发症的患者应该用胰岛素控制高血糖。但是,糖尿病心血管病变者尽量降低低血糖发生率,因为严重低血糖发作可诱发急性心脑血管事件。
(二)降压治疗需达到控制目标值
临床研究显示,2型糖尿病患者有效降压可降低糖尿病相关终点事件、心血管死亡及全部死亡风险。我国部分地区糖尿病患者血压控制达标率仅为1/3,伴大量蛋白尿患者血压达标率不足1/5,且糖尿病患者血糖和血压控制同时达标率更低。依据2010年ADA糖尿病指南及我国糖尿病指南推荐,糖尿病患者血压控制<130/80mmHg,而合并肾损害且蛋白尿>1g/d者血压应<125/75mmHg。同时降压目标需遵循个体化原则。强调糖尿病高血压的管理做到三级预防,早期诊断和早期达标,对初诊糖尿病患者以及有高血压危险性的患者每次就诊需常规进行血压测量。
高血压治疗包括非药物治疗和药物治疗,前者包括控制体重、合理饮食(尤其限盐)、适当运动、心理治疗和戒烟、限酒。目前常用降压药包括RAS阻断剂[血管紧张素转化酶抑制剂(ACEI)和血管紧张素Ⅱ受体阻滞剂(ARB)]、钙通道阻断剂(CCB)、利尿剂和α受体阻滞剂等。ACEI及ARB推荐为糖尿病合并高血压的初始降压药或基础用药,但不推荐两者联合应用,利尿剂、CCB和α受体阻断剂一般在ACEI/ ARB应用基础上适当联合使用。对糖尿病合并高容量性高血压、水钠潴留及心功能不全者加用少量噻嗪类利尿剂,对糖尿病合并心衰和严重水肿者可适当选择袢利尿剂,如呋塞米等;CCB为糖尿病高血压患者有效的降压药物。
脉压增宽是动脉硬化的简易、实用而敏锐指标,在预测心血管疾病方面,优于高压与低压。大动脉与心脏收缩呈反向运动。心脏收缩时大动脉扩张,缓冲心脏射血时的压力;心脏舒张时大动脉回位,利于血液进入心脏。当大动脉硬化,弹性减退,造成收缩压升高,舒张压降低,脉压增宽。脉压增宽直接损害动脉内膜,牵拉、撕裂动脉壁弹力纤维,进一步加重动脉硬化,脉压增宽与动脉硬化之间恶性循环。
研究表明,脉压大于60mmHg,冠状动脉硬化的严重程度与病变范围明显加重;脑卒中的发生率是脉压小于40mmHg的5.5倍;肌酐清除率等肾脏功能明显减退。在单纯收缩期高血压患者中,收缩压水平相似的情况下,脉压每增宽10mmHg,疾病总死亡率、心血管病死亡率与高血压靶器官受损相对风险分别升高38%、48%和64%。
抗高血压治疗中,降低脉压是减少血管损害的策略之一。其具体措施与一般抗高血压治疗并无区别,钙拮抗剂、转换酶抑制剂、硝酸酯类药物均有一定效果。在营养治疗中更强调限制饱和脂肪酸和低钠膳食。同时应行调脂药物治疗。
1.ACEI和ARB
不但可降低血压,还可防止糖尿病肾病,减少尿白蛋白排泄。此外,ACEI还能改善胰岛素的敏感性,但ACEI有干咳的副作用。ARB效果温和,单独应用一般要在用药4周后才可见到降压效果,因此对血压较高者最好在钙拮抗剂或利尿剂应用的基础上选用。
2.钙拮抗剂
对糖尿病高血压有较好效果,尤其是一些不适宜选用ACEI的患者。伴有冠心病者应首选钙拮抗剂。服用短效钙拮抗剂的高血压患者心肌梗死的危险性比用利尿剂或β受体阻滞剂者高60%(与血压的谷峰比值增大有关),因此主张应用长效钙拮抗剂。
3.β受体阻滞剂
通过降低心排血量和抑制RAA系统而起降压作用。其对年轻、心率较快、无其他并发症的糖尿病伴高血压的患者或伴有冠心病心绞痛而无充血性心力衰竭的患者适用。这类药物影响糖代谢、脂代谢和胰岛素分泌;但UKPDS对ACEI与β阻滞剂(阿替洛尔)的降压效果进行了比较,结果显示β阻滞剂略优。这两种降压药物对研究终点,如糖尿病相关死亡、心肌梗死和所有微血管并发症的影响无优劣之分。另外,两种药物对微蛋白尿和显性蛋白尿的影响亦无差别,ACEI与β受体阻滞剂用于治疗T2DM伴高血压同样安全有效。
4.利尿剂
糖尿病伴高血压因有钠潴留,应用利尿剂可减低钠和体液容量,同时降低血管紧张度,纠正血管对加压物质的高反应。但噻嗪类及袢利尿剂可加重糖及脂代谢紊乱及电解质紊乱,因此应慎用。合并心肾功能不全者可短期选用呋塞米加保钾利尿剂。吲达帕胺(indapamide)是一种磺胺类利尿剂,通过抑制肾皮质稀释部分对钠的重吸收而发挥作用,通过改变离子交换,降低心血管平滑肌收缩力,刺激舒血管PGE2和PGI合成,且不影响血脂及糖类的代谢。
5.α受体阻滞剂
可扩张血管,降低外周阻力,使血压下降,对糖及脂代谢无不利影响。但由于糖尿病患者常伴有心脏交感神经病变,肾素分泌不足,主动脉和颈动脉窦压力感受器不敏感,末梢血管敏感性降低,常发生直立性低血压。
(三)调脂治疗降低心血管事件发生率和死亡率
糖尿病控制与并发症试验(DCCT)及英国前瞻性糖尿病研究(UKPDS)认为,降低高血糖可使糖尿病微血管并发症发生率下降,但不能降低心血管事件的发生率。LDL-C是糖尿病患者罹患冠心病的预测因子,4S(scandinavian simvastatin survival study)研究发现,塞伐他汀(zocor)降低血胆固醇,使心血管病死亡率降低42%,冠心病突发事件减少55%。
1.生活方式干预
TLC包括合理饮食、运动和保持合适体重。饮食要求总脂肪的摄入量不高于每日总热量的30%,其中饱和脂肪的摄入量不超过总热量的10%。每日总胆固醇的摄入量应该小于200mg,减少饮酒和戒烟。临床研究显示坚持有氧运动锻炼(例如步行、游泳、慢跑或骑车)20~30分钟,每周4~5次可显著提高HDL-C水平,降低TG。除TLC干预外,大多数糖尿病患者需要进行药物调脂治疗。
2.调脂药物治疗
糖尿病患者存在多种血脂异常,处理原则亦不相同。2009年ADA糖尿病治疗指南对T2DM的血脂管理原则和要求是:①生活方式治疗(低脂饮食和运动等)有利于血脂谱异常的改善;②无论血脂谱是否异常,对所有伴有1项危险因素的40岁以上的T2DM患者均需要加用他汀类药物治疗;③单纯糖尿病患者的血脂首要管理目标是使LDL-C降至100mg/dl以下,合并心血管病的T2DM患者应使用较大剂量的他汀类药物,使LDL-C降至70mg/dl以下;④如果使用最大剂量的他汀类药物无法达到上述目标,那么可选的目标是降低LDL-C 40%;⑤TG<150mg/dl,HDL-C>40mg/dl(男性)或>50mg/dl(女性)。
(1)他汀类药物
首先应处理升高的血LDL-C和改变LDL成分,治疗目标要使血LDL-C<100mg/dl(2.6mmol/L)。他汀类药物是目前降低LDL-C最有效的药物。T2DM患者无论LDL-C水平如何,均应使用他汀类药物治疗。另外,欧洲胆固醇指南也为糖尿病患者制定了更为严格的降脂治疗目标,并建议糖尿病患者的血脂治疗目标值应和已确诊为心脏病的患者相同或者要求更严格。NCEP ATPⅢ指南新近推荐,极高危人群LDL-C应降至1.8mmol/L(70mg/dl)以下。临床研究提示,辛伐他汀(simvastatin)升高HDL和ApoA1的作用优于阿托伐他汀(atorvastatin)。LDL-C达标后,应重点考虑的目标是升高血HDL-C。T2DM患者的血脂异常通常表现为血HDL-C降低,而且血HDL-C可作为冠心病风险的预测指标。尽管饮食、运动、减轻体重和戒烟等行为干预对升高血HDL-C有益,但若不同时进行药物治疗,效果并不理想。
(2)贝特类
如血HDL-C<1.04mmol/L(<40mg/dl),而LDL-C介于2.6~3.3mmol/L,可选用贝特类调脂药物。高TG血症是T2DM患者最常见的脂代谢异常表现形式之一,治疗高TG血症应控制高血糖。良好的血糖控制会明显降低TG,如果血糖控制满意而TG仍未达标,就要选用贝特类药物;对于同时伴有血LDL-C升高和TG升高的T2DM患者则应选用大剂量他汀类药物,但对于血TG≥11.3mmol/L(≥1000mg/dl)的严重高TG血症患者,必须严格限制饮食中的脂肪含量(<总热量的10%),并配合贝特类降脂药物治疗,以避免发生胰腺炎。
(四)抗血小板药物预防心血管事件
1.阿司匹林
阿司匹林对糖尿病患者的心脑血管并发症有多种有益作用:①抑制COX、NF-κB和免疫球蛋白重链结合蛋白(immunoglobulin heavy chain binding protein,BiP)等关键性炎症物质;②抗血栓形成作用;③抗氧化应激作用。
ADA和美国心脏病学会(AHA)联合推荐40岁以上并具有心血管危险因素的糖尿病患者采用小剂量阿司匹林治疗。然而,该共识来自过去的研究资料,而且在该研究人群中糖尿病患者较少。研究显示,阿司匹林在既往有心肌梗死或卒中的患者中可有效减少高危患者的发病率和死亡率。Ogawa和Belch等的两项随机对照研究显示,阿司匹林治疗并不能显著减少糖尿病心血管终点事件的发生,因此对糖尿病患者应用阿司匹林作为一级预防治疗的措施提出质疑。抗血小板临床试验(ATT)共入组了95 000例受试者,包括4 000例糖尿病患者。结果显示,阿司匹林可使发生心血管事件危险性减少12%,在非致死性心肌梗死患者中,其减少心血管事件发生的危险性最显著,对冠状动脉粥样硬化性心脏病所致的死亡和卒中的危险性作用较小。阿司匹林减少糖尿病患者心脑血管事件存在性别差异,如在男性患者中,阿司匹林主要减少心血管事件;然而,在女性患者中,阿司匹林主要减少脑血管事件。基于上述研究结果,2010版的ADA临床实践指南仅推荐10年的心血管风险>10%的T1DM及T2DM患者使用阿司匹林进行一级预防,包括男性年龄>50岁、女性>60岁,且伴1项其他心血管危险因素者。
常用剂量和联合用药可有3种选择:①单用阿司匹林:成人的一般常用剂量为每晚100mg,亦可根据患者的将剂量调整至50~325mg/d范围内;②阿司匹林联合用药:阿司匹林50mg/d加延长释放型双嘧达莫(extended release dipyridamole)400mg/d;③氯吡格雷(clopidogrel):对血压控制良好的年龄≥65岁者可改为阿司匹林隔日80~100mg。有严重出血素质、出血性疾病和活动性消化性溃疡者宜慎用或禁用。已发生脑出血者、反复发生的脑出血者和房颤患者禁用。
在心血管病的二级预防中,阿司匹林的抗心血管事件效应明显大于其出血风险,但周围血管病变可能例外。氯吡格雷似乎优于阿司匹林,阿司匹林-氯吡格雷联合治疗对高血栓栓塞风险者的疗效满意,但对长期控制慢性稳定型心血管病不理想,而且当应用两种抗血小板药物时,新发的冠脉事件仍较高。新的腺苷二磷酸受体拮抗剂(adenosine diphosphate receptor antagonists)普拉格雷(prasugrel)、替格雷洛(ticagrelor)和坎格雷洛(cangrelor)可能具有更高的疗效和更小的不良反应。
2.其他药物
尚有低分子肝素、噻氯匹定、低分子右旋糖酐、山莨菪碱、地诺前列酮、延长释放型双嘧达莫和氯吡格雷等药物,可根据病情选用。
(五)特殊心血管病实施个体化治疗
1.糖尿病并心绞痛
在控制糖尿病的基础上,按照冠心病心绞痛的处理原则进行治疗,改善冠状动脉的供血和减轻心肌的耗氧。病程较长和年龄较大的糖尿病常伴有隐性心肌缺血,在评价手术的心血管风险时,需要进一步明确手术耐受性,如运动心电图、多巴酚丁胺负荷超声心动图(dobutamine stress echocardiography)和双嘧达莫心肌灌注闪烁扫描(dipyridamole myocardial perfusion scintigraphy),如果风险较高,应在手术前作相应处理,如预防性心脏血管重建术或药物治疗(β受体阻滞剂、他汀类和阿司匹林)。
2.糖尿病并急性心肌梗死
糖尿病发生急性心肌梗死的治疗原则同非糖尿病急性心肌梗死。但糖尿病患者的预后较非糖尿病患者要差,其原因可能与糖尿病急性心肌梗死患者冠脉病变范围较广泛有关。
3.糖尿病并心力衰竭
与一般心力衰竭的处理原则相同,包括扩血管、利尿和强心等。
4.糖尿病并脑梗死
严格控制血糖,降低血液黏滞度,纠正脂代谢紊乱等。脑梗死的治疗与非糖尿病患者发生脑梗死的治疗原则相同,在脱水和降压的治疗过程中要注意观察电解质、血糖和血渗透压,以免诱发非酮症高渗性昏迷。
5.糖尿病并外周血管病变
糖尿病外周血管病变的预后取决于血管病变的严重程度和患者恢复的潜能。轻到中度动脉闭塞的治疗包括控制危险因素(包括戒烟酒,减轻体重),抗血小板聚集,改善血凝,血管重建,改善血供以及在运动过程中保护足部和每日仔细检查足部。血管重建的适应证包括间歇性跛行(尤其是进行性加重者)、缺血性静息痛、夜间痛、溃疡、坏疽和外科手术不能治愈的缺血)。根据血管病变的部位、程度和临床表现的不同,而采用不同的术式。糖尿病患者对血管重建术耐受性好,死亡率与非糖尿病患者相当。
6.高龄糖尿病心血管病
应考虑以下的特殊之处:①糖尿病的慢性并发症和非糖尿病合并症多,多数合并有高血压、冠心病或脂代谢异常;②容易发生药物性低血糖症,且不容易感知;③多数使用多种其他治疗药物,药物之间的相互作用明显;④身体虚弱,需要更多的个体关照和护理。因此,在降糖治疗时应严密监测,防止发生低血糖症。药物性低血糖又可导致跌倒、心肌缺血和脑梗死,甚至昏迷死亡。治疗措施包括心理治疗、饮食治疗、运动治疗和药物治疗,同时应加强糖尿病知识的宣传教育。应强调的是,针对具体的老年糖尿病患者,治疗方案和措施应个体化。功能状态良好的老人糖尿病患者可将HbA1c控制在<7.0%范围内,而体质虚弱或生命预期<5年者只要控制在8.0%水平即可。
(六)介入治疗和手术治疗改善局部血液供应
介入治疗和血管重建术是冠心病不可缺少的治疗手段,包括经皮冠脉内血管成形术、血管内支架术、斑块旋切术、斑块旋磨术和血管内超声干预等。研究表明,糖尿病患者接受经皮冠脉内血管成形术后较非糖尿病患者更易发生死亡和再梗死;胰岛素治疗的糖尿病患者经皮冠脉内血管成形术后心血管事件和血管重建危险性增加2倍;糖尿病患者外科血管重建术预后较差。BARI研究显示,糖尿病患者外科血管重建术后5年生存率(73.3%)较非糖尿病患者低(91.3%),需胰岛素治疗的糖尿病患者外科手术治疗的效果好于经皮冠脉内血管成形术。
介入治疗的创伤小,恢复快,容易为患者接受。但是不能完全代替外科手术。如果患者是单支血管病变而且病变是局限的,比较适合支架处理。但多支血管病变,特别是关键部位的病变不适合支架治疗。糖尿病患者合并冠心病时,冠状动脉病变往往是弥漫性的。对多发性冠状动脉狭窄患者,单纯介入治疗困难。相反,外科手术治疗的效果肯定,年死亡率1%~1.5%。如果用动脉做血管材料,血管桥的10年通畅率达到90%。不足之处是创伤较大。
搭桥和支架治疗可缓解狭窄远端心肌的缺血问题,不能阻止血管病情的进展。糖尿病是冠心病早发高发的重要因素,而糖尿病的发生与不良生活习惯、高血糖、肥胖和高血压等因素有关。改变不良的生活习惯,纠正或预防代谢紊乱,尤其要把血糖控制在理想范围内,控制血糖波动,避免低血糖发生,注意调脂,降低高血压,并使脉压维持在正常范围内。













