英文名称 :diabetic kidney disease
糖尿病肾脏病是糖尿病的主要并发症之一,是发达国家患者中导致终末期肾病的(end stage renal disease,ESRD)首位病因(约占50%)。我国糖尿病肾脏病的患病率亦呈上升趋势。1型和2型糖尿病患者一生中发生糖尿病肾脏病的风险大致相当。
2007年美国国家肾脏基金会(National Kidney Foundation,NKF)所属“肾脏病预后质量提议”(K/DOQI)工作组提出,将糖尿病导致的肾脏疾病命名为糖尿病肾脏病(diabetic kidney disease,DKD),并建议用DKD代替传统专业术语糖尿病肾病(diabetic nephropathy,DN),而糖尿病肾小球病变(diabetic glomerulopathy,DG)这一病理诊断术语仍保留。DKD的定义陆续被改善全球肾脏病预后组织(Kidney Disease:Improving Global Outcomes,KDIGO)和美国糖尿病学会采纳。DN侧重于病理诊断,大致与DG的概念相似,二者需肾活检确诊。DKD定义为慢性高血糖所致的肾脏损害,病变可累及全肾,包括肾小球、肾小管间质、肾血管等。临床上以持续性白蛋白尿和/或肾小球滤过率(GFR)进行性下降为主要特征,可进展为ESRD。
糖尿病肾病光镜下早期可见肾小球肥大,基底膜轻度增厚,系膜轻度增生。随着病情进展,基底膜弥漫增厚,基质及少数系膜细胞增生,形成典型的K-W(Kimmelstiel-Wilson)结节,称为结节性肾小球硬化症。部分患者无明显结节,称为弥漫性肾小球硬化症。常可见内皮下纤维蛋白帽、球囊滴、小动脉透明样变,伴随肾小管萎缩、近端肾小管上皮细胞空泡变性、肾乳头坏死及间质炎症细胞浸润等。
免疫荧光检查可见沿肾小球毛细血管袢、肾小管和肾小球基膜微弱的弥散的线状IgG沉积,还可伴有IgM、补体C3等沉积。系膜区及K-W结节中罕见IgG、IgM或C3沉积。
电镜下,早期肾小球基底膜不规则增厚,系膜区扩大,基质增多,晚期则形成结节状,这与光镜下所见的K-W结节吻合;渗出性病灶可显示为微细颗粒状电子致密物,还可见足突融合等。
2010年肾脏病理学会(RPS)国际专家组制定了糖尿病肾小球病变病理分级标准,该分级系统适用于1型和2型糖尿病患者。根据肾脏组织光镜、免疫荧光和电镜的改变,将糖尿病肾小球病变分为Ⅰ~Ⅳ型(表1),并对肾小管、间质与血管的损伤进行了定量评分(表2)。
表1 糖尿病肾小球病变的病理分型标准

注:a肾小球基底膜厚度以电镜测量结果为准,其他测量方法亦可参考本数值。
表2 糖尿病肾脏病的间质病变和血管病变评分标准

续表

注:∗只评定,不参与评分。
由胰岛素代谢障碍而致长期高血糖是糖尿病肾脏损伤发生的最关键原因,高血糖造成肾脏血流动力学改变以及葡萄糖本身代谢异常所致的一系列后果为造成肾脏病变的基础,众多生长因子、细胞因子被激活则是病变形成的直接机制。
(一)糖代谢紊乱
高血糖导致的代谢异常是糖尿病肾脏病发生发展的最重要因素。高血糖可以导致:活性氧产生增加;还原型烟酰胺腺嘌呤二核苷酸减少;多元醇通路激活,促进二酰甘油产生,导致蛋白激酶C(protein kinase C,PKC)活性增加;氨基己糖通路改变;对组织蛋白产生非酶糖基化作用,如产生晚期糖基化终末产物(advanced glycation end products,AGEs)。上述机制都参与了糖尿病肾小球病变和其他糖尿病微血管病变的发生、发展过程。
(二)肾脏血流动力学改变
主要表现为肾小球高滤过、高灌注、高压力。导致高滤过的原因有:入球小动脉与出球小动脉不成比例的扩张,扩张入球小动脉的活性物质(如前列腺素、一氧化氮、心房钠尿肽等)过多或作用过强;肾小管-肾小球反馈失常;肾髓质间质压力过低;近来认为近端肾小管中钠、葡萄糖协同转运过强使钠盐在该处过度重吸收是发病的关键。由于这种过度重吸收使鲍曼囊压力降低,肾小球滤过被迫增多。高滤过可导致肾小球血流量及毛细血管压力升高、蛋白尿生成、肾小球毛细血管应切力改变、局部肾素血管紧张素醛固酮系统(RAAS)兴奋、血管活性因子/生长因子增加等。在血糖控制欠佳的患者中,也可以出现肾小球体积增大,肾小球毛细血管表面积增加。肾小球内血流动力学和结构的改变导致糖尿病肾损伤的发生和发展。
(三)激素和细胞因子的作用
一系列细胞因子、激素及细胞内信号通路(如转化生长因子β(TGF-β)、结缔组织生长因子、血管紧张素Ⅱ、血管内皮生长因子、内皮素、前列腺素和一氧化氮等)可能参与了糖尿病肾脏病的发生、发展。
(四)遗传因素
许多证据表明,遗传因素在糖尿病肾脏病的患病和严重程度中起作用。如糖尿病患者有兄弟姐妹或父母罹患糖尿病肾脏病时,该患者出现糖尿病肾脏病的概率明显升高,1型和2型糖尿病均是如此。糖尿病患者肾脏累及还存在种族差异性。
(一)糖尿病肾病以微血管病变为病理特征
糖尿病肾病不仅仅是肾小球病变,而是一种波及全肾组织以微血管病变为特征的弥漫性肾损害。肉眼观可见肾脏体积增大,肾脏表面长期保持光滑,终末期可呈颗粒状肾萎缩表现。组织学基本病变是基底膜样物质增多,并累及系膜细胞,同时有毛细血管基底膜增厚和系膜细胞轻度增生。电镜检查示系膜细胞中细胞器增多。免疫荧光检查可见有IgG、IgM、补体C3和纤维蛋白原呈线样或颗粒样沿基膜沉着,病变继续发展,肾脏可出现典型的肾小球硬化病变,肾脏增大、缩小或正常。糖尿病肾病的早期病理改变是系膜区扩张,主要是由于细胞外基质沉积和系膜细胞增生所致,肾小球基底膜增厚也在早期可见,主要是由于细胞外基质合成增加,排出减少。肾小球上皮细胞(足突细胞)直接覆盖在肾小球基底膜上,近期研究发现在糖尿病肾病的早期即可发生功能和结构的变化。足突细胞通过α3β1和α2β1整合素黏附在基底膜,高糖可使整合素表达的调节紊乱,足突细胞减少伴功能障碍。
(二)肾小球病变包括三种病理类型
肾小球的病理改变有3种类型,包括结节性肾小球硬化、弥漫性肾小球硬化和渗出性病变,其中以结节性肾小球硬化最具特征性,又称毛细血管间肾小球硬化或Kimnel-Steil-Wilson结节(K-W结节)。
1.结节性病变
在不同的肾小球中,其数量和大小不一。完全形成的结节呈近乎圆形或锥形,直径20~200μm,是由糖蛋白、糖和脂质组成的一种透明样沉积物。结节病变随年龄或病程而增大。增大的结节中心呈分叶状。结节外周可见同心圆形排列的系膜细胞核。肾小管及间质也可发生病理改变,远端肾小管细胞普遍肿胀,上皮细胞空泡变性,基膜增厚,间质病变主要表现为间质纤维化,晚期可见肾小管萎缩、基膜增厚和管腔扩张。Kimnel-Steil-Wilson结节为糖尿病肾病的特异性损害,但当临床上找不到糖尿病肾病或糖尿病的其他依据时,要与特发性结节性肾小球硬化症鉴别。后者的肾脏病理特征是肾小球硬化呈结节状,伴入球和出球小动脉粥样硬化,肾小球基底膜增厚,可见局灶性肾小球系膜溶解(focal mesangiolysis)和毛细血管微血管瘤形成。在这些病例中,实际上多数仍存在糖代谢紊乱或糖尿病,真正的特发性结节性肾小球硬化罕见。本病的病因未明,可能是肾小动脉狭窄致肾小球缺血所致。此外,糖尿病性结节性肾小球硬化还应与继发性局灶性肾小球硬化鉴别。
2.弥漫性病变
肾小球中系膜基质广泛增多,为嗜酸性,PAS染色阳性物质,或局限于小叶的中央部分和结节相似,或广泛地播散于毛细血管间;肾小球毛细血管基膜有不同程度的增厚,轻者仅少数毛细血管累及,病理形态如系膜增生型肾炎;如累及毛细血管较多,基膜增厚较著,则和基膜增生型肾炎相似。在一个患者中可同时存在结节性病变和弥漫性病变。
3.渗出性病变
患者肾毛细血管中有均匀、圆形的嗜酸性物质沉着,常呈半月形,位于周围毛细血管,性质似纤维素,有时含脂类物质,病变无特征性。
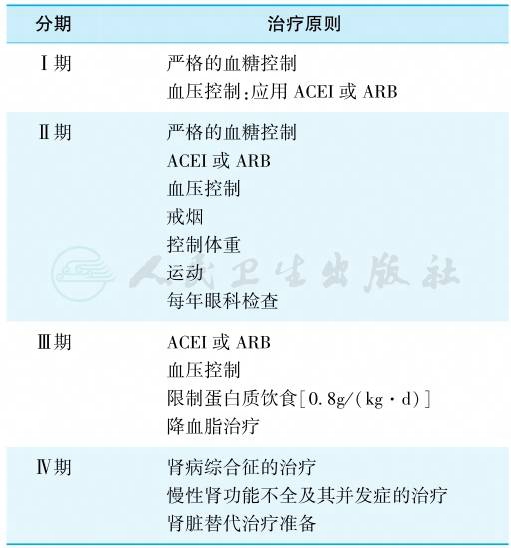
糖尿病肾脏病的治疗,主要强调早期干预各种危险因素,包括积极控制高血糖、控制血压、纠正脂质代谢紊乱、治疗肥胖、戒烟等措施,以防止进一步肾损害,不同病期、不同对象治疗的侧重点有所不同。DKD各期的治疗原则如表3所示。
表3 各期糖尿病肾脏病的治疗原则
(一)控制血糖
糖尿病肾脏病患者的血糖控制应遵循个体化原则。对于未透析的CKD患者,糖化血红蛋白(HbA1c)目标值<6.5%~8.0%。由于CKD患者的红细胞寿命缩短,在CKD G4~G5期的患者中,特别是透析患者,HbA1c的准确性下降,可以用果糖胺、糖化血清白蛋白、连续血糖监测等反映血糖控制水平。
控制血糖的治疗,除了生活方式的改善之外,在降糖药物的选择方面,最新的KDIGO指南建议将二甲双胍和钠-葡萄糖协同转运蛋白2(sodium-dependent glucose transporters 2,SGLT-2)抑制剂(SGLT2i)作为糖尿病合并CKD,且 eGFR≥30ml/(min•1.73m2)患者的一线治疗。由于二甲双胍具有明显的降糖作用,但对DM并发症的长期作用中等;而SGLT2i虽降糖作用较弱,但对CKD进展和心血管并发症具有明显的保护作用,因此对于eGFR≥30ml/(min•1.73m2)的2型DM CKD患者,二甲双胍和SGLT2i联合使用受益更大。在使用二甲双胍时,需监测肾功能变化,若eGFR<45~60ml/(min•1.73m2),需调整剂量;若eGFR<30ml/(min•1.73m2),需停用二甲双胍。如二甲双胍与SGLT2i联合使用,仍未达到降糖目标,可加用其他降糖药物。人胰高糖素样肽-1(GLP-1)受体激动剂(GLP-1RA)利拉鲁肽或索马鲁肽因具有明确的心血管保护作用,以及可能的肾脏保护作用可作为首选的添加药物。需根据肾功能,调整GLP-1RA剂量。若与其他药物如磺酰脲类或胰岛素合用后低血糖风险增加,建议合用时减少磺酰脲类或胰岛素剂量。
(二)控制血压
血压升高是糖尿病肾脏病进展的重要危险因素。既往认为糖尿病患者的血压控制目标应低于一般人群,但近年来研究注意到糖尿病肾病患者低血压的不利影响,因此提倡中等程度的血压控制(收缩压为130~140mmHg)。
ACEI或ARB在糖尿病肾脏病中有控制血压、减少蛋白尿、延缓肾功能进展的作用,是目前治疗糖尿病肾脏病的药物中临床证据最多的,被推荐作为治疗糖尿病肾脏病的一线药物。对于糖尿病伴高血压和白蛋白尿的患者,使用ACEI或ARB,可用至患者可耐受的最高批准剂量。对于糖尿病伴白蛋白尿但无高血压的患者,可以考虑使用RAS抑制剂。虽然在这类患者中RAS阻断的益处尚待研究,但由于糖尿病患者白蛋白尿的严重程度和ESRD强烈相关,因此可能有益。在应用ACEI、ARB过程中,特别是初始应用的第1周,应监测血清肌酐及血钾水平。不应对糖尿病肾病患者使用ACEI加ARB联合治疗,联合治疗并不能预防肾病进展和死亡,且会使严重不良事件的发生率升高。
若血压控制仍未达标,可联合使用其他降压药,如利尿剂、心脏选择性β受体阻滞剂、α受体阻滞剂、钙通道阻滞剂(CCB)等。
(三)纠正脂质代谢紊乱
高脂血症不仅直接参与糖尿病胰岛素抵抗和心血管并发症的发生,低密度脂蛋白胆固醇(LDL-C)还可以加重蛋白尿和肾小球及肾小管间质纤维化的进展,因此积极纠正脂代谢紊乱具有重要意义。
低密度脂蛋白胆固醇(LDL-C)的治疗目标应<2.6mmol/L,合并心血管疾病的糖尿病患者LDL-C<1.8mmol/L。建议首选口服他汀类药物,单用他汀类药物治疗效果不理想者,可考虑他汀类和依折麦布联用。以甘油三酯升高为主时,可选择贝特类降脂药。对于维持性血液透析的2型糖尿病肾脏病患者,由于目前的大型随机对照临床试验未发现他汀类治疗对心脑血管事件的益处,所以患者如果临床无特定的心血管方面的治疗指征,可以不予他汀类药物治疗。如果患者开始透析时已接受他汀类药物治疗,则可继续治疗。
(四)生活方式的调整
糖尿病患者生活方式的自我调整包括饮食治疗、运动、戒酒、戒烟、控制体重等,有利于减缓糖尿病肾脏病进展,保护肾功能。
适宜的营养治疗可能延缓肾脏损伤的进展,对于非透析CKD患者和透析患者,蛋白质摄取量分别为0.8g/(kg•d)和1.0~1.2g/(kg•d)。限制钠饮食,每日钠摄入<2g,或氯化钠<5g有助于血压的控制。每日摄入的总热量应使患者维持接近理想体重。
(五)肾脏替代治疗
当糖尿病肾脏病患者接近ESRD时,处理原则与非糖尿病患者类似。通常情况下,当GFR<10ml/(min•1.73m2)时需开始透析治疗,但对于糖尿病肾脏病患者尤其合并容量依赖性高血压,或难以控制的高钾血症者,往往需要早期开始透析治疗。可供选择的肾脏替代治疗包括血液透析、腹膜透析和移植。肾移植患者的长期存活和生活质量高于慢性透析患者,但肾移植本身不能改善其他微血管并发症(如视网膜病变、神经病变)。胰腺或胰-肾联合移植可改善糖尿病肾脏病患者自主神经病变,延缓视网膜病变进展,同时可避免胰岛素应用相关并发症,使患者的生活质量得到明显提高。













