体内的碳水化合物代谢产生两种乳酸同分异构体(enantiomers),即左旋乳酸(L-乳酸,L-lactate,levolatic acid)和右旋乳酸(D-乳酸,dextrorotary lactate,dextrolatic acid)(图5-28-3)。因此,乳酸性酸中毒应分为L-乳酸性酸中毒(L-lactic acidosis)和D-乳酸性酸中毒(D-lactic acidosis)两类。但是,一般情况下的乳酸性酸中毒仅指L-乳酸性酸中毒。机体乳酸产生过多和(或)其清除减少引起血L-乳酸明显升高(≥5mmol/L),导致代谢性酸中毒(血碳酸氢盐≤10mmol/L,动脉血气pH≤7.35),称为L-乳酸性酸中毒(简称乳酸性酸中毒),而D-乳酸性酸中毒是指血清D-乳酸≥3mmol/L的临床状态。血乳酸增高而无血pH降低称为高乳酸血症(hyperlactacidemia)。在糖尿病基础上发生的乳酸性酸中毒称为糖尿病乳酸性酸中毒(diabetic lactic acidosis,DLA),亦应包括糖尿病L-乳酸性酸中毒(常见)和糖尿病D-乳酸性酸中毒(少见)两种。DLA的发病率在0.25%~4%,多发生于服用大量苯乙双胍伴肝肾功能不全和心衰等的糖尿病患者,虽不常见,但后果严重,死亡率高。

图5-28-3 乳酸的同分异构体
乳酸性酸中毒可分为L-乳酸性酸中毒和D-乳酸性酸中毒两类,其病因与分类见表5-28-5。
表5-28-5 乳酸性酸中毒的病因与分类

(一) L-乳酸和D-乳酸的来源和代谢不同
1. L-乳酸来源与代谢
正常人血清中的L-乳酸来源于细胞代谢,以左旋乳酸为主,葡萄糖分解代谢生成的丙酮酸大部分经三羧酸循环氧化供能,但在缺氧或氧利用障碍时,大部分丙酮酸则在乳酸脱氢酶的作用下还原为乳酸。机体内产生乳酸的部位主要为红细胞(无线粒体)、骨骼肌、皮肤和神经等代谢活跃的组织;在氧供不充足时,人体绝大多数组织都能通过糖酵解途径生成乳酸。当人体在剧烈运动时,组织处于相对缺氧的生理状态;一些疾病(休克、心功能不全造成组织低灌注以及窒息或严重贫血造成低氧状态)也可导致机体处于缺氧的病理状态,均可使体内无氧糖酵解增强,乳酸生成增多。
2. D-乳酸来源与代谢
人类缺乏D-乳酸脱氢酶,仅能通过D-α-羟酸脱氢酶(D-α-hydroxy acid dehydrogenase)生成丙酮酸(图5-28-4)。由甲基乙二醛途径(methylglyoxal pathway)生成的D-乳酸很少,仅11~70nmol/L,尿D-乳酸<0.1μmol/h。但在某些情况下,肠道细菌可产生大量D-乳酸,使血清D-乳酸升高数百至数千倍。此外,外源性D-乳酸或L-乳酸可来源于发酵食品(如腌菜和酸奶等)。D-乳酸在组织中的转运依赖于质子-依赖性单羧酸盐转运体(proton-dependent mono carboxylate transporters,MCT1~8),表达MCT的组织很多,如视网膜、骨骼肌、肾脏、肝脏、脑组织、胎盘、血细胞、毛细血管内皮细胞、心肌细胞和肠黏膜细胞等。
(二) 肝/肾是利用和清除L-乳酸的主要器官
正常情况下,肝脏可利用机体代谢过程中产生的乳酸为底物,通过糖异生合成葡萄糖,即所谓的Cori循环,或转变为糖原加以储存,少量乳酸经肾自尿液排出,机体乳酸的产生和利用之间保持平衡,血乳酸浓度相对恒定。若血乳酸明显升高,大大超过肝脏的处理能力,同时超过乳酸肾阈值(7.7mmol/L),则可通过肾脏由尿中排泄,因此在肝肾功能不全时,易出现高乳酸血症,严重时可发生乳酸性酸中毒。
乳酸产生过多见于:①休克和左心功能不全等病理状态造成组织低灌流;②呼吸衰竭和严重贫血等导致动脉血氧合降低,组织缺氧;③某些与糖代谢有关的酶系(葡萄糖-6-磷酸脱氢酶、丙酮酸羧化酶和丙酮酸脱氢酶等)的先天性缺陷。乳酸清除减少主要见于肝肾功能不全。临床上,大多数的乳酸性酸中毒患者均不同程度地同时存在着乳酸生成过多及清除的障碍。
(三) 缺氧/疾病/药物/中毒引起L-乳酸性酸中毒
L-乳酸性酸中毒可分为组织缺氧型(A类)和非组织缺氧型(B类)两类。
1. 组织缺氧型乳酸性酸中毒(A类)
常见于心衰、心源性休克、窒息、一氧化碳中毒或脓毒败血症等,此时因缺氧导致了大量乳酸产生,远超过机体的清除能力,同时也可能伴有清除能力下降。T2DM患者常并发心血管疾病,因此也可表现为此类。在各种休克的抢救过程中,常需使用较大剂量的儿茶酚胺类升压药。许多缩血管药物可恶化组织灌注,细胞缺血、缺氧更为严重。细胞内,尤其是线粒体的呼吸链缺氧可导致严重的高乳酸血症。有些患者的血乳酸升高不明显,但乳酸/丙酮酸或乳酸/酮体总量比值明显升高,这部分患者的死亡率更高。乳酸/丙酮酸比值升高及高乳酸血症持续的时间越长,多器官衰竭和死亡的概率也越高。
2. 非组织缺氧型乳酸性酸中毒(B类)
即无明显低氧血症或循环血量不足。B类又可分为B-1、B-2和B-3型:①B-1型:见于糖尿病、恶性肿瘤、肝功能衰竭、严重感染及肾衰竭等情况。②B-2型:多由于药物及毒物引起,主要见于双胍类口服降糖药、果糖、山梨醇、木糖醇、甲醇和乙二醇等的中毒。用反转录蛋白酶抑制剂治疗HIV感染时,常发生继发性脂肪营养不良(外周性脂肪萎缩伴中枢性肥胖)和肝损害,患者往往还并发乳酸性酸中毒(NRTI-LD综合征)。长期使用抗反转录病毒治疗时,还可发生严重的多器官衰竭-乳酸性酸中毒综合征。有人用大剂量硫胺(维生素B1)治疗取得较好效果。③B-3型:由于先天性代谢疾病所致,常见者为葡萄糖-6-磷酸酶缺陷(Ⅰ型糖原贮积症)、丙酮酸脱氢酸缺陷、丙酮酸羟化酶缺陷、果糖1,6-二磷酸酶缺陷及线粒体呼吸链的氧化磷酸化障碍等情况。细胞的氧化磷酸化在线粒体呼吸链上进行。参与呼吸链氧化磷酸化的酶类很多,这些酶可因先天性缺陷或后天性病变及毒物中毒而发生功能障碍。这类疾病是线粒体病中的一种类型——线粒体呼吸链病(mitochondrial respiratory chain diseases,MRCD)。MRCD可为局限性(如仅发生于肝脏)或泛发性(肝、脑和肌肉细胞等)。局限于肝脏的MRCD的最优治疗是肝移植,但必须选择好肝移植的受体对象。
此外,无论是儿童或成年人的短肠综合征患者均易发生乳酸性酸中毒,其发生机制未明。
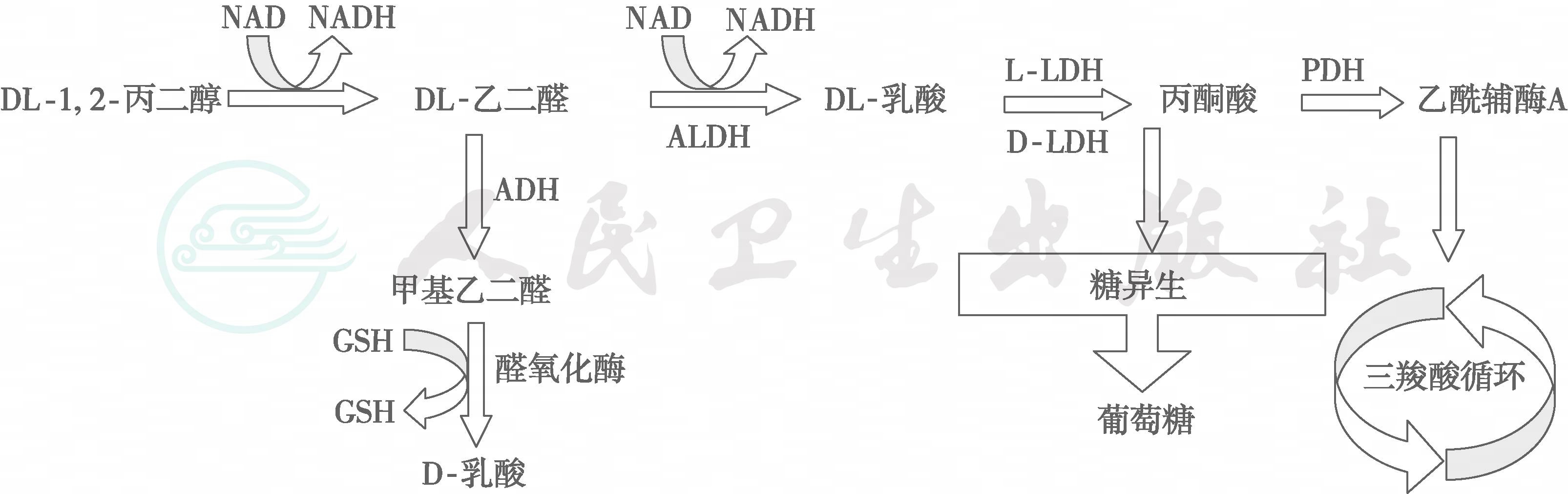
图5-28-4 乙二醇代谢
注:glycol:乙二醇;ADH:alcohol dehydrogenase,醇脱氢酶;ALDH:aldehyde dehydrogenase,醛脱氢酶;GSH:reduced glutathione,还原型谷胱苷肽;PDH:pyruvate dehydrogenase,丙酮酸脱氢酶;L-LDH:L-lactate dehydrogenase,L-乳酸脱氢酶;D-LDH:D-lactate dehydrogenase, D-乳酸脱氢酶
糖尿病存在乳酸利用缺陷。当感染、DKA、HHS或缺氧时容易造成乳酸堆积和乳酸性酸中毒。糖尿病患者易发生DLA是因为:①糖尿病患者常伴有丙酮酸氧化障碍及乳酸利用缺陷,平时即有血乳酸轻度升高,因此在存在乳酸性酸中毒诱因时,更易发生乳酸性酸中毒;②糖尿病性急性并发症如感染、脓毒血症、糖尿病酮症酸中毒(DKA)和非酮症高渗性糖尿病昏迷等时可造成乳酸堆积,因此乳酸性酸中毒可与DKA或非酮症高渗性糖尿病昏迷同时存在;③糖尿病患者可合并心、肝、肾脏疾病或(和)并发心、肝、肾脏损害,可造成组织器官血液灌注不良和低氧血症;同时由于糖化血红蛋白增高,血红蛋白携氧能力下降,更易造成局部缺氧,这些均可引起乳酸生成增加。此外,肝脏及肾脏功能障碍又可影响乳酸的代谢、转化及排出,进而导致乳酸性酸中毒。
(一) 双胍类药物诱发L-乳酸性酸中毒
糖尿病患者常服用双胍类药物,因其能增强糖的无氧酵解,抑制肝脏和肌肉对乳酸的摄取,抑制糖异生作用,故有致乳酸性酸中毒的作用,特别是高龄,合并心、肺、肝和肾疾病的糖尿病患者长期、大剂量服用苯乙双胍(用量>100mg/d)时,易诱发乳酸性酸中毒,但在国内因苯乙双胍导致乳酸性酸中毒的报道较少,其原因可能与用量较小有关。二甲双胍仅使血乳酸轻度升高,多<2mmol/L,二甲双胍致乳酸性酸中毒的发生率与死亡率分别为0~0.8/1000和0~0.024/10 000,仅为苯乙双胍的1/20,两者的差异可能与二甲双胍的半衰期(1.5小时)较苯乙双胍明显缩短(12小时)有关。有研究表明,与接受其他降糖药治疗的糖尿病患者相比,服用二甲双胍的患者的血乳酸水平和乳酸性酸中毒的发病率并无显著差异。Pongwecharak等在泰国南部的Hatyai观察了门诊糖尿病患者的二甲双呱使用情况,有80%以上的患者存在该药的禁忌证(如慢性肝病、心衰和慢性肾病),但并未增加乳酸性酸中毒的发生率,说明二甲双呱引起的乳酸性酸中毒并非常见。
鉴于苯乙双胍易诱发DLA,目前临床上已基本不用,而以二甲双胍代替。如用苯乙双胍,每日剂量最好不超过75mg。
糖尿病患者使用二甲双胍前,应首先评价肾功能,评价的方法是:①如果血清肌酐高于96.5μmol/L,即列为二甲双胍的禁忌证;②因为肾功能正常者使用该药亦可诱发高乳酸血症,ALT和BMI是引起高乳酸血症的独立相关因素,ALT和BMI越高,发生高乳酸血症的可能性越大,因此应同时考查ALT和BMI状况;③肾小球滤过率(GFR)60~90ml/min者可以使用二甲双胍,但应减量,并避免使用经肾排泄的其他药物。
(二) 缺氧/感染/DKA/HHS/肺心病/酗酒/一氧化碳中毒诱发DLA
糖尿病伴有感染、各种休克、脓毒败血症、DKA和高渗性非酮症高血糖性昏迷综合征等急性并发症的糖尿病患者,常因微循环障碍、组织器官灌注不良、组织缺氧、乳酸生成增加和排泄减少而诱发DLA。糖尿病患者合并大血管和微血管慢性并发症,如心肌梗死、糖尿病肾病和脑血管意外,可造成或加重组织器官血液灌注不良,出现低氧血症以及乳酸清除减少,导致乳酸性酸中毒。
此外,糖尿病合并严重肺气肿、肺心病、肺栓塞和白血病等也可引起组织缺氧,使血乳酸升高。或因酗酒、一氧化碳中毒、水杨酸、儿茶酚胺、硝普钠和乳糖过量诱发乳酸性酸中毒。二甲双胍中毒可因诱发顽固性L-乳酸性酸中毒(refractory L-lactic acidosis)而导致死亡。
糖尿病乳酸性酸中毒是糖尿病急性并发症之一。其在临床中发病率较低,易误诊,但一旦发生,病情严重,预后差,死亡率高达50%,因为这些患者多伴有肝肾功能不全、感染和休克等严重合并症,目前尚无满意的治疗方法,加强糖尿病的宣传教育,加强医生与患者间的联系,注重预防,早期发现,及时治疗。
为安全考虑,在临床中严格掌握双胍类药物的适应证和禁忌证,尽可能不用苯乙双胍。糖尿病患者若并发心、肝和肾功能不全,或在缺氧、过度饮酒和脱水时,应尽量避免使用双胍类药物。美国糖尿病协会已建议当血肌酐(Cr)>125μmol/L时,应避免使用双胍类药物。使用双胍类药物时,应定期监测肝肾功能。
(一) 去除DLA诱因并治疗原发病
目前仍缺乏统一的诊疗指南,其治疗很不规范,疗效差异大。在连续监测血乳酸,及时判断疗效的前提下,进行如下治疗。
1. 诱因和原发病治疗
一旦考虑DLA,应立即停用双胍类等可导致乳酸性酸中毒的药物、保持气道通畅和给氧。对于由肺部疾病导致缺氧者,应针对原发病因及时处理,必要时作气管切开或机械通气,以保证充分氧合;如血压偏低、有脱水或休克,应补液扩容改善组织灌注,纠正休克,利尿排酸,补充生理盐水维持足够的心排血量与组织灌注,必要时可予血管活性药及行中心静脉压监护,但尽量避免使用肾上腺素或去甲肾上腺素等强烈收缩血管药物,以防进一步减少组织的灌注量。补液量应根据患者的脱水情况和心肺功能等情况来决定;如病因不明的严重乳酸性酸中毒患者,应着重先考虑有感染性休克的可能,及早行病原体培养,并根据经验,尽早选用抗生素治疗。
西柚子汁(grapefruit juice)似乎可改善胰岛素抵抗,降低体重,但可能增加二甲双呱致乳酸性酸中毒的风险。
2. DKA和HHS治疗
当DKA或HHS患者合并高乳酸血症时,一般按DKA或HHS的治疗即可,高乳酸血症将在治疗过程中自然消退;如果DKA或HHS患者合并有严重的乳酸性酸中毒,则应该在治疗的同时更积极地处理原发病、改善循环、控制血糖和维持水电解质平衡,但补碱的原则仍与DKA相同,禁忌大量补充碱性溶液。
3. 糖尿病治疗
控制血糖采用小剂量胰岛素治疗,以0.1U/(kg·h)速度持续静脉滴注,不但可降低血糖,而且能促进三羧酸循环,减少乳酸的产生并促进乳酸的利用,如血糖正常或偏低,则应同时予葡萄糖及胰岛素,根据血糖水平调整糖及胰岛素比例。监测血钾和血钙,视情况酌情补钾和补钙,以防低血钾和低血钙。
(二) 纠正酸中毒并维持水电解质平衡
1. 纠正酸中毒
目前对乳酸性酸中毒使用碱性药物仍有争议。一般认为过度的血液碱化可使氧离曲线左移,加重组织缺氧,而且可以使细胞内液和脑脊液进一步酸化和诱发脑水肿,并无确切证据表明静脉应用碳酸氢钠可降低死亡率,故补碱不宜过多和过快。当pH<7.2和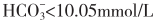 时,患者肺脏能维持有效的通气量以排出蓄积的二氧化碳,以及肾功能足以避免钠水潴留,应及时补充5%碳酸氢钠100~200ml(5~10g),用生理盐水稀释到1.25%的浓度。酸中毒严重者(血pH<7.0,
时,患者肺脏能维持有效的通气量以排出蓄积的二氧化碳,以及肾功能足以避免钠水潴留,应及时补充5%碳酸氢钠100~200ml(5~10g),用生理盐水稀释到1.25%的浓度。酸中毒严重者(血pH<7.0,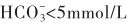 )可重复使用,直到血pH达>7.2,则停止补碱。24小时可用碳酸氢钠4.0~170g。如补碱过程中血钠升高,可予呋塞米,同时也将有助于乳酸及药物的排泄。若心功能不全或不能大量补钠,可选择使用三羟甲基氨基甲烷(THAM),应注意不可漏出血管。二氯乙酸盐(dichloroacetate,DCA)可通过增加氧摄取,激动丙酮酸脱氢酶复合物,促进乳酸氧化,降低血乳酸,缓解酸中毒症状,对多种原因引起的乳酸性酸中毒有较好的疗效,日剂量在100~1 500mg/kg之间,短期应用无不良反应。
)可重复使用,直到血pH达>7.2,则停止补碱。24小时可用碳酸氢钠4.0~170g。如补碱过程中血钠升高,可予呋塞米,同时也将有助于乳酸及药物的排泄。若心功能不全或不能大量补钠,可选择使用三羟甲基氨基甲烷(THAM),应注意不可漏出血管。二氯乙酸盐(dichloroacetate,DCA)可通过增加氧摄取,激动丙酮酸脱氢酶复合物,促进乳酸氧化,降低血乳酸,缓解酸中毒症状,对多种原因引起的乳酸性酸中毒有较好的疗效,日剂量在100~1 500mg/kg之间,短期应用无不良反应。
2. 透析疗法
多用于伴肾功能不全或严重心衰及血钠较高的危重患者,应使用不含乳酸钠的透析液,可清除药物,加快乳酸的排泄,可采用血液透析或腹膜透析。
3. 支持和对症处理
积极改善心功能、护肝、保护肾功能及加强营养和护理等综合治疗。
1. Misbin RI,Green L,Stadel BV,et al. Lactic acidosis in patients with diabetes treated with metformin. N Engl J,1998,338(4):265-266.
2. Cryer DR,Nicholas SP,Henry DH,et al. Comparative outcomes study of metformin intervention versus conventional approach the COSMIC Approach Study(Abstract). Diabetes Care,2003,28(3):539-543.
3. Salpeter SR,Greyber E,Pasternak GA,et al. Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus:systematic review and meta-analysis. Arch Intern Med,2003,163(21):2594-2602.
4. Pongwecharak J,Tengmeesri N,Malanusorn N,et al. Prescribing metformin in type 2 diabetes with a contraindication:prevalence and outcome. Pharm World Sci,2009,31(4):481-6.
5. Philbrick AM,Ernst ME,McDanel DL,et al. Metformin use in renal dysfunction:is a serum creatinine threshold appropriate?Am J Health Syst Pharm,2009,66(22):2017-23.
6. Herrington WG,Levy JB. Metformin:effective and safe in renal disease?Int Urol Nephrol,2008,40(2):411-7.
7. Liu F,Lu JX,Tang JL,et al. Relationship of plasma creatinine and lactic acid in type 2 diabetic patients without renal dysfunction. Chin Med J(Engl),2009,122(21):2547-53.
8. Arroyo AM,Walroth TA,Mowry JB,et al. The MALAdy of metformin poisoning:Is CVVH the cure?Am J Ther,2010,17(1):96-100.
9. English P,Williams G. Hyperglycaemic crises and lactic acidosis in diabetes mellitus. Postgrad Med J,2004,80(943):253-261.
10. Chawla LS,Shih S,Davison D,et al. Anion gap,anion gap corrected for albumin,base deficit and unmeasured anions in critically ill patients:implications on the assessment of metabolic acidosis and the diagnosis of hyperlactatemia. BMC Emerg Med,2008,8:18.
11. Htyte N,White L,Sandhu G,et al. An extreme and life-threatening case of recurrent D-lactate encephalopathy. Nephrol Dial Transplant,2011,26(4):1432-5.
12. Kraut JA,Kurtz I. Use of base in the treatment of severe acidemic states. Am J Kidney Dis,2001,38(4):703-727.
13. Toth PP,el-Shanti H,Eivins S,et al. Transient improvement of congenital lactic acidosis in a male infant with pyruvate decarboxylase deficiency treated with dichloroacetate.J Pediatr,1993,123(3):427-430.













