60岁以上的老年人,甲状腺重量减少40%~60%,滤泡间结缔组织增加,伴纤维化并有炎性细胞浸润及结节形成,甲状腺滤泡缩小,滤泡内胶质染色异常。老年人患甲亢症并不少见,老年患者约占全部甲亢患者的10%~25%。在住院的甲亢患者(533例)中,60岁以上者占64.7%。女性多于男性(3.5∶1)。老年甲亢的临床表现各异,常不典型或很轻微,易与增龄性改变或其他疾病相混淆。
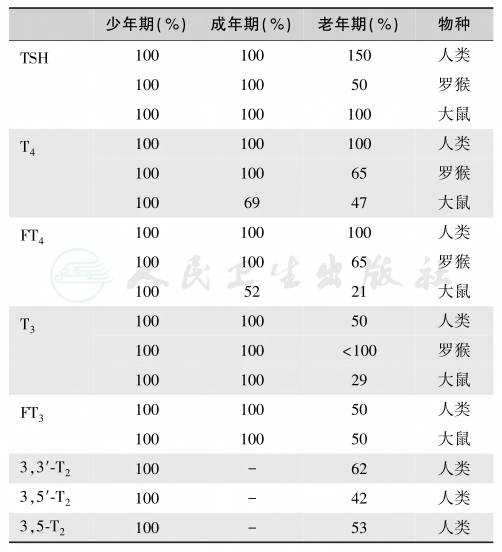
老年动物的甲状腺功能减退,但一些组织能保存T3,故可维持正常代谢水平,组织保存甲状腺激素是调节能量代谢水平的一种方式(表1)。除基因组途径外,T3也通过非基因组-细胞质信号发挥作用,其与经典途径的区别在于,甲状腺激素代谢产物也有调节活性。例如,3,5-二碘-L-甲腺原氨酸(T2)增加氧化还原敏感蛋白去乙酰化酶SIRT1防止老化,而T3可能有致老化效应。
表1 老年人血清甲状腺激素和TSH变化
大约3/4的老年患者下丘脑-垂体-甲状腺轴的活动减弱,相应激素分泌随之减少,基础代谢率和耗氧量下降以适应性代谢变化,以非甲状腺性病态综合征(euthyroid sick syndrome,ESS)最常见,其次为甲亢、甲减及自身免疫性甲状腺病。FT3是评估患者预后的较好指标[1,2]。老年人甲状腺功能异常具有多方面的特殊性,见表2。
表2 老年人甲状腺功能异常的特殊性

随着病程延长,非毒性甲状腺肿和病灶反复恶化和缓解,至后期呈非毒性结节性甲状腺肿(NNG),发病率接近50%。老年人多结节性甲状腺肿具有解剖结构和功能上的不均一性,且倾向于发生功能自主性。一般认为,长期TSH刺激或高度刺激与复原的反复循环,造成多结节性甲状腺肿和某些增生区域的功能自主性。局部出血、坏死、纤维化及钙化更加重结构和功能上的不均一性。如果血清TSH降低,则用超声或核素扫描进一步明确结节的性质与功能[3-5];可疑恶性病变时行甲状腺结节穿刺活检。
在老年人群中,引起甲亢的Graves病所占比例下降,而多结节性甲状腺肿伴甲亢(Plummer病)和自主性高功能甲状腺结节所占比例上升,常因含碘药物及多食含碘食物(如长期服用胺碘酮、长期大量进食海产品甚至用非离子型造影剂)而诱发。
(一)临床表现
老年人甲亢常缺乏高代谢症群、甲状腺肿大和突眼等一般表现,而以厌食呕吐、少动淡漠、背痛或某一系统症状为突出表现。老年人甲亢常因厌食而体重减轻,可呈恶病质,甚至长期漏诊或误诊。腹泻亦不多见,反而易出现便秘或便秘与腹泻交替现象。老年甲亢有时以心血管系统症状为突出表现,在初发老年甲亢中,80%的患者伴有冠状动脉供血不足,20%有心绞痛,40%伴房颤,60%主诉心悸,66%存在充血性心力衰竭。甲亢控制后,心房颤动和心力衰竭得以控制。老年甲亢出现房室传导阻滞时常提示有缺血性心脏病可能,应警惕心血管事件的突然发生。淡漠型甲亢(隐匿型甲亢)多见于老年人,此型甲亢的特征为疲乏、嗜睡、衰弱、淡漠、抑郁、消瘦、对刺激缺乏反应,心率往往不快,易被误认为精神失常或恶性肿瘤。这些患者和其他甲亢患者血液循环中甲状腺激素水平无差异,可能与靶器官对甲状腺激素的敏感性不同有关。有些患者血清T3和T4增高不明显,但甲状腺131I吸碘率或其他核素显像显示甲状腺激素合成功能明显增高。还有一部分患者表现为亚临床甲亢,即仅有TSH降低,而无T3和T4升高,部分可进展为临床型甲亢,常伴有骨质疏松症。
老年甲亢患者可出现多种肌病,主要表现为肌肉软弱无力。过多的甲状腺激素抑制磷酸肌酸激酶活性,减少骨骼肌内肌酸和磷酸含量。甲状腺激素作用于肌细胞内线粒体,使其发生肿胀和变性,出现肌细胞能量代谢紊乱,并导致肌麻痹、肌痛和肌无力。病变涉及的部位以手部大小鱼际、肩胛肌、骨盆肌和臀肌较为明显,甚者可影响全身肌肉;严重时可有肌群自发性疼痛、压痛和肌萎缩,抬肩、爬楼、蹲位起立甚至梳头困难。甲亢所致的骨质疏松属继发性骨质疏松症。老年女性较老年男性更多见,因绝经后女性头10年内,骨量每年约以2%的幅度下降,在过量甲状腺激素的作用下,骨矿物质丢失明显加速,更易导致骨质疏松甚至病理性骨折。此外,由于甲状腺随增龄而萎缩,甲状腺肿大及血管杂音较少见,但甲状腺结节较中青年人多见。
老年甲亢患者食欲减退较多,约占半数以上,消瘦更为突出,呈恶病质。眼病和高代谢症群表现较少。
(二)老年甲亢并发症
1.心房颤动发病率20%~35%[6],其中以毒性结节发病率最高。但因窦房结变性和心脏传导系统纤维化,患者常无心悸气促等表现[7]。
2.心血管病脉压增大,运动不耐受和心肌肥厚为心血管病的早期表现[8],晚期则出现心肌缺血、梗死和猝死。
3.骨质疏松症患者的骨密度降低,多数患者的骨转换率正常,骨折风险升高[8-12]。
4.眼病的严重程度与年龄呈正相关[13]。
(三)诊断
多结节性甲状腺肿的临床表现与诊断见第2篇第4章第6节。多结节甲状腺肿的病因鉴别较困难,可疑恶性结节需要采用超声加闪烁扫描进行鉴别,必要时做细针穿刺检查。超声检查主要用于筛选可疑的恶性结节或作为细针穿刺的引导,实性结节、低回声结节、微钙化结节、结节内血管影像和边界不清的结节是恶性结节的常见特征。甲亢的诊断有赖于甲状腺功能检查及详细病史和仔细临床观察,多数患者血清 TT3、FT3、TT4和 FT4升高,TSH降低。而T3型甲亢则TT3和FT3升高,TSH降低,多见于老年甲亢早期或复发期。碘诱发的甲亢患者常以TT4和FT4升高为主。TSH测定对仅有TT3或FT4轻度升高甚至正常高限的老年甲亢诊断有重要意义,诊断有疑问时可作TRH兴奋试验,甲亢时TSH不被TRH兴奋。结节性甲状腺肿需做甲状腺B超和甲状腺核素显像,必要时可作甲状腺CT检查或核素扫描检查。
(四)治疗
首选抗甲状腺药物治疗,但剂量酌情减小。慎用甲状腺片,由于老年人甲亢多合并缺血性心脏病,使用甲状腺片或左旋甲状腺素(L-T4)时需严密观察。放射性碘治疗安全有效、经济方便和不良反应少,亦可作为老年甲亢的首选疗法之一,对并发心血管疾病及出血性疾病不宜手术的老年甲亢患者更为适用,但必须先用抗甲状腺药物控制甲亢症病情。放射性碘治疗的近期不良反应为放射性甲状腺炎,远期不良反应有甲状腺功能减退。除结节性甲状腺肿大明显和功能自主性甲状腺瘤外,原则上不采用手术治疗。亚临床型甲亢是否需要治疗,临床有不同的意见,若仅是生化异常,依据是否有并发症选择是否治疗。β-受体阻滞剂可降低收缩压和心率,改善震颤与兴奋症状;抗凝药物可防止血栓形成。
(一)流行病学特点
老年甲减相当常见,随着增龄,其发病率越来越高[14-20],见表3。
表3 老年人甲减的流行病学调查
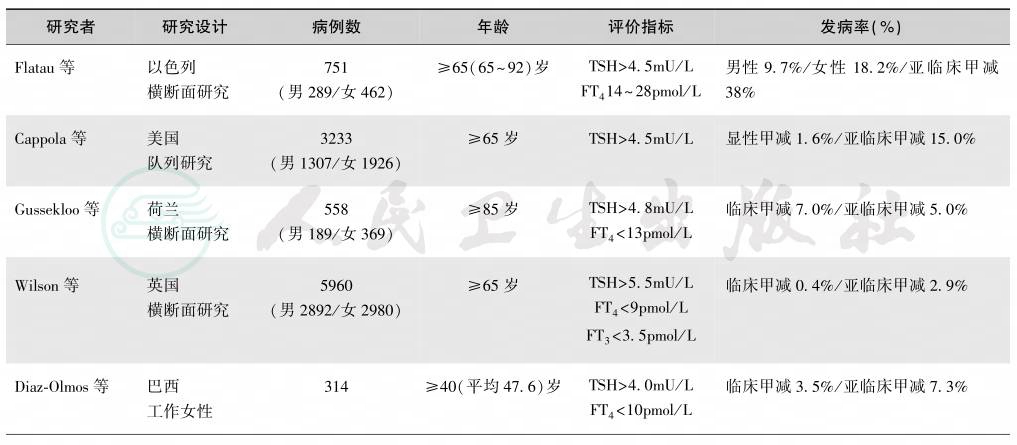
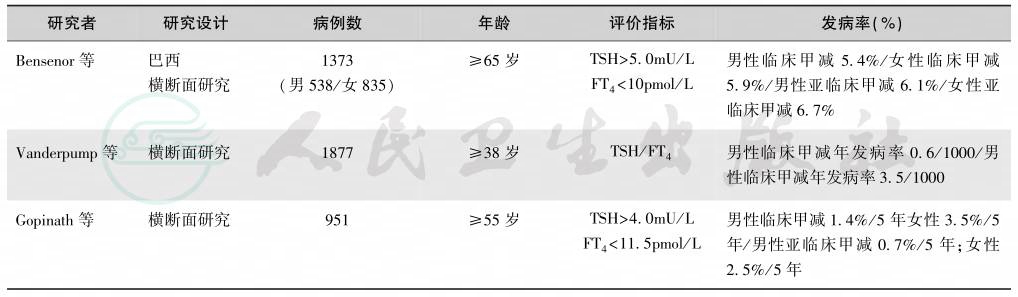
续表
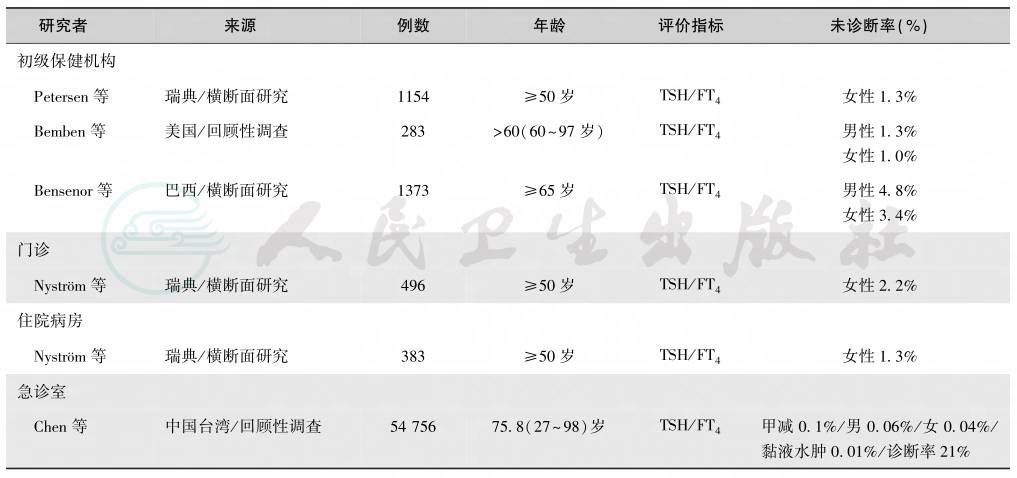
由于症状缺乏或症状无特异性(如虚弱、注意力不集中、皮肤干燥、便秘、抑郁等),大量的亚临床甲减漏诊(表4)[21]。诊断的主要依据是测定血清TSH和FT4,50岁以上者应在常规健康体检时测定这些指标[22-27]。
表4 未诊断的老年临床型甲减
有学者报道了2139例60岁以上老年人,发现10%~30%有血清TSH升高,其中2.5%为临床型甲减,其余为亚临床型甲减,女性约为男性的2倍,亚临床型为临床型的3倍多。
(二)病因与临床表现
1.随着年龄增长,甲状腺自身抗体增加,因此老年人甲状腺自身抗体阳性率高于中青年。老年人原发性甲状腺功能减退症TSH升高与甲状腺抗过氧化物酶抗体(TPOAb)相关,这提示老年人甲减可能系甲状腺自身免疫疾病所致,可伴有甲状腺肿(桥本甲状腺炎),也可无甲状腺肿(甲状腺退行性病变)。老年人因心血管疾病服用含碘药物(胺碘酮)诱发甲状腺功能减退症者较多。抗甲状腺药物、放射碘及手术治疗、恶性肿瘤颈部放疗亦可引起甲状腺功能减退症。
2.临床表现 亚临床型甲减为临床型甲减的早期表现,多见于老年女性。患者无明显临床症状,多在体检时发现后仔细询问病史发现临床亦有异常,如疲乏、皮肤毛发干燥、便秘、抑郁和注意力不集中等。老年亚临床甲减具有如下潜在危险:50%的亚临床型甲状腺功能减退症患者心肌收缩异常,常有血脂异常,如低密度脂蛋白胆固醇(LDL-C)和载脂蛋白B(apoB)升高,高密度脂蛋白胆固醇(HDL-C)和载脂蛋白A(apoA1)降低。亚临床型甲状腺功能减退症是否会转变成临床型甲减,与血TSH浓度及甲状腺自身抗体滴度有关,高滴度甲状腺自身抗体的亚临床型甲减转变为临床型甲减的可能性大。部分未经处理的亚临床型甲减可因感染、外伤、寒冷或服用镇静剂或服用含碘药物使症状明显,进展为临床型甲减,甚至出现黏液水肿性昏迷。老年人临床型甲减常无典型症状和体征,症状无特异性。有些患者表现为听力下降、贫血、脱发、记忆力下降、讲话声调变化和反应较迟钝等,易导致漏诊。多数患者伴有动脉硬化或冠心病,但因患者基础代谢率降低,心脏负荷相对较低,故较少出现心绞痛或心力衰竭,但在感染或使用甲状腺激素替代时易诱发。严重黏液性水肿昏迷好发于老年人,其主要表现为精神异常、理解定向力障碍、嗜睡、意识模糊、精神病甚至昏迷和低体温,合并严重感染时体温不高(表5)。
如果老年人存在声音嘶哑、皮肤干燥、毛发干枯、不耐冷、疲倦、肌无力、便秘、抑郁等不适,虽然这些表现无特异性,但当多种症状并存时应想到甲减可能(表6)。
表5 老年甲减合并危重症的临床表现

表6 老年症状性甲减与甲减治疗研究
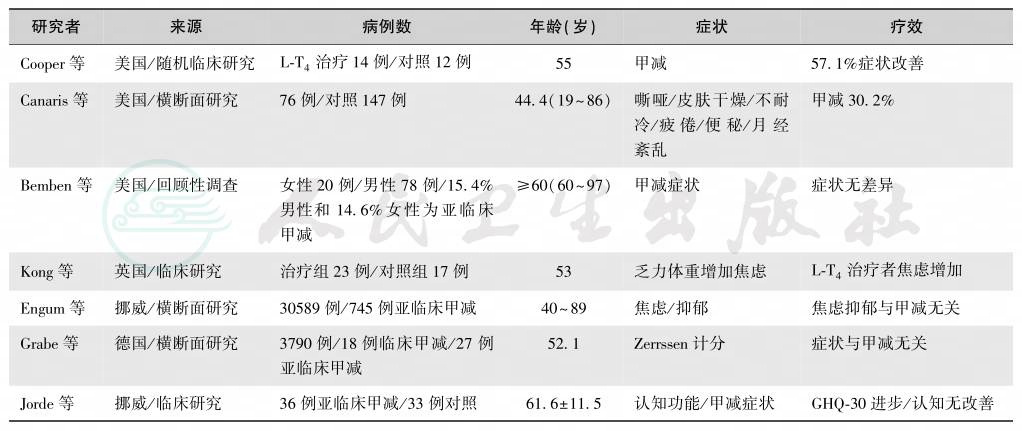
Canaris等应用14种症状的阳性可能率(positive likelihood ratio,LR)拟诊和筛选甲减[28]。
(三)诊断
由于健康老年人随增龄TSH可下降,当TSH值处于正常上限时,即应考虑甲状腺功能减退症可能。确诊原发性甲减最敏感的指标是测定血浆中TSH水平,因为在症状出现和T4下降前即有TSH升高。血TT4和FT4的诊断价值较TT3和FT3大。甲减时先有T4降低,随病情加重T3亦降低。因在高TSH作用下,甲状腺合成生物活性较强的T3增加,或T4在周围组织转变为T3增加所致。诊断甲减的敏感性依次是TSH>FT4>TT4>FT3>TT3。抗甲状腺自身抗体检查有助于甲减的病因诊断。T3随增龄降低,而T4不受年龄影响。当应用β受体阻滞剂等原因使T4在外周组织转变为T3受阻,致使T3降低,但TSH和T4是正常的,rT3增加,称为低T3综合征,在老年人当中此种情况常见,不能误诊为甲减。
(四)治疗
1.临床甲减的治疗临床甲减的治疗目的是防止病情进展至黏液性水肿,TSH降低和FT4升高者的死亡率升高,但高TSH或低FT4的临床意义未明;因此老年人的亚临床甲减治疗存在争论。
甲状腺激素宜小剂量开始,缓慢增加剂量,维持量少于年轻患者,并发冠心病者剂量更小,并注意心绞痛及心力衰竭的发生。通常亚临床型甲减伴下列情况时需要治疗:①有疲乏、便秘、注意力不集中和抑郁等症状;②无症状而LDL-C升高和HDL-C下降;③TSH>10mU/L伴甲状腺自身抗体阳性;④甲状腺次全切除术后或放射性碘治疗后。一般选用左旋甲状腺素(L-T4)口服,因其在肠道吸收快,生物效价稳定,代谢缓慢,其半衰期为8天,在体内一部分转变为T3,每日服一次即可。剂量从12.5~25.0μg开始,4~6周增加1次剂量,使TSH维持在正常范围内。也可用甲状腺片,但生物效价不稳定,使用后血清T3波动较大。剂量(与L-T4等剂量为3mg甲状腺片≈5μg左旋甲状腺素)以10~20mg/d开始,每4~6周增加1次。如患者合并冠心病,补充甲状腺激素的剂量宜为常规量的1/2~1/3,从更小剂量开始,L-T412.5μg/d,每4周增加1次剂量12.5μg/d,当出现心绞痛或心电图上心肌缺血加重需停药2~3天,然后减至原剂量,避免诱发心绞痛、心肌梗死或心力衰竭等。如无禁忌证,可加用β受体阻滞剂以提高对甲状腺激素的耐受量。
黏液性水肿昏迷时,L-T3首剂40~120μg静脉注射,以后每6小时5~15μg。由于L-T3对心脏不良反应较大,易致心律失常和心力衰竭,必须严密监测心功能。如用L-T4,首剂静脉注射100~200μg,以后每日注射L-T450μg。亦可联合应用L-T3和L-T4,前者20μg/d和后者50μg/d静注。至患者清醒改为口服。无注射剂也可将片剂研粉加水鼻饲,L-T3每次20~30μg,每4~6小时1次;甲状腺片每次40~60mg,每6~8小时1次。合并冠心病者首剂为一般用量的1/5~1/4。一般应同时加用糖皮质激素,如氢化可的松100~200mg/d。补液不宜过多,以免引起心衰。并同时加强补充维生素、保暖和给氧等对症支持治疗。常伴有冠心病或其他心脏病病史以及精神症状,甲状腺激素更应从小剂量开始,并应缓慢递增,使TSH维持在正常高值或稍高于正常范围。如导致心绞痛发作、心律不齐或精神症状,应及时减量。因而应在开始甲状腺激素替代治疗前,评价甲状腺激素的利弊。建议应用成人剂量的1/3~1/2;如不够,可逐步加至理想剂量。对于已有频繁发作心绞痛的患者来说,甲状腺激素替代治疗要格外小心。
2.亚临床甲减的治疗L-T4的半衰期为6天,常规剂量为1.6μg/kg,如果存在心血管病风险,应进一步降低剂量。研究发现,亚临床甲减的治疗效果不一(表7),多数研究未发现治疗获益,少数发现能改善血脂谱,降低心血管病风险[29-32]。老年人的亚临床甲减的诊断切割值和治疗益处需要进一步大规模临床研究确定。可能是由于组织对TS的敏感性、代谢转换率或清除率改变,血清 TSH、FT4和FT3水平随着增龄而变化[4-13],老年人 TSH、TPOA和TgAb升高[16],所以目前并未确定老年人的TSH正常上限值。研究发现,TSH>10mU/L者的心血管发病风险增加,而<10mU/L的亚临床甲减可能有利于长寿,不需要进行医学干预。
表7 亚临床甲减治疗研究
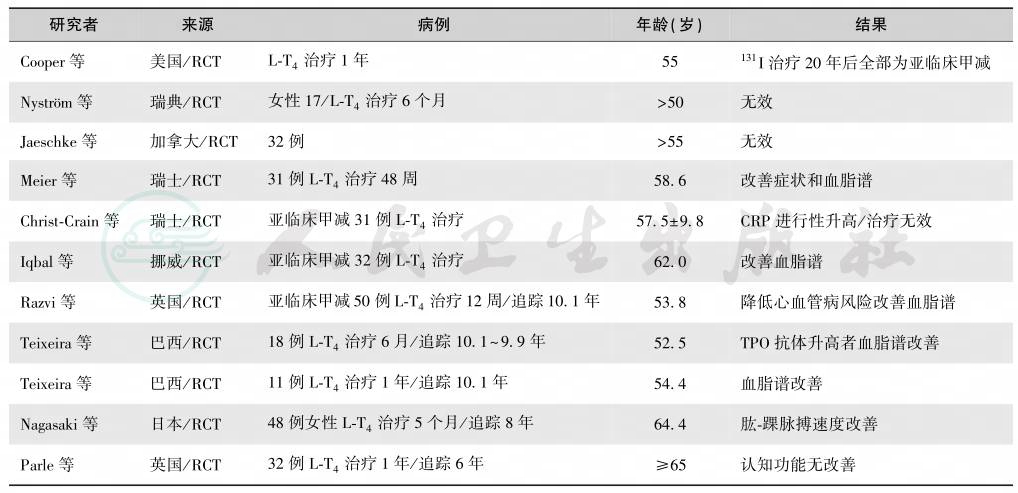
注:RCT:randomized placebo-controlled,double-blind clinical trial,随机双盲对照临床研究
非甲状腺病态综合征主要见于老年人伴有营养不良、急慢性感染、肝硬化、糖尿病、尿毒症、神经性厌食、外科手术后、重症创伤、麻醉和中毒等情况。
L-T4治疗能否防治患者由亚临床甲减进展为临床甲减仍无定论(表8和表9),一般认为,如果TSH>10U/L,并存在TPO抗体阳性,应给予治疗,维持TSH在0.1~4.0mU/L水平[33,34] 。
表8 老年人甲状腺功能调查
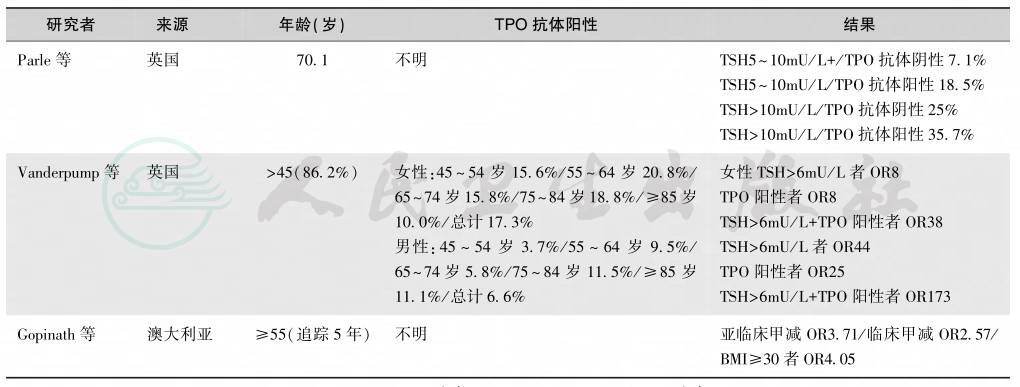
注:TSH:thyrotropin or thyroid stimulating hormone,促甲状腺素;FT4:free-thyroxine,游离甲状腺素;OR:odds ratio,风险比;BMI:body mass index,体质指数
表9 亚临床甲减的心血管并发症
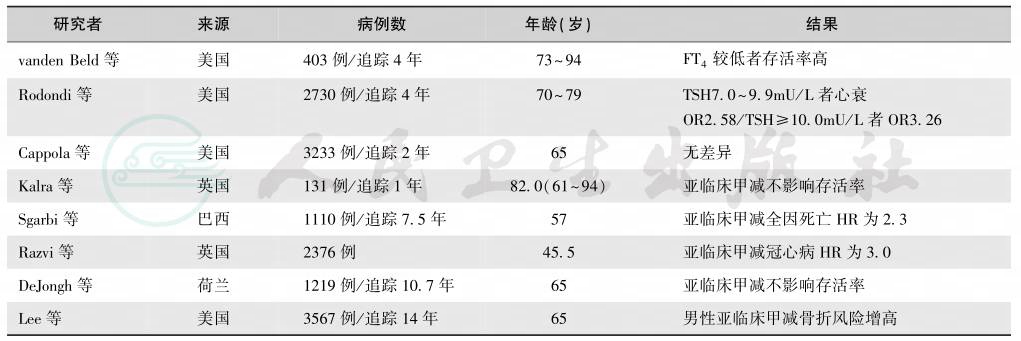
注:HR:hazard ratio,风险比
50~70岁者的甲状腺癌发病率约0.1%[35],以后随着增龄而升高[36,37]。一般以分化良好的甲状腺乳头状癌常见,其次为散发性髓样癌和间变性甲状腺癌[38,39] 。
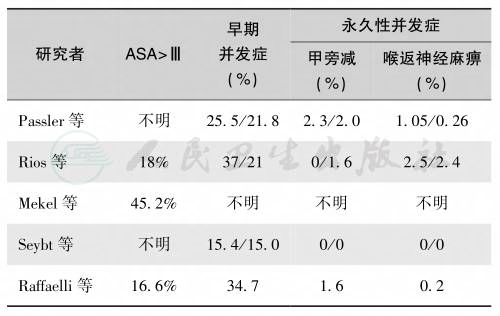
甲状腺癌的特殊性在于分期时必须考虑年龄因素[40-42]。因为45岁以上者的预后明显下降[43-45]。对于直径<1cm的甲状腺癌应做甲状腺全切手术,清除颈部所有淋巴结,其疗效可靠,永久性并发症低(表10和表11)。术后加用放疗(7.4GBq,200mCi)以上[46]。术后测定血清基础甲状腺球蛋白含量,1年后测定。TSH刺激后的甲状腺球蛋白含量。如果甲状腺球蛋白含量>2ng/ml,应立即行核素扫描确定肿瘤复发与转移病灶。抑制性L-T4替代治疗使TSH维持在0.1mU/L或更低水平。
表10 老年患者甲状腺癌手术治疗研究
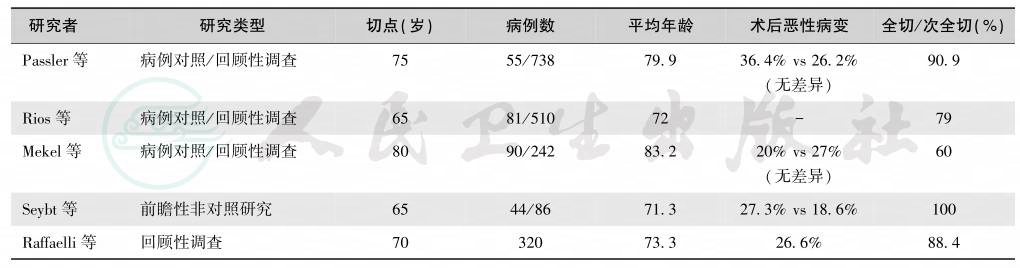
表11 老年患者甲状腺切除并发症
1.Daimon CM,Chirdon P,Maudsley S,et al.The role of Thyrotropin Releasing Hormone in aging and neurodegenerative diseases[J].Am J Alzheimers Dis (Columbia), 2013, 1 (1).doi: 10.7726/ajad.2013.1003.
2.Aggarwal N,Razvi S.Thyroid and aging or the aging thyroid? An evidence-based analysis of the literature[J].J Thyroid Res,2013,2013:481287.
3.Cooper DS,Doherty GM,Haugen BR,et al.Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer[J].Thyroid,2009,19(11):1167-214.
4.Tabatabaie V,Surks MI.The aging thyroid[J].Curr Opin Endocrinol Diabetes Obes,2013,20(5):455-459.
5.Visser WE,Visser TJ,Peeters RP.Thyroid disorders in older adults[J].Endocrinol Metab Clin North Am,2013,42(2):287-303.
6.Cooper DS.Approach to the patient with subclinical hyperthyroidism[J].J Clin Endocrinol Metab,2007,92(1):3-9.
7.Boelaert K,Torlinska B,Holder RL,et al.Older subjects with hyperthyroidism present with a paucity of symptoms and signs:a large cross-sectional study[J].J Clin Endocrinol Metab,2010,95(6):2715-2726.
8.Dorr M,Wolff B,Robinson DM,et al.The association of thyroid function with cardiac mass and left ventricular hypertrophy[J].J Clin Endocrinol Metab,2005,90(2):673-677.
9.Cummings SR,Nevitt MC,Browner WS,et al.Study of osteoporotic fractures research group.Risk factors for hip fracture in white women[J].N Engl J Med,1995,332(12):767-773.
10.Bassett JH,Williams GR.The molecular actions of thyroid hormone in bone[J].Trends Endocrinol Metab,2003,14(8):356-364.
11.Bauer DC,Ettinger B,Nevitt MC,et al.Study of osteoporotic fractures research group.Risk for fracture in women with low serum levels of thyroid-stimulating hormone[J].Ann Intern Med,2001,134(7):561-568.
12.Schuit SC,van der Klift M,Weel AE,et al.Fracture incidence and association with bone mineral density in elderly men and women:the Rotterdam Study[J].Bone,2004,34(1):195-202.
13.Lin MC,Hsu FM,Bee YS,et al.Age influences the severity of Graves'ophthalmopathy[J].Kaohsiung J Med Sci,2008,24(6):283-288.
14.Sabbadin C,Donà G,Bordin L,et al.Transient hypercortisolism and symptomatic hyperthyroidism associated to primary hyperparathyroidism in an elderly patient:case report and literature review[J].BMC Endocr Disord,2015,15:4.
15.Sawin CT,Castelli WP,Hershman JM,et al.The aging thyroid.Thyroid deficiency in the Framingham Study[J].Arch Intern Med,1985,145(8):1386-1388.
16.Magri F,Muzzoni L,Cravello M,et al.Thyroid function in physiological aging and in Centenarians:possible relationships with some nutritional markers[J].Metabolism,2002,51(1):105-109.
17.Mariotti S,Franceschi C,Cossarizza A,et al.The aging thyroid[J].Endocr Rev,1995,16(6):686-715.
18.Mitrou P,Raptis SA,Dimitriadis G.Thyroid disease in older people[J].Maturitas,2011,70(1):5-9.
19.Danforth E Jr,Burger AG.The impact of nutrition on thyroid hormone physiology and action[J].Annu Rev Nutr,1989,9:201-227.
20.American College of Physicians.Clinical guideline,part 1.Screening for thyroid diseases[J].Ann Intern Med,1998,129(2):141-143.
21.Patel KV.Epidemiology of anemia in older adults,Semin Hematol,2008,45(4):210-217.
22.Guralnik JM,Eisenstaedt RS,Ferrucci L,et al.Prevalence of anemia in persons 65 years and older in the United States:evidence for a high rate of unexplained anemia[J].Blood,2004,104(8):2263-2268.
23.Compton WM,Conway KP,Stinson FS,et al.Changes in the prevalence of major depression and comorbid substance use disorders in the United States between 1991-1992 and 2001-2002[J].Am J Psychiatry,2006,163(12):2141-2147
24.Gebretsadik M,Jayaprabhu S,Grossberg GT.Mood disorders in the elderly[J].Curr Psychiatry Rep,2006,8(1):34-40.
25.Bensenor I.Screening for thyroid disorders in asymptomatic adults from Brazilian populations[J].Sao Paulo Med J,2002,120(5):146-151.
26.Gharib H,Tuttle RM,Baskin HJ,et al.Consensus Statement#1:Subclinical thyroid dysfunction:a joint statement on management from the American Association of Clinical Endocrinologists,the American Thyroid Association,and The Endocrine Society[J].Thyroid,2005,15(1):24-28.
27.American Association of Clinical Endocrinologists.American Endocrinologists medical guidelines for clinical practice for the evaluation and treatment of hyperthyroidism and hypothyroidism[J].Endocr Pract,2002,8(6):457-469.
28.Canaris GJ,Steiner JF,Ridgway EC.Do traditional symptoms of hypothyroidism correlate with biochemical disease?[J].J Gen Intern Med,1997,12(9):544-550.
29.Razvi S,Ingoe L,Keeka G,et al.The beneficial effect of L-thyroxine on cardiovascular risk factors,endothelial function,and quality of life in subclinical hypothyroidism:randomized,crossover trial[J].J Clin Endocrinol Metab,2007,92(5):1715-1721.
30.Teixeira PF,Reuters VS,Ferreira MM,et al.Treatment of subclinical hypothyroidism reduces atherogenic lipid levels in a placebo-controlled double-blind clinical trial[J].Horm Metab Res, 2008, 40(1):50-55.
31.de Teixeira PF,Reuters VS,Ferreira MM,et al.Lipid profile in different degrees of hypothyroidism and effects of levothyroxine replacement in mild thyroid failure[J].Transl Res,2008,151(4):224-231.
32.Papaleontiou M,Haymart MR.Approach to and treatment of thyroid disorders in the elderly[J].Med Clin North Am,2012,96(2):297-310.
33.McDermott MT,Haugen BR,Lezotte DC,et al.Management practices among primary care physicians and thyroid specialists in the care of hypothyroid patients[J].Thyroid,2001,11(8):757-764.
34.Koch L.Pharmacotherapy:Levothyroxine in the elderly-finding the breaking point[J].Nat Rev Endocrinol,2011,7(8):435.
35.Castro MR,Gharib H.Continuing controversies in the management of thyroid nodules[J].Ann Intern Med,2005,142(11):926-931.
36.Hundahl SA,Fleming ID,Fremgen AM,et al.A National Cancer Data Base report on 53,856 cases of thyroid carcioma treated in the U.S.,1985-1995[J].Cancer,1998,83(12):2638-2648.
37.Aschebrook-Kilfoy B,Ward MH,Sabra MM,et al.Thyroid cancer incidence patterns in the United States by histologic type,1992-2006[J].Thyroid,2011,21(2):125-134.
38.Hughes DT,Haymart MR,Miller BS,et al.The most commonly occurring papillary thyroid cancer in the United States in now a microcarcinoma in a patient older than 45 years[J].Thyroid,2011,21(3):231-236.
39.Roche B,Larroumets G,Dejax C,et al.Epidemiology,clinical presentation,treatment and prognosis of a regional series of 26 anaplastic thyroid carcinomas(ATC).Comparison with the literature[J].Ann Endocrinol(Paris),2010,71(1):38-45.
40.Haymart MR.Understanding the relationship between age and thyroid cancer[J].Oncologist,2009,14:216-221.
41.Greene FL,Page DL,Fleming ID,et al.American Joint Committee on Cancer:Cancer Staging Manual.6.New York:Springer-Verlag;2002.Thyroid;pp.77-87.
42.Dean DS,Hay ID.Prognostic indicators in differentiated thyroid carcinoma[J].Cancer Control,2000,7:229-239.
43.Mazzaferri EL,Kloos RT.Current approaches to primary therapy for papillary and follicular thyroid cancer[J].J Clin Endocrinol Metab,2001,86:1447-1463.
44.Halnan KE.Influence of age and sex on incidence and prognosis of thyroid cancer.Three hundred forty-four cases followed for ten years[J].Cancer,1966,19(11):1534-1536.
45.Sautter-Bihl ML,Raub J,Hetzel-Sesterheim M,et al.Differentated thyroid cancer:prognostic factors and influence of treatment on the outcome in 441 patients[J].Strahlenther Onkol,2001,177(3):125-131.
46.Tuttle RM,Leboeul R,Robbins RJ,et al.Empiric radioactive iodine dosing regimens frequently exceed maximum tolerated activity levels in elderly patients with thyroid cancer[J].J Nucl Med,2006,47:1587-1591.













