英文名称 :insulinoma and persistent hyperinsulinemic hypoglycemia of infancy
胰岛素瘤(insulinoma)和婴幼儿持续高胰岛素性低血糖症(persistent hyperinsulinemic hypoglycemia of infancy,PHHI)都是因内源性高胰岛素血症引起低血糖症,只是前者的病因为胰岛素分泌瘤,多见于中青年;后者的病因是胰岛β细胞,多见于婴幼儿,偶见于成人。
胰岛素瘤原名胰岛β细胞瘤,是内源性高胰岛素血症引起低血糖最常见的原因之一。胰岛素瘤为胰岛细胞瘤中最多见的一种,占全部胰岛内分泌肿瘤中的70%~75%,被研究得较详尽。胰岛素瘤罕见,患病率8/10万~9/10万。各个年龄段都可发生,多见于青、中年,好发年龄30~60岁,15岁以下儿童少见。女性稍多于男性,约占60%。少数(约10%)可为家族性多发性内分泌肿瘤综合征的表现之一。成人胰岛素瘤以单个胰岛素瘤常见,多发性腺瘤或微腺瘤少见。大多数儿童和个别成年人无弥散的肿瘤,仅是细胞增生(胰岛β细胞增殖症)。胰岛素瘤90%以上为良性,恶性胰岛素瘤多是在转移后才被诊断,恶性胰岛素瘤能够分泌绒毛膜促性腺激素、促肾上腺皮质激素、5-羟色胺、促胃酸素和胰高血糖素等。在胰岛素瘤的发展过程中每段时期可能分泌不同的激素,如一段时期以胰岛素分泌占优势,另一段时期又可能以另一种激素分泌占优势。50%以上的胰岛素瘤细胞中及外周血浆中可同时测到增高的胃泌素、胰高血糖素或胰多肽等。有人认为,良性肿瘤的发病率在男女间无差别,恶性肿瘤则以男性为多。
胰岛素瘤的发病机制未明。可能与遗传缺陷及一些获得性因素有关。一般认为,成年人的胰岛β细胞缺乏再生能力,但在动物模型中,成年动物的胰岛β细胞仍有较强的再生能力,可能与再生基因(regenerating gene,Reg)的表达有关。Reg基因编码一种含166个氨基酸残基的蛋白质。这种蛋白质由胰腺腺泡细胞合成和分泌,但也可在β细胞表达。Reg基因的过度表达可引起β细胞增生,但是否为PHHI或胰岛素瘤的病因之一,尚无定论。
镜下,胰岛素瘤细胞和正常的胰岛细胞颇为相似,排列成团状或腺泡状。恶性胰岛素瘤和良性腺瘤较难鉴别。
(一)胰岛素瘤局限于胰腺组织
99%以上的胰岛素瘤发生于胰腺,且多位于胰腺尾部和体部,因该处胰岛细胞较头部多。全国24个省市70个单位的501例累积资料调查结果表明,绝大部分胰岛素瘤为单发灶,胰头、体、尾分布大致相等,大小不一,平均直径1~2cm,但也可大至15cm(表1)。绝大多数为单个腺瘤,10%为多发性腺瘤,4%~10%为腺癌,胰腺以外区域,包括十二指肠壁、肝门和胰腺附近等也发现有“异位胰岛素瘤”,但十分罕见。
(二)特殊染色鉴定肿瘤的性质和类别
正常β细胞能被特异性染色(如醛-品红,醛-硫堇染色),约3/4的胰岛素瘤呈阳性反应。含有可染性分泌颗粒的肿瘤细胞数以及每个细胞中的颗粒数,在不同病例有很大差异,有时仅在极少的细胞内显示稀少的胰岛素颗粒或无分泌颗粒。这提示肿瘤细胞储存的胰岛素少于正常β细胞,肿瘤组织内胰岛素浓度也低于正常胰岛组织。
表1 胰岛素瘤病理特点
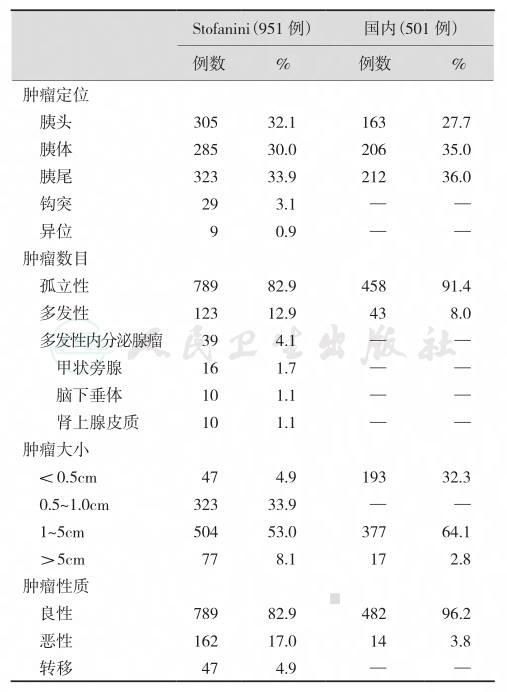
使用荧光素或过氧化物酶标记的胰岛素抗体进行免疫组织学检查,表明某些醛-硫堇染色阴性肿瘤对过氧化物酶标记抗体却起阳性反应(表2);胰岛素浓度低于1.0U/g的肿瘤,免疫组织学检查常为阴性。应用嗜银染色(Hell-Estrom-Hellman法或Grimelius法),正常胰岛β细胞阴性,而约40%的胰岛素瘤Grimelius嗜银染色阳性。嗜银染色的强度和嗜银染细胞数常与瘤内胰岛素浓度呈负相关。Ⅰ型胰岛素瘤对嗜银染色常阳性,而Ⅲ和Ⅳ型往往呈阴性反应。
表2 各种类型胰岛素瘤的组织内胰岛素浓度和染色结果
注:IRI:免疫反应性胰岛素;+:阳性;-:阴性
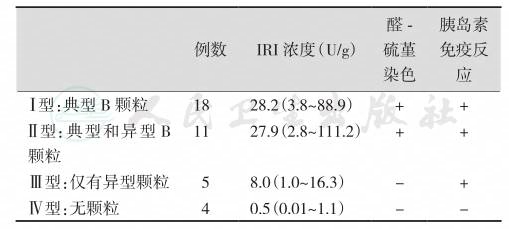
(三)胰岛素瘤分为四种类型
电镜下,可见胰岛素瘤细胞颗粒有典型B颗粒和异型颗粒两种。根据细胞内所含颗粒的特征,可分为4种病理类型:① Ⅰ型:细胞内含典型的B颗粒;②Ⅱ型:细胞内同时含有典型B颗粒和异型颗粒;③Ⅲ型:细胞内仅含异型分泌颗粒;④Ⅳ型:肿瘤细胞不含颗粒。Ⅰ型和Ⅱ型最常见,所含免疫反应性胰岛素(IRI)浓度最高,Ⅳ型含胰岛素最少,Ⅲ型也较低。肿瘤内无颗粒性细胞数越多,IRI浓度越低。异型颗粒为一种小的球状颗粒,电子密度高,大小不一,常比胰岛α、β、δ细胞内的分泌颗粒小,已知正常胰岛内Ⅳ(D1)细胞含有这种颗粒,其功能不明,但肯定不含胰岛素。在某些肿瘤内还可见到异常的多形性分泌颗粒,状如小棒或逗点,而正常胰岛不含这种颗粒。
胰岛素瘤细胞内所含胰岛素较正常胰岛β细胞内少,正常胰岛β细胞内IRI浓度为49~485U/g。另一方面,胰岛素瘤内胰岛素原在全部免疫反应胰岛素含量中所含比例较正常人为高。由于由胰岛素原转化为胰岛素发生于高尔基体和分泌颗粒内,因此细胞内颗粒越少,所含胰岛素原就越多。目前认为,胰岛素瘤细胞能合成胰岛素,对已知的各种刺激有反应,但储存胰岛素的能力部分或完全丧失。正常的β细胞能按机体需要释放胰岛素,血糖高时,胰岛素释放增加;血糖低时,释放减少;而胰岛素瘤的这种反馈机制消失,以致胰岛素持续释放而引起低血糖症。
(四)胰腺β细胞增生引起胰源性非胰岛素瘤性低血糖症
儿童和成人均可发生胰腺β细胞增生,并成为餐后低血糖症的重要原因。这些患者的空腹血糖可能正常,胰腺影像检查阴性,诊断特别困难。但是,动脉内钙刺激试验能发现胰岛分泌胰岛素明显增多,此种现象称为胰源性非胰岛素瘤性低血糖综合征(non-insulinoma pancreatogenic hypoglycemia syndrome,NIPHS)。其临床特征是:①发病年龄较轻(平均40岁左右);②非肥胖(平均BMI 22左右,而胰岛素瘤患者多为肥胖);③延长的OGTT显示,多数为餐后低血糖发作,少数为空腹低血糖症;④低血糖发作时的血清胰岛素仅轻度升高,个别可能正常或居于正常高值;⑤病理检查不能发现肿瘤而仅见胰岛β细胞增生。
胰岛素瘤术前定位有助于提高手术成功率,缩短手术时间,避免再次手术。尽管目前影像学及新的定位技术有所发展,但仍然很难发现直径小于1.0cm的肿瘤。例如,经腹B超的阳性率约30%,增强CT/MRI阳性率不足60%,胰腺动脉灌注CT扫描和选择性动脉内钙刺激肝静脉取血测定胰岛素(calcium arterial stimulation)定位胰岛素瘤阳性率70%~80%,胃镜下超声检查和增强超声检查定位准确率约90%。组合不同的术前定位检查可以提高胰岛细胞瘤定位的准确率。术中定位主要是高分辨超声检查和胰腺静脉分段取血。GLP-1受体闪烁显像定位胰岛素瘤的有效性有待进一步证实。因此,胰岛素瘤的术前诊断不能过分强调并依赖于影像检查,这是因为:①胰岛素瘤可以凭生化检查和激素测定明确诊断;②胰岛素瘤几乎全部位于胰腺内,或者最多也只是“异位”至Vater壶腹部;③胰岛素瘤的体积很小,难以被现有的影像检查发现;④影像检查不能鉴别胰腺内“结节”或“肿块”的生物学性质和内分泌功能;⑤术中可用高分辨B超和分子探针定位,并可用实时血糖和胰岛素监测判断肿瘤是否被清除。
1.高分辨率B超和CT
可作为筛选检查,但阳性率低。由于肿瘤通常<2cm,CT的阳性率约50%。内镜超声发现80%~90%的肿瘤,而术中B超的阳性率在95%以上。
2.腹腔选择性动脉造影
Olsson首先应用腹腔选择性动脉造影(SAG)诊断胰岛素瘤,随后报道其阳性率达90%以上。阳性者于病变处可见肿瘤瞬间充盈、肿瘤染色、血管增多和胰内小动脉呈不规则扩张。同一患者在连续摄片上,同一部位可见到不同的征象。动脉钙刺激试验(calcium arterial stimulation test)是在术中造成选择性胰动脉内高钙血流并在肝静脉采样定位胰岛素瘤的合适方法。该法于1989年由Doppman等首先采用,其原理是:肿瘤细胞对钙的反应与正常β细胞有别,定位成功率88%(MRI 43%;血管造影36%,CT 17%,B超9%)。在完成动脉造影后,将10%葡萄糖酸钙用生理盐水稀释后注入动脉内,用量C0.0125mmol Ca2+/kg体重,并于-20、20、40和60秒时分别自左(或右)肝静脉采血测定血胰岛素和血糖等。结果判断的标准是:如果血胰岛素升高大于基础值2倍以上可认为属于阳性反应。在没有动脉的解剖变异情况下,如果从胃十二指肠动脉或肠系膜上动脉注入钙剂,那么阳性反应提示胰岛素瘤位于胰腺的头颈部。如果自近端脾动脉或中脾动脉注入钙剂,那么阳性反应说明肿瘤位于胰体或胰尾部;而自肝固有动脉注入钙剂后的阳性反应表示已经发生肝转移。但是,有时可因动脉解剖变异而发生阳性反应,此时可根据反应最显著者来估计肿瘤的部位。
3.放射性核素扫描和核素探针
一般放射性核素扫描的检出率甚低。应用标记单克隆抗体(131I-抗胰岛素抗体或131I-抗人C肽抗体)进行扫描,可望提高阳性率。此外,因胰岛素瘤很小而不易被发现;隐性胰岛素瘤(occult insulinoma)占全部胰岛素瘤的10%~20%,Ressetta等用γ-探针(C-Trak,以放射标记的奥曲肽作示踪物)可从形态上与周围组织毫无区别的部位发现胰岛素瘤(直径7mm)。目前,敏感性最高的影像技术是18F-L3,4-二羟苯丙氨酸-PET(fluorine-18,L-3,4-dihydroxyphenylalanine positron emission tomography,18FDOPA-PET)。
4.经皮肝门静脉插管分段取血
经皮肝门静脉插管,分段取门脉血标本测定胰岛素有助于肿瘤定位。但需注意,胰静脉内胰岛素浓度可有很大波动,这是因为胰岛素往往呈脉冲(脉冲周期7~15分钟)式分泌。因此,应连续多次取样测定。另外,胰岛素瘤主要分泌胰岛素原,后者半衰期较长,致使跨肿瘤的血浆免疫反应胰岛素梯度变得不明显。但如果在门静脉或脾静脉内发现胰岛素浓度呈阶梯上升,提示相应部位有肿瘤存在。术中作胰静脉插管,分段取血测定胰岛素浓度,也有助于肿瘤定位。动脉造影加选择性静脉采样测定胰岛素的敏感性约80%。
5.不能定位的胰岛素瘤
只能用胰尾盲目切除术(blind distal pancreatectomy)治疗,但该法的治愈率低,并发症多,现已弃用。
手术切除肿瘤
延迟手术有可能由于长期低血糖而致中枢性神经系统严重损害,或因患者过多进食而致肥胖,导致日后手术难度增加。
1.术式选择
手术常取上腹横切口或两肋下切口,以便充分暴露整个胰腺及周围脏器,仔细探查肝、肝门和胰腺组织,以了解有无转移灶。凡属可疑病灶和淋巴结均应作冷冻切片检查。如果发现在胰头、颈或体内有良性肿块,并位于胰腺表面,可作肿瘤剜出术;但如病变范围很大时,则作次全或全胰切除术,甚至Whipple手术,有根治可能。胰体和尾部恶性肿瘤可选用远端切除术治疗。如肿瘤已有肝内转移,无根治希望,则尽可能切除原发癌和转移灶,可使相当一部分患者术后症状缓解,减少术后化疗药物的剂量。
2.麻醉选择
由于大多数全麻药物对葡萄糖通过细胞膜具有抑制作用而影响血糖水平,因此一般不用全麻,而以硬膜外麻醉为宜。术中应防止发生低血糖症和肿瘤切除后的高血糖症。术前可应用糖皮质激素作准备,术中应用泵控匀速输入少量葡萄糖,可防止低血糖症发作对麻醉管理的影响。
3.术中定位
如果术中全胰探查未发现肿瘤,胰周组织亦正常,或原已作过1次或1次以上手术探查均阴性,而临床上又有低血糖症状,可在B超引导下行胰腺针吸活检或应用术中高分辨B超进行定位,尽量寻找肿瘤或增生灶。另一种办法是在术中用生长抑素受体γ探针闪烁(somatostatin receptor scintigraphy,SRS)扫描,定位肿瘤灶,同时进行放疗。
在各种定位诊断均告失败后可选用以下措施进行处理:①盲目胰体-尾切除术,即切除门静脉以左的胰体尾部。有人认为胰岛素瘤既然均匀分布于胰头、体、尾部或甚至更多在体尾部,故盲目切除胰体尾部可有1/2~2/3成功的机会。但实际上并非如此,因为体尾部肿瘤较易发现,隐匿的肿瘤更多地遗留在头钩部。如果不是肿瘤而是增生,仅切除体尾部并不能解决问题,因此许多学者不主张盲目作胰体尾部切除。②有人认为,肿瘤隐匿在胰头和钩部的机会多,主张行盲目胰头-十二指肠切除术。但此种手术创伤大,并发症多,死亡率高,对于胰岛增生的病例更不合适。除个别学者外,绝大多数不同意采用此法。③以血糖为监测指标,自左至右切除胰腺,根据血糖上升值来决定切除胰腺的范围,切下的标本同时做冷冻切片组织学检查。具体方法是:手术当日麻醉前2小时即停止给葡萄糖,麻醉诱导后测血糖,以后每15~30分钟测1次,切除胰腺后每5~15分钟测1次。血糖常在胰岛素瘤摘除后30分钟上升,如手术切除成功,血糖平均每小时上升1.33mmol/L。多数在切除80%左右时,即能见效。如切除至70%~80%时血糖仍不上升,为保留消化和胰腺的其他内分泌功能,一般不主张进一步切除,可在术后应用美克洛嗪(meclizine,meclozine)控制低血糖症。此种手术方法有假阳性和假阴性反应,即摘除肿瘤后血糖虽上升,但以后发现还有残留的肿瘤或功能亢进的增生胰岛组织,也有切除肿瘤后数小时才见血糖上升者。尽管如此,本法是目前比较可行的方法,尤其适用于手术探查阴性或已作过胰体尾部切除的病例。内镜超声定位加内镜下切除胰岛素瘤已应用于临床,其疗效可靠,无明显并发症。
Moore等对一例术后复发的胰岛素瘤患者行选择性胰动脉插管,注入微纤维胶原(microfibrillar-collagen)进行栓塞治疗,使患者空腹血糖和胰岛素水平迅速改善,随访11个月仍良好。但本法可致胰腺炎和十二指肠梗死,所以仅适用于不能手术切除的特殊病例。
饮食/糖皮质激素/胰岛素分泌抑制剂/链佐星/生长抑素缓解症状
非手术治疗应用于下列情况:①解除低血糖症状;②作为术前准备;③已有转移而不能切除恶性胰岛素瘤患者;④拒绝手术治疗或手术有禁忌证者;⑤手术未找到腺瘤或切除腺瘤不彻底,术后仍有症状者。恶性胰岛素瘤的药物治疗可减缓临床症状,即使已转移至肝和局部淋巴结的病例,其病程仍长达5~6年,故仍需积极治疗。
1.饮食疗法
少量多餐以避免低血糖发作,可应用吸收缓慢的糖类。在预期易发时间前口服或静脉注射葡萄糖。低血糖发作时,快速口服或静脉输入葡萄糖,以纠正低血糖症。
2.糖皮质激素类药物
对减轻症状有一定的效果,但由于常带来显著的副作用,不宜常规使用。
3.胰岛素分泌抑制剂
主要有:①二氮嗪:为噻嗪类利尿剂的衍生物。由于开放ATP敏感性K+通道,能直接抑制β细胞分泌胰岛素,兴奋β-肾上腺素能神经促进糖异生,减少外周葡萄糖的利用,升高血糖。该药可致水肿和钠潴留、胃肠不适和多毛,故常和利尿剂三氯噻嗪(trichlormethiazide)合用。二氮嗪的常用剂量为300~400mg/d,有时需1000mg/ d,同时给予三氯噻嗪2~8mg/d。②苯妥英钠:引起高血糖的机制不明,可能是由于抑制了胰岛分泌胰岛素,苯妥英钠中毒时常伴有高血糖症甚至高渗性高血糖状态。剂量为300~600mg/d,分3次服用。临床上胰岛素瘤低血糖发作易被误诊为癫痫发作,使用苯妥英钠治疗而使部分症状得以缓解,导致诊断更为延误,应引起注意。但一般仅1/3病例有效,且长期应用可致严重共济失调。③链佐星:强力阻抑DNA及蛋白质合成,还有抑制糖异生和吡啶核苷酸合成的作用。曾用来治疗伴有肝脏转移的恶性胰岛素瘤,取得一定疗效。该药目前主要用于治疗胰岛β细胞癌,可单用,也可与氟尿嘧啶和氟化嘧啶(fluorinated pyrimidine)合用。一疗程剂量为每周1~1.5g/m2,或每日500mg/m2,连用5天,每6周1疗程。该药的副作用主要为胃肠道反应(恶心和呕吐)和肾损害。首先出现蛋白尿(1~2g/24h尿),继之发生肾小管酸中毒、肾性糖尿和氮质血症。但对骨髓无抑制作用。氯脲霉素(chlorozotocin)为链佐星的衍生物,作用与链佐星相似,但肾毒性很小。④生长抑素:对二氮嗪无效病例可试用。不宜手术者或因其他原因暂不宜手术者亦可用奥曲肽控制症状。
4.其他药物
主要有:①门冬酰胺酶(左旋门冬酰胺酶):Schein等使用该药治疗1例其他治疗措施无效的胰岛素癌,取得疗效。该药可用于胰岛素癌患者短程姑息治疗。由于其毒性甚大,不宜常规应用。但又因该药对骨髓无抑制作用,故可配合其他药物应用。②普萘洛尔(心得安)和氯丙嗪:偶可作为胰岛素癌的辅助治疗。③其他药物:如结核菌素、长效胰高血糖素、柔红霉素和普卡霉素,多应用于恶性胰岛素瘤病例。













