自身免疫性多内分泌腺病综合征(autoimmune polyendocrinopathy syndrome,APS)又称为免疫性内分泌病综合征(immunoendocrinopathy syndrome),是指个体在一生中同时或先后发生两种以上自身免疫性内分泌腺病和非内分泌腺病的一组疾病群,其中绝大多数为内分泌腺(或内分泌细胞)功能减退或衰竭,血中可检出腺体特异性自身抗体,是一种呈家族发病倾向的遗传性疾病。民族与地区之间的发病率有一定差异。
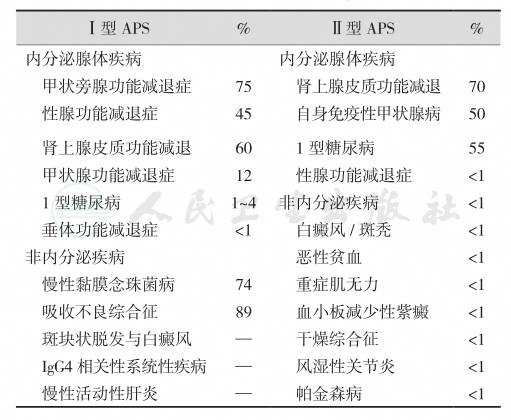
根据病因及临床特征,可分为Ⅰ型APS和Ⅱ型APS两型,以Ⅱ型较多见。过去曾将APS分为3型,但现在多采用Neufeld(1981年)提出的两型分类法,虽然Ⅰ型和Ⅱ型APS的组成成分有许多重叠,但在发病年龄、性别、病因和遗传特征方面有明显差别,见表3-19-1。Ⅰ型APS主要累及女性,可能主要与X染色体有关;其特点是自身免疫调节(autoimmune regulator protein,AIRE)基因突变及其引起的T淋巴细胞耐受缺损,又称自身免疫性念珠菌感染-多内分泌腺病-外胚层营养不良症(autoimmune polyendocrinopathycandidiasis-ectodesmal dystrophy,APECED)。APECED为芬兰人的世袭遗传病,发病率高达1/2500,而伊朗犹太人的发病率为1/9000;意大利北部、英国、新西兰、沙特人中均有报道。Ⅱ型APS以人类白细胞抗原(human leukocyte antigens,HLAs)变异引起的器官特异性自身免疫为特点,并伴有非器官特异性自身免疫反应。此外,以前提出的Ⅲ型APS患者伴有自身免疫性甲状腺病和其他自身免疫性疾病(不包括Addison病),其中以Hashimoto甲状腺炎最多见;Ⅳ型APS的自身免疫性内分泌疾病分类不符合Ⅰ型APS、Ⅱ型APS或Ⅲ型APS。另一种APS称为X性连锁的免疫紊乱-多内分泌病-肠病(X-linked immune dysfunction-polyendocrinopathyenteropathy,IPEX)综合征,病因为FOXP3基因突变;是否属于Ⅰ型或Ⅱ型APS以外的特殊类型尚无定论。
表3-19-1 自身免疫性多内分泌腺病综合征的分型及组成
一般的自身免疫性疾病均为多基因多因素性病因;但Ⅰ型APS(AIRE突变)、IPEX和X-性连锁的自身免疫性淋巴细胞增生综合征(X-linked autoimmune lymphoproliferative syndrome)均为单基因遗传病。
(一) AIRE突变导致Ⅰ型APS
AIRE基因位于21q22.32,其所有外显子与内含子交界处都有典型的G7-AG系列。启动子在第1个外显子上游,有1个TATA盒、1个GC盒和1个CPG岛。其3′末端与同链上的PFKL基因启动子重叠。具有转录调节的功能,但AIRE蛋白在Ⅰ型APS发病机制中所起作用尚不完全清楚。
Ⅰ型APS是由于AIRE基因突变所致(图3-19-1)。迄今至少发现有45种突变,已报道的致病性突变包括无义突变、错义突变、沉默突变、插入和缺失以及剪接位点突变等。不同民族和地区引起Ⅰ型APS的突变各不相同。在芬兰人中,82%患者的AIRE基因突变为R257X突变,中国1型APS患儿有A19T和R257X的复合杂合突变,而且其突变分别由父亲(A19T)和母亲(R257X)遗传所致。在伊朗患者中,98%有Y85C突变;82%的沙特患者为R139X突变。两种最常见的突变为R257X和967-979缺失。前者的突变在外显子6的889位核苷酸有C→T取代,导致终止密码子提前出现,使AIRE蛋白被截短。后一种突变在外显子8,缺失从967位起到979位共缺失16个核苷酸。2006年,Ulinski等报告1例患者的AIRE缺失1734个核苷酸,其表达的AIRE蛋白只有44个氨基酸残基。突变热点为外显子2和10,前者有8种突变;后者有10种突变。AIRE基因突变外显率几乎达100%。
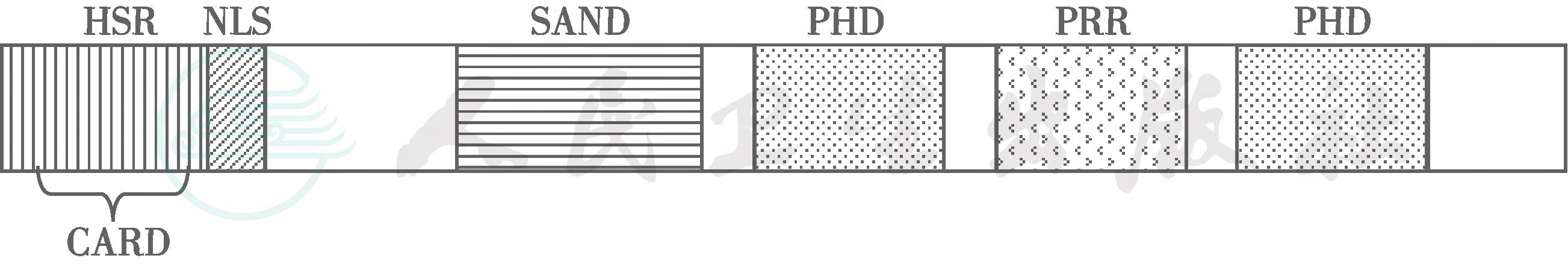
图3-19-1 人AIRE蛋白结构示意图
注:HSR:homogeneously staining region at amino acids 1~106,第1~106位氨基酸均匀染色区;CARD:capase recruitment domain at anino acids 8~96,第8~96位氨基酸的半胱天冬酶募集结构域;NLS:nuclear loealization signal at amino acids 181~280,第181~280位氨基酸的核定位信号区;SAND:domain of Sp100-AIRE-NucP41/75-DEAF-1 at aminoacids 181~280,第181~280氨基酸区的Sp100-AIRE-NucP41/75-DEAF-1结构域;PHD:plant homeodomain type Zincfinger at amino acids 299~340 and 434~475,第299~340与434~475位氨基酸的植物同源结构域锌指;PRR:proline-rick region at amino acids 350~407,第350~407位氨基酸的脯氨酸富含区
表3-19-2 APSⅠ与APSⅡ的比较

(二) AIRE功能异常引起多内分泌腺自身免疫性损害
AIRE蛋白主要在胸腺髓质的上皮细胞中表达,分为多个功能区。HSR区需要多同聚体化,其中还含有半胱天冬酶募集结构域,该区是AIRE转化激活的关键部位。SAND结构域含有DNA结合活性,但与其他蛋白的转录因子有别;两个PHD锌指区的作用只限于核转录调节,第1个PHD区与非甲基化的组蛋白H3结合。特异性E3连接酶是免疫耐受的关键调节因子,而突变后即导致自身免疫性疾病。两个PHD结构域之间的脯氨酸富含区与蛋白-蛋白相互作用有关,AIRE突变主要发生于HSR和SAND区。
关于AIRE蛋白结构与功能关系的研究很多。目前已知,AIRE存在于胞质中,但可进入细胞核。在细胞核中AIRE蛋白以二聚体形式与特殊的DNA结合,起着转录辅激活子(transcriptional co-activator)的作用,AIRE基因也可调节组织特异性自身免疫反应性T细胞克隆的阴性选择(negative selection)。但如Ⅰ型APS的病因只是AIRE单个基因突变,如何引起那么多的内分泌腺与非内分泌细胞自身免疫病和念珠菌感染和外皮层营养不良,其发病机制尚未明了。
(一) 一般治疗和对症治疗
轻度腹泻症状者用肠蠕动抑制剂有效,自身免疫性肝炎除用免疫抑制剂外,还应给予护肝和降酶药物。恶性贫血和萎缩性胃炎者可补充维生素B12和稀盐酸,严重者可输血。并发神经系统损害在对症治疗的基础上可考虑糖皮质激素治疗。
(二) 抗真菌治疗
局部浅表感染者使用抗真菌霜涂抹,伊曲康唑(itraconazole)适用于指(趾)甲感染。深部或器官内感染可口服抗真菌药,但均易复发。治疗深部真菌感染的药物如两性霉素B、酮康唑、氟康唑都有较大的不良反应。其中两性霉素B毒性较大,只能短期慎用,特别是有肾功能不全和白细胞减低者,需要密切观察肾功能变化。酮康唑和氟康唑的剂量为200mg/d。口腔感染者一般需要连服10天,皮肤感染者需用1~2个月,其他深部真菌感染的治疗时间更长,有些病例需要反复给药,但因毒副作用大而难以坚持。
(三) 激素补充治疗
1. 甲旁减
一般不用PTH替代治疗。补充维生素D和钙剂,使血钙保持在稍低于正常水平。维生素D2和D3剂量为每天50μg/kg,1α-D3和1,25-(OH)2D为每天0.03μg/kg。如果患者同时有甲状旁腺和肾上腺皮质功能减退,应同时补充维生素D、钙剂和糖皮质激素。如果遇到应激应增加糖皮质激素的剂量。
2. 自身免疫性1型糖尿病
必须用胰岛素治疗。如果同时有甲状腺和肾上腺皮质功能减退症,则患者对胰岛素作用敏感,胰岛素剂量应从小剂量开始。
3. 自身免疫性肝炎
用于治疗自身免疫性肝炎的药物有泼尼松和硫唑嘌呤或环孢素。一般先用泼尼松,每天1.5~2mg/kg,分4次口服;当血清谷丙转氨酶降低至原来的1/2~1/3后,改用硫唑嘌呤,剂量为每天2mg/kg。
4. 自身免疫性肾病
可用泼尼松、硫唑嘌呤和环孢素治疗。
1. Stolarski B,Pronicka E,Korniszewski L,et al. Molecular background of polyendocrinopathy-candidiasis- ectodermal dystrophy syndrome in a Polish population:novel AIRE mutations and an estimate of disease prevalence. Clin Genet,2006,70(4):348-354.
2. Selmi C. The X in sex:how autoimmune diseases revolve around sex chromosomes. Best Pract Res Clin Rheumatol,2008,22(5):913-922.
3. Su MA,Anderson MS. Monogenic autoimmune diseases:insights into self-tolerance. Pediatr Res,2009,65(5 Pt 2):20R-25R.
4. 刘彩虹,石岩. 自身免疫性多内分泌腺病综合征Ⅰ型分子遗传学研究进展. 国际儿科学杂志,2010,37(1) :45-48.
5. 刘彩虹,石岩,阴怀清,等. 中国人自身免疫性多内分泌腺病综合征Ⅰ型AIRE基因突变.中华医学遗传学杂志,2010,27(1):18-22.
6. Michels AW,Eisenbarth GS. Autoimmune polyendocrine syndrome type 1(APS-1) as a model for understanding autoimmune polyendocrine syndrome type 2(APS-2). J Intern Med,2009,265(5):530-540.
7. Owen CJ,Cheetham TD. Diagnosis and management of polyendocrinopathy syndromes. Endocrinol Metab Clin North Am,2009,38(2):419-36,x.
8. Shikama N,Nusspaumer G,Holl?nder GA. Clearing the AIRE:on the pathophysiological basis of the autoimmune polyendocrinopathy syndrome type-1. Endocrinol Metab Clin North Am,2009,38(2):273-288,vii.
9. Collins SM,Dominguez M,Ilmarinen T,et al. Dermatological manifestations of autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy syndrome. Br J Dermatol,2006,154(6):1088-1093.
10. Meager A,Visvalingam K,Peterson P,et al. Anti-Interferon Autoantibodies in Autoimmune Polyendocrinopathy Syndrome Type 1. PLoS Med,2006,3(7):e289.
11. Levin M. Anti-Interferon Auto-Antibodies in Autoimmune Polyendocrinopathy Syndrome Type 1. PLoS Med,2006,3(7):e292.
12. Brown EM. Anti-parathyroid and anti-calcium sensing receptor antibodies in autoimmune hypoparathyroidism. Endocrinol Metab Clin North Am,2009,38(2):437-445,x.
13. Van den Driessche A,Eenkhoorn V,Van Gaal L,De Block C.Type 1 diabetes and autoimmune polyglandular syndrome:a clinical review. Neth J Med,2009,67(11):376-387.
14. Blanco Quirós A,Arranz Sanz E,Bernardo Ordiz D,et al. From autoimmune enteropathy to the IPEX(immune dysfunction,polyendocrinopathy,enteropathy,X-linked) syndrome. Allergol Immunopathol(Madr),2009,37(4):208-215.
15. Ruemmele FM,Moes N,de Serre NP,et al. Clinical and molecular aspects of autoimmune enteropathy and immune dysregulation,polyendocrinopathy autoimmune enteropathy X-linked syndrome. Curr Opin Gastroenterol,2008,24(6):742-748.
16. Oliva-Hemker M,Berkenblit GV,Anhalt GJ,et al. Pernicious anemia and widespread absence of gastrointestinal endocrine cells in a patient with autoimmune polyglandular syndrome type I and malabsorption. J Clin Endocrinol Metab,2006,91(8):2833-2838.
17. Vujovic S. Aetiology of premature ovarian failure. Menopause Int,2009,15(2):72-75.
18. Welt CK. Autoimmune oophoritis in the adolescent. Ann N Y Acad Sci,2008,1135:118-1122.
19. 刘彩虹,石岩,阴怀清,等. APS—Ⅰ早期确诊方法(附1例病例报道). 中国医药导报,2009,5(6),15:10-13.
20. Oliveira JB,Notarangelo LD,Fleisher TA. Applications of flow cytometry for the study of primary immune deficiencies. Curr Opin Allergy Clin Immunol,2008,8(6):499-509.
21. Husebye ES,Perheentupa J,Rautemaa R,et al. Clinical manifestations and management of patients with autoimmune polyendocrine syndrome type I. J Intern Med,2009,265(5):514-529.
22. Owen CJ,Cheetham TD. Diagnosis and management of polyendocrinopathy syndromes. Endocrinol Metab Clin North Am,2009,38(2):419-436,x.
23. 金善,曹霞,乔红波等. 自身免疫性多内分泌腺病综合征并发神经系统损害二例. 中华神经科杂志,2010,5(43):383-384.













