英文名称 :male precocious puberty
男孩在9岁前出现性腺增大和第二性征称为男性性早熟(male precocious puberty),可分为中枢性性早熟(central precocious puberty,CPP)和周围性性早熟(peripheral precocious puberty,PPP)两类。CPP又称为真性或GnRH依赖性性早熟;PPP又称为假性或非GnRH依赖性性早熟。中枢性性早熟是指下丘脑-垂体-性腺轴不适当地过早活跃,导致青春期发育提前出现,其表现与正常的性发育相同,第二性征与遗传性别一致,能产生精子或卵子,有生育能力。周围性性早熟由性腺中枢以外的因素产生过多的性激素引起,只有第二性征发育,生殖细胞并无同步成熟、无生育能力。临床上,真性性早熟比假性性早熟多见,而女性性早熟常属于良性过程,但男性性早熟多为病理性。其实,汉语中的“性早熟”并没有准确反映“precocious puberty”或“sexual precocity”的含义,患者提前出现青春期发育(如CPP)或仅有性发育时间提前(如PPP),而性腺的激素分泌功能、性发育表征或生育功能均没有“成熟”,所以并非真实的“青春期发育提前”,因而称“性发育提前”可能更为恰当;但从习惯考虑,本书仍采用性早熟之称。
性早熟的病因很多,一般有两种分类方法,各有优缺点(表1)。临床上以女性 GnRH依赖性性早熟较常见。另外,性教育的普及和书刊影视中性场景泛滥,使青春期发育提前启动也是儿童性早熟发生率增高的原因之一。
表1 男性性早熟病因与分类

注:CNS.中枢神经系统;CYP21.21-羟化酶缺陷;CYP11B.11-羟化酶;3β-HSD:3β-羟类固醇脱氢酶
性早熟所带来的医疗问题主要有三方面:①引起骨骼的线性生长加速和骨骺的过早闭合,导致儿童期高身材和成年期矮身材,使身高一般不超过155cm。②性早熟患儿的性器官达到成人成熟水平,但思维方式和能力与实际年龄不一致,带来性行为监护问题。③器质性病变所致性早熟需及时诊断和处理,特别是恶性肿瘤。因此,一旦明确诊断后,应积极治疗。由于病因多样,故要尽可能明确病因,并避免性教育的普及和书刊影视中性场景的泛滥。一般可以通过下列治疗达到治疗目的:①终止性发育直至正常青春期启动年龄,并使已出现的第二性征消退;②抑制过快的骨骼生长速度,使最终的身高能达到正常范围;③治疗中枢神经病变;④最大限度地消除患儿的心理障碍;⑤防止非法妊娠。
(一)真性性早熟的治疗
CPP的病因是多方面的,在确定CPP后应排除中枢病变。对于非特发性CPP,应强调同时进行病因治疗(如鞍区肿瘤的手术治疗)。特发性CPP可考虑首选GnRH-A治疗,但应合理掌握应用指征,治疗中应监测和判断疗效以及把握生长和成熟的平衡,才能达到改善成年身高的目的。
1.GnRH类似物(激动剂,GnRH-A)
垂体在外源性GnRH类似物(激动剂,GnRH-A)的大剂量持续非脉冲刺激下产生受体降调节,LH和FSH在短暂释放增加后分泌受到抑制,且受体后的负反馈机制的激活通路被阻断,从而抑制下丘脑-垂体-性腺轴功能。GnRH-A能有效抑制LH分泌,使性腺暂停发育,性激素分泌回落至青春前期状态,从而延缓骨龄增长和骨骺融合,延长生长年限,改善最终身高。Gn-RH-A是治疗CPP的理想药物。目前,国际上主要有曲普瑞林(triptorelin)、达菲林(diphereline)、亮丙瑞林(leuprorelin),见表3。注射用GnRH-A在体内的半衰期为天然GnRH的3~10倍。男性CPP的GnRH-A应用指征是:①中枢性GnRH依赖性性早熟的诊断肯定,GnRH兴奋试验示LH和睾酮能到达青春期水平;②骨龄:男孩≤12.5岁,骨龄大于年龄2岁或以上;预测成年身高男孩<160cm;③骨龄/年龄>1,骨龄/身高年龄>1,或以骨龄判断的身高的标准差积分(SDS)≤-2;④发育进程迅速,骨龄增长/年龄增长>1.2。应用时,首剂80~100μg/kg,2周后加强1次,以后每4周1次,剂量60~80μg/kg,根据性腺轴功能抑制情况(包括性征、性激素水平和骨龄进展)而定,抑制差者可参照首剂量,最大剂量3.75mg/次。
表3 用于治疗中枢性性早熟的GnRH激动剂
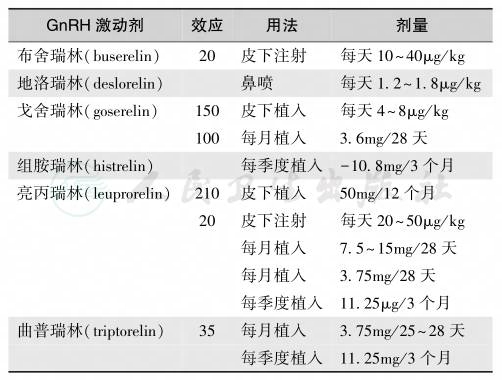
注:各种GnRH激动剂的效应以天然GnRH 100%计算
GnRH激发试验显示LH值处于青春前期水平,说明剂量合适,复查基础血清睾酮浓度以判断性腺轴功能抑制状况。治疗过程中,每2~3个月测量身高以及检查第二性征,每半年复查骨龄。为确切了解骨龄进展的情况,应对治疗前后的骨龄进行评定和对比。为改善成年身高,GnRH-A的疗程至少需要2年。一般在骨龄12~12.5岁时可停止治疗。对年龄较小开始治疗者,在年龄已追赶上骨龄,且骨龄已达正常青春发动年龄时可停药,使其性腺轴功能重新发动。治疗结束后第1年内应每半年复查身高、体重和第二性征。用新的曲普瑞林长效皮埋制剂(11.25mg)治疗CPP的效果满意[15]。梁雁等报道每6周皮下注射曲普瑞林3.75mg,可与4周肌内注射疗法同样有效地改善临床症状和抑制性激素的水平,且6周皮下注射方案在延缓骨龄增长、提高预测成人期身高方面优于4周肌内注射[16]。Tanaka等用亮丙瑞林治疗13例男性 CPP患儿(4.1±2.5)年,并随访了(2.6±1.1)年,结果:90.9%患儿达到成年身高,全部患儿的血浆睾酮恢复到成人水平,对生殖功能恢复无不良作用[17]。GnRH-A应用的反指征包括:①骨龄:男孩≥13.5岁;②男孩遗精后1年;③因性发育进程缓慢(骨龄进展不超越年龄进展)而对成年身高影响不大的CPP,但需定期复查身高和骨龄变化。
2.甲羟孕酮或氯地孕酮
可直接抑制下丘脑GnRH脉冲发生器和垂体促性腺激素的释放,抑制性腺合成性激素。此外,可能对靶组织的性类固醇受体也有抑制作用,能抑制性早熟患儿的第二性征发育,尤其对女性患儿疗效较好。其缺点是对骨龄发育加速无影响,不能改变患儿的最终身高;长期应用可导致性腺类固醇的靶器官萎缩,停药后月经恢复慢。甲羟孕酮或氯地孕酮的治疗剂量相同,4~10mg/次,一般小剂量开始,根据治疗反应逐渐增加剂量。由于此药有类皮质激素作用,可引起体重增加、高血压和类 Cushing综合征。
3.环丙孕酮
环丙孕酮(赛普龙,cyproterone acetate)为孕激素的衍生物,既能与AR结合,在受体水平阻断睾酮和二氢睾酮的作用,又能竞争性地阻断垂体的GnRH受体,抑制促性腺激素的合成与释放。口服每日剂量70~100mg/m2,或肌注100~200mg/m2体表面积,每2~4周1次。对性器官成熟有明显抑制作用,对骨龄加速的抑制作用不肯定。不良反应除可有头痛、疲乏、失眠和恶心外,对ACTH的分泌也有抑制作用,因而长期用药要观察肾上腺皮质功能的变化。
4.17,20裂解酶抑制剂
酮康唑可用于男性特发性CPP经GnRH-A治疗无效者。该药主要影响类固醇17,20裂解酶,从而干扰睾酮生成。200~600mg/d,分2~3次口服。比卡鲁胺和阿那曲唑的不良反应较少,效果更佳[18]。
5.芳香化酶抑制剂
骨龄的进展决定于雌激素对骨生长板的作用。在男孩中,睾酮在芳香化酶的作用下转化为雌二醇。在GH缺乏所致的矮小症中,骨龄进展是GH替代治疗的主要障碍,它阻碍了躯体长高。芳香化酶抑制剂可分为三代,第三代药物可抑制体内98%的芳香化酶活性,可阻止睾酮向雌二醇,雄烯二酮向雌酮及16羟-雄烯二酮向雌三醇的转换,其不良反应较轻。第三代芳香化酶抑制剂福美坦(formestane)25~50mg/d,达峰 1小时,半衰期 8.9小时,最大抑制使雌二醇下降62%±14%。可用于治疗体质性青春期发育延迟、特发性矮小症和生长激素缺乏症的治疗。初步研究报道,第三代芳香化酶抑制剂来曲唑(letrozole)联合抗雄激素药物可延长生长板的生长期,使躯体的线性生长和青春期发育延迟[19]。此外,亦可用于McCune-Albright综合征、睾酮中毒症和先天性肾上腺皮质增生所致的矮小症的治疗。治疗过程中应追踪BMD和血脂变化。该类药物对精子生成是否有影响尚无定论。对于McCune-Albright综合征患者,目前认为并非是由于性腺中枢提早启动的真性性早熟,用上述药物无效。此外,家族性男性性早熟用GnRH-A无效,可用螺内酯(安体舒通)和睾内酯(一种芳香化酶抑制剂)联合治疗。
(二)假性性早熟的治疗
由于是非依赖GnRH的性早熟,故用GnRH-A治疗无效。可依据病情选用甲羟孕酮、睾酮内酯、螺内酯、酮康唑等。在正常的青春期发育中,男性的身材发育和骨成熟依赖于雄激素的作用。Feuillan等主张用睾内酯(testolactone)结合抗雄激素药物螺内酯治疗。由先天性肾上腺皮质增生症引起者应使用糖皮质激素同时辅以必要的矫形治疗如切除肥大的阴蒂等。睾丸、肾上腺及其他部位肿瘤所致者应行手术或放射治疗。













