英文名称 :nonthyroidal illness syndrome
在饥饿或某些疾病时,血清甲状腺激素水平出现变化。疾病程度较轻时,只涉及血清T3的降低;当进一步加重恶化时,T3、T4都降低,称为非甲状腺病态综合征(nonthyroidal illness syndrome,NTIS)、正常甲状腺功能性病态综合征(euthyroid sick syndrome,ESS)、低 T3综合征(low T3syndrome)或低T3/T4综合征(low T3/T4syndrome)。近年来,一般称此种临床状态为NTIS,因为它突出了甲状腺无器质性病变的重要特征,NTIS有多种类型,其中以血清T3降低、而T4和TSH可正常或降低为多见。
NTIS是神经内分泌系统对疾病适应反应的一部分表现或严重疾病的结果,在临床上相当常见。NTIS的变化范围大,且易受药物和疾病本身等因素的干扰,常造成诊断和治疗上的困难。NTIS包括以下几种临床情况:①低T3综合征;②低T3/T4综合征;③高T4综合征;④低TSH/T3/T4综合征;⑤甲状腺激素分泌和合成的其他异常。Torre等报道,老年患者的甲状腺功能异常占12.6%,其中甲减占45%,甲亢占15.6%,低T3综合征占39.4%。各种重症疾病或消耗性疾病亦使血TT4降低(低T3/T4综合征),占ICU患者的 30%~50%;高T4综合征约占1%。NTIS是机体拮抗体能过度消耗的一种代偿性反应,其阶段因子有IL-1β、IL-6、TNFα核IFN-γ,通过这些细胞因子抑制甲状腺激素代谢(表1)。
表1 非甲状腺疾病引起的血清T3/T4/rT3和TSH改变
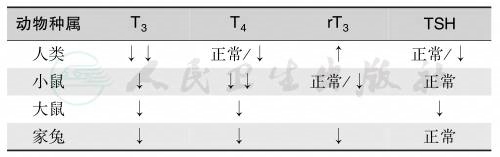
甲状腺激素作用于组织水平,血清中的NTIS表现并不能代表各自组织的代谢状况。血清活性甲状腺激素和TSH降低提示下丘脑TRH和TSH对甲状腺功能的调定点升高而代谢水平明显降低。
(一)急性疾病的肝脏甲状腺激素代谢
1.肝脏的甲状腺激素代谢
肝脏是甲状腺激素的重要靶组织,甲状腺激素决定了肝脏葡萄糖和脂质的代谢水平。肝脏主要表达TRβ1、TRα1和TRα2,60%的T3调节基因依赖于TRβ的调节,正常人的肝脏D3表达量很低,而D1是决定血清T3水平的关键因素,但在急性疾病状态时,肝脏的D1表达急剧降低,从而引起血清T3降低。急性炎症反应时TRβ介导的肝脏D1表达改变也与竞争有限的SRC-1有关,SRC-1是甲状腺激素受体(TR)的辅活化子,可使D1表达降低。
2.肌肉的甲状腺激素代谢
甲状腺激素调节骨骼肌的功能,1型肌纤维(主要存在于线粒体中)受慢运动神经元(slow motor neuron)支配,其ATP生成需要氧化磷酸化供能,其底物为脂质,而糖原含量低。相反,Ⅱ型纤维活动是高频率肌肉收缩的前提,并需要糖原分解提供ATP高转换(ⅡA型)或无氧糖酵解生成乳酸(ⅡB型)。多数骨骼肌含有Ⅰ型和Ⅱ型纤维,肌肉活动开始时募集Ⅰ型纤维,继而激活Ⅱ型纤维。Ⅰ型纤维更高度依赖于甲状腺激素状态,而Ⅱ型纤维的活动相对独立于甲状腺激素。肌肉功能的维持需要在D2、D3、TRα1的协同作用下,提供合适的甲状腺激素水平、TRβ1、甲状腺激素转运体8(MCT8)和 MCT10。 骨骼肌D2不仅与局部的T3生成有关,而且与外周提供的T3量有关。因此急性炎症时,骨骼肌的D2增加而D3降低,与TR低表达相一致,提高局部的T3可用性。
3.脂肪组织的甲状腺激素代谢
甲状腺激素调节脂肪代谢,急性炎症刺激脂解,抑制甘油三酯合成,ME和T3靶基因和GLU表达下调。游离脂肪酸进入肝脏代谢,以适应急性相反应(acute phase response)。
(二)慢性炎症状态的甲状腺激素代谢
慢性炎症时,血清甲状腺激素(尤其是T3)水平明显下降,炎症时亦降低。炎症或低氧状态下的甲状腺激素信号变化见图1。
1.肝脏甲状腺激素代谢
急性炎症通过特异性炎症因子降低血清甲状腺激素水平,减少食物摄取,相反,LPS引起的慢性炎症对肝脏 D1、TRα1、TRα2和 TRβ1表达没有明显影响,但D3活性降低。细菌性败血症时,肝脏甲状腺激素代谢的改变与畸形炎症反应相似。D1的合成需要硒参与,硒缺乏影响肝脏D1的表达与活性,但补充硒不能获益。
2.肌肉甲状腺激素代谢
在NTIS患者中,血清T3降低,rT3、TNFα、IL-6、IL-8 和IL-2R升高。 骨骼肌TRα1、TRβ1、RXRγ和D2也降低,甲状腺激素作用、D2和D3活性均被抑制。肌肉T3增加有助于能量消耗由脂肪转向葡萄糖,线粒体活性增强,乳酸增多,局部pH降低,T2激活细胞色素C氧化酶。细菌性败血症时,肌肉D2、TRβ1和 RXRγ表达降低,D3活性升高,肌肉T3的生物可用性增强,线粒体功能紊乱。急性炎症、慢性炎症和败血症时的肌肉脱碘酶表达反映了基本的严重程度(图2)。
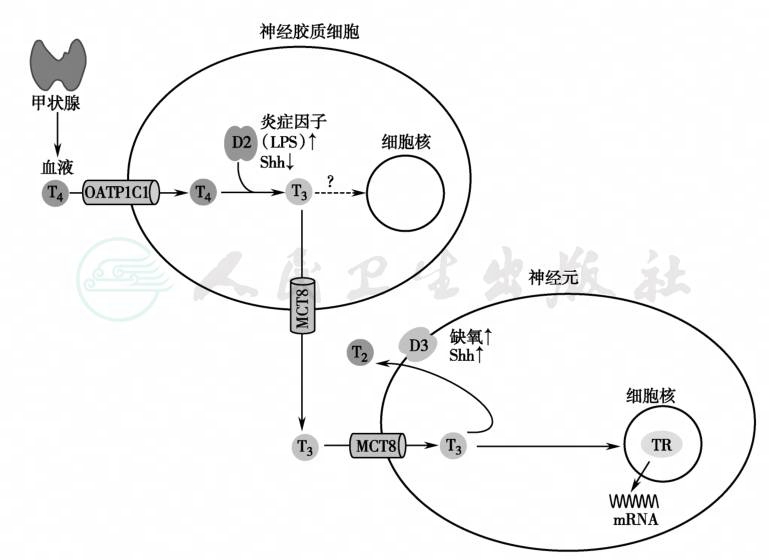
图1
炎症或低氧状态下的甲状腺激素信号变化可分为三步,首先是在甲状腺激素转运体OATP1C1的协助下,T4进入神经胶质细胞(glial cell)、星形细胞(astrocyte)和脑室膜细胞(tanycyte),继而,T4通过2型脱碘酶(D2)的作用,神经胶质细胞T4转换为T3并出胞,在甲状腺激素转运体MCT8协助下进入邻近的神经细胞,最后是T3与核受体结合,调节靶基因的转运活性;LPS能激活D2基因转录,而Shh促进D2灭活,缺氧也激活D3基因转录
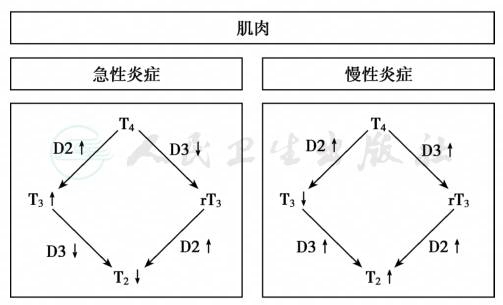
图2 急慢性炎症时的肌肉脱碘酶变化
左侧为急性炎症时的LPS表达,右侧为慢性炎症时的LPS表达;急性炎症时局部T3升高,而慢性炎症时T4浓度增加
白色脂肪表达 MCT8、TRβ1、TRα1、RXRα、RXRβ、RXRγ、D1、D2 和 D3。 败血症时,MCT8、TRβ1、TRα1 和 RXRγ 表达减少,脂肪细胞的T3摄取减少。
(三)粒细胞脱碘酶表达
多核粒细胞表达大量的D3,加速T4和T3灭活,细胞内的碘化物积聚,有利于杀灭细菌。
(四)长期重症疾病的甲状腺激素代谢
急性炎症时的甲状腺激素代偿性变化有利于支持免疫反应,但在转入慢性期后,这种反应于机体康复不利。肝脏甲状腺激素代谢紊乱,血清T3、T4和TSH降低,而rT3升高;D1活性被抑制加速病情恶化。肌肉线粒体减少,乳酸增多,肌肉功能紊乱。补充甲状腺激素不能改善病情,但TRH和GH能提高脉冲性TSH分泌量,升高血清T4和T3水平,减少蛋白降解。
(一)应激代偿反应引起的NTIS
引起NTIS的疾病和原因很多(表2),临床上以老年人、营养不良、急慢性感染、肝硬化、糖尿病、尿毒症、神经性厌食、外科手术后、重症创伤、麻醉、中毒等常见。其发病机制未明。近年来对NTIS的发生机制有了深入了解。许多疾病可诱发下丘脑性甲减。例如营养不良时,因为瘦素对下丘脑的作用减弱而引起局部脱碘酶2和3表达,并进而使局部的T3生成增多,TRH分泌减少,但血清T3和T4的下降与此无关,后者主要是Ⅰ型脱碘酶活性下降所致。另一方面,NTIS时的甲状腺激素转运体表达上调。有研究显示,活性氧自由基的增加导致的氧化应激反应是伴有NTIS患者的特征之一。细胞内的氧化还原反应会扰乱脱碘酶的功能,干扰脱碘酶发挥作用所需要的细胞内环境。此外,缺硒可以减弱谷胱甘肽过氧化酶的作用,通过过强的氧化应激反应加重低T3综合征。危重老年患NTIS与血清硒水平降低相关,血清硒水平越低,甲状腺功能紊乱越严重。
(二)5′-单脱碘酶活性降低和甲状腺激素代谢障碍引起的NTIS
饥饿、手术应激、应用糖皮质激素、糖尿病、严重感染等都可减弱1型脱碘酶的活性。类似的情况尚见于胎儿、新生儿、老年人、营养不良、肝肾功能不全、使用抗甲状腺药物、普萘洛尔、碘剂等,出现低T3综合征。导致NTIS血清T3、rT3及TSH变化的因素见表3,一般认为与以下几种因素有关。
表2 非甲状腺性病态综合征病因

表3 引起非甲状腺性病态综合征甲状腺轴激素变化的因素

注:MDI:单脱碘酶;CMPF:3-羧基-4-甲基-5-丙基-2-呋喃丙酸;FFA:非酯化脂肪酸;TBG:甲状腺结合球蛋白
1.5′-单脱碘酶活性降低
一些药物如糖皮质激素、普萘洛尔、胺碘酮可抑制5′-单脱碘酶活性。细胞因子如IL-1β、IL-6、TNF-α、IFN-γ 等亦可抑制其活性。 NTIS 患者血清中含有5′-单脱碘酶抑制物,使T4向T3的转化障碍,T3生成率(PR-T3)下降;rT3清除延迟,而每日 rT3的生成率(PR-rT3)正常,故血 rT3升高。
2.甲状腺激素代谢障碍
用示踪物做甲状腺激素的合成、分泌与代谢研究发现,甲状腺激素由高特异性、高亲和性和低结合力的甲状腺激素转运体(52~62kD)携带而进入靶细胞;除垂体组织外,其他组织转运每一种甲状腺激素的甲状腺激素转运体都是专一的,但都依赖于细胞的能量供应(如细胞膜内外的钠离子梯度)。在急性疾病情况下,将T4转运进入T3生成细胞的能力下降,因而使血清T3浓度降低,导致低T3综合征。
3.组织摄取甲状腺激素受抑制
NTIS患者血中胆红素和非酯化脂肪酸常增加,这些物质使肝脏摄取减少,但不影响TSH的分泌。此外,空腹时,肝细胞的ATP生成减少也可使T3和T4的摄取和外周组织的T3生成下降。
4.T 4与血白蛋白结合受抑制
呋塞米、NSAID等可抑制T4与结合蛋白(TBG、前白蛋白、白蛋白)结合,因此血TT4下降,但FT4仍正常。
5.下丘脑-垂体-甲状腺轴功能改变
饥饿时,下丘脑室旁核的TRH mRNA生成减少,TSH的夜间脉冲释放减少,甚至血清TSH下降,予以TRH治疗可使血TSH增加。
6.细胞因子的作用
IL-1、IL-6、TNFα及 IFN-γ抑制TSH、Tg、T3和 TBG的合成与分泌,并下调5’-单脱碘酶 mRNA及T3核受体的表达。注射TNFα、IFN-γ或IL-6在几小时内会造成血T3降低,rT3上升,TSH下降。细胞因子和免疫因子对甲状腺激素合成与分泌的影响可以是原发因素,也可能是其他病理生理过程的继发性反应。
(三)NTIS的临床类型
NTIS时血T3降低,血TSH正常或降低,甲状腺功能被抑制。一些资料提示 NTIS时TSH的合成、分泌、调节及其作用均有异常。当NTIS恢复时,血TSH暂时增加说明在NTIS时TSH是受抑制的。这和NTIS时处于应激状态,伴皮质醇和儿茶酚胺升高及热能耗竭有关,可以认为是机体的一种保护性反应。下丘脑的TRH主要受T3/T4的调节,其调节方式是T3β2受体和磷酸化的cAMP反应元件结合蛋白与TRH基因结合位点的竞争。NTIS时,虽然血T3降低,但下丘脑的TRH神经元表达的TRH因CREB的竞争和其他调节因子(regulatory factors)的作用而下调,故引起TSH降低。这些调节因子包括由弓状核(arcuate nucleus)分泌的黑色素刺激素 α(α-MSH)、可卡因或苯丙胺调节性转录因子(cocaine-and amphetamine-regulated transcript)、agouti-相关蛋白(agouti-related protein)及神经肽Y(NPY)。
NTIS时,甲状腺功能改变有如下解释:①血甲状腺激素低下时间短而不严重;②临床轻度甲减诊断不敏感;③机体组织对T3敏感性增加;④机体存在T3以外的活性甲状腺激素(硫酸-T3);⑤低T3血症对TSH的影响减少;⑥NTIS时T3受体数量及亲和力增加。
1.低T 3综合征
是NTIS的最常见类型。在急性病变后2~24小时就可出现血T3下降,rT3升高。在中等严重病情的患者中,血T4在正常范围内。由于蛋白与激素的结合降低对T4的影响甚于T3,故FT3/T4的比例或FT4常增加。血TSH及其对TRH的反应一般正常。低T3综合征时的血TSH的诊断意义不同于甲亢和甲减,NTIS的血TSH波动范围可达0.2~10mU/L,因此必须结合T3和测定来综合判断。若存在上述引起低T3综合征的原发病因,血TT3降低,FT3正常或降低、血清rT3升高,血清TSH和TT4正常,FT3增高或正常,游离T4指数增加,一般可诊断低T3综合征。
2.低T 3/T 4综合征
血TSH反映低T3/T4综合征的病情。患者血清T3和T4均降低,FT3、FT4和TSH正常或降低。部分患者血TBG减少,蛋白与T3、T4的结合降低明显;部分病情严重者血TSH明显降低,TSH对TRH的反应迟钝。血TT4、FT4和TSH降低提示腺垂体功能被抑制,可能与IL-1、IL-2、IL-6、TNF-α、INF-α 等对垂体的作用有关。 虽然血 T3和T4减少,但因疾病严重时其降解减弱,血rT3仍然升高。基础疾病好转后,TSH可升高,直至T4和T3血浓度恢复正常。血清T3和T4降低的幅度与患者预后有关。若患者存在严重的消耗性疾病(如肝硬化、肾功能不全、烧伤、重症感染、长期饥饿、神经性厌食、重大手术后、恶性肿瘤等),血 TT3和FT3均降低,FT4正常或降低。血TSH正常或正常低值,rT3正常或升高,TBG正常或正常低值,TRH兴奋试验正常或呈反应迟钝,可诊断为低T3/T4综合征。
3.高T 4综合征
常见于重症肝胆疾病,此时血FT4和TT3可能正常,FT3正常低值或降低,但血清rT3升高。用胺碘酮治疗或用含碘口服胆囊造影剂者,血清FT4常升高,这些药物降低肝脏摄取T4并降低T4向T3转化,在自主性甲状腺结节患者中可诱发甲亢。一般剂量的口服胆囊造影剂对其影响不足24小时。血清TT4和FT4升高的NTIS患者(尤其是服用碘剂者)应仔细检查有无甲亢。因为药物或疾病本身对周围T4向T3转化有影响,血清T3正常或降低,但在疾病过程中TT4可突然升高。有些患者在疾病的急性期,血TT4升高,FT4升高或正常,TT3正常,FT3正常低值或低于正常,血清rT3升高应疑为高T4综合征(在老年女性患者中较常见,大多有服用含碘药物病史),但应注意与T4型甲亢相鉴别。
4.低TSH/T 4/T 3综合征
无论是何种类型的NTIS都只在非甲状腺疾病严重时发生,一般当系统性疾病控制后自然消失。慢性重症疾病时,NTIS的持续时间可能很长。急性重症疾病时,NTIS(特别是血T4降低和rT3升高的幅度)对疾病的预后判断有重要价值。在NTIS中,血T4或T3低下预示肝硬化、晚期充血性心力衰竭及其他严重的全身性疾病的死亡率增加。而血T4低下同时伴显著降低的血T3患者预后最差。血T4<38.7nmol/L的患者死亡率达68%~84%。多数重度低T4综合征者于2周内死亡(70%),若T4<25.8nmol/L,1个月内全部死亡。
(四)鉴别诊断
1.血TSH降低的鉴别
NTIS的最重要特点是血清TSH降低,因而NTIS的鉴别其实就是低TSH血症的鉴别,在临床上,遇到TSH降低时,不能仅根据下丘脑-垂体-甲状腺的长负反馈原理而武断为甲亢或NTIS,仅仅在该两种情况之间进行鉴别,因为许多临床情况和药物均可导致血清TSH降低,如中枢性甲减、甲状腺炎、TSH非平衡状态、药物、HCG升高等,甚至偶尔亦见于正常人。
2.与原发性或继发性甲减的鉴别
详见本章第13节。在NTIS中,T3、T4异常的严重性预示着患者的预后。血清T3低下预示肝硬化、晚期充血性心衰及其他严重的全身性疾病的死亡率增加(血T4低下的意义相同)。而血清T4降低同时伴随显著降低的血T3的患者预后最差。NTIS患者的甲状腺疾病诊断有一定困难,这时的甲亢患者血TT4和TT3可能正常,然而血FT4和FT3仍有诊断价值。甲亢时血TSH多不可测得(<0.10mU/L)。但在NTIS中仅7%以下的患者TSH不可测得(常见于多巴胺和糖皮质激素治疗患者)。在NTIS中,临床型甲减也难以诊断。如果TSH在25~30mU/L以上极可能为原发性甲减,约12%的NTIS患者TSH在正常以上,不足3%NTIS患者的TSH在20mU/L以上。未用抑制TSH分泌药物的NTIS患者,血FT3降低强烈提示为甲减,但rT3对甲减诊断无帮助。继发性甲减的血TSH可能降低、正常或轻度升高。如果NTIS患者无垂体或下丘脑疾病,血皮质醇常正常或升高,而血PRL和促性腺激素正常。相反,如果血皮质醇、促性腺激素降低而PRL升高则支持中枢性(垂体或下丘脑性)损伤。NTIS患者的甲状腺疾病诊断最好在急性恢复后进行。
3.亚临床型T 4甲亢
多数甲亢患者虽然血清T3和T4均增高,但血T3增高较明显。提示甲亢时甲状腺释放较多T3及末梢组织将T4转化为T3增加。T4型甲亢是指血清有较明显增高,而血T3大致正常为特点的一种甲亢类型,主要见于既往过多暴露于碘的老年人。若无过量碘摄入史,多提示外周组织T4转化为T3受抑制,而高综合征时血rT3升高,TSH正常可资鉴别。
(一)肾病综合征
甲状腺和肾脏关系密切,两者都能清除血浆碘;当甲状腺清除碘的能力降低时,肾脏能加强对碘的清除,反之亦然。慢性肾衰时,血浆碘和甲状腺摄碘率升高。事实上,这些患者的甲状腺功能正常(FT4正常),甲状腺摄碘率正常或升高,甲状腺对TSH的反应和腱反射恢复时间亦正常。TT4降低可能与下述因素有关:①大量蛋白尿,使甲状腺结合球蛋白(TBG)丢失;②每天经尿排出的T4和T3显著高于正常人;③合并垂体或甲状腺疾病,使机体丧失代偿能力。血清rT3常在正常范围内,大多数患者没有甲状腺肿,偶见血TT4和TT3明显降低,大量蛋白尿时血清TSH轻度升高,可伴甲状腺肿大。
(二)慢性肾衰竭
肾衰竭对甲状腺功能有多种影响。T4的脱碘障碍使血T3下降。正常人T4向T3的转化率为37%,而肾衰竭的非透析治疗患者可下降至13%~16%。肾移植后,可上升至34%,血清T4降低,与肾功能损害的严重程度一致。T4向rT3转化不增加,rT3常在正常范围或轻度增加。通常TT4轻度降低或正常(偶可增高),可能是肝素抑制与蛋白质结合的结果。慢性肾衰竭者血TSH正常或不能测到,TSH对TRH的反应延迟。低蛋白和低磷饮食有利于降低TNF-α,防止NTIS的发生。
(三)透析治疗
在透析开始阶段,血清T4正常,但长期接受透析后,血清TT3和FT3均下降。Dandone等报告一组12例血液透析长达3年以上的患者,3例的血T4下降、TSH上升,表现为临床型甲减。腹膜透析更易引起甲减,因腹膜透析更易丢失与蛋白结合的T3、T4、碘和其他小分子激素。Afand等观察到,接受血液透析和体外循环冠状动脉旁路移植术的患者,手术中的血浆TBG和甲状腺素转运前白蛋白(transthyretin)可丢失40%以上,同时伴血清T4下降,多数患者于术后逐渐恢复。TBG和TTR下降的原因未明,手术中下降的速率很快,不能用TSH抑制来解释。TBG是丝氨酸蛋白酶抑制剂(serpin)中的一种,可能是其在手术中消耗过多所致。
(四)肾移植后
肾移植后,血TBG上升,TT4恢复正常,由于T4向T3转化正常,血清T3上升,但TSH对TRH不敏感,可能是糖皮质激素治疗抑制了TSH对TRH的敏感性。
(五)肝损害
肝脏通过多种途径影响甲状腺功能:①肝脏的T4脱碘降解作用减弱。②肝脏是合成白蛋白、TBG和TTR的场所。因此,甲状腺激素在血液中运输也受肝脏的影响。③肝脏摄取T4并释放T4、T3入血。门脉性肝硬化患者的甲状腺功能变化取决于患者肝功能的代偿程度。肝硬化患者T4向T3的转化率仅15.6%,导致TT3下降,FT3正常或轻度降低,而rT3常升高。血清TT4可正常或轻度下降。TBG的变化不恒定。与其他低T3或低T4综合征不同的是,肝硬化的TSH常升高,其程度与T3下降无关,临床上无甲减表现。
(六)糖尿病
在糖尿病动物及糖尿病患者中均发现血T4、T3下降,rT3增加,而且 T3下降的程度与一些代谢物(酮体、pH值及碳酸氢根浓度)的异常程度相关。血清T3/T4比值下降,与血糖成反比,并随饮食控制和胰岛素治疗后的病情改善而上升。一般认为,血T3下降与rT3的上升是由于T4易于向rT3转化,从而 T4向T3的转化减少。Pittman发现,高血糖对甲状腺激素的脱碘有抑制作用。在正常人,33%的T4通过非脱碘途径降解,其余77%需脱碘降解,其中35%形成T3,42%形成rT3;但在糖尿病时,T4通过非脱碘降解上升到47%,而脱碘形成T3的百分率下降至6.8%~12%。4%~17%的糖尿病患者易并发原发性甲减,多见于老年女性,其特点与低T3或T4综合征不同。血rT3下降,而TSH升高,T3降低明显,抗甲状腺自身抗体常为阳性。糖尿病酮症酸中毒时TSH对TRH反应消失,治疗恢复后的反应仍迟钝。血TSH降低影响Tg的水解,导致血清T4下降。实验证明,糖尿病的T3受体数目也下降,但T3对组织的结合力与正常人并无差别。
(七)心肌梗死和脑血管意外
血清T3和rT3的变化与心肌梗死面积、并发症及谷草转氨酶(GOT)升高的程度有关,而且梗死早期和后期的甲状腺功能变化不同。在梗死最初24~48小时内,血T4可正常、升高或降低,T3恒为降低,rT3上升。急性心肌梗死6~7天后,随病情进展,血TSH和T4上升。血rT3与预后有关,有并发症的心肌梗死者,T3和rT3迟迟不能恢复正常。死亡者的rT3常达最高水平。除病变本身的严重程度外,热量限制、肾上腺糖皮质激素、普萘洛尔、胺碘酮、洋地黄的使用均会影响T3和rT3的血清水平。脑血管意外也是NTIS的常见病因。
(八)恶性肿瘤
其原因是:①受体结合力下降;②甲状腺激素脱碘加强,因而从血中清除加快;③下丘脑和垂体对降低的T3、T4缺乏正常反应,故TSH不能随之上升。低T3综合征需与消耗性甲减鉴别,后者的血TSH是升高的。乳腺癌患者血TSH有升高倾向,血清T3下降,晚期乳腺癌和结肠癌患者rT3升高。肺癌患者伴甲状腺功能异常者占33%,最显著的变化为血清T3下降,其预后较差。恶性淋巴瘤也伴有T3下降。
(九)急性传染病
通常有血T3、T4下降,TSH正常,T3下降的程度与体温升高的程度成正比,但患脑膜炎和伤寒时,血TT4轻度上升。T3、T4下降的原因可能是TSH对甲状腺刺激减弱,甲状腺激素分泌减少,T4降解加速及甲状腺激素与转运蛋白结合受抑制。严重感染时,热能供应不足也影响甲状腺功能,发热和应激均能抑制TSH。Wartofsky等发现,患疟疾时,TSH对TRH的反应正常,而泌乳素对TRH反应增强,说明垂体贮备功能正常,但下丘脑功能有缺陷。
一些无症状的HIV感染患者,血清T4和TBG升高,血T3正常,而rT3下降,TBG增高与HIV感染的进程呈正相关,而与T3摄取呈负相关。与其他重症慢性疾病一样,在感染HIV的同性恋患者中,随着HIV感染的进展,甲状腺激素合成、转换及转运异常,导致血清FT4、FT3下降,TBG无明显变化。动物实验表明,细胞因子如IL-1β、TNF-α可能介导这些变化,同时,IL-1β亦可导致血TSH降低。AIDS终末期患者特别是合并严重感染及消瘦的患者,TT3、FT3明显下降甚至测不到。在临终的HIV感染患者中,血TT4、TT3、FT3和白蛋白明显下降,TSH正常或轻度受抑制。HIV感染者约16%出现NTIS,其发病机制包括下丘脑-垂体-甲状腺轴功能紊乱,甲状腺激素合成和分泌异常以及甲状腺激素周围转换与作用失常。甲状腺激素代谢的改变(如T4、T3及rT3动力学)包括T4向T3的转换,rT3的清除,甲状腺激素向靶细胞转运的受限等。血清抑制物(非酯化脂肪酸、急性期蛋白、细胞因子等)在 NTIS 的发病中起着重要作用,例如 IL-1、TNF-α、IFN-γ能抑制碘的有机化、甲状腺激素的释放和TSH的分泌。
(十)老年人
老年卧床患者中NTIS组在贫血发生率、贫血程度、白蛋白水平、鼻饲进食上与对照组有显著差异。老年卧床患者NTIS发生率更高,蛋白质热能营养障碍是NTIS高发的主要原因。
NTIS代表的是机体对应激事件的一种保护性反应(protective reaction),故一般不必治疗;但是TNTIS有可能是机体的非适应性反应(maladaptive response),那么就有治疗的理论基础。因此,有关NTIS的治疗问题仍存在较多争论。在某些情况下,给予甲状腺激素替代是有益处的,如热量限制、心脏疾病、急性肾衰竭、脑死亡的器官捐献者或烧伤患者。高红梅等小剂量左旋甲状腺素治疗扩张型心肌病伴甲状腺功能正常的病态综合征有效。在一般情况下,治疗似乎无害但也没有足够的依据证明治疗有益。慢性疾病患者可应用TRH改善物质代谢,恢复腺垂体TSH的脉冲分泌,但目前的依据仍不足。
NTIS的突出病理生理特点是甲状腺功能被抑制,这是机体的一种自我保护性反应,有利于降低机体的基础代谢率和氧消耗。当NTIS恢复时,甲状腺功能可完全恢复正常。低T3综合征亦常见于老年人,这些人可无急性重症并发症,其原因未明,一般不必治疗。
Brent曾观察11例严重NTIS患者服用L-T4,并以12例患者作为对照,两组死亡率无区别,认为补充甲状腺激素无效。同样在婴儿呼吸窘迫综合征中,L-T4对降低死亡率、改善神经发育及体重没有差别,可能与患者不能将补充的T4转化为T3有关,但补充T3的对照试验也不能证明这一点。有人观察142例接受冠状动脉旁路移植术的患者,术前血T3正常,手术开始30分钟后,血T3下降40%,静脉输入T3后,血T3上升,术后又恢复正常。术后输入T3的患者心脏指数高于对照组,周围血管阻力低于对照组,但两组心律失常的发生率和死亡率无差别。故不主张用L-T4治疗。
但是,如果存在以下情况,可以试用L-T3:①证明或怀疑有明显甲状腺功能减退,特别是出现甲减的相应临床表现,如低体温时;②血清T3、T4明显下降,而TSH升高时。一般考虑给予T425~50μg/d,分次服用,治疗中每天监测血TSH、T3、T4、FT3和FT4,调整剂量使血T3达到正常低值,待原发疾病稳定或急性应激解除后,重新评价甲状腺功能。













