英文名称 :gigantism and acromegaly
巨人症(gigantism)和肢端肥大症(acromegaly)是垂体持续分泌过多生长激素,导致软组织、骨骼及内脏的增生肥大、代谢紊乱等的综合征。95%以上由垂体生长激素腺瘤导致。临床上表现为嘴唇增厚、鼻翼增大、手脚增粗、头痛等。在青春期前发病者,因骨骺未闭合,表现为巨人症;而成人发病者表现为肢端肥大症。垂体生长激素腺瘤占全部垂体瘤的10%左右,发病无明显性别差异。文献报道肢端肥大症患病率为28/100万~134/100万,发病年龄以31~50岁多见。导致肢端肥大症和巨人症的罕见病因包括下丘脑或异位GHRH过度分泌、异位垂体腺瘤、分泌生长激素的其他肿瘤、纤维性骨营养不良综合征(McCune-Albright综合征)及多发性内分泌腺瘤病1型。在混合性垂体瘤中,GH与PRL的混合瘤最常见。
垂体生长激素细胞腺瘤属于良性肿瘤,腺癌罕见。95%的垂体生长激素腺瘤属于散发。近年发现,在约40%的生长激素腺瘤中,存在GNAS1基因的体细胞突变,该基因编码兴奋性三磷酸鸟苷(GTP)结合蛋白α亚单位(Gsα),使GH的合成和分泌增加。该基因突变也见于McCune-Albright综合征,患者也会出现GH分泌过多的表现。约30%的家族性肢端肥大症与AIP基因的生殖系突变有关,在散发的肢端肥大症中,AIP基因突变的比例为5%~10%。低龄儿童发病的X连锁的肢端巨人症(X-linked acrogigantism,XLAG)极罕见,与 GRP101基因的微重复有关。
根据病理可将生长激素瘤分为四种类型:致密颗粒型GH腺瘤、稀疏颗粒型GH腺瘤、GH细胞与PRL细胞混合型腺瘤及巨生长激素细胞型腺瘤。致密颗粒型GH腺瘤起病隐匿,发病年龄晚,肿瘤体积小并生长缓慢,对生长抑素类似物的反应好;稀疏颗粒型GH腺瘤多年轻时发病,细胞增殖活跃,肿瘤体积大并易侵袭,分泌GH旺盛,对生长抑素类似物不敏感,易复发,预后较差。GH细胞与PRL细胞混合型腺瘤临床同时分泌GH与PRL,GH细胞呈致密颗粒型,而PRL细胞呈稀疏颗粒型。巨生长激素细胞型腺瘤的特点是GH与PRL同时存在于一个细胞的同一颗粒内,常见于巨人症,除生长激素显著升高外伴有轻微升高的PRL。
在持续高GH和IGF-1的作用下,多个脏器体积增大,包括甲状腺、心、肝、肺、肾、脾等,肠壁肥厚,淋巴组织增生。骨骼系统病变常颇明显,有下列特征:巨人症的长骨增长,肢端肥大症的长骨骨骺部加宽,外生骨疣。肢端肥大症患者颅骨增厚,以板障为著,颧骨厚,枕骨粗隆增粗突出,下颌骨向前下伸长,指(趾)端增粗而肥大。脊柱骨软骨增生,骨膜骨化,骨质常疏松,引起脊柱骨楔状畸形,腰椎前凸与胸椎后凸而发生佝偻。
持续高生长激素与肝脏上的生长激素受体(growth hormone receptor,GHR)结合,促进胰岛素样生长因子-1(IGF-1)合成,因此巨人症和肢端肥大症患者血浆中GH和IGF-1水平都显著高于正常同龄人。GH作为影响代谢的重要激素,对脂肪、葡萄糖和蛋白质代谢都有诸多影响。GH促进脂肪动员分解和脂肪酸氧化,促进LDL的清除;肢端肥大症患者甘油三酯升高,其他血脂谱的变化报道不一。GH可直接或通过拮抗胰岛素的作用而影响葡萄糖的代谢,包括抑制葡萄糖的氧化和利用、促进肝脏葡萄糖的合成,因此肢端肥大症患者易合并高血糖。GH促进氨基酸的摄取和蛋白质的合成代谢,减少蛋白质的氧化分解。
部分肢端肥大症患者可合并高催乳素血症,以及肿瘤的占位效应导致性腺轴、甲状腺轴、肾上腺轴功能低下,患者可有相应的临床表现。
治疗目标是要降低疾病相关的致残率,使死亡率恢复到正常人群水平。即通过安全的治疗手段,减轻肿瘤造成的不良影响或消除肿瘤,GH和IGF-1恢复至正常,并避免垂体功能减退。目前公认的治愈标准为:①口服葡萄糖抑制试验GH谷值<1.0μg/L;②IGF-1恢复到与年龄和性别相匹配的正常范围内;③影像学检查肿瘤消失,无复发。目前主要治疗手段包括手术治疗、药物治疗和放射治疗。
(一)手术治疗
外科切除腺瘤是多数患者的首选治疗,主要包括经蝶和经额两种入路的垂体瘤切除术。微腺瘤的治愈率约90%,大腺瘤的治愈率50%~60%。软组织肿胀在肿瘤切除后迅速得到改善。GH水平在术后1小时内即降到正常水平,IGF-1水平在3~4天内恢复正常。约10%的患者在手术全切后数年复发;垂体功能低下发生率达15%。术者的经验与手术疗效、并发症的发生直接相关。手术并发症包括尿崩、脑脊液鼻漏、出血、视神经损伤、脑膜炎及垂体功能减退。
(二)药物治疗
1.生长抑素类似物(SSA)
该类药物包括奥曲肽、长效奥曲肽、兰瑞肽及帕瑞肽。作用机制为结合生长抑素受体(SSTR,以SSTR2和SSTR5为主),抑制GH的分泌和细胞增殖。其临床疗效包括抑制GH和IGF-1水平,改善头痛和肢端肥大症状、缩小瘤体等。该类药物的生化达标率为50%~60%,部分患者对该类药物不敏感,年龄(<20岁)、肿瘤体积大、病理稀疏颗粒类型、肿瘤SSTR2低表达及AIP基因突变是SSA不敏感的相关因素。快速奥曲肽抑制试验能有效预测药物敏感性,患者在注射100μg奥曲肽后如GH下降超过90%,提示对药物敏感。
(1)奥曲肽长效制剂(octreotide LAR):
作用时间较长。每次肌内注射20mg,每28天注射1次。
(2)兰瑞肽:
作用时间约为14天。每次40~60mg,每2周注射1次,如生化不达标,可将注射间期缩短至7~10天。
(3)帕瑞肽:
是新一代的生长抑素类似物,有长效和短效制剂。其对 SSTR1、SSTR2、SSTR3及 SSTR5都有较强的结合力,因此对GH瘤的抑制作用比第一代奥曲肽更强。
多数患者对生长抑素类似物耐受性良好。不良反应多是短期的,且多数与生长抑素抑制胃肠活动和分泌相关。恶心、腹部不适、脂肪吸收不良、腹泻和肠胃胀气发生于1/3的患者,这些症状多在2周内缓解。奥曲肽抑制餐后胆囊的收缩,延缓胆囊的排空,高达20%的患者长期治疗后发生胆囊泥沙样回声或无症状的胆囊胆固醇结石。另有10%患者发生心动过缓。
2.GH受体拮抗剂
培维索孟(pegvisomant)是GH受体拮抗剂,能阻断GH受体二聚体的形成,从而阻止GH的外周作用,使IGF-1水平降至正常。但对肿瘤体积没有减少作用,应使用IGF-1作为评估疗效指标。该药可单用于对SSA类似物抵抗或不耐受者,以及单独使用SSA不能完全缓解的患者联合使用。
3.多巴胺激动剂
该类药物对于GH的分泌也有一定抑制作用,常用于GH和IGF-1轻度升高的患者,剂量较大,约20%患者可达到生化缓解。溴隐亭还可改善糖代谢,美国食品药品监督管理局(FDA)批准溴隐亭速释片治疗2型糖尿病。合并糖尿病的肢端肥大症患者口服溴隐亭后糖代谢可改善。
(三)放射治疗
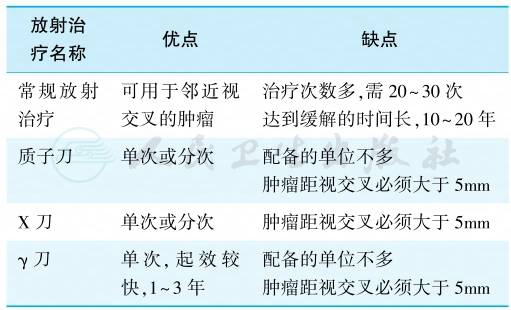
包括常规放射治疗、质子刀、X刀和γ刀,表1概括了不同方法的优缺点。放射治疗常作为辅助治疗手段。放射治疗起效慢,50%的患者需要至少8年才能使GH水平降到5μg/L以下;18年后有90%的患者能够抑制到此水平,但是GH抑制欠佳。在放射治疗效果达到最大之前,患者可能需要数年的药物治疗。多数患者还可发生下丘脑-垂体损害,在治疗后10年内发生促性腺激素,ACTH和/或TSH不足。有生育要求的患者不适合放射治疗。放射治疗的并发症主要包括脱发、脑神经麻痹、肿瘤坏死出血,垂体功能减退,偶尔可发生失明、垂体卒中和继发性肿瘤。
本症患者须长期随访。手术治疗后,患者应每3个月一次接受随访直到生化水平得到控制。其后,每半年进行一次激素评估。达到治愈标准的患者,每1~2年进行一次MRI检查。对于未能达到治愈标准的患者或需要激素替代治疗的患者,应每半年进行一次视野检查和垂体储备功能检查,每年进行一次MRI检查,并对临床表现、内分泌代谢表现进行评估。对年龄超过50岁的患者和患有息肉病的患者应进行乳房检查和结肠镜检查。
表1 几种不同的垂体放射治疗的比较
垂体生长激素瘤治疗流程见图4。
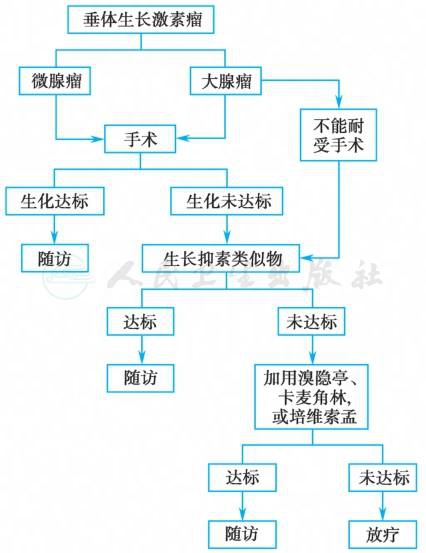
图4 垂体生长激素瘤治疗流程













