英文名称 :syndrome of inappropriate AVP secretion
中文别名 :Schwartz-Bartter综合征
抗利尿激素(arginine vasopressin,AVP;antidiuretic hormone,ADH)不适当分泌综合征(syndrome of inappropriate AVP secretion,SIADH)又称Schwartz-Bartter综合征,是由于AVP过量分泌导致体内水分潴留、稀释性低钠血症、尿钠与尿渗透压升高的临床综合征。SIADH的起病隐匿,多继发于呼吸系统疾病、肿瘤、炎症、药物应用或外科手术。
机体排泄过多水的能力取决于肾功能、肾血流灌注和AVP分泌的抑制因素。在低血容量状态下AVP适当分泌,而此时的血容量降低可能明显或不明显,当血容量的维持建立在损失血浆渗透压基础上(或维持血容量以降低血渗透压为代价)时,正常血容量或高血容量状态下的AVP分泌即为“不适当”。胃肠炎所致的失水为低血容量性,引起AVP分泌是适当的,而脑损伤、疼痛、应激和药物引起的AVP分泌则是“不适当”的。例如,发生低钠血症的原因可能是适当抗利尿激素分泌(appropriate antidiuretic hormone secretion,SAADH)抑或不适当抗利尿激素分泌(inappropriate antidiuretic hormone secretion,SIADH),但临床上以SAADH更常见。
除罕见的AVP受体活化性突变引起自主性AVP分泌和少数SIADH始终无明确病因(特发性)外,绝大多数SIADH患者均有导致SIADH的明确病因。一般可将SIADH的病因分为两类,一是主要通过AVP分泌过多引起的SIADH(一般病情较重),二是主要通过渗量感受器、牵张感受器和容量感受器、压力感受器调节引起的SIADH(一般病情较轻)。但是,不少患者可能同时兼有两种原因。
(一)肿瘤引起SIADH
多种肿瘤可异源性分泌AVP,以小细胞型肺癌、原发性脑肿瘤、血液系统恶性肿瘤、胸腔内非肺部癌肿、皮肤肿瘤、胃肠道癌肿、妇科癌肿、乳腺癌、前列腺癌及各种肉瘤相对多见。胸腺神经母细胞瘤、腹膜乳头状癌、淋巴瘤相关性噬血细胞综合征、非小细胞型肺癌伴多发性旁癌综合征(multiple paraneoplastic syndrome)也可引起SIADH。
肺组织内散在分布着特殊类型的神经-内分泌细胞,它们起源于胚胎期前肠膨出部的外胚层,与肠道上皮的嗜银细胞(kutchitsky 细胞,K细胞)相似。临床上,起源于该细胞的肿瘤具有胺前体摄取和脱羧基化作用,常引起皮质醇增多症、肥大性关节病、AVP分泌过多症、成年男性乳腺增生等。小细胞肺癌(small cell lung cancer,SCLC)包括燕麦细胞型、中间细胞型和复合燕麦细胞型3种。癌细胞类似于淋巴细胞,胞质含神经内分泌颗粒,可分泌AVP、5-羟色胺、儿茶酚胺、组胺、激肽、ACTH、PTH、PTHrP、降钙素、胰岛素原样物质、生长激素释放激素(GRH)、血管活性多肽(VIP)等,引起类癌综合征(carcinoid syndrome)。SCLC易于侵犯血管和早期转移到肺门和纵隔淋巴结,生长快,远处转移早,因此在初次确诊时,60%~88%的患者已有脑、肝、骨、肾上腺转移。SCLC细胞在支气管镜活检时极易受挤压而变形,但对放疗和化疗较敏感。SCLC引起的旁癌综合征有以下几种,部分患者因多尿症状明显而需要与SIADH鉴别。
1.AVP不适当分泌综合征
发生率7%~12%。常表现为低钠血症和低渗透压血症,出现倦睡、易激动、定向障碍、癫痫样发作或昏迷。诊断依据为低钠血症、低渗透压血症和尿钠排出持续增加,水负荷试验显示摄入水量等于排出水量,尿渗透压增高,血肾素活性、肾功能、甲状腺功能和肾上腺皮质功能正常。
2.异位CRH/ACTH综合征
约70%的患者血ACTH增高,但文献报告有异位CRH/ACTH综合征者仅1%~3%,Cushing综合征表现(如色素沉着、水肿、肌萎缩、低钾血症、代谢性碱中毒、高血糖或高血压等)多不典型,向心性肥胖和紫纹罕见。
3. 神经-肌肉综合征
为非转移性神经肌肉病变,可发生于肺癌出现前数月甚至数年。常见多发性周围神经病、重症肌无力、肌病和小脑变性等。肌无力综合征(Lambert-Eaton myasthenic syndrome)多见于SCLC,与神经末梢乙酰胆碱释放缺陷有关。临床上表现为随意肌肌力减退,早期侵犯骨盆带肌群及下肢近端肌群;反复运动后肌力可暂时改善。70%以上的病例对新斯的明试验反应欠佳;肌电图低频反复刺激显示动作电位波幅递减,而高频刺激时引起暂时性波幅增高,根据该特点可与其他肌病区别。
4.高钙血症
肿瘤细胞分泌甲状旁腺素相关肽(PTHrP),可激活破骨细胞活性和前列腺素E2,引起高钙血症。轻症者表现为口渴和多尿,重症者有恶心、呕吐、便秘、嗜睡和昏迷等。
5.促性腺激素分泌综合征
分泌促性腺激素者引起男性乳腺发育,常伴有肥大性肺性骨关节病。
6.类癌综合征
因5-羟色胺分泌过多引起类癌综合征,表现为哮鸣样支气管痉挛,皮肤潮红、水样腹泻、阵发性心动过速等。
(二)颅内病变导致SIADH
颅内病变局部刺激引起AVP分泌过多,引起的SIADH病情均较轻。病因一般可分为以下3类。
1.脑外伤与颅内手术
可直接兴奋下丘脑-神经垂体轴,引起AVP过度释放。儿童患者发生SIADH的主要病因是颅内疾病或外伤。
2.脑肿瘤
肿瘤造成脑损害,引起AVP渗透压调节机制紊乱,虽然渗透压值已降低,但仍有AVP释放;多数肿瘤致SIADH经手术、放疗或化疗后病情可缓解。Berghmans等对106名恶性肿瘤患者的低钠血症进行分析,发现由SIADH引起者约占1/3。
3.颅内非肿瘤性病变
主要见于颅内炎症,如结核性或化脓性脑膜炎、脑脓肿、脑炎、急性感染性多发神经炎。急性脑炎引起的SIADH常属暂时性SIADH。如下丘脑-神经垂体遭到破坏,可引起AVP漏出,或胸腔内容量感受器兴奋,使迷走神经不能正常地将神经冲动传导到中枢(肿瘤累及迷走神经或发生多发性神经炎)等情况下也可发生SIADH。血肿、蛛网膜下隙出血、脑血栓形成、脑萎缩、小头畸形、系统性红斑狼疮、中枢神经系统肉芽肿性血管炎及各种剧烈的精神刺激、剧痛、正压呼吸都可引起SIADH。
下丘脑-神经垂体通路病变(颅内出血、炎症或颅压升高)破坏下丘脑-神经垂体通路的细胞通透性,使AVP的释放不依赖于血浆渗透压的变化,AVP分泌过量。此外,δ氨基乙酰丙酸脱水酶缺陷性卟啉症(delta-aminolevulinic acid dehydratase deficiency porphyria)、急性特发性全自主神经功能异常(acute idiopathic pandysautonomia)患者的下丘脑同时受损时可引起SIADH。淋巴瘤相关性噬血细胞综合征(lymphoma-associated hemophagocytic syndrome)患者血IL-1β和INF-α显著升高,刺激AVP分泌,导致SIADH。SIADH还可伴有异位CRH/ACTH分泌综合征。
(三)药物引起SIADH
应用各种抗精神病药物(如选择性血清素再摄取抑制剂或抗癫痫药)常引起低钠血症和SIADH。卡马西平、氯贝丁酯(安妥明)、氯磺丙脲、选择性5-羟色胺再摄取抑制剂如帕罗西汀和氟西汀、舍曲林(瑟特灵,sertralin)、α-干扰素、长春碱、长春新碱、左旋苯丙酸氮芥、环磷酰胺、高剂量的塞替哌、全身麻醉药、巴比妥类、噻嗪类利尿剂、三环类抗抑郁药如氯米帕明(氯丙米嗪)、抗精神病药物、非甾体类抗炎药物、胺碘酮(乙胺碘肤酮)等都可引起SIADH。氯磺丙脲、卡马西平、氯贝丁酯可刺激AVP分泌。环磷酰胺等抗癌药也可刺激下丘脑释放AVP。淋巴瘤儿童在自体骨髓移植前进行骨髓化疗期间可发生SIADH。抗精神病药物诱导的神经阻滞剂恶性综合征(neuroleptic malignant syndrome)伴有下丘脑功能失常,导致AVP释放。血管紧张素转换酶抑制剂(如赖诺普利)可阻滞外周的血管紧张素-1(AT-1)向血管紧张素-2(AT-2)转换,但在大脑中却没有这一作用;过多的AT-1进入脑组织并转换为AT-2,后者刺激渴感中枢,使AVP分泌增加,导致低钠血症。
(四)渗量感受器/牵张感受器/压力感受器异常引起SIADH
1.肺部疾病
肺部疾病致SIADH的机制可能是:①胸内压增加、低氧血症和高碳酸血症引起肺小血管收缩,导致肺血管阻力增加,使肺静脉回心血量减少,兴奋左心房和颈静脉窦压力感受器,通过迷走反射刺激中枢,中枢“误判”为血容量减少而释放AVP;②低氧血症、高碳酸血症可通过外周化学感受器和压力感受器使AVP分泌;③感染的肺肉芽组织(如严重肺结核、结节病)可异位合成并释放AVP类物质。
2.慢性感染
Ohta等研究了4例SIADH导致的低钠血症患者,发现SIADH与炎症的关系密切。患者发热、血浆C反应蛋白(CRP)上升时血钠水平即下降,此时血浆IL-6与AVP亦上升。动物实验证实,静脉注射或脑室内注射IL-1β可升高血浆AVP、心房利钠肽(ANP)和ACTH,如预先静脉注射吲哚美辛(消炎痛),血浆ANP和ACTH则无此变化,静脉注射IL-1β可增加尿钠排泄。炎症时产生的IL-6可刺激AVP过量分泌,导致SIADH。此外,阿米巴性肝脓肿也可导致SIADH。
3.其他因素
引起SIADH的其他常见的原因有:①牵张感受器和容量感受器兴奋:严重中枢神经系统疾病和瘫痪状态时由于肢体运动减少,静脉回流障碍,左心房充盈不足,左心房内压力降低,导致牵张感受器兴奋,AVP释放引起肾脏对水的重吸收增强,产生水潴留与稀释性低钠血症。二尖瓣分离手术时,左心房压力迅速降低,影响容量感受器,促使AVP分泌。②压力感受器急性颈髓损伤:颈髓损伤患者常并发SIADH,其机制可能是自主神经功能调节障碍,有效血容量减低,经压力感受器的神经调节机制使AVP分泌增加,或颈椎颈髓损伤时视丘下部轻微损伤或受刺激使AVP分泌增加。③腹腔镜胆囊切除术和颈部手术可导致SIADH。④吸烟引起SIADH,随着年龄的增加,吸烟与SIADH的关系更为密切,但一般表现很轻微。⑤少数SIADH始终无明确病因(特发性),衰老、水负荷过多,低钠鼻饲可能是SIADH发病的危险因素。
由于SIADH的病因多种多样,临床上存在原发疾病的临床表现或药物应用、手术、损伤史。但SIADH的病程均较短,原发疾病的表现往往不明显。如SIADH系由中枢神经系统疾病所致,两者均可引起神经精神方面的表现,宜定时监测血钠、血渗透压、尿渗透压及尿钠排泄量等。
(一)血浆渗透压下降不能抑制AVP自主分泌
AVP不适当分泌(inappropriate secretion)的特点是:①低渗刺激时,AVP过量分泌导致低钠血症;②血AVP正常,但对渗透压来说已是相对性增高;③随机性AVP高分泌;④基础AVP分泌“不适当”,但对增高的渗透压的改变反应正常;⑤渗透压感受器的敏感性重调,低渗状态亦刺激AVP分泌;⑥血AVP降低或测不到,导致低钠血症的原因不在AVP,但具体因素不明。
(二)稀释性低钠血症伴非水肿性水潴留是SIADH的突出表现
稀释性低钠血症导致细胞水肿,容量扩张,肾小球滤过率增加,肾素与醛固酮分泌受抑,尿钠排泄增加,容量扩张时,心房利钠素分泌增加,促使尿钠排泄增加,钠代谢处于负平衡状态,低钠血症与血浆低渗状态加重。AVP使肾远端小管和集合管水通道开放,水顺渗透梯度进入肾间质,水重吸收增加,由此导致自由水清除率不适当降低,尿钠排泄量和尿渗透压不适当增加,导致稀释性低钠血症及血浆渗透压下降,大量水向细胞内转移。SIADH多继发于其他疾病,起病隐匿,症状和体征无特异性,易被忽视。临床上除原发疾病的表现外,存在由水潴留引起的循环扩张和低钠血症所致的水中毒表现,低血浆渗透压及低血钠时尿钠排泄仍持续进行,AVP的分泌不适当增多。
1.血液稀释
SIADH的临床表现取决于低血钠、低血浆渗透压的严重程度及其进展速度,以脑细胞水肿造成的功能紊乱最为明显。当水潴留、低钠血症发生缓慢、血钠≥120mmol/L时,临床上无明显症状,仅表现为少尿、体重增加。此时易将少尿归咎于脱水和循环不良,忽视了体重增加,盲目补充低渗液体,加快SIADH的进展,以致水在体内大量潴留,循环迅速扩张,发生急性肺水肿。患者可出现皮肤灰白、极度烦躁、呼吸增快、发绀加重及双肺啰音增多,用呋塞米(速尿)治疗症状可获改善。当血钠快速下降或≤120mmol/L时,可发生急性脑水肿;出现恶心、呕吐、易激惹或嗜睡、食欲不振、软弱无力、体重增加,严重时有意识改变、性格改变、木僵状态、精神失常、惊厥、昏迷,甚至发生脑疝,致中枢性呼吸衰竭而死亡。若在24小时内血钠急性降低至120mmol/L以下,成年患者死亡率高达50%。当血钠<110mmol/L时可有肌无力、腱反射减弱或消失;有时可呈延髓麻痹或假性延髓麻痹症,惊厥、昏迷甚至死亡。如果血钠缓慢下降,则表现为深反射减弱、全身肌无力、过度换气或阳性病理体征。
2.无水肿性水潴留
因为体内大量水潴留,SIADH还存在血液稀释的表现,临床上除低钠血症外,还可出现低肌酐血症、低尿素氮血症和低尿酸血症,血氯降低的程度与低钠血症一致。SIADH的另一重要特征是水潴留而不伴有组织间隙水肿,血压一般正常。这可能是由于当细胞外液容量扩张到一定程度时,心房利钠素释放增加,抑制钠的重吸收,尿钠排泄增多,所以不会出现水肿,但会进一步加重低钠血症和低渗状态。
3.急性脑水肿/肺水肿
长期水潴留的主要并发症是急性脑水肿,患者在逐渐加重的恶心、呕吐、食欲不振、软弱无力、体重增加基础上,出现意识改变、性格改变、木僵状态、精神失常、惊厥昏迷,甚至发生脑疝。脑肿瘤引起的SIADH可因脑卒中而突然死亡。急性肺水肿相对少见,但如发生,预后不良。
(一)实验室检查/水负荷试验/神经垂体MRI协助诊断
SIADH所致的低钠血症是正常血容量性低钠血症(euvolemic hyponatremia),其特点是体位对生命体征没有影响,缺乏水肿,中心静脉压正常。
1.实验室检查
主要有:①血钠<130mmol/L;②血浆渗透压<270mOsm/L;③尿渗透压不适当升高,在血浆渗透压下降时尿渗透压>血渗透压;④尿钠排泄增加(>20mmol/L);⑤二氧化碳结合力正常或稍偏低,血清氯化物偏低;⑥血清尿素氮<10mg/d(×0.357=mmol/L),尿渗透压>100mOsm/ kg。CO2 结合力和血钾正常。、肌酐、血尿酸尿酸<4mg/dl(×59.485=μmol/L)、白蛋白常降低;⑦尿AVP升高,血浆AVP>1.5pg/ml(血渗透压<280mOsm/L时,血浆AVP值<0.5~1.5pg/ml);⑧甲状腺、肝脏、肾脏、心脏和肾上腺皮质功能正常。
2.神经垂体MRI
神经垂体MRI高信号消失对SIADH的诊断有重要意义。
(二)稀释性低钠血症伴血AVP升高是诊断SIADH的基本依据
临床上凡遇有顽固性低钠血症和循环扩张、水潴留而不伴水肿、中枢神经系统疾病或神经精神表现伴血和尿AVP升高者应考虑SIADH可能。经典的诊断标准包括:①血钠<135mmol/L;②血浆渗透压降低伴尿渗透压升高,血浆渗透压<280mOsm/L,尿渗透压>血浆渗透压;③尿钠>20mmol/d;④临床上无脱水和水肿表现;⑤心脏、肾脏、肝脏、肾上腺、甲状腺功能正常。
一、一般治疗与病因治疗
关于SIADH所致的低钠血症的治疗措施曾有很多争论,目前的意见趋向一致,即主要是使用高渗盐水与限制水的摄入,但两种方法都有严格的适用范围,其中特别强调避免高渗盐水使用过量而引起的中枢脑桥脱髓鞘综合征(central pontine myelinolysis syndrome)。理论上,AVP受体拮抗剂是最佳的治疗药物,因为它仅增加无溶质水的排泄,但实际效果有待进一步验证。
(一)限制水摄入并抑制AVP分泌
尽量限制水分的摄入。轻型患者每天给水800~1000ml,入水量的多少主要根据体重的变化,有效的限水应使体重减少1~1.5kg。一般7~10天后可使血浆渗透压及血清钠逐步升至正常水平。部分病例由于长期卧床,肢体运动减少,可行肢体按摩、抬高床脚端等处理,促进静脉回流,增加左心房充盈,可反馈抑制AVP的释放。
(二)去除病因和清除过多AVP
目前尚无抑制肿瘤分泌AVP的药物,其治疗依赖对肿瘤的手术、放疗或化疗。恶性肿瘤应尽早诊断,尽早切除、放疗或化疗。SIADH的病情常随着肿瘤的缓解而减轻。Ciaudo等报道1例外周T细胞淋巴瘤伴噬血细胞综合征伴有SIADH,每次化疗使淋巴瘤临床缓解后SIADH也缓解,前者复发SIADH也再度出现。有感染者应积极采用适当抗菌药物控制感染。对于肺部原发病,经抗感染,改善通气换气功能,纠正缺氧、酸中毒后,AVP的分泌减少,肾排水增多,循环扩张和低钠血症会自行消退。药源性SIADH应立即停用可疑的药物。多西环素(强力霉素)可预防卡马西平(酰胺咪嗪)引起的低钠血症。一般情况下,如必须继续使用引起SIADH的药物,应同时使用地美环素(去甲金霉素)以减少低钠血症的发生。
(三)AVP/AVP受体拮抗剂减轻水潴留
如果患者的尿渗透压降低,应积极限制水的摄入,而尿渗透压升高(>600mOsm/kg)者最适合使用V2拮抗剂。
1.精氨酸加压素拮抗剂
静脉应用的作用持续约4小时,0.5mg/kg可使血钠浓度提高约3mmol/L;单剂量0.25~0.5mg/kg可增加尿量,减少尿渗透压至225mOsm/kg· H2O以下,这种利尿作用不依赖于尿的溶质排泄。本药还可用于内耳水肿(耳聋)的治疗。选择性非肽类AVP受体拮抗剂将成为治疗慢性低钠血症、SIADH、心衰和肝硬化等的理想药物。考尼伐坦(conivaptan)是AVP的V1/V2受体拮抗剂,已用于低钠血症的治疗;托伐普坦(tolvaptan)、利希普坦(lixivaptan)和沙特普坦(satavaptan)为V2受体的选择性拮抗剂,能有效降低血容量。AVP的不适当分泌亦见于多囊肾、肝硬化和充血性心衰,利希普坦和沙特普坦能拮抗AVP的作用,缓解症状。
2.地美环素
地美环素(去甲金霉素,demeclocycline)可拮抗AVP的受体作用,抑制肾小管水的重吸收(致肾性尿崩症样作用)。剂量600~1200mg/d,分3次口服,可引起等渗或低渗性利尿。于5~14天内低钠血症可获得缓解,因其影响骨骼发育,故不宜应用于8岁以下的儿童。地美环素可诱发氮质血症,应定期复查肾功能。
3.其他药物
锂盐可拮抗AVP对肾小管的作用而引起多尿,因其不良反应大,故临床少用。苯妥英钠可抑制神经垂体分泌AVP,但其作用短暂。环丙吗喃醇(oxilorphan)抑制神经垂体分泌AVP的作用,增加尿量。现已有多种AVP受体拮抗剂(vasopressin antagonists)可供应用(如vaptans),但疗效短,所以仅用于急性低钠血症患者的治疗。
二、慢性低钠血症的治疗
细胞外液(extracellular fluid,ECF)状态是低钠血症治疗的决定因素,而ECF的丢失可能是体液消耗所致,也可能是由于低血容量的结果。如患者存在ECF扩张,治疗的关键是去除原发病因而非纠正ECF。如果存在血容量降低,要考虑患者合并了体液消耗性低渗综合征(depletion-induced hypoosmolality syndrome),此时宜用等渗盐水治疗,并注意补钾。
(一)利尿剂治疗低钠血症
仅在严重水中毒症状(如抽搐、昏迷等)出现时使用。必须使用呋塞米(速尿)等快效利尿排水。袢利尿剂可抑制肾小管袢升支对钠的重吸收,阻碍肾髓质高渗状态的形成,使肾小管腔内水的重吸收受阻,抑制AVP的作用。1次给予呋塞米40mg或依他尼酸(利尿酸钠)50mg,如在用药后8小时内尿量<全日尿量的60%,则将剂量加倍。应用利尿剂同时适量加服口服钠盐可使效果更佳。利尿剂治疗可产生低钾血症,应同时补钾,或加用保钾利尿剂氨苯蝶啶或螺内酯(安体舒通)。大剂量尿素(60mg/d)可产生渗透性利尿,不引起低钾血症,但因其胃肠道反应而限制了其应用。噻嗪类利尿剂如氢氯噻嗪(双氢克尿塞)往往无效,有时可加重SIADH。血钠和渗透压初步恢复后,可用等渗盐水,但不用5%葡萄糖。此后应限制水分摄入,以防SIADH复发。
(二)盐皮质激素治疗低钠血症
如纠正Addison病低钠血症时,只需用去氧皮质酮5mg/d即可,而治疗SIADH时应增加至20mg/d。醛固酮的用量为1mg/d,9α-氟氢可的松的用量为2~8mg/d。潴钠激素氟氢可的松可减少尿钠排出,辅以口服补钠效果更好(因钠盐口感差,可将蛋糕、面粉皮等包裹钠盐做成小丸服用),其用法为0.1~0.3mg/次,每日2次,可提高血钠4~8mmol/L,因其增加尿钾排泄,应酌情补钾。
三、急性低钠血症治疗
(一)合理使用高渗/等渗盐溶液
急性低血容量性低钠血症的特点是:①血容量降低伴低钠血症;②已使用了利尿剂;③尿钠<30mmol/L。治疗的方法是使用等渗盐水,50~75ml/h,同时补钾。轻型患者仅需限水,不需补钠。略重者可在限水利尿的同时口服补钠。正常血容量性低钠血症对等渗盐水的反应差,一般要应用高渗(3%)盐水。必须注意,0.9%的NaCl的渗透压为308mOsm/kg,如果尿液的渗透压高于此值(SIADH患者常常如此),输入生理盐水将导致自由水潴留和血清钠进一步下降。高渗盐水(3%)的渗透压为1026mOsm/kg,故适用于SIADH的治疗。当患者病情严重,出现意识模糊、抽搐、昏迷,或血钠<115mmol/L时,应静脉输注3%~5%氯化钠200~300ml,以便提高血钠至120mmol/L以上,但必须严格控制高渗盐水提升血钠的速度。防止诱发肺水肿,可同时给予呋塞米(速尿)静滴,切不可迅速纠正血钠浓度及血浆渗透压至正常水平。
当出现以下情况时,要暂时终止高渗盐水治疗:①症状已消失;②血钠≥120mmol/L;③血钠上升幅度≥20mmol/L。如必要,应限制水分的摄入和用利尿剂等治疗。
(二)避免快速纠正低钠血症引起的脑桥脱髓鞘综合征
急性与慢性水过多和低钠血症的治疗有所不同。严重的水中毒和快速纠正低钠血症都是危险的,所以必须充分权衡两者的利弊。在临床上,更应强调的是后者,因为快速纠正严重的低钠血症可导致渗透性脱髓鞘综合征(osmotic demyelination syndrome,ODS)或中枢脑桥脱髓鞘综合征(central pontine myelinolysis syndrome,CPMS),严重病例可导致死亡。CPMS多出现在快速纠正严重的低钠血症的最初数天内,偶见于严重的高钠血症患者。其发生原因与脑组织(以白质为主)细胞脱水和血-脑屏障被破坏有关,死亡率高,预后不良。除临床表现外,MRI有助于神经髓鞘溶解症的诊断,典型的改变是脑桥的三角区在T2上为强信号(渗透性脱髓鞘综合征,图1);但如病程在3~4周内,可无阳性发现。
除了电解质平衡紊乱外,CPMS的其他病因主要有慢性酒精中毒、糖尿病、高血压、肾衰、肺部感染、肺栓塞、肝硬化等,因此,如果患者原来存在这些基础疾病,那么当发生电解质平衡紊乱时,更容易诱发CPMS。CPMS本身的治疗措施主要包括TRH、甲泼尼龙、血透和免疫球蛋白等。
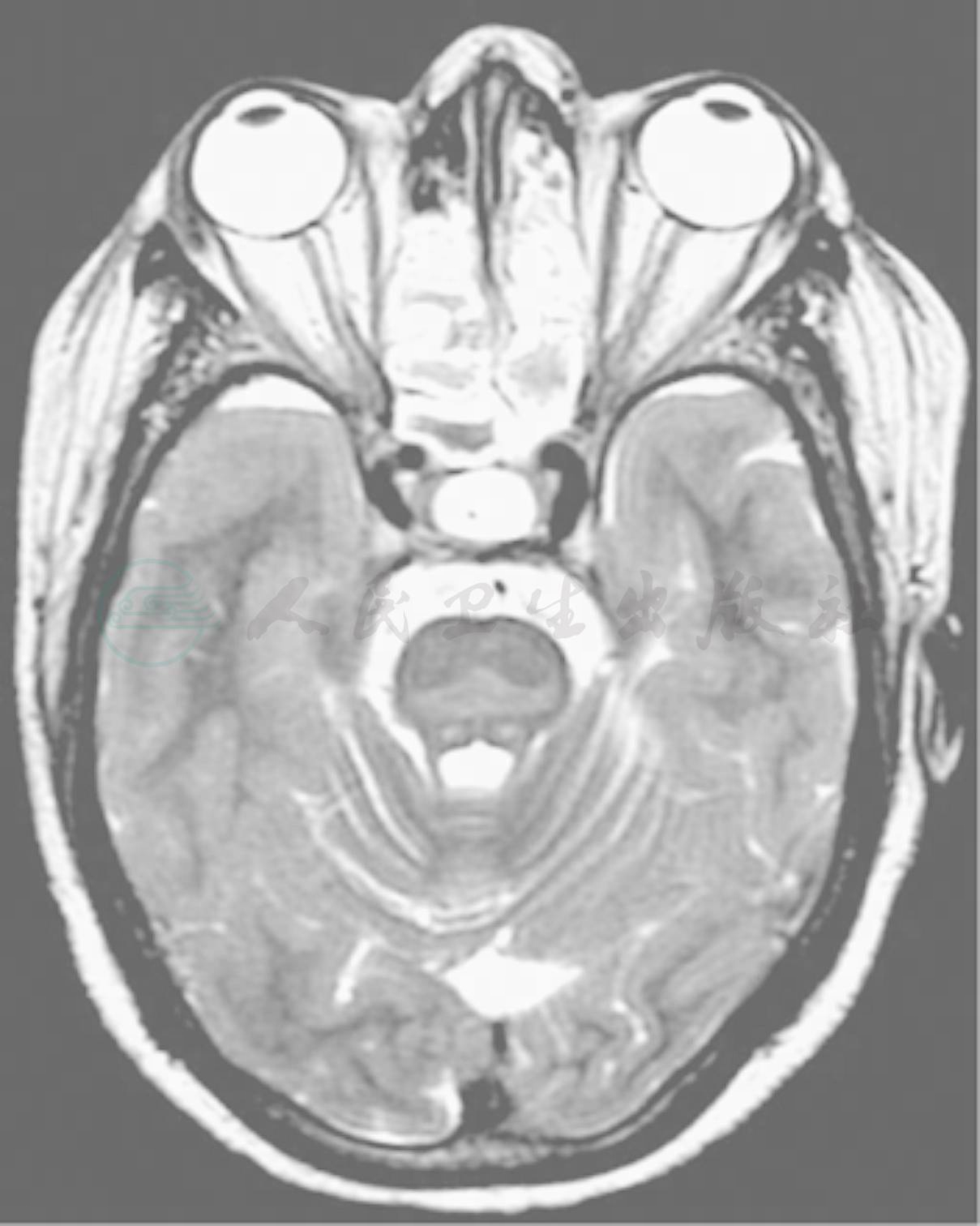
图1 渗透性脱髓鞘综合征的MRI所见
注:渗透性脱髓鞘综合征(osmotic demyelination syndrome,ODS)亦称中枢脑桥脱髓鞘综合征(central pontine myelinolysis syndrome,CPMS),MRI显示,脑桥三角区在T2上为强信号
严重低钠血症的治疗要注意分析3点:①低钠血症的严重程度;②低钠血症的病程;③患者存在的神经损害症状。为了防止发生CPMS,在开始治疗的24~48小时内,血钠升高的幅度要低于25mmol/L,最好低于12mmol/24h或18mmol/48h。CPMS的危险性主要决定于已经存在的低钠血症的程度和时间,治疗前血钠高于120mmol/L者很少发生该并发症,其他危险因素有慢性酒精中毒和营养不良。













