英文名称 :hepatopul monary syndrome
肝肺综合征(hepatopul monary syndrome,HPS)指的是在慢性肝病或急性肝衰竭时,由于肺内血管床扩张而使阻力降低,致使肺泡‐小动脉氧梯度(alveolar‐arterial oxygen gradient,AaPO2)增大,气体交换受干扰,造成通气和灌注不相适应所致的低氧血症(hypoxemia)。HPS是否成立还必须具备:①原先可能并无肺部或心脏的基础性疾患;②不论是否有低氧血症,氧分压(<70mmHg)降低,是HPS的可靠证据,而且肺泡‐小动脉(或称毛细血管)内氧梯度增加(>15mmHg,年龄>64岁者>20mmHg),当从仰卧到直立体位变化时,氧值有明显下降;③有肺内血管扩张或(及)动‐静脉分流(intrapul monar y arteriove nous shunt)。
早在百余年前(1884年),已有关于发绀、槌状指及肝硬化三联征的记载。Gilbert等(1895年)对一例少年增生性胆汁性肝硬化患者也有类似的发现,也有对肥大性骨关节病(hypertrophic osteoarthropathy)的叙述(Humans等,1901年)。Snell等(1935年)在慢性肝病患者首次测到有低氧血症。Keys等(1938年)证实了有氧合血红蛋白的离解曲线右移。Rydell等(1956年)在急性肝衰竭患者也观察到有低氧血症,此患者在尸检时证明有肺内的动‐静脉分流。此后又有许多类似报道,并认为动‐静脉分流乃因血管活性物质所致,槌状指的发生乃由于指尖动静脉吻合,以及还原型铁蛋白(ferritin)作用的结果。肝肺综合征一词首先由Kennedy等(1977年)提出,后来被多数人采用。Erikson等(1989年)也用这一术语来描述低氧血症与肝硬化之间的关联。
约45%~60%的肝硬化或肝功能不全者有低氧血症存在,仅极少数证实有严重的低氧血症(氧分压<50mmHg)。在等候进行肝移植的患者中,13%~47%的患者被证明有肺内血管扩张。约有30%的肝硬化患者表现出肺内血管收缩功能减低,可能发生HPS者达4%~19%。HPS多见于肝硬化而少见于肝外门静脉阻塞者。
各种原因引起的肝硬化是HPS的最常见病因。其他原因引起的门脉高压如布‐加综合征和门静脉栓塞等亦可以引起。此外,缺血性肝炎和急性病毒性肝炎发生一过性HPS亦有报道。
HPS最常见于各种病因所致的肝硬化,也可发生于非肝硬化的门脉高压症,甚至无肝硬化、无门脉高压的急、慢性病毒性肝炎。慢性肝病患者中4%~47%有HPS,肝硬化患者的发病率为4%~30%,发病率的差异主要是由于采用的诊断标准不同所致。
HPS发病机制并未完全阐明,根据病理生理推测低氧血症的原因包括:①氧气和血红蛋白亲和力改变;②肺内分流;③肺泡毛细血管弥散障碍;④肺脏灌注/通气比例失调。
HPS发病的中心环节为因一氧化氮(nitric oxide,NO)产生增加而引起的肺血管扩张。NO产生增加包括以下机制:①内皮素‐1(endothelin‐1,ET‐1)途径:肝病或门脉高压时,较多的ET‐1被释放,并通过与肺毛细血管内皮高表达的ET‐B受体结合,激活内皮源性NO合成酶,从而使NO产生增加,引起血管扩张;②肿瘤坏死因子α(tumor necrosis factorα,TNF‐α)途径:肝脏的巨噬细胞系统在清除由胃肠道来源的微生物病原体中起关键作用,肝硬化门脉高压状态下,门体分流形成,同时肠黏膜屏障功能受损,微生物病原体所致的内毒素血症发生概率增加,这使血液中TNF‐α水平升高,后者可使巨噬细胞聚集并进一步激活NO合成酶,产生更多的NO。患者NO呼出增多,及患者进行肝移植后NO呼出降低均表明NO是肺血管扩张的主要介质。除此之外,其他血管扩张物质如前列环素、前列腺素E、前列腺素I、血管活性肠肽、降钙素、P物质、心房利钠尿多肽、胰高血糖素、血小板活化因子均参与了肺血管扩张。与此同时,肺血管在肝病状态下对血管紧张素Ⅱ的敏感性下降也是肺血管扩张的另一因素。
新近研究表明,在广泛肺血管扩张基础上和在血管内皮生长因子的作用下,肺脏出现新的毛细血管增生,肺血管进行重建、重构,这也加重了气体交换障碍。此外,肝硬化患者会出现心排血量增加及高排低阻的高动力循环状态,从而缩短了血流在肺内停留的时间,使氧合的时间缩短,进一步加重低氧血症。
主要表现为肺脏毛细血管前水平的动静脉交通支增多,胸膜蜘蛛痣样血管瘤形成,毛细血管扩张。根据血管扩张的情况可分为两型:Ⅰ型为弥漫型,表现为肺内血管弥漫广泛扩张,并进一步可分为轻度和重度,轻度表现为弥漫的轮廓清晰的蜘蛛痣样血管异常;重度则表现为海绵状或者斑块状血管异常。Ⅱ型为局限型,仅表现为局部的动静脉瘘、动静脉短路的形成。
肝肺综合征的主要原发结构改变是肺毛细血管前、后血管扩张,使混合静脉且快速,甚至直接进入肺静脉,同时由于低氧血管收缩机制受损也导致血管张力缺失或减低。动脉低氧血症在肺内有三个决定因素:肺泡通气‐灌注失衡,肺内分流增加和氧弥散下降;其中通气‐灌注最主要,基本上反映了弥散‐灌注缺损;相反,门‐肺静脉交通作用并不大(图1)。但临床上也观察到一些现象,如有些患者尽管在吸入100%纯氧后,其PaO2有显著增加,可>40kPa(>300mg),但其存在的肺内分流也显著增高(可达≥20%的心排血量)。严重患者在吸入室内空气时,对氧的弥散损害,比PaO2下降更明显,对这些现象的解释是由于灌注增加而有利于吸入纯氧提高PaO2,而其他因素不变。虽然毛细血管内血容量可能增加,但氧的弥散也受影响,部分是由于高流量使红细胞的转运时间缩短,因而产生弥散‐灌注失衡。CO弥散下降则可能是由于在扩大的肺微血管的中央主流中,肺泡和红细胞间的距离增加,以致不能使CO和血红蛋白完全平衡;无论如何,肺的气体交换状态仍然和低氧血症的三个机制并存,但其作用地位则分别和疾病的严重程度相关。
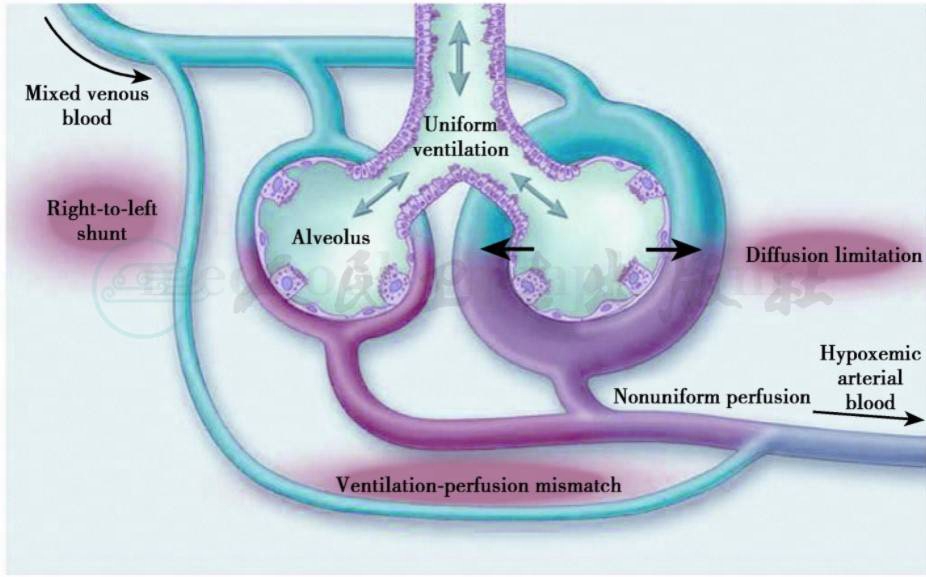
图1 动脉低氧血症在肺内决定因素
1.动脉血气分析
动脉血气分析是临床上常用的呼吸功能检测方法,根据肺泡‐动脉血氧分压差和动脉血氧分压可以将HPS分为轻、中、重、极重度(表1)。
表1 HPS分度

因有时该分度与患者病情严重程度及预后并无明显相关,故临床上根据血氧分压的动态变化来评判患者的严重程度。
2.对比增强超声心动图
对比增强超声心动图是非侵袭性检查肺血管扩张的首选方法,它不仅可用于诊断有无肺内血管扩张,还可用于排除心脏右向左分流而致的低氧血症,可分为经胸壁和经食管检查两种。其原理是用振荡的过氧化氢溶液或吲哚氰绿静脉内注射作为对比剂,对比剂可以产生15μm直径的微泡,正常情况下,这些微泡会在流经肺循环时在肺内完全吸收。当存在心内分流或者肺内分流时,这些微泡会出现在左心房,存在心内分流时,左心房在3次心搏后会出现微泡;存在肺内分流时,左心房在4~6次心搏后出现微泡。经食管超声较经胸壁超声更敏感,但缺点是不能区分肺血管扩张还是动静脉分流,而且缺乏特异性。左心房容积量是HPS最新的预测指标,容积量大于50ml常提示存在HPS。
3.99m锝人血清白蛋白聚合颗粒动态肺灌注成像
正常情况下,由于肺血管直径为8~15μm,故静脉注入直径大于20μm的标记白蛋白不能通过肺毛细血管床而聚集在肺组织。HPS时由于存在肺内血管扩张,标记白蛋白会流经肺循环,而被脑、肾和肝脏等其他器官摄取。正常情况下,脑内检测到99m锝标记的人血清白蛋白聚合颗粒的量不超过5%,如果脑内检测量超过6%,则提示肺内分流,这种方法的优点是还可以计算肺内分流量。
4.肺功能
肺功能检查异常很常见,但无特异性。除同时伴有阻塞性和限制性肺疾病外,肺容积和呼气流速一般正常。HPS常见弥散功能障碍。
5.肺血管造影
肺血管造影不仅可以明确HPS的分型,是确定肺血管改变和定位的金标准,同时还可以除外肺栓塞引起的低氧血症。其典型表现可以分为弥漫型和局限型,弥漫型表现为弥漫分布的蜘蛛状、海绵状影像,前者提示轻度的肺血管扩张,后者表明肺血管扩张比较严重;局限型仅表现为孤立的蚯蚓状或团状影像。由于肺血管造影昂贵、有创,且对肺血管扩张的敏感性低,故不应作为常规检查,但若吸100%纯氧仍不能有效改善动脉血氧,应考虑行肺血管造影检查。
6.其他
胸部X线的主要表现为以双肺下叶为主的弥漫性小粟粒影;肺动脉干扩大;肺纹理增粗。胸部CT可显示肺远端血管扩张,有大量异常的末梢分支,甚至波及胸膜血管,可提示HPS的存在,但这些表现均无特异性。胸部CT主要可排除低氧血症的其他原因,如肺气肿、肺纤维化等。近年来有研究显示,胸部高分辨率CT可通过显示肺内周围血管扩张及计算肺血流通过时间来佐证HPS存在。
1.一般治疗
治疗重点应长期保护肝功能和降低门脉压力,改善血管活性物质的平衡,改善低氧血症,有腹水者应给予利尿剂或放腹水以改善肺容量及功能性肺泡面积。
2.氧疗
适用于轻型、早期HPS患者。吸氧一般应使血氧饱和度维持在90%以上,可增加肺泡内氧浓度和压力,有助于氧弥散,缓解患者症状,促进肝细胞再生和肝功能的恢复。病情较轻的早期患者,经鼻导管给予低流量吸氧即可纠正低氧血症。而病情较重者,单纯氧疗效果较差,高压氧疗法能使血氧分压增高。
3.药物治疗
目前尚缺乏特效治疗药物。NO合成酶抑制剂亚甲蓝可使患者肺内NO产生减少,从而抑制血管扩张,改善低氧血症和高动力循环状态。奥曲肽是生长激素类似物,作用于血管平滑肌,减少内脏血流,改善门体分流。也有应用大蒜胶囊、麻黄碱、吲哚美辛、二甲磺酸阿米三嗪等治疗HPS的报道,但其疗效有待进一步证实。
4.栓塞治疗
适用于孤立的肺动静脉交通支的栓塞,即肺血管造影Ⅱ型的HPS患者。尤其对吸入100%纯氧反应差的低氧血症患者。
5.肝移植
肝移植是HPS唯一确切的治疗方法。研究表明,HPS患者肝移植术后的5年生存率为76%,而不进行移植的患者,5年生存率仅为23%。术前血氧分压小于50mmHg是肝移植预后不良的重要预测指标,这些患者的移植死亡率可高达30%,而氧分压超过50mmHg的移植死亡率仅为4%。
积极控制原发病,避免出现肺部感染等,定期监测肝功能等,如出现呼吸系统症状如气短等不适应及时就诊。













