英文名称 :high altitude pulmonary edema
高原肺水肿(high altitude pulmonary edema,HAPE)是急性高原病中最常见和严重的一型,且发病急骤、经过凶险,治疗不当,可致死亡,对高原建设者、旅游者、登山者都是巨大的威胁,因此是防治的重点。另外,从某种意义上讲,HAPE是高原低氧所致肺损伤的一个典型例子,所以对HAPE病理生理和发病机制的研究已经超过了HAPE作为高原病本身的意义,可以作为许多临床医学中低氧所致肺损伤病理生理机制认识的借鉴。
(一)海拔高度
高原肺水肿的发病高度一般在海拔3 000m以上,但如在进山期间有强体力活动,也可在海拔2 000m发病。随着海拔增高,发病率升高。
(二)年龄与性别
再入性高原肺水肿以2岁以上小儿和少年患病率高,从而认为青少年是一个高危个体,其易感性可能一方面青少年肺血管对低氧刺激有更强的收缩反应,另方面青少年抵达高原后兴奋好动,活动量大,运动导致缺氧加重,肺动脉压升高。成年人中Hackett曾指出:男性、年轻、好动者易患,的确符合大多观察,但男女两性及各年龄都可罹患。
(三)进入高原的速度
在短期内急速进入高原,如乘飞机与数小时内抵达高原,机体没有一个习服过程,则易发生高原肺水肿。近年来,由于从平原乘飞机进入青藏高原的人数大为增加,故乘飞机患病者显著增多。例如中国人民解放军西藏军区总医院收治的171例高原肺水肿患者中,有140例系乘飞机进藏者。现代化的交通工具提供了进入青藏高原的便利条件,但也增加了HAPE的发病率。相反,如乘大巴或乘火车缓慢进入高原者患病率较低,特别是经阶梯适应,逐步登高者HAPE的发病率明显降低。
(四)劳动强度
快速进入高原立即进行剧烈体力活动或过度劳累容易罹患高原肺水肿。劳动或剧烈运动时机体耗氧量明显增加,加重高原缺氧。在海拔4 000m以上,初入高原时,即使作中等以上劳动也易发生高原肺水肿。
(五)寒冷
高原肺水肿一年四季均可发病,但冬、春季节患病者较多。本病与寒冷关系密切,寒冷时不仅机体代谢增加,耗氧量增多,使体循环血管收缩,肺血流量增加,致肺动脉压和肺血管阻力升高,因而可诱发高原肺水肿。
(六)并发上呼吸道感染
约50%的患者发病前有上呼吸道感染的历史。感冒等上呼吸道感染多伴有发热,使耗氧量增加,更主要是高原低氧损伤加炎症感染的双重作用,这促使了高原肺水肿的发生。
高原肺水肿在世界不同地区的患病率有所不同。如Rennie统计在尼泊尔珠峰地区海拔4 000~5 000m的初来高山的旅游者中患病率为0.66%。而Singh报道,1962年在喜马拉雅山区的印度军人中患病率低者为0.75%,高者达到15.5%。
在我国,对不同高原地区、不同人群和不同劳动性质的调查结果发病率相差很大,为0.2%~10%。据我们对青藏高原海拔3 301~4 200m地区调查结果为,人群年发病率为28/10万~78/10万,说明此病并不罕见。劳动条件和高原卫生保障明显影响HAPE的发病率,如同在唐古拉山海拔4000~4500m地区,20世纪80年代,在青藏公路建设工人中HAPE发病率高达9.8%,而2001—2005年,青藏铁路修建时,由于高原卫生防护条件的明显改善,建设工人中HAPE发病率仅为0.47%。
根据发病情况,可将高原肺水肿分为以下两型:
(一)初入型高原肺水肿(entry or ascent HAPE)
未经习服的平原地区人,在急速进入高原后的1~3天,或晚至7~14天发病。这在我国的参与高原建设者、旅游者和登山者中最常见。
(二)再入性高原肺水肿(reentry or renascent HAPE)
指久居或世居高原者,已获得对高原低氧环境的习服-适应,到海平面或海拔低处短期居住一段时间(1~15天)后,于重返高原后很快发病。这在南美的安第斯地区居民,尤儿童及青少年多见。近年来我国高原居民去往平原或海平面再回高原的往返日益频繁,这一类型HAPE也渐多见。
尽管发病情况有别,但两种高原肺水肿的病理生理和临床表现相同。
(一)组织形态学
肺充血水肿,重量增加,压之充实,有大量粉红色液体溢出。肺的水肿分布常不一致,有些区域明显水肿或出血,有些区域则正常或仅过度膨胀。肺部血管直至毛细血管均有显著扩张充血,导致肺泡隔膜增厚。肺泡及胸膜可有散在出血灶。镜下可见肺泡腔内充满水肿液,有水肿凝块,红细胞、多形核白细胞、巨噬细胞,而数量不多(图1),肺泡腔内常有透明膜(hyaline membranes)形成,与肺泡壁密切相接,这种透明膜的组织化学性质与新生儿呼吸困难综合征(respiratory distress syndrome of the new-born)的透明膜相似。肺毛细血管呈充血状内有红细胞沉积,肺小动脉或薄壁小肺静脉内可见新鲜血栓形成或纤维素凝块,且肺内有小梗死区。血管周围水肿出血可见。有肺淋巴管扩张及间质性肺水肿。重症者伴有肺泡出血,在充血的脑髓中有出血灶;或同时伴有高原脑水肿病变。右心室扩张,左心室一般正常。在平原人罹患初入性HAPE者其肺血管的肌层是正常的。
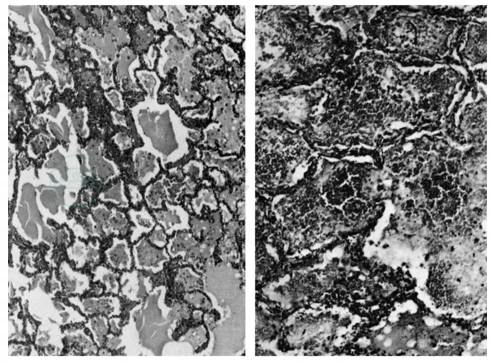
图1 高原肺水肿病理,肺泡腔内充满水肿液凝块
(二)超微结构学
Heath等曾进行了与HAPE相关的动物实验,将Wistar大鼠置于减压舱内,模拟大气压为265mmHg下12小时,这一高度相当于珠峰峰顶高度(8848.86m,PB 243~255mmHg)。在这一极度低氧条件下,肺内有多发性的内皮水疱形成,并伸入到肺毛细血管内。从纵切面观,这些水疱顺着所在毛细血管呈长形,足以阻塞肺毛细血管。水疱以蒂从肺泡壁融合的似有积液的基底膜局部增宽处突出,被一层极薄的由局部积液所扩张的肺毛细血管内皮细胞及其细胞质所覆盖。当将水疱作横切面时,有时则未见疱蒂,看来是由双重膜覆盖的圆形体,给以游离于肺毛细血管内的假象。在模拟高原低氧条件下,肺内许多毛细血管均含有水疱,从而使含有红细胞的毛细血管变形,其血管直径减小。膜性肺细胞显示出微饮液作用(micropinocytosis)和水肿变性。
(一)肺动脉高压
肺血流动力学的研究证实肺动脉高压是关键因素,Fred等(1962)及Hultgren等(1964)首先应用心导管术直接测量HAPE患者的肺动脉压力,发现有不同程度的肺动脉高压,显著者可高达144/104mmHg(19/14kPa)。同时左心房压及肺楔压正常,排除了左心衰竭,是非心源性肺水肿。对曾患HAPE的恢复期患者吸入低氧气体,出现明显的低氧性肺动脉增压反应(HPVR),提示肺血管对低氧存在易感性。
由于肺小动脉解剖学的特征,即高原缺氧导致了肺肌性小动脉明显收缩,而肺非肌性小动脉的通路则变大,从而引起不均匀的肺局部灌注,即血管痉挛处血流减少,而大量血流则涌入这些大口径的通道流动,造成它们供血的那些毛细血管的流体静力压增高,使液体渗入肺。以后大量有创和无创性血流动力学研究进一步证实了以上结论。
(二)肺微血管裂隙
电子显微镜技术证实了肺微血管裂隙的存在。Severinghaus等做过一系列研究。首先在Long-Evans大鼠身上分离出肺,给予静脉注入12~35μm的聚苯乙烯乳胶小球以完全阻塞终末血管床,使血流被迫进入未被阻塞的肺动脉,使之过度扩张并增压至100mmHg(13.3kPa),结果发现在血管周围出现袖带状水肿。以后在犬的实验进一步证实,但有时在未加血管栓塞而有低氧肺高压的对照组也可出现类似的血管周围袖带状水肿,不过在单纯栓塞而无肺高压时则从不出现这种水肿。
肺泡壁通常是由邻近肺泡上皮细胞的细胞质突起连接形成,肺毛细血管壁亦以同样方式由内皮细胞的细胞质突起构成。发生本病时,发现肺泡上皮和肺血管内皮细胞变性,细胞质突起皱缩,细胞因缩回突起而使这种突起的连接点处间隙变大,形成内皮细胞分离,基底膜暴露,经血管裂隙形成,于是较大的分子,如水、胶体粒子甚至细胞可通过此孔隙从毛细血管进入肺泡。这一裂隙说(leakage theory)提供了HAPE时肺毛细血管通透性增高的生物物理学原理。
(三)肺毛细血管应激衰竭
近年来,West等通过一系列动物实验观察到低氧应激下肺毛细胞壁的完整性受损,认为这是低氧下肺毛细血管应激衰竭(stress failure of pulmonary capillaries)的结果。他们首先对Sprague-Dawley大白鼠在极度低氧下(大气压236~294torr,相当于7 000m~9 000m)8~12小时后,肺动脉收缩压由对照的30.5mmHg±0.5mmHg(4.06kPa±0.07kPa)上升至48mmHg±2mmHg(6.38kPa±0.27kPa)。此时于气管内可见泡沫血样液体,超微结构检查观察到一系列肺毛细血管受损现象,包括毛细血管内皮层或整个壁层崩裂、肺泡上皮层肿胀、红细胞及水肿液进入肺泡壁间质中,肺泡腔内充满蛋白液体及红细胞,内皮细胞饮液突起伸入毛细血管腔内。
随后在兔的实验突然增高左心房或肺动脉压力,可引起高分子量蛋白及红细胞由血管内外渗至肺泡腔内,电镜观察可见在肺泡腔内有内皮细胞及上皮细胞碎片,渗漏的高分子蛋白、红细胞、白三烯B4(leukotriene B4,LTB4)。这些形态改变在升压至24mmHg(3.2kPa)有时即可出现。这一学说进一步为HAPE时肺毛细血管损伤,导致通透性改变及随之的炎症反应打下了理论的基础。
(四)高蛋白、高渗出性肺水肿
在肺水肿的发病机制上,在肺通透性渗漏和流体静力性渗漏间存在着差别,前者一般由炎症为起因使肺血管内皮屏障易受损害而导致大量蛋白及红细胞从血管内渗漏至血管外间隙。而流体静力型渗漏是由于血管内压增高,最常见于充血性心力衰竭,引起液体和蛋白选择性地渗漏至间质或肺泡腔,渗液为低蛋白含量。临床上如何区别二者?1979年Fein等首先推荐用测定肺水肿患者的肺水肿液蛋白含量来判别是否属于肺泡-毛细血管通透性肺水肿。自1984年起,Schoene等先后在麦金利峰海拔4 000m处,应用纤维支气管镜技术采集HAPE患者的支气管肺泡灌洗液(BALF),获得了惊人的发现。首先发现HAPE的BALF含有大量高分子蛋白,其总蛋白量比健康对照组高达60倍,这种高通透性渗漏与ARDS极为相似,但HAPE的BALF中有大量肺泡巨噬细胞,而ARDS则为大量多形核中性粒细胞(polymorphonuclear neutrophile,PMN),显示炎症反应。
以后的研究获得了更丰富的内容,HAPE患者的BALF中不仅有大量蛋白、肺泡巨噬细胞,还有中性粒细胞、淋巴细胞及红细胞,并且有较高量的免疫球蛋白IgG、IgA、IgM,α-补体C3、补体C5裂片、α1-抗胰蛋白酶、蓝胞浆素等。
这样的BALF特性,可以除外HAPE是如左心衰竭因肺毛细血管压力增高引起低蛋白渗漏液的肺水肿,而是一种高蛋白、高渗出性肺水肿。然而另外表明肺水肿性质与ARDS的相似也增加了鉴别的难度。
在同一地区的急性高原病(AMS)不伴有肺水肿者,则BALF并无蛋白渗漏,尽管其血氧合水平降低,SaO2为70.0%±2.4%,Schoene等认为此时可能有间质性肺水肿而尚无肺泡水肿,间质性肺水肿可以导致肺膨胀不全,肺内分流和通气/灌注(V/Q)障碍。
(五)细胞因子和炎性介质的共性作用
这方面是近年来的研究热点。日本信州大学医学部以酒保惠嗣为首的研究小组,对发生在日本Alps(长野)登山者中的HAPE进行了这方面的研究。他们对入院1~4天内的HAPE患者抽取了BALF,发现细胞总数、肺泡巨噬细胞、中性白细胞及淋巴细胞数均增多,同时总蛋白、白蛋白、乳酸脱氢酶(LDH)、白介素(interleukin,IL)-1β、IL-6、IL-8、肿瘤坏死因子(TNF)-α增高,但IL-1α及IL-10不增高。还注意到IL-6及TNF-α与肺动脉压-楔压呈正相关及与PaO2值呈负相关,即低氧血症愈重,肺动脉压愈高,IL-6及TNF-α的含量愈高。因此他们认为炎性介质在HAPE发病早期起着一定作用。尽管这些炎性介质十分类似于ARDS,但其反应是短暂的,并且没有原发性感染的原因。
德国汉堡大学以Bärtsch为首的一批学者却得出不同的结果,他们在HAPE早期,测定血清TNF-α、IL-1、IL-2及IL-6均不增高。另一组Pavlicek等对HAPE易感者(即曾患过HAPE者)在抵达海拔4 000m第1天,尽管出现明显低氧血症(SaO269.6%±9.1%),血清补体C3及α1-抗胰蛋白酶水平有所提高,但仍在临床允许范围内,IL-6、运铁蛋白(TF)及C反应蛋白(CRP)均不增高。为此,Bärtsch认为所观察到的炎症反应只是继发现象而非原因,他们坚持HAPE的流体静力压说,即高原低氧作用下,肺小动脉及小静脉发生显著的低氧性肺血管收缩,导致某些血管壁过度扩张,由此使细胞连接开裂及可能引起肺泡-毛细血管膜应激衰竭。由于上述这些肺损伤,所出现的HAPE时BALF中的炎症反应只是一个继发性事件。在此基础上,血纤溶活性功能障碍导致纤维蛋白异常增高,促进了肺血管微血栓形成,也是一个重要因素。
但是不论是始发机制或继发现象,效应细胞、细胞因子及炎性介质在HAPE的病理生理过程中有重要作用。
(六)HAPE发病与相关基因的研究
基因表达的变化对认识HAPE的病理生理,特别其易感机制有重要意义。一项短时间(3小时)的低氧暴露即已观察到出现一些不同类型的基因表达。在低氧暴露下还发现许多基因是与细胞的抗氧化能力有关,动物实验中脑和肺的转录也观察到基因表达变化伴有血管再收缩及抗氧化调节变化。近年来的研究发现HAPE是与多种基因类型间相关,包括一氧化氮合酶3(nitric oxide synthase 3,NOS3)、细胞色素P450(cytochrome P450)、家族型11(family 11)、亚家族B(subfamily B,CYP11B)、血管紧张素转换酶(angiotensin 1 converting enzyme,ACE)、热激蛋白70(heat shock protein 70,HSP 70)、内皮素-1(endothelin-1)、肺表面活性蛋白(pulmonary surfactant protein A1)、羟基酪氨酸酶(tyrosine hydroxylase,TH)及血管内皮生长因子(vascular endothelial growth factor,VEGF)。这些基因是依赖于不同的生物分子作为介导体而表达为各种生理表征。
近年的一项研究观察到在低氧条件下大量覆盖的基因不同的表达伴有能量代谢改变可能由此引起易感性,在HAPE其发生易感性是与基因组广泛的表征伴有不同的氧化磷酸化(oxidative phosphorylation)通路调控有关。
最引人注目的是一氧化氮(NO)的基因表达。NO也即血管内皮舒张因子(endothelial reflation factor,EDRF),由肺血管内皮细胞释放,是重要的舒血管物质。高原低氧下可显著抑制一氧化氮合酶(NOs)的基因表达,NO合成减少,从而成为低氧性肺血管收缩的重要机制之一。Busch等测定了HAPE易感者呼出气的NO量,结果在吸入12%氧2小时后,NO排出量减少了25%,而健康对照组并无减少。还注意到低氧下肺动脉收缩压(SPAP)的升高程度与呼吸道排出NO的浓度呈负相关(r=-0.49,P=0.04)。Duplain等系在高山现场(海拔4 559m)测定HAPE呼出气NO含量比健康对照组低30%。张西洲等(1999)对海拔3 700m的11例HAPE患者测定血浆NO含量,结果治疗前为(59.60±6.8)μmol/L,比治疗后(69.80±4.65)μmol/L明显为低(P<0.01)。以上研究也为应用NO治疗HAPE提供了依据,并已取得了实际效果。
HAPE如治疗处理及时有效,则恢复快且可完全治愈。几十年来的临床观察一致认为迅速低转至平原是最有效的策略,病情很快反转及自愈。然而在患者发病的现场、地形、交通及种种当时条件常不允许实施快速低转,此时只有采取就地治疗为第一步,同时应用综合疗法。
(一)迅速低转
发现患者后立即迅速向低地转移是最有效的疗法,至少争取向下低转1 000m。在高山条件下,低转应有效组织和有经验的人来实施,做好各种准备(药物、氧气)和随时采取应急措施。直升机或救护车当然理想,但很多情况是靠人力抬运或牦牛驮运,这时患者应处于被动尽量安静状态,因任何导致患者颠簸活动都会加剧缺氧而使病情恶化。
在患者不可能或不适宜低转,或在低转过程中(如青藏铁路建设唐古拉山需长途低转过程),可用简便手提式低压舱,即增压袋(pressure bag),目前有多种类型,可按2~4lb/in(1lb=0.45kg,1in=2.54cm)增压数小时达到模拟下降1 500m或更低。
(二)呼吸末正压通气
对重症HAPE或怀疑发生ARDS者,可应用持续正压通气(continuous positive airway pressure,CPAP)治疗,在有自发性呼吸的患者可以保持呼吸道的正压通气,而类似于呼吸末正压通气(positive end-expiratory pressure,PEEP)的生理效果。
(三)氧气应用
不论低转或暂时难以低转,供氧都是关键性治疗,应立即实施。改善动脉血氧水平可以减低肺血管收缩和降低肺动脉压力,从而移除血管外潴积的液体。供氧的综合措施是吸入高流量氧(4~6L/min),严格卧床,加强保温,争取立即低转500~1 000m。氧气治疗是最关键,结合迅速低转将取得显著效果。
(四)吸入一氧化氮(nitric oxide,NO)
NO产生于肺内皮细胞,是一种自然的血管扩张剂。而在HAPE易感者在低氧条件下其呼出气的NO水平降低。Scherrer等首先对18例HAPE易感者在4 559m治疗。治疗前与非HAPE易感对照组相比,MPAP增高明显而PaO2下降,出现了肺动脉高压及低氧血症。NO治疗后PAP降低而PaO2升高,但对照组的PaO2则下降,这可能与通气/灌注比率失衡(V/Q mismatching)加重有关。NO首先到达具有通气功能和非水肿区并扩张此处血管。由此将水肿区的血流驱向非水肿区和改善了V/Q比率,而纠正了低氧血症。一般吸入40ppm 15分钟可以改善HAPE患者的氧合能力。
在临床上已观察到,对有低氧性肺动脉高压的患者,在予以吸入低浓度NO后,NO可选择性地作用于肺血管、扩张肺动脉、降低PAP、改善心功能、提高对周围组织的氧供,而取得明显疗效。
但在高原现场应用NO治疗限于条件常不可能实施,此时可用NO的合成前体L-精氨酸(L-arginine)替代治疗。在医院等应用NO是值得推荐的,疗效是被肯定的,而且应配合其他药物治疗,主要有:地塞米松(dexamethasone)、硝苯地平(nifedipine)和西地那非(sildenafil)等,参阅以上预防用药。
个体和群体都存在对HAPE的易感性。HAPE的预防一个是强调逐步登高,一般原则是在海拔2 000m以上,每天的上升高度不要超过350m,防止快速连续急进高原,因急进高原既可诱发高原病,又延长高原习服的时间。另一个是避免抵达高原后的前数日即作强烈体力活动。要禁酒及不用安眠药。药物预防是一种手段,但不可替代上述措施。药物使用的原理是促使肺血管扩张,以防止肺动脉增压反应及改善肺的气体交换。
(一)硝苯地平(nifedipine)
是钙离子(Ca2+)通道阻滞剂。HAPE降低肺动脉高压为防治的关键,而多种钙通道阻滞剂均可同时作用于体循环和肺循环而使血管扩张,具有降低肺动脉压力及阻力和改善肺气体交换的功能。此药用以预防HAPE已有一段实践时间,证明硝苯地平有抑制低氧性肺血管收缩的作用,降低高原肺动脉高压、改善运动能力、改善肺气体交换及减少肺X线影像上的病损。
(二)他达拉非(tadalafil)或西地那非(sildenafil)
他达拉非10~20mg,每日2次;西地那非50mg,每8小时1次,应在进入高原前24小时开始应用。二者均为5型磷酸二酯酶抑制剂(phosphodiesterase-5 inhibitors),可以有效防止HAPE发生。
(三)沙美特罗(salmeterol)
沙美特罗是一种β肾上腺素受体激动剂,应用于支气管哮喘,观察到可逐步清除掉肺部积液。Sartori等由此提出了一个理论即HAPE对肺内皮细胞钠的转运不足,因此进行一项实验,对37名登山队员是对HAPE的易感者,于1天内攀登至Mount Rosa(4559m),分为两组对比,吸入沙美特罗组HAPE的发生率比安慰剂对照组下降了50%以上。但下列疾病:肝脏功能不全、低钾血症及过速型心律失常者应禁用。他达拉非和沙美特罗对进入高原地区人员的安全性都值得进一步研究。
(四)地塞米松(dexamethasone)
已证明这一皮质激素可有效预防AMS,对预防HAPE也有效。一般认为用小剂量的糖皮质激素即可预防AMS,又不至于影响肾上腺皮质对低氧的正常反应。一般在进山前一天开始服用,可沿用至下山;登山速度为>1 000m/d在5天以内时,用量为4~8mg,每12小时1次。其预防作用根据动物实验,地塞米松可以通过抑制低氧介导的内皮功能障碍而促使NO合酶的合成,因此具有扩血管作用而预防HAPE。在高原,地塞米松不能突然停用,尽管其不一定促进习服,但对抵抗HAPE者可提高体能。
(五)乙酰唑胺(acetazolamide)
是碳酸酐酶抑制剂可以阻断肺血管的收缩,其主要用于AMS和HAPE,也有减低HAPE的危险因素,如可抑制低氧性肺血管收缩反应,从而起到预防HAPE的效果。用量为250mg,每8小时1次,在上山前一天开始服用。近来都建议250mg,每天2次,同样有效而副作用少。但在肾功能不全的患者,据情或减少剂量及延长用药间期或者完全禁用。如患者原已有酸中毒、磺胺类药物过敏及肝病者也应禁用。













