英文名称 :pneumoconiosis
中文别名 :尘肺
肺尘埃沉着病(pneumoconiosis),又称尘肺,是指在职业活动中长期吸入生产性粉尘而引起的、以肺组织弥漫性纤维化为主的全身性疾病,它是目前我国最常见和最主要的职业病,约占全国每年新发职业病总数的90%。根据有关资料,到2017年底,我国累计发生尘肺病例已近90万例,并以每年新增2万名患者的速率递增,发病年龄在30~50岁者约占患者总数的90%以上,死亡率高达22%,全国每年因尘肺造成的直接经济损失超过400亿元人民币。由于绝大部分(90%以上)是农民工,多在劳动条件极差、缺乏职业卫生监督的小型或家庭式厂矿工作,流动性强,故发病情况绝大多数未能进入国家卫生统计数据;此外,目前粉尘接触者的体检率还不到实际接尘人数的30%,这使卫生统计部门报告的病例数更远远低于实际情况。近三四十年来,发达国家在改善粉尘作业环境和个人保护方面做出了巨大努力,有效控制了尘肺的发病,尘肺患者日渐减少,中国和一些欠发达国家患者较多,后者迫于经济发展压力,尚难以集中精力关注尘肺的治疗问题;即便在中国,尘肺的治疗和研究也多局限在少数职业病防治专职机构,尚未形成整体医疗体系的合力,以致久攻不下。专家预测,即使从现在开始采取有效防控措施,鉴于尘肺的迟发特点,今后若干年内,我国尘肺的防治形势仍将十分严峻。
以往多认为只有二氧化硅(SiO2)形成的硅尘才能引起肺纤维化,其病变程度也与肺内硅尘蓄积量密切相关。但大量临床病例证实,还有一些生产性粉尘,如煤尘(主要由碳、氢、氧、氮组成的有机矿物)、石棉尘(主要是镁和硅构成的硅酸盐)、滑石尘(主要为含镁的硅酸盐和碳酸盐)、炭黑尘(主要是碳氢化合物)等,也可引起尘肺,只是致纤维化能力较二氧化硅弱、引起尘肺的潜隐期也较长而已。按照致病性粉尘的种类,可将尘肺大致分为五大类:
1.硅沉着病
又称硅肺(silicosis),系吸入含有游离二氧化硅的粉尘所致。
2.硅酸盐肺(silicatosis)
系吸入含有与金属离子相结合的二氧化硅(硅酸盐)粉尘所致,如石棉肺、滑石尘肺、云母尘肺、水泥尘肺等。
3.碳素尘肺(carbon pneumoconiosis)
系吸入含炭粉尘所致,如煤肺、石墨尘肺、炭黑尘肺、活性炭尘肺等。
4.金属尘肺(metallic pneumoconiosis)
系吸入某种金属粉尘所致,如铝尘肺、钡尘肺等。
5.混合性尘肺(mixed pneumoconiosis)
系吸入两种或多种粉尘所致,如电焊工尘肺、煤硅肺、铁硅肺等。
我国2013年颁布的职业病分类目录中将硅肺、煤工尘肺、石墨尘肺、石棉肺、炭黑尘肺、滑石尘肺、水泥尘肺、云母尘肺、陶工尘肺、铝尘肺、电焊工尘肺、铸工尘肺等12种尘肺规定为法定职业病;还另外预留了尘肺病种的扩展空间,即根据《职业性尘肺病的诊断》和《职业性尘肺病的病理诊断》可以诊断的其他尘肺。
很多工业生产过程可以产生粉尘,尤其是下列这些生产岗位,如防护措施不良,即可引起尘肺:
1.矿山开采
各种金属和非金属矿山(包括金属矿、石棉矿、煤矿等)的开采、凿岩、爆破,以及运输、粉碎、焙烧、加工等过程。
2.机械制造业
如铸造、造型、清砂、打磨、电焊等工种。
3.建筑材料(包括、耐火材料、水泥、石料等)生产制造
包括开采、运输、破碎、筛选、切割、打磨等过程。
4.其他
如公路、铁路、水利、水电建设中的隧道开凿、工程爆破,以及陶瓷、玉器、砂轮、油毡等加工、生产过程。
1.尘肺发病机制的经典学说
近百年来,尽管进行了大量的研究,但对尘肺发病机制的认识,一直停留于对海量数据的困惑中,认识偏于局限,缺乏整体关联,不少认识仍止步于几种古老学说之前,认为尘肺的发病机制过于复杂,难以澄清厘清。经典的尘肺发病机制学说主要有如下几个:
(1)机械作用学说
人们对石棉沉着病(又称石棉肺)的研究发现,胸膜内的石棉纤维绝大多数是细而短的温石棉,因易于刺入胸膜而具有较强的损伤性;此种纤维体积较大,更不易经由淋巴系清除;闪石石棉纤维直而硬,机械刺激作用更强,故接触闪石石棉者肺间皮细胞瘤的发病率也最高。因此认为,机械刺激作用可能是尘肺发病的重要机制,Setanton还据此提出了纤维“外观(长/径)比值(aspect ratio)”的石棉肺发病理论。
(2)表面活性学说
由于任何物体表面都能吸附所在介质中的分子和颗粒,表面积越大,吸附力也越大,因此提出,粉尘颗粒也可吸附那些在肺内产生的氧自由基(如硅氧自由基、硅过氧基、超氧阴离子、羟自由基等),并借此引起肺组织脂质过氧化和炎症性损伤,最终导致成纤维细胞增生及肺纤维化。
(3)免疫反应学说
免疫反应是人体抵御外来侵袭和维持体内环境平衡的一种重要方式。从尘肺病理形态来看,初期的硅肺结节含有较多细胞成分,随着病变进展,导致大量纤维组织增生,使硅结节逐步转化为无细胞成分的玻璃样变组织,推测此一过程可能有抗原-抗体反应参与;有关尘肺的生化、血清免疫学等方面研究资料亦证实尘肺发生发展过程中有免疫因素参与。
(4)肺泡巨噬细胞(pulmonary alveolar macrophage, PAM)激活学说
粉尘进入并滞留肺组织时,可激活肺内广泛存在的巨噬细胞,使之吞噬尘粒,并产生大量炎性物质和活性氧类(reactive oxygen species,ROS),进一步吸引巨噬细胞集聚,引起巨噬细胞性肺泡炎;吞噬尘粒的巨噬细胞会发生坏死崩解,释出粉尘颗粒,这些粉尘和含尘巨噬细胞(尘细胞)可在肺间质(包括淋巴组织)聚集,形成粉尘灶(尘斑),再进而形成尘细胞肉芽肿,其可逐渐被胶原纤维取代,导致肺纤维化。此学说自20世纪60年代提出以来,已逐渐为学界接受,但其对发病的关键环节,如巨噬细胞的激活、肺组织的损伤修复、粉尘的归宿等细节仍缺乏清晰诠释,总体认识仍处于朦胧状态,也使临床精准诊断和有效治疗难有进展。
2.尘肺发病机制的深入进展
(1)分子层面的认识
近一二十年来,由于分子生物学、分子免疫学等领域的飞速进展,已经勾画出尘肺发病机制的细致环节,其清晰度并不亚于目前对其他疾病的认识。兹以最为典型、致病力最强的硅尘(SiO2粒子)为例:
研究发现,硅尘本身即具有“病原体相关分子模式”(pathogen-associated molecular pattens,PAMPs)或损伤相关的分子模式(damage associated molecular patterns,DAMPs)特征,前者是存在于低等微生物细胞壁上的一些保守成分,后者则来自机体细胞死亡所释出的内源性分子,这些成分在高等哺乳动物体内均不存在,属于“非己成分”,故可借此被体内免疫细胞识别,进而启动激活、吞噬、清除等一系列免疫应答反应。因此,硅尘一旦进入肺泡或肺间质并与肺巨噬细胞(pulmonary macrophage,PM)相遇,尘粒表面的这些结构特征即会为PM膜上模式识别受体(pattern recognition receptor,PRRs)识别,这些受体——如清道夫受体(scavenger receptor,SRs)、Toll样受体(Toll-like receptors,TLRs)、核苷酸结合寡聚化结构域(NOD)样受体[nucleotide binding oligomerization domain(NOD)-like receptors,NLRs)等,都是一些异质非酶跨膜蛋白质,可以识别来源于非高等动物保守的分子结构,通过一系列蛋白级联反应使PM进入激活状态,吞噬SiO2尘粒,进而经由NALP3炎性体、MAPKs信号通路激活NK-κB、AP-1等核转录因子产生更多炎性因子吸引更多巨噬细胞,加剧巨噬细胞性肺泡炎;激活的巨噬细胞会释放各种生物活性因子和大量活性氧,直接损伤肺泡间质成分(包括肺泡毛细血管)和肺上皮细胞。上述粉尘颗粒和含尘巨噬细胞(尘细胞)在肺间质及淋巴组织聚集,还可坏死崩解释出尘粒及细胞成分,进一步诱发炎症过程,在局部形成尘细胞肉芽肿——尘(硅)结节(dust noduls or silicotic nodules),肉芽肿为纤维组织取代后即导致肺纤维化。
综上可见,硅肺的本质其实就是一种非特异性肺内炎症反应,它主要包括三个重要环节:①进入肺内的SiO2尘粒,其可视为尘肺发病的“点火器”,因其一旦进入肺泡或间质,即可为肺巨噬细胞“识别”,并吞噬尘粒形成“尘细胞”(dust cells);此过程产生的ROS会通过激活线粒体凋亡通路甚至细胞死亡受体(TNFR-1、FAS等)介导巨噬细胞凋亡;凋亡细胞释出的尘粒,部分经肺内淋巴系统进入血液循环,尚未排出的尘粒又可再次为PM吞噬,重复上述过程。②肺巨噬细胞激活,此可视为引起肺间质炎症的“导火索”,因此过程会生成大量ROS及各种细胞因子,引起炎症的“瀑布效应”,不但招募更多巨噬细胞聚集,且造成肺组织损伤,包括间质组织(肺血管、肺淋巴管)和肺泡上皮。③肺损伤的过度修复,可视为肺间质纤维化的“加速器”,因大量激活的巨噬细胞产生的炎性因子不少成分,如白介素(interleukin)、趋化因子(chemokines)、肿瘤坏死因子-β(tumor necrosis factorβ,TGF-β)、结缔组织生长因子(connective tissue growth factor,CTGF)等,都是纤维化病变的正性调节因子,不但可诱导成纤维细胞大量分化为肌成纤维细胞(myofibroblast),而且能引起细胞外基质大量生成,从而在尘粒或尘细胞周围诱发肉芽肿、纤维化,形成真正的尘肺病变——“尘(硅)结节”。上述病变的积累必然会造成肺组织的结构重塑(remodeling),使细支气管、肺血管、肺泡等扭曲、变形、阻塞,最终导致肺通气障碍、肺气肿、肺大疱、肺循环压力增高、右心功能不全,低氧血症逐渐加重,构成硅肺典型临床表现的病理生理基础。
(2)肺内尘粒的归宿
以往多认为二氧化硅等尘粒基本不会溶解,一旦诱发肺内纤维化过程,则被包裹在胶原纤维中形成“硅结节”。近年利用电感耦合等离子体质谱技术(inductively coupled plasma mass spectrometry,ICP-MS)可以十分精确地检测血、尿、肺组织等生物标本中的含量;研究发现,呼吸性粉尘进入肺泡后,可透过直径10~15μm的肺泡孔(alveolar pores)进入间质,或被肺泡巨噬细胞(alveolar macrophage,AM)吞噬随痰液排出,也可在巨噬细胞凋亡后重复前述过程。吸入的粉尘量越多,接尘时间越长,进入间质的尘粒越多,肺间质的炎症反应愈加激烈,纤维化进程也随之加速。已有研究证实,进入肺间质的粉尘也可像进入间质的其他“异物”,如病毒、细菌、其他微生物等一样(大小均在5μm左右,甚至更小),可经由肺内淋巴系统排入血液,而后由尿液排出。本研究室利用胸导管淋巴瘘模型直接观察硅肺大鼠肺内硅尘排出机制和规律,利用免疫组化技术在显微镜下发现硅尘可以直接诱导肺内淋巴小管增生(采用LYVE-1标记),染硅大鼠肺间质淋巴管数量从灌注二氧化硅后一周开始即呈现时间依赖性增加,三周左右达到高峰;借助偏振光显微镜和扫描电镜,可见肺内各级淋巴管、支气管淋巴结均存在白色、折光的晶体颗粒,能谱分析进一步证实,该白色结晶即为二氧化硅;同时,其胸淋巴导管淋巴液、血清和尿中硅含量亦见增加,且与肺淋巴管密度呈直线相关;近年更有研究开始探讨尿硅在硅肺临床诊治中价值。大量临床研究还证实,肺内淋巴结中硅结节的形成远早于肺野其他部分出现的硅结节,提示肺内淋巴系统在肺内粉尘排出中确实具有重要地位。另有研究表明,如果接尘浓度不是很高[假设在时间加权平均浓度(time weighted average,TWA)上下],<5μm尘粒占80%,年工作时间为300天、日工作时间为8小时、劳动强度中等情况下接触30年,此接尘者肺内粉尘沉积量的理论值应在600g以上;但死亡病例尸检结果均显示,此类患者死后肺内SiO2含量平均仅3g左右,显示肺内99%的硅尘已经消失,从另一侧面提示肺内淋巴系统对肺间质粉尘强大的清除能力。
上述进展提示:①硅肺的本质实际上是肺间质的慢性非特异性炎症,病因即是硅尘本身;②硅结节并不是长在肺里的“石头”,其主要成分是机体的纤维组织,是蛋白质。这一新的认识为开展硅肺的科学治疗提供了重要的理论基础。
3.尘肺发病的影响因素
总的说来,尘肺的发病比较缓慢,病因不同,发病的潜隐期也不同,如硅肺,多在接触二氧化硅粉尘后5~10年后才发病,石棉肺则在接触石棉尘15~20年才发病,而煤工尘肺、水泥尘肺更慢,一般在接触粉尘20~30年后才发病;但其也受一些因素的影响,主要有:
(1)空气中粉尘浓度
作业场所粉尘浓度越高,发病率越高、发病时间也越短,提示加强防尘措施,减少接尘浓度,可以明显延长发病时间,减少甚至杜绝肺病的发生。
(2)粉尘性质
不同性质的粉尘致纤维化程度不同,其中以游离二氧化硅(SiO2)致纤维化的作用最强,其次为石棉和滑石;减少这些物质在粉尘中含量,也可明显延长发病时间,减少尘肺发生。
(3)粉尘颗粒大小
直径<10μm的粉尘才可被吸入呼吸道深部,故被称为“可吸入性粉尘”(inhalable dusts);直径<5μm的尘粒则被称为“呼吸性粉尘”(respirable dusts),它更为细小,分散度更大,更容易进入肺泡。
(4)进入肺泡粉尘数量
此为尘肺发病的重要影响因子,如有研究表明,进入肺内二氧化硅的总量不到4g者不会引起硅肺,达到5g以上可能引起Ⅰ期硅肺,6、7g以上才有可能引起Ⅱ、Ⅲ期硅肺。
(5)尘粒物理性状
新产生的尘粒,表面的生物活性和致纤维化能力均强;尘粒表面越粗糙,产生炎症刺激和致纤维化能力越强。溶解度低的粉尘(如二氧化硅、石棉等),致肺纤维化能力多较强,反之,致尘肺能力亦减弱(面粉、铍化合物等)。此外,粉尘颗粒的机械作用也不容忽视,如闪石石棉纤维直而硬,其导致的肺间皮细胞瘤的发病率也最高,此种机械刺激作用与石棉肺的发生尤其具有密切关系。
(6)机体状况
慢性呼吸道及肺部疾病者,防御功能下降,更易受粉尘侵袭;机体的免疫功能更对尘肺的发生发展有明显影响,如某些个体在接触煤尘后可出现免疫指标迅速增高(停止接尘后即下降),引起煤工尘肺后常伴发关节炎或红斑狼疮或结节性动脉炎或硬皮病或结节病等免疫性疾病,有的甚至发生“类风湿尘肺”(又称卡普兰综合征,Caplan syndrome)——肺内出现0.5~5cm、大小不一的圆形阴影,进展迅速,常伴有类风湿性关节炎;高浓度硅尘接触者有的尚可发生“急进性硅肺”(acute silicosis),接尘1年左右即发病,进展十分迅速,数年内即因呼吸衰竭死亡,肺内则出现大量蛋白沉积,均提示与免疫功能异常有关。
尘肺病按病因大致可分为五大类。
1.吸入游离二氧化硅粉尘所致的矽肺。
2.吸入硅酸盐粉尘所致的硅酸盐肺,如石棉肺、滑石肺、云母尘肺、陶工尘肺、水泥尘肺等。
3.吸入含炭粉尘所致的炭素尘肺,如煤肺、石墨尘肺、炭黑尘肺等。
4.吸入某种金属粉尘所致的金属尘肺,如铝尘肺等。
5.吸入两种或多种粉尘所致的混合性尘肺,如电焊工尘肺、煤矽肺等。
我国2009年颁布的尘肺病名单中,已将矽肺、煤工尘肺、石墨尘肺、炭黑尘肺、石棉肺、滑石尘肺、水泥尘肺、云母尘肺、陶工尘肺、铝尘肺、电焊工尘肺、铸工尘肺等12种尘肺病规定为我国的法定职业病;另外还规定,根据《尘肺病诊断标准》和《尘肺病理诊断标准》可以诊断的其他尘肺也可按职业性尘肺处理。
1.尘肺的基本病理改变
尘肺的基本病理改变为巨噬细胞性肺泡炎(macrophages alveolitis)、尘细胞肉芽肿(dust cells granuloma)和尘性纤维化(dust fibrosis);此类病理改变主要位于肺间质,三者并存,随时间推移逐渐以肺纤维化为主。
2.尘肺肺纤维化的基本类型
大致有三种:结节性肺纤维化(nodular pulmonary fibrosis)、尘斑性肺纤维化(dust spots pulmonary fibrosis)弥漫性肺纤维化(diffuse pulmonary fibrosis)。
(1)结节型肺纤维化
主要发生在接触硅尘或硅混合尘工种,是硅肺、煤硅肺的主要病理表现,基本病理改变是胶原和纤维组织(粉尘可以和胶原纤维共存,但以后者为主),称为“硅结节”(silicotic nodules),其也可融合形成大块纤维化,多分布在支气管和血管周围,以及肺泡、肺小叶间隔和胸膜,肺淋巴引流区域的淋巴结也可见结节和纤维化。肉眼观察呈圆形或类圆形,境界清楚,色灰黑,触摸有坚硬感,直径为2~3mm(范围多在1~5mm);也可为硅结核结节,即硅结节或混合尘结节与结核性病变混合形成结节。晚期或重度硅肺的病理特点是数量不等的硅结节互相融合形成团块,或代之以粗大的胶原纤维;团块中血管、淋巴、气道俱被毁损,肺组织重塑严重,构成死腔通气、肺大疱、肺气肿、肺内分流、淋巴循环受阻、肺循环高压、严重低氧血症的病理基础。
肺引流淋巴结也可查见硅结节,且早于肺内硅结节形成;硅肺病例尸检发现肝、脾、腹腔淋巴结中也可出现硅结节,提示肺内硅尘可通过淋巴进入血液循环,表明肺内淋巴系统确为肺内粉尘的重要排泄途径。
(2)尘斑型肺纤维化
多见于煤尘、炭系粉尘及金属粉尘所致之尘肺,见于铸工和电焊工尘肺。尘斑主要由尘粒和胶原纤维构成,偶见结节形成,灶周有肺气肿,所在处小叶间隔及胸膜下纤维化明显,脏层胸膜表面尘斑甚至聚合成大小不等的黑色斑片。尘斑外观呈灰黑色、质软,境界不清,直径0.5~1.5mm,灶中可见网织纤维、胶原纤维与粉尘相间杂,但以粉尘为主;病灶与纤维化肺泡壁或肺间质相连呈星芒状,位于小叶中心。
煤尘还易引起肺内大块纤维化(直径大于20mm);个别免疫功能异常的煤尘接触者甚至可在类风湿关节炎基础上伴发“类风湿尘肺结节”。
(3)弥漫性肺纤维化
主要发生于石棉肺,也可见于水泥、滑石、电焊尘等所致尘肺。主要病理改变为弥散全肺的肺纤维化,病变由剥脱性支气管-肺泡炎开始,逐渐发展为支气管及其周围肺泡纤维化;由于无气肺泡增多,常形成小支气管的囊样扩张,构成蜂窝样改变,甚至进展成胶原纤维硬化区;胸膜病变与肺内病变同步进行,其可因石棉纤维刺激而发生急、慢性炎症,形成局部或弥漫性增厚;肺引流淋巴结无特殊变化。
X线影像学检查是肺部疾病最重要、可靠、直观检查手段,自1935年左右开始出现防电击、防散射的X线设备后,使该技术在临床得到广泛应用,80余年来,成像技术从普通摄影发展为高千伏摄影、体层摄影、数字X线成像、计算机体层成像等,显示和分辨能力不断提高,使临床诊断水平得到大幅提升。我国用于尘肺诊断的X线影像技术近年也开始从高千伏摄影逐渐向数字X线成像过渡,希望不久将来,能有更多影像学新技术得以用于尘肺的诊断工作。根据目前常用X线成像技术,尘肺的肺部特征性X线表现有如下几个:
1.小阴影(small opacity)
主要指肺野内最大直径不超过10mm的阴影,根据其形态不同,可分为圆形或不规则形两类,圆形小阴影按直径大小又分成p(<1.5mm)、q(1.5~3mm)、r(>3mm)三种;不规则小阴影也可按直径大小分成s(<1.5mm)、t(1.5~3mm)、u(>3mm)三种。
(1)圆形小阴影(round small opacity)
X线胸片上呈圆形或椭圆形阴影,直径1~5mm,边界较清晰,质地较致密,其相应的病理学基础主要是硅结节,较大的阴影多半是多个硅结节相互重叠的结果;石棉肺在X线胸片上也可出现圆形小阴影,可能是肺内弥漫性纤维化相互重叠所致,而非真正的结节性病变。X线胸片上圆形小阴影的大小和密度与吸入粉尘中SiO2含量有一定关系,一般而论,p型小阴影密度也较低,多见于煤尘和其他含SiO2较少粉尘引起的尘肺;较大的小阴影(如q型小阴影)密度也往往较高,则多见于含游离SiO2较高粉尘引起的尘肺。此外,小阴影的致密程度还与尘结节周围组织的对比度有一定关系,尘结节周围出现一定程度肺气肿,可使小阴影更易显现,轮廓也更清晰,但严重的肺气肿亦会遮掩小阴影,使之影像模糊。
圆形小阴影偶可发生钙化,可能与尘结节中心血管闭塞引起结节变性、软化、机化有关,因在此基础上容易引起钙质沉着。钙化点的密度明显增高,边缘锐利;可表现为小阴影中心钙化,也可为多个小钙化点成簇出现于小阴影中。
(2)不规则小阴影(irregular small opacity)
主要指X线胸片上一些粗细、长短、形态不一的致密阴影,可以互不相干,也可杂乱无章地交织在一起,构成毛玻璃状、网状、蜂窝状表现;其相应的病理学基础是弥漫性肺间质纤维化,也可能与各类尘结节、支气管扩张、肺大疱及肺组织重塑等病理变化有关。此类阴影尤多见于石棉肺、煤工尘肺、陶工尘肺。
2.大阴影(large opacity)
指直径和宽度大于10mm以上的阴影,除肺部表现外,还可以有胸膜和肺门阴影的改变;其相应的病理学基础是肺间质出现范围较大的纤维化,使众多尘结节被融合在一起;其大小差异很大,可从直径10mm到侵占一侧肺的大半,且不受叶间裂的限制,多见于SiO2含量较高的粉尘引起的尘肺,如硅肺。
大阴影大多由较密集的类圆形阴影聚集形成,初时密度并不均匀,单个小阴影仍可分辨,周围气肿带不明显,边界也不太清晰,通常称为“小阴影聚集”(aggregation of small opacities);随纤维化加剧,小阴影轮廓逐渐消失,最终形成密度均匀、边界清楚的大阴影。其多对称分布于两肺上、中野中、外带,呈“八”字形,周围有较清晰的气肿带;有时也可在单侧肺野出现,右侧往往居多;此种大阴影还可向上、下延伸,纵贯全肺。
大阴影有时也可由两上肺的“发白区”发展而来,阴影外缘常与胸壁相连,密度由外向内逐渐降低,边界不清;随病情进展,逐渐形成密度高而均匀、轮廓清晰的条形大阴影,并向肺门靠拢,阴影外侧出现气肿带。有时大阴影可由少量斑片、索状阴影,逐渐形成条状大阴影,多与后肋骨垂直,常见于两肺上肺野中、外带(有时也可发生于其他部位,如心影区、脊柱或纵隔旁,后前位X线胸片则难发现,需做CT检查方易观察)。大阴影有时也可表现为单发或多发的类圆形大阴影,密度较高,边界清楚,外侧缘有气肿带,其发展多较缓慢,可见于各个肺区。
大阴影中心可发生空洞,多因感染后发生液化坏死所致,最常见于结核感染,洞多较小,洞壁较厚,且不整齐,需注意与结核空洞鉴别。
3.肺纹理(lung markings)
主要为肺血管(也包括伴随的小气管、淋巴管)的投影形成,正常时从肺门向外延伸,由粗变细,逐渐减少或消失;尘肺患者则见肺纹理增多、增粗,直至外带,乃血管周围发生纤维变性所致,支气管壁增厚时尚可形成与肺纹理平行的双线影。肺内纤维化严重时,由于发生肺组织重塑、纤维组织牵拉、血管走向改变或管腔闭锁,可使肺纹理紊乱、模糊、减少、中断,甚至消失;支气管和肺泡感染也可引起上述变化。
4.肺门(hilus of lung)
在解剖上,肺门是由肺根部的大动静脉、支气管、淋巴结、结缔组织、脂肪等成分构成。在X线胸片上,肺门主要是肺内大血管的投影,正常淋巴结不易显示;一旦尘细胞在肺门淋巴结聚集崩解,并导致淋巴结发生胶原增生或纤维化,X线胸片上即呈现肺门增大、密度增高影像。纤维增生的淋巴结易发生坏死、钙盐沉积(于包膜下),形成肺门“蛋壳样钙化”,多见于双侧肺门或肺门附近肺野,可见于各期尘肺,甚至在肺野出现小阴影前,与粉尘接触量和粉尘含硅量有密切关系。肺门部位的纤维增生、收缩、牵拉还会造成肺门结构紊乱、轮廓不清、向上或向外移位;晚期患者由于肺循环压力升高、扩张,则产生肺门残根现象;肺门部位的纤维组织还可牵拉肺内大阴影向肺门移动,与肺门和纵隔阴影重合,使阴影外侧膨成弧形,但周围常有较为显著的气肿带,与纵隔肿瘤有别。
5.其他改变
主要有如下两个:
(1)胸膜
胸膜改变以石棉肺最为突出,最常见“弥漫性胸膜增厚”,主要由脏层胸膜增厚引起,也可见于其他尘肺及非尘肺性肺疾病(如结核性胸膜炎、脓胸及肺内慢性炎症等),并非尘肺的特异性改变。对石棉肺具有诊断意义的胸膜改变为“胸膜斑”(pleural plaques),其为厚度大于5mm的局限性胸膜增厚阴影,多发生于中、下肺野侧后壁层胸膜,也可波及心包膜和膈面胸膜,使该部膈肌呈现局限性僵直;如心包膜与胸膜粘连、增厚,则易造成心缘模糊紊乱,形如毛发,故称“蓬发心(shaggy heart)”;胸膜斑易发生钙化,使其更易辨认。
(2)肺气肿
也是尘肺最常见的并发症之一,主要因终末细支气管远端气道弹性减退,或伴有气道壁破损所形成,主要因吸烟、感染、大气污染、长期吸入刺激性化学物质或粉尘等引起慢性细支气管炎症,造成管腔狭窄或阻塞而致;此也与蛋白酶-抗蛋白酶功能失衡有关——因慢性炎症可引起体内蛋白酶活性增高,α1抗胰蛋白酶缺乏者对蛋白酶的抑制能力减弱,更易发生肺气肿。尘肺患者常见如下几种类型:①弥漫性肺气肿,X线胸片上可见两肺透光度普遍增高,肺纹理稀疏;肋骨趋于水平,肋间隔增宽;横膈降低;心膈角和肋膈角均增大。②瘢痕旁肺气肿,多表现为环绕大阴影周围的透明带。③泡性肺气肿,X线胸片上表现为蜂窝样改变。④肺大疱,大小不一,分布广泛,X线胸片上表现为薄壁透亮区,可呈多房性,泡壁也可不完整;其可压迫附近肺组织造成肺纹理靠拢、小阴影密集,多见于晚期尘肺。
近年由于对尘肺发病机制认识的提升,发病的关键环节获得了较为清晰的诠释,为尘肺新的治疗策略提供了科学依据。近年的临床实践表明,尘肺的彻底治愈已经成为可能,尘肺的临床预后已逐渐呈现出重大变化。主要策略是利用现有条件,采用中西医结合办法,针对尘肺发病机制的关键环节展开综合阻遏,实施要点有以下五个方面:
1.改善咳痰喘症状
此症状虽非尘肺的特征性表现,而是慢性支气管炎、慢性阻塞性肺疾病的表现,大约见于40%尘肺患者,且主要与吸烟有关,但随肺内纤维化病情加剧,常成为晚期患者的主要病情之一,故需尽力克服。其治疗的首要措施除戒烟外,还需注意消除其肺循环障碍,降低肺循环压力,改善右心功能;其次是采用临床应对慢性阻塞性肺疾病的治疗原则,如消炎、止咳、祛痰、平喘、肺脏灌洗等,积极改善症状。鉴于尘肺患者抵抗力普遍下降,且存在不同程度弥漫性肺纤维化和肺组织重塑,很易发生各类感染,治疗中尤需注意如下几点:
(1)加强肺内感染预防
如适当加强深呼吸锻炼,注意防寒,避免出汗时脱衣,避免流感流行期间出入公共场所,每年入冬前接种流感疫苗等。
(2)抗感染
一旦发生呼吸系统感染,应尽早给予规范的抗菌药物治疗,可能情况下应及时选择敏感抗菌药物。
(3)加强排痰
对此类患者最为重要,首先应培训其本人和家属学会体位、手法、机械辅助等排痰方式。此外,可使用祛痰剂降低痰液黏滞度,使之易于咳出。目前临床最常使用的祛痰药是黏液溶解剂,如蛋白分解酶(如链道酶strptodornase)、二硫键裂解剂[如乙酰半胱氨酸(acetylcysteine),羧甲基半胱氨酸(carbocisteine),厄多司坦(erdosteine)]和糖蛋白溶解剂[如溴己新(bromhexine),氨溴索(ambroxol)等];以雾化吸入疗效更好,高渗盐水甚至盐粒气溶胶雾化吸入也能达到良好的祛痰效果。
(4)平喘
喘息为本病患者另一突出症状,故解痉、平喘为改善呼吸系统症状的又一重点。一般可用甲基黄嘌呤类平喘药[如氨茶碱(aminophylline)、多索茶碱(doxofylline)等]、β2受体激动剂[如丙卡特罗(procaterol)、沙美特罗(salmeterol)、福莫特罗(formoterol)、博利康尼(bricanyl)等,后三者有吸入剂型,效果更好,但沙美特罗需30分钟才能起效,故不适治疗急性发作]、抗胆碱药[如异丙托溴铵(ipratropium bromide)、噻托溴铵(tiotropium bromide)等,后者作用时间长达24小时,应用更为简便],临床也可联用上述药物,以更有效地改善症状和肺功能。
(5)止咳
咳嗽虽然也是本病的常见症状,但多不严重,且患者多有黏痰,故一般情况下不宜使用强力止咳药,而应使用兼具祛痰、平喘作用药物,如复方福尔可定(compound pholcodine)等;刺激性干咳尚可选用右美沙芬(dextrome-thorphan)、苯丙哌林(benproperine)、苯佐那酯(benzonatate)、左羟丙哌嗪(levodro-propizine)等,但不宜久服,以免影响排痰。
气溶胶(雾化)吸入途径由于可将药物分散成细小微粒悬浮于气体中,容易进入呼吸道深部及肺内,故对于肺内病变尤其是慢性肺疾病的治疗具有优势,不仅可以大大减少用药量,增强肺部疾病疗效,且可改善呼吸道症状,值得推广;如有临床报告,即便单纯吸入岩盐气溶胶,亦有助于湿化气道、排痰消炎、止咳平喘,对于慢性气道炎症、哮喘和尘肺患者有明显辅助疗效。上述治疗虽非针对尘肺肺纤维化病变的根本措施,但对于提升患者生活质量、减轻心理压力、增强治疗信心均具重要价值,不可忽视。
2.抗炎治疗
前已述,在尘肺发病机制中,肺间质炎症既是尘肺发病的“导火索”,也是“火药桶”,因此,抑制肺内炎症反应当可有效阻遏尘肺发病进程,故为尘肺重要的基础治疗。由于尘肺发病的关键环节是肺间质存在持续炎症状态,故抗炎治疗必须长期坚持;注意此处所指“炎症”乃病理学范畴广义的“炎症反应”,并非狭义的“感染”。
(1)抗炎症
临床可采用的手段很多,如全面抑制炎症反应(NSAID、改性四环素类、免疫抑制剂等);或抑制相关炎症因子的合成酶,如脂氧合酶(减少前列腺素生成,可用苯恶洛芬、黄芩黄素等)、磷酸酯酶A2(减少花生四烯酸生成,可用糖皮质类固醇等)、血栓素合成酶(减少血栓素生成,可用咪唑、酮康唑等);或抑制白细胞与血管内皮吸附(可用白介素-4、白介素-8、转移生长子β、氨苯砜等);此外,乌司他丁(ulinastatin)也有明显抗炎作用,可在选用之列。原则是尽量选用使用方便、价格低廉、效果可靠、副作用小的药物,以便于推广。
(2)抗氧化
这是加强抗炎治疗效果的重要辅助措施。因粉尘(尤其是SiO2)本身、PM对SiO2的识别激活过程,以及之后发生的肺间质炎症,都会产生大量活性氧;现代医学科学进展更发现炎症的病理机制即是氧化损伤,肺内长期持续的氧化损伤引起的过度修复正是肉芽肿及纤维化发生的重要原因。目前已有大量抗氧化剂进入临床应用,如维生素类(维生素C、维生素E、β胡萝卜素等)、金属类(硒、锌等)、活性物质[如半胱氨酸、金属硫蛋白及氨基酸类(色氨酸、DL-甲硫氨酸、DL-组氨酸、L-半胱氨酸等)];不少中药也具有抗氧化功能,如五味子、雪莲、人参、红参、党参、丹参、生地、当归、酸枣仁、灵芝、何首乌、黄芪、白芍、生姜、桑叶、车前子、女贞子、枸杞子等。近年来,临床更常使用下列药物:还原型谷胱甘肽(GSH)、辅酶Q10、超氧化物歧化酶(SOD)、银杏叶制剂、红景天制剂、依达拉奉(edaravone)、乌司他丁(urinastatin)、α硫辛酸(alpha lipoic acid)等,效果肯定。
(3)减轻粉尘侵袭
一旦罹患尘肺,应尽早脱离粉尘接触。此外,还可采用肺灌洗疗法,如大容量全肺灌洗(massive whole-lung lavage,MWLL),此法虽对驱排肺间质粉尘、消除尘肺结节或纤维团块帮助不大,但对清除呼吸道内粉尘、分泌物、炎症细胞和细胞碎片,减少进入肺间质的粉尘量、减轻呼吸道和肺间质炎症、改善气道功能和症状,均有较好效果可将其列为尘肺的规范防治手段,定期(每4~5年)为接尘人员(包括尘肺患者)进行一次大容量全肺灌洗,以阻滞尘肺的发生和进展。
需要指出的是,上述抗炎措施是对疾病发生发展阶段的早期干预,故需尽早应用;但该类药物对疾病损伤的后果并无修复作用,临床很难对其“疗效”进行精确评估,但决不可因此而忽略其重要价值。
3.改善呼吸困难
呼吸困难是尘肺的特征性临床表现,其病理基础是肺间质广泛的胶原增生和纤维化导致肺间质结构重塑所造成的小气道和小血管狭窄闭塞、肺循环压力增高、肺血流减少,进而引起通气血流比例失调、肺循环“分流”、死腔样通气、右心功能不良、低氧血症,最终导致不断加重的劳力性呼吸困难。临床和实验研究证实,进入肺间质的粉尘绝大多数可以被肺内淋巴系统主动排出,残留在肺间质的粉尘仅为吸入量的1%左右,提示药物驱排粉尘并非治疗重点,而改善肺间质状况(包括血液循环、淋巴循环),不仅有助于促进粉尘排出,且可改善肺泡氧合功能,从而能有效减轻或消除呼吸困难。本项治疗重点有如下几个:
(1)降低肺循环压力
目前尚无专门针对因肺间质纤维化引起的肺循环高压的治疗药物,适合长期使用、副作用小、效果肯定的方法大致有如下几种:①缓和的扩胸和深呼吸运动;②鼓励经常饮水;③适当抗凝,如阿司匹林、华法林、蛇毒溶栓剂等;④血管舒张药,如地巴唑、烟酸肌醇、单硝酸山梨醇酯、钙离子通道阻滞剂(地尔硫䓬、硝苯地平、氨氯地平)等;也可吸入NO,但目前应用尚不普遍,仍需积累经验。其他扩血管药物如磷酸二酯酶5抑制剂、内皮素1受体拮抗剂、前列环素类等也可使用,但副作用较大、价格较贵,不适长期应用。
(2)合理氧疗
出现发绀或查有低氧血症者,需及时给氧,以保持血液循环有适度氧张力,防止低血氧引起血管收缩,加重症状。但对此类患者必须强调低浓度、低流量、间断给氧原则(重度患者在低氧血症纠正后亦应按此原则给氧),以免导致CO2潴留及呼吸性酸中毒。此外,长期高浓度给氧还会加速肺纤维化进程,应引起高度警惕。
(3)化解间质淤积状况
尘肺的呼吸困难,主要源于粉尘诱发的肺间质持续的炎症反应导致的间质胶原增生、纤维化生和组织重塑。多年研究已经证实此种“尘结节”或尘性纤维团块的主要成分是蛋白成分,并非粉尘本身;而由蛋白质引起的沉积是可以通过药物逆转(美国曾使用微小分子RNA使实验性尘肺大鼠肺纤维化完全消失),或予以化解、逆转、吸收的(如临床对于冠状动脉栓塞、脑栓塞、脑出血、血管栓塞等疾病治疗均取得很好效果),尘肺的肺间质胶原和纤维组织也不应例外。21世纪初开始,北京大学第三医院职业病研究中心的研究团队就此展开了艰苦的实验研究和临床实践,获得圆满结果,目前正组织全国性多中心临床研究,以期早日在临床推广,造福广大患者。鉴于专用药物尚需审批、临床试验等冗长过程,目前主要利用已在临床使用的类似药物代用,主要是通络活血化瘀类中草药(如通心络胶囊、蚓激酶胶囊、溶栓胶囊、三七丹参片、血塞通胶囊等);如辅以西医扩张血管、抗凝溶栓等药物,疗效当更为显著。一般在服用7~10天即可见效;30天为一疗程,间隔7~10天,直至症状明显改善或消失。
4.抗纤维化治疗
尘肺的抗纤维化治疗迄今仍无特效药物;动物实验曾显示有些药物可以抑制硅尘所致肺纤维化病变,如克矽平、磷酸哌喹、羟基磷酸哌喹、柠檬酸铝、汉防己甲素、矽肺宁等,但单独或联合应用于临床后均未见明显效果。临床曾寄希望于治疗特发性肺纤维化的药物,目前该类药物只有二个获得正式批准,即尼达尼布(nintedanib)和吡非尼酮(pirfenidone,piresupa),但迄今临床仅观察到对肺纤维化微弱的阻滞作用,并无法逆转纤维化进程。肺移植(lung transplantation)曾被认为是治疗特发性肺纤维化和晚期硅肺的希望,但由于肺移植的供体来源有限、移植后生存期较短(很少超过10年)、术后并发症较多、需终身接受免疫抑制剂治疗、费用高昂等原因,使其很难成为临床的常规治疗手段。其他抗纤维化方法仍在探索之中,如γ干扰素、酪氨酸激酶FAK、赖氨酸氧化酶、白三烯拮抗剂、内皮素受体拮抗剂、脯氨酸同系物、盐酸克洛肟、NO、CO、H2,甚至干细胞等,迄今尚未见可靠的临床效果报告。
5.辅助治疗
彻底戒烟、适当营养、合理的生活制度、适度的体育活动,以及对症治疗有助于提高机体抵抗力、改善肺功能、预防感染和并发症,对延缓尘肺进展,延长患者寿命具有肯定作用,应给予充分重视,并纳入规范化管理。
尘肺最根本的、最有效的防控手段是改善粉尘作业生产环境,完善工人个人防尘措施,切实减少工人的粉尘接触量。此概念百年以前即为人所熟知,发达国家自20世纪初开始,即不断加强立法并采取严格措施,大力改善粉尘作业卫生环境,降低作业工人的粉尘接触量,至20世纪70年代,其尘肺发生率几乎接近零。在新中国成立初期就曾着力强调粉尘作业卫生管理工作,并陆续颁布了一系列尘肺防治的政策、法规和办法,如1987年12月国务院发布的《中华人民共和国尘肺防治条例》、2001年修订的《中华人民共和国职业病防治法》(现为2018年修订),对防尘及职工健康管理等做了更加明确细致的规定,针对防尘降尘总结出了“宣、革、水、密、风、护、管、查”八字方针,提出三大防控措施:
1.组织管理措施
主要是加强领导,发动群众,建立和健全防尘规章制度,定期督促检查,开展卫生宣教,坚决贯彻“预防为主”方针。
2.生产技术措施
关键是改革工艺过程、革新生产设备;应用产尘量小和/或致肺纤维化能力弱的原材料,推广遥控操作、隔室监控等现代技术手段降尘防尘;尽可能地采用湿式作业,防止粉尘飞扬,降低生产现场的粉尘浓度;对不能采取湿式作业的场所,采用密闭尘源与局部抽风相结合的办法,防止粉尘外逸;要求粉尘作业场所空气中粉尘浓度达到国家卫生标准(表1)。
表1 工作场所空气中粉尘容许浓度(GBZ 2.1—2019)
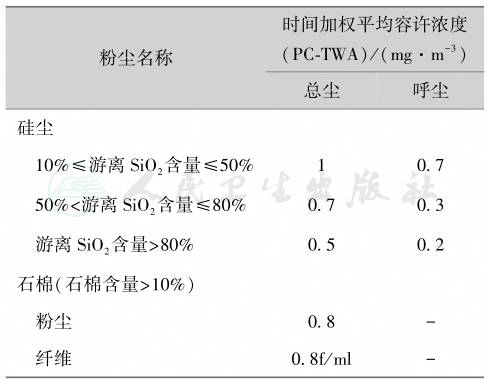
注:①总尘(total dust),指用直径为40mm滤膜,按标准粉尘测定方法采样所得到的粉尘;②呼尘为呼吸性粉尘(respi red dust)的总称。指按呼吸性粉尘标准测定方法所采集可进入肺泡的粉尘粒子,其空气动力学直径均7.07μm以下,空气动力学直径5μm粉尘粒子的采样效率为50%。
3.卫生保健措施
包括加强个人防护措施,如佩戴防尘护具(安全帽、防尘口罩、送风头盔、送风口罩等),讲究个人卫生,勤换工作服,勤洗澡等;接尘工人进行健康监护包括上岗前、在岗期间定期健康检查和离岗时体检;工龄较长的工人须进行离岗后随访检查等。
综上可见,尘肺的防治仍是一项艰巨任务,需要卫生行政部门、职业安全卫生监督机构、涉尘厂矿企业、各级医疗研究机构密切配合、长期积极坚决贯彻“预防为主”方针,彻底改变涉尘作业“脏、乱、差”的状况,才能有效遏制尘肺的高发趋势。值得反思和痛定思痛的是,尽管上述原则和法律、法规已经宣传、实施了60余年,但我国尘肺的发病情况依然十分严峻,发病率未见明显下降,累计的患病人数却近90万人,给国家发展和社会进步带来巨大压力。其实,彻底控制尘肺的发生并非“天方夜谭”式的神话,众多发达国家已经做出了榜样。关键在于所有的防护原则和措施必须依法认真执行,只要切实贯彻预防为主的方针,确保粉尘作业现场空气中粉尘浓度得到切实控制无需很久,我国就一定能够彻底消除尘肺,使健康中国战略目标得以顺利实现。













