中文别名 :SSc合并肺动脉高压
SSc合并肺动脉高压(SSc-PAH)的发病率为6%~60%,其中局限型SSc较易发生PAH。局限型SSc临床上诊断PAH者仅有9%,但病理活检发现65%有PAH。通常,50%~60%局限型SSc和33%弥漫型SSc合并PAH。SSc-PAH发生原因有两方面:一是继发于严重的肺间质纤维化;另外可能是由于肺血管本身的病变,也即孤立性的PAH,其严重程度与间质病变的程度无关。孤立性PAH几乎仅见于局限型SSc。孤立性PAH常见于长期合并雷诺现象、血浆ACA阳性、显微镜检查有甲皱毛细血管扩张的患者,而与年龄、性别、病程等无关。SSc发生PAH的危险因素包括:皮肤受累有限、病程超过10年、起病年龄较大、雷诺现象的严重程度和时间及甲褶毛细血管的密度等。肺弥散功能(DLCO)的降低是发生PAH的独立危险因素。
SSc发生PAH的机制为进行性的肺纤维化和血管闭塞,肺动脉血管痉挛,以及左室功能衰竭等。严重的肺间质纤维化导致肺血管逐渐闭塞、肺血管床进行性减少。研究表明肺活量(VC)和肺血管床大小线性相关,VC在50%~80%预测值时静息肺动脉压正常、运动时肺动脉压升高,VC小于50%时静息肺动脉压升高。肺血管痉挛是PAH的另一可能机制,其原因为收缩血管和舒张血管的因子比例失衡。内皮素-1(endothelin-1,ET-1)由肺血管的内皮细胞产生,内皮细胞功能异常,ET-1产生增加及其他缩血管因子产生减少,导致PAH。有研究报道,血流动力学监测过程中注入冰盐水时,引起肺动脉收缩、导致急性PAH,被称为肺雷诺现象。几乎所有局限型SSc合并PAH的患者都有雷诺现象,这部分患者从温暖环境转移到冷空气中时,会引起DLCO下降。此外,高凝状态、肺血管内膜增生和动脉外膜的纤维化导致的血管阻塞等因素也参与发病。高血压或者心肌受累时也会导致充血性的PAH。
继发于严重肺间质纤维化的PAH病理改变如前所述。孤立性的肺动脉高压几乎全发生在局限型SSc患者。肺血管病变主要累及肌性小动脉,小动脉向心型纤维化、逐渐替代了正常的内膜及中层,使血管壁增厚、硬化、狭窄。按病变严重程度分3级:1级指肌性动脉中层肥厚,内膜层内富含酸性黏多糖的胶原向心型沉积;2级病变包括血管内膜纤维弹性组织斑块形成,血管闭塞近50%;3级病变指多数动脉血管闭塞>75%。1、2级病变肺动脉压增高并不明显,3级病变常常有明显的PAH。严重的肺纤维化很少见。坏死性血管炎、丛样病变和再通几乎见不到。小动脉纤维弹性组织斑块中有单核细胞浸润,提示炎症和自身免疫导致血管内皮损伤。上述病变在局限型SSc中更明显,也可见于弥漫型SSc、但病变较轻。同样的病变可以出现在支气管动脉,肺静脉也可以有硬化表现。严重的孤立性肺血管病变可以继发的右心肥厚,并且比继发于肺纤维化者更严重。
1.影像学
X线胸片及胸部CT示肺野内大致正常。X线胸片可有PAH表现:右下肺动脉横径≥15mm,或右下肺动脉横径/气管横径≥1.07;肺动脉段突出、其高度≥3mm;中心肺动脉扩张和外周分支变细形成鲜明对比;右心室增大等。
2.超声心动图
经胸壁超声心动图(transthoracic echocardiography,TTE)是诊断PAH的无创性方法。TTE根据三尖瓣反流速度可以估测肺动脉收缩压(PASP),是目前最常用的筛查方法。荟萃分析显示,TTE测量的三尖瓣反流速度与右心导管结果有较好的相关性。其他可以提示肺动脉高压的TTE表现包括右房右室扩大,室间隔变形,肺动脉反流增加及右室射血加速时间缩短等。欧洲呼吸学会/欧洲心脏学会关于TTE诊断肺动脉高压的标准为,如果三尖瓣反流速度>3.4m/s并且PASP>50mmHg则提示很可能为肺动脉高压。如果三尖瓣反流速度≤2.8m/s,PASP≤36mmHg,并且无其他提示肺动脉高压的超声表现,则肺动脉高压可能性很小。
3.脑钠肽N末端片段(NT-proBNP)
Pro-BNP也可用于SSc-PAH筛查。Pro-BNP水平与右心导管血流动力学相关。Pro-BNP>240pg/ml对于诊断SSc-PAH的特异度为90%。但是Pro-BNP正常不能除外PAH。另外,SSc可有心肌受累和心功能不全,Pro-BNP也可以增高。
4.肺功能
合并ILD时肺功能改变如前所述。PAH肺功能障碍表现为单纯性DLCO下降。因此DLCO也可以用于筛查PAH。DLCO<43%诊断PAH的敏感度为87%。DLCO/VA<70%提示2.5年内发生SSc-PAH的风险增加18倍。SSc-PAH患者中DLCO>80%很少见,仅有不到1/6的SSc-PAH患者DLCO>60%。
5.右心导管检查
经外周静脉(颈内静脉、锁骨下静脉)插入导管,经腔静脉、右心房、右心室达肺动脉,可以直接测量肺动脉压力。右心导管是测肺动脉压最准确的方法,可以诊断上述无创手段不能发现的PAH。仅有约1%的SSc-PAH患者血管舒张试验有反应,并且SSc-PAH患者使用钙离子拮抗剂治疗有多种副作用。因此目前指南并不推荐SSc-PAH患者在右心导管检查时进行血管舒张试验,也不推荐使用钙离子拮抗剂。
6.6分钟步行试验
在特发性肺动脉高压患者中,6分钟步行试验有助于评估病情进展和监测治疗反应,但在SSc-PAH患者中的应用尚未证实。SSc患者骨骼肌肉受累较常见,可影响6分钟步行检测结果。
1.一般治疗
血氧饱和度低于90%可予以氧疗。水肿或者容量过多时使用利尿剂。难治性右心衰竭所致的心律失常时使用地高辛治疗。IPAH和CTD-PAH合并晚期PAH时,可以口服抗凝治疗,但是抗凝治疗的风险效益比尚不明确。由于SSc患者溃疡性食管炎和胃窦血管扩张的发病率较高,不到一半的SSc-PAH患者能够耐受长期抗凝治疗。因此SSc-PAH是否抗凝应该个体化,充分衡量获益及出血风险。
2.扩张肺血管药物治疗
目前已有三类药物可以用于SSc-PAH治疗,包括前列环素类似物、内皮素受体拮抗剂和磷酸二酯酶抑制剂。但是目前上述药物尚不能改善预后。目前不推荐使用钙离子拮抗剂治疗SSc-PAH,但钙离子拮抗剂可以用于改善雷诺现象。SSc-PAH的治疗要比IPAH复杂,治疗有效率更低。
(1)前列环素(PGI 2)类似物:
依前列醇(epoprostenol)是已知的治疗PAH最有效的药物,并且是唯一被随机对照研究证实可以改善IPAH生存的药物。依前列醇治疗SSc-PAH,可以改善活动耐力和血流动力学,但是不能改善生存。依前列醇的缺点是需要持续静脉注射,使用不方便。吸入前列环素类似物是另外一种选择,但是目前还没有治疗SSc-PAH和CTD-PAH的队列研究。Triprostinil(remodulin)可供皮下注射,但是由于注射后局部皮肤疼痛,限制其使用。目前推荐前列环素类似物适用于美国纽约心脏病学会(NYHA)心功能分级四级、一线治疗无效的SSc-PAH患者。国内只有吸入性伊洛前列素上市,该药起效迅速,但作用时间较短,半衰期为20~25min。每次吸入5~20μg,每天6~9次。
(2)5型磷酸二酯酶抑制剂:
西地那非及他达拉非同其他降肺动脉压药物比较优势在于口服给药,耐受良好,并且每天只需要用1次(他达拉非)至3次(西地那非)。关于西地那非治疗SSc-PAH的研究数据解释起来比较困难,这是由于缺乏单纯为SSc-PAH设计的试验。研究表明,西地那非治疗PAH 12周,可以改善6分钟步行距离。该试验亚组分析显示,西地那非治疗CTD-PAH(其中45%为SSc-PAH),6分钟步行试验增加55米,mPAP和PVR也有改善。尽管数据仍然有限,但是由于费用较低,使用方便并且耐受良好,5型磷酸二酯酶抑制剂仍然被列为治疗SSc-PAH的一线用药。西地那非推荐初始剂量20mg,每天3次。
(3)内皮素受体拮抗剂:
波生坦是口服内皮素受体拮抗剂,治疗IPAH能够改善6分钟步行距离、血流动力学和临床恶化时间。但是有小规模回顾性研究显示,波生坦对于SSc-PAH疗效不佳,多数患者随诊6个月功能分级有下降。安立生坦(ambrisentan)是选择性更强的内皮素受体拮抗剂。能够抑制内皮素A受体激活介导的血管收缩和细胞增殖,而保留了内皮素受体B的功能,后者可以促进一氧化氮和前列环素(prostacyclin)释放起到血管舒张作用。安立生坦能够改善CTD-PAH患者的6分钟步行距离。荟萃分析显示,内皮素受体拮抗剂能够改善PAH患者的活动耐力,但是亚组分析显示CTD-PAH(多数为SSc-PAH)疗效不显著。尽管指南推荐内皮素受体拮抗剂和磷酸二酯酶抑制剂并列为PAH治疗的一线用药,但是对于SSc-PAH,有专家推荐内皮素受体拮抗剂用于不能耐受磷酸二酯酶抑制剂或者磷酸二酯酶抑制剂单药治疗无效的患者。波生坦推荐用法是初始剂量62.5mg,每天2次,连用4周;后续剂量125mg,每天2次,维持治疗。
(4)联合用药:
对于单药治疗无效的患者,可给予联合用药治疗。目前有多个临床试验证实,联合治疗PAH效果优于单药治疗。但是这些研究没有包括足够的SSc-PAH患者。以下情况可以考虑联合用药:如果胃肠外用药治疗不可行的情况下,联合用药可以作为替代方案;等待肺移植的过渡期;帮助胃肠外用药减量。
SSc治疗方案如图2所示。
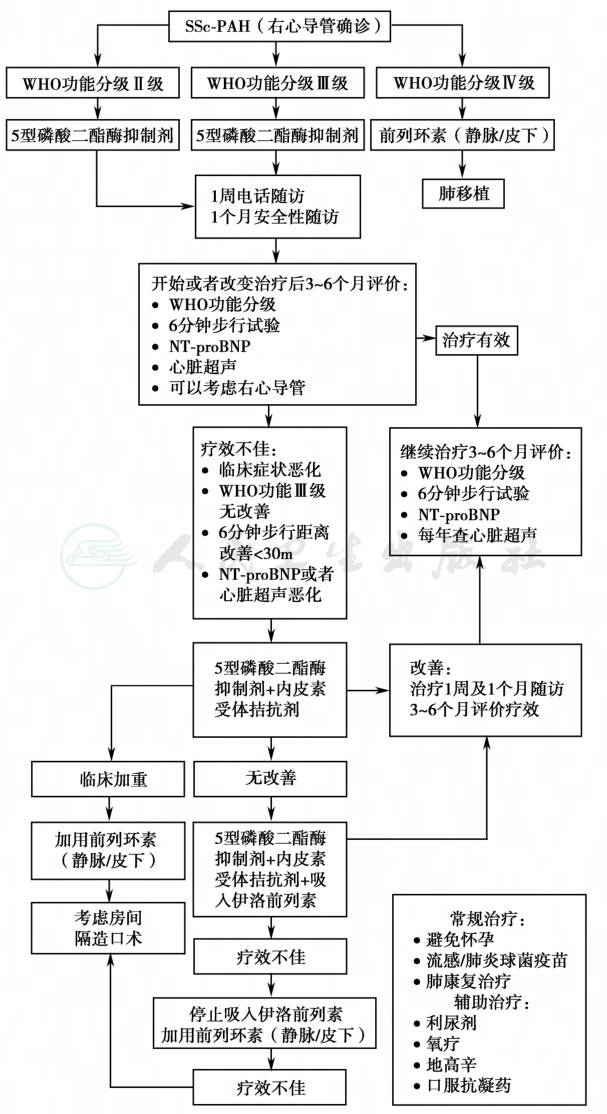
图2 SSc-PAH治疗方案(Johns Hopkins肺动脉高压方案)
3.肺移植
终末期患者、无其他脏器活动性病变者可以考虑。













