结缔组织疾病(connective tissue diseases,CTD)是一组临床上常见的自身免疫性疾病,为侵犯全身结缔组织的多系统疾病,可累及多种脏器,使疏松结缔组织发生黏液性水肿、类纤维蛋白变性、小血管炎性坏死和(或)组织损伤。CTD包括类风湿关节炎(RA)、系统性红斑狼疮(SLE)、系统性硬皮病(SSc)、干燥综合征(SS)、多发性肌炎/皮肌炎(PM/DM)、复发性多软骨炎(RP)、强直性脊柱炎(AS)和显微镜下多血管炎(MPA)等多种疾病。由于肺和胸膜由丰富的胶原、血管等结缔组织构成,且有调节免疫、代谢和内分泌等非呼吸功能,故CTD大多可损伤肺和胸膜等呼吸系统各器官,累及呼吸肌群、胸膜、传导气道、小气道、肺实质、肺间质和肺血管等,诱发结缔组织病的肺部表现。结缔组织引起肺和胸膜病变的病理基础是:间质炎症、肺泡间隔炎症、血管炎、肺泡渗出、肉芽肿形成和胸膜渗出等。CTD引起肺、气管-支气管、肺血管、胸膜、咽喉和呼吸肌的病损时,常以咳嗽、咳痰、气短等呼吸系统症状为首发症状。而且这些患者并发社区获得性肺炎以及与免疫抑制药物相关的肺部感染发生几率增加。抗肿瘤坏死因子α(TNF-α)制剂增加了感染的风险,尤其是分枝杆菌感染,包括结核和非结核性分枝杆菌感染。细胞毒药物,特别是甲氨蝶呤和金制剂,也能够诱发肺间质各种各样的非感染性反应,常与原发性的结缔组织病的肺部表现难以鉴别。
近年来关于结缔组织病在肺部表现的报道日益增多,肺部表现往往与全身疾病同时或先后出现。但也有部分患者首先出现肺部表现,其病因尚不清楚。临床上大部分结缔组织病的肺部表现发生在已经明确诊断的结缔组织病患者中,但是有时肺部病变可能比典型的系统性表现出现更早。例如,RA和PM/DM患者中,肺部间质性病变的出现也许会早于关节和肌肉的病变数月甚至数年。SSc病例也有类似报道。已有研究发现19%的患者最初诊断为特发性肺纤维化,而在其后的1~11年期间发展为结缔组织疾病,其中主要是RA或PM/DM。这些患者以年轻患者居多,且大多数为女性。胸膜炎伴有或不伴有胸腔积液常常是RA或SLE的先兆表现。已有报道急性免疫性肺炎或弥漫性肺泡出血可能是SLE、PM/ DM和混合结缔组织疾病的信号。
实际上,结缔组织疾病合并肺部并发症和胸膜病变的发生频率变异较大。高达60%的患者在疾病过程中可以发现间质性肺疾病(ILD),而SSc患者尸检病理发现100%有肺间质病变。但在强直性脊柱炎患者中间质性肺疾病并不多见。总之,目前间质性肺疾病在结缔组织疾病中的发生率正在增加,这与当今临床医师对疾病的认识水平不断提高相关,也与现有的诊断技术发展有关,例如HRCT的应用、支气管肺泡灌洗的开展,因而能够在临床症状不明显以及胸片正常的患者中,发现肺部异常改变。许多早期病例的发现依靠生理学检查,包括:肺功能检查,肺容积测定和弥散功能测定等。目前静息状态下和运动气体交换临床应用不多,实际上这是间质性肺疾病最敏感的生理指标。
结缔组织疾病是继发性间质性肺疾病(ILD)的首要原因,ILD在 CTD各疾病类型中的发生率有所不同,SSc为58%~80%、PM/DM为43%、RA为18%、SLE为18%、SS为13%、混合结缔组织疾病(MCTD)为30%~85%。ILD是导致CTD死亡的重要原因之一,结缔组织疾病合并间质性肺疾病(CTD-ILD)的病死率:SSc为9%~30%、PM/DM为30%、RA为5%、SLE为18%、SS为13%、MCTD为30%~85%。在美国CTD-ILD占全部ILD死亡的25%。北京协和医院1990~1997年住院CTD病例统计结果显示,ILD在结缔组织疾病中的发生率和死亡率分别如下:SSc为49.4%和12.5%、PM/DM为57.4%和31.9%、SS为15.5%和11.1%;而ILD的发生率:RA为22.5%、SLE为3.2%、MCTD为14.5%。
因此为了认识和研究CTD肺部表现的临床与发病机制,必须熟悉和重视CTD在呼吸系统的临床表现、发病机制、组织病理学、诊断方法、诊断标准和治疗。CTD的肺部表现临床诊断较困难。有时即使已经明确诊断为全身CTD的患者,如出现呼吸系统症状,仍须严格排除肺部感染、肺水肿等肺部其他各种常见并发症,才能诊断结缔组织病的肺部表现,必要时应该行肺、胸膜活检。支气管肺泡灌洗(BAL)、放射性核素扫描和胸部HRCT等对CTD肺部表现有一定诊断意义。
肺部优势结缔组织疾病(lung-dominant CTD)是新近提出的一个临床概念,特指一类患者,其基础疾病是系统性自身免疫疾病,但临床上仅仅表现为某种间质性肺炎;而且这些患者的临床预后比特发性间质性肺炎(IIP)患者的预后要好。这些患者可能属于隐性的CTD患者或者为不完全类型的CTD合并间质性肺炎患者,现把这些特殊类型的患者归类于“肺部优势结缔组织疾病”,以便提供一个平台进行多学科合作研究。
临床上已经发现相当一部分的IIP患者存在循环自身抗体、特异的组织病理学改变或肺外表现,但按照目前的风湿病学诊断标准,还不能将其归纳于某种特异的CTD疾病,因为患者仅仅有间质性肺炎的表现,而无CTD的其他表现,故难以诊断为某种CTD。现有的CTD分类诊断标准是基于特异的肺外症状和体征、加上特异的血清学自身抗体检查。这些患者其基础疾病很可能为隐性的CTD或者是系统性自身免疫疾病的不完全类型,其肺部表现实际上属于CTD的肺部表现。
隐性的CTD实际上并不少见,在IIP患者中约有15%患者以后可以发现患有CTD。有人随诊68例IIP患者11年,其中11例(19%)最终出现典型的CTD表现。通常在系统性表现出现之前,临床上并不能鉴别IIP与CTD合并间质性肺炎。
1.自身抗体在发现隐性CTD中的作用
目前还没有临床指南指导诊断以间质性肺炎为主要表现的CTD。IIP患者如果测定ANA、RF或其他自身抗体阳性,应该在免疫内科就诊。但是,相当一部分患者ANA、RF或其他自身抗体仅仅是低滴度的阳性,其特异性相当差。而且,如果ANA、RF或其他自身抗体阴性,则可能不再考虑CTD,因而可能妨碍临床上进一步评估。隐性的CTD患者,ANA、RF或其他自身抗体可以呈阴性,例如抗合成酶综合征。在评估CTD合并间质性肺炎时应该进行较多的自身抗体测定,包括抗Scl-70、抗tRNA合成酶(Jo-1、PL-7、PL-12)、抗Ro(SS-A)、抗RNP、抗CCP等抗体。抗Scl-70抗体对诊断SSc高度特异,抗Ro抗体存在于许多CTD中,其特征性表现为间质性肺炎(如干燥综合征),高滴度的抗RNP支持MCTD的诊断,抗tRNA合成酶抗体阳性可确诊抗合成酶综合征,抗CCP抗体为诊断RA的高度特异指标。
2.组织病理学
仔细研究外科肺活检标本,可以发现诊断CTD合并间质性肺炎的证据。NSIP或LIP在CTD患者中常见,如果这些患者的组织病理学发现血管周围有稠密的胶原,广泛的胸膜炎,集合淋巴结伴有生发中心形成以及明显的浆细胞浸润等,需高度怀疑阴性CTD。
3.肺部优势结缔组织疾病的诊断标准
为一种新颖的临床诊断途径,其介于呼吸内科学和风湿病学之间,适用于某些带有“免疫色彩”的间质性肺炎临床病例(表1)。这些病例特异性抗体阳性或有某些组织病理学特征,但由于缺乏适当的肺外特点而还不能明确诊断为某一种CTD。肺部优势结缔组织疾病提示,特异性抗体和组织病理学特征能够说明患者患有CTD合并间质性肺炎。如果发现患者有肺外特点,例如:雷诺现象、食管运动不全、腕或掌指关节炎、干燥性角膜结膜炎等,则进一步支持CTD。但是,如果缺乏这些表现也不能除外肺部优势结缔组织疾病。此外,间质性肺炎患者如果具备这些表现,而没有CTD的特异性抗体和组织病理学特征,也不能明确提示肺部优势结缔组织疾病。
表1 肺部优势结缔组织疾病暂行诊断标准
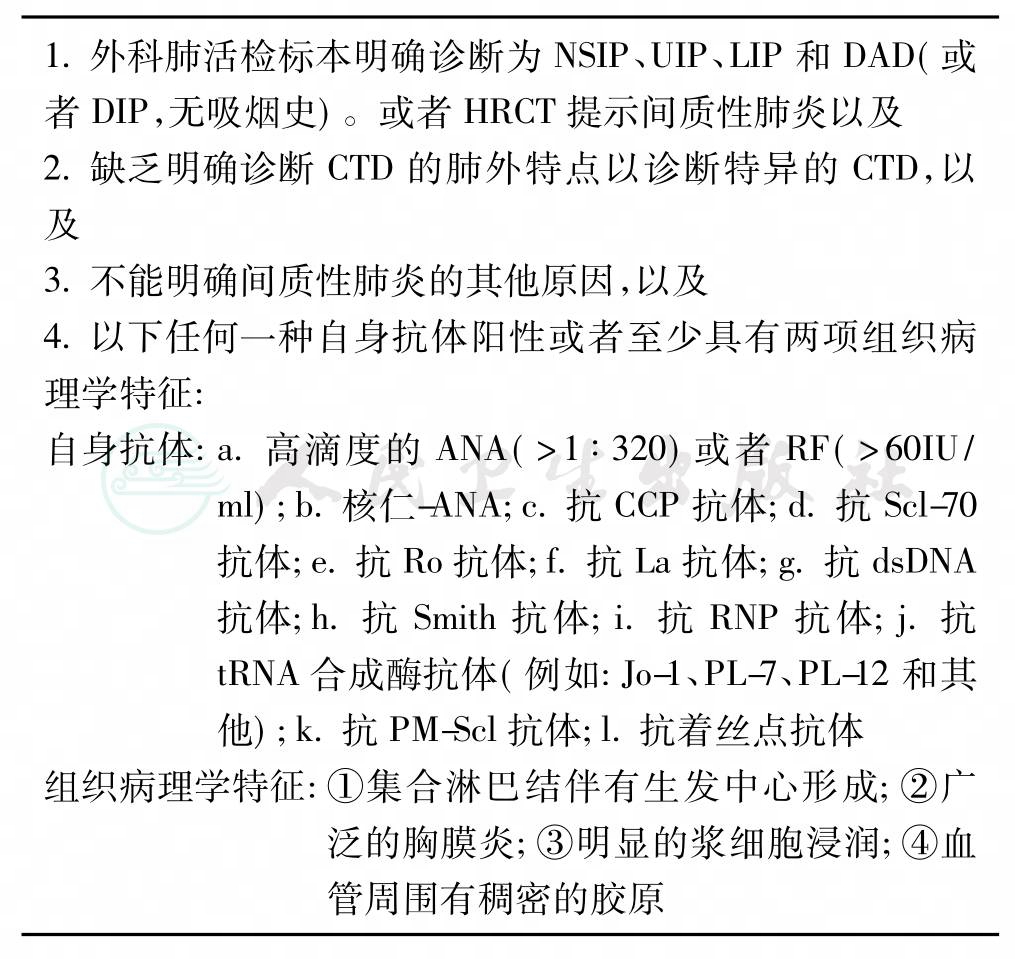
上述标准提出了一个客观和可以判断的标准以供临床应用,标准未涉及特异的临床症状(包括肌痛、关节痛、食管反流等),也未提及特异性的炎性标志物(例如:血沉)以及低滴度的ANA或RF,因为这些都是常见的临床表现,且不能诊断CTD。此外,术语“肺部优势结缔组织疾病”主要是指某些肺间质肺炎,可能为CTD的肺部表现,但按照风湿病学会的现行分类标准,还不能明确诊断为特定的CTD,患者需要进一步评估。同时也将“肺部优势结缔组织疾病”患者从IIP中区分开来,有助于临床探讨其诊断、治疗和预后。
4.“肺部优势CTD”新标准的优点
①诊断标准具有客观性和可测定性;②非特异性症状、非特异性炎症标志物和低滴度ANA、RA等未被纳入;③“肺部优势CTD”的表述方法表明其与IIP具有明显的区别;④由于肺部优势CTD的定义包括了可演变为CTD的患者,所以这些患者需要接受有关监测;⑤肺部优势CTD的诊断可将这些患者从IIP的分类中排除,以明确诊断某一种类型的CTD,并可为其治疗提供相应的方法。
(一)间质性肺疾病(ILD)
肺间质受累是结缔组织疾病常见的呼吸系统表现,肺部呈现为多种类型的炎症反应。每种反应可能代表了肺损伤的不同形式或对损伤的反应。确定患者间质性肺疾病的基本反应性质,对于患者的治疗和预后有重大临床意义。
1.弥漫性肺泡损伤(diffuse alveolar damage,DAD)
这一基础病理改变可见于ARDS、特发性急性间质性肺炎(Hamman-Rich综合征)、严重的病毒性肺炎和某些细胞毒药物造成的肺损伤。肺损伤主要是由间质性炎症浸润、间质性水肿和纤维蛋白沉积混合组成,以及伴有特征性的肺泡内透明膜形成。重症病例肺泡内可发现红细胞(弥漫性肺泡出血)。随着疾病的进展,出现肺泡内机化,肺泡内和间质纤维化,肺泡塌陷,晚期纤维化阶段出现“蜂窝肺”。SLE中可发生一种急性免疫性肺炎,即急性狼疮性肺炎。PM/DM也可出现这种基础组织病理学表现。
2.非特异性间质肺炎(NSIP)
为肺间质内淋巴浆细胞不同程度浸润和胶原沉积为特征的组织病理学的一组系列改变(图1)。肺间质内淋巴浆细胞炎症与Ⅱ型肺泡上皮细胞增生共同存在。纤维化组内炎症常伴有胶原(纤维)均匀的沉积。疾病进展时可发生肺部结构的变形或蜂窝肺,出现纤维化后可以显著影响疾病的临床进程,并且提示普通型间质性肺炎(UIP)的可能性。NSIP多见于RA、PM/DM、混合结缔组织疾病和硬皮病。
3.淋巴细胞间质性肺炎(LIP)
为肺间质内成熟淋巴细胞的单一浸润(图2)。这些淋巴细胞倾向于在间质内形成成双的核心,并以血管中心分布。LIP的其他特征包括巨噬细胞、肉芽肿形成和淀粉样物质沉积。LIP能够进展成为UIP和晚期出现蜂窝肺。在结缔组织疾病中,这种类型的间质性肺炎最常见于原发性干燥综合征,其次见于伴随于其他结缔组织疾病的继发性干燥综合征,多见于RA。
4.普通型间质性肺炎(UIP)
为特发性肺纤维化的基本病理损伤,也可以出现在结缔组织疾病中。由各种程度的单核细胞浸润和成纤维细胞增生,导致肺泡间质内胶原沉积(图3)。随着疾病的进展,这种纤维化反应造成肺结构的显著破坏,遗留下由上皮细胞形成的2~3mm的囊腔,称之为“蜂窝肺”(图4)。UIP的其他特征包括:Ⅱ型上皮细胞增生,肺泡间质内有巨噬细胞和平滑肌浸润。结缔组织疾病伴发UIP时的其他异常发现(这些现象不存在特发性肺纤维化中)有:局灶性慢性胸膜炎、淋巴样滤泡生发中心形成、血管周围胶原沉积和CD4+T淋巴细胞增多,这在RA患者中尤为多见。
5.闭塞性细支气管炎伴机化性肺炎(BOOP)
BOOP是一种组织学损伤,通常由药物、感染、放射和特发性病变所致。BOOP也见于结缔组织疾病的合并症,尤其是RA和PM/DM。其组织病理学常有以下三个特征:
(1)肺泡腔内和肺泡管内成纤维细胞的增殖和早期胶原沉积(Masson体)。
(2)由成纤维细胞和单核细胞组成的炎性息肉突入呼吸和末端细支气管内。
(3)累及区域内肺泡间隔淋巴浆细胞浸润伴有Ⅱ型肺泡细胞增生(图5)。
BOOP是一种潜在的能够完全可逆的损伤;但是,如果损伤继续,那么可能演变进展成为晚期纤维化和蜂窝肺。
(二)肺血管疾病
肺动脉高压最常见于系统性硬化病,目前也已经在SLE、RA和MCTD中发现,这一类型肺动脉高压的组织学等同于特发性肺动脉高压综合征(IPAH),IPAH原称为原发性肺动脉高压,IPAH见于无结缔组织疾病的年轻女性。此类丛源状增殖性疾病影响小动脉和肺肌小动脉。这种类型的肺动脉高压必须与继发于低氧性血管收缩所致的肺动脉高压相鉴别,低氧性血管收缩常常是由间质性肺疾病或重症COPD所造成。在这种丛源状病变内有内膜上皮增殖和平滑肌细胞增殖,造成血管内膜增厚形成洋葱环样的病变,最终形成血管腔内堵塞。因低氧血症所致的继发性肺动脉高压,其血管中层肥厚是主要改变。在SLE和抗磷脂综合征患者中,发生肺动脉高压的原因常常与反复发生的肺栓塞相关,临床上和IPAH相似。血管炎是指血管损伤的急性炎症过程,造成血管壁的纤维性坏死。在结缔组织疾病中,最常见的是小血管炎,通常涉及小动脉和肺肌性小动脉。一般多见于SLE,其次是RA、PM/DM和MCTD。伴随小动脉炎发生的是毛细血管炎。
(三)弥漫性肺泡出血
弥漫性肺泡出血(DAH)是指肺泡腔内红细胞累积,导致含铁血黄素在肺泡和肺间质内沉积,可形成纤维化。DAH有两种不同的组织类型。一种是单纯的出血,缺乏炎症,类似于特发性肺含铁血黄素沉积症(图6)。另一种是肺毛细血管炎,为肺泡间质内中性粒细胞浸润,导致肺泡-毛细血管基底膜的坏死和丧失完整性,毛细血管破坏和血栓形成,而红细胞漏出至肺泡腔内,造成肺泡腔内红细胞的累积(图7)。肺毛细血管炎的一个重要特征是中性粒细胞大量浸润、白细胞碎片和其他染色凋亡细胞。细胞核碎片聚集在坏死、水肿的间质和肺泡腔内,由于毛细血管的破坏,红细胞能够漏出到间质基质内。也可见毛细血管和动脉内血栓、机化性肺炎和Ⅱ型上皮细胞增生。
毛细血管炎最常见于系统性血管炎,尤其是坏死性肉芽肿血管炎(韦格纳肉芽肿病)和显微镜下多血管炎、结节性多动脉炎的小血管类型。在结缔组织疾病中,单纯的肺泡出血类型和继发于肺毛细血管炎的弥漫性肺泡出血类型,两种类型都常见于SLE。肺毛细血管炎的病例也可见于RA、SS、PM/DM和MCTD。
(四)细支气管炎
细支气管炎是指累及末端支气管和呼吸性细支气管的炎症-纤维化过程以及围绕肺泡的结构。呼吸性细支气管炎主要见于吸烟者伴有或不伴有结缔组织疾病。也有一种细胞型毛细支气管炎的原发类型,可以并发于结缔组织疾病,通常发生在RA和SS。从组织学上看,这是一种单核细胞浸润毛细支气管管壁的类型,而没有侵犯细支气管的管腔。与之相反,闭塞性细支气管炎有细支气管管腔的中心纤维化,导致严重的阻塞性肺疾病(图8)。闭塞性细支气管炎多见于RA的并发症。
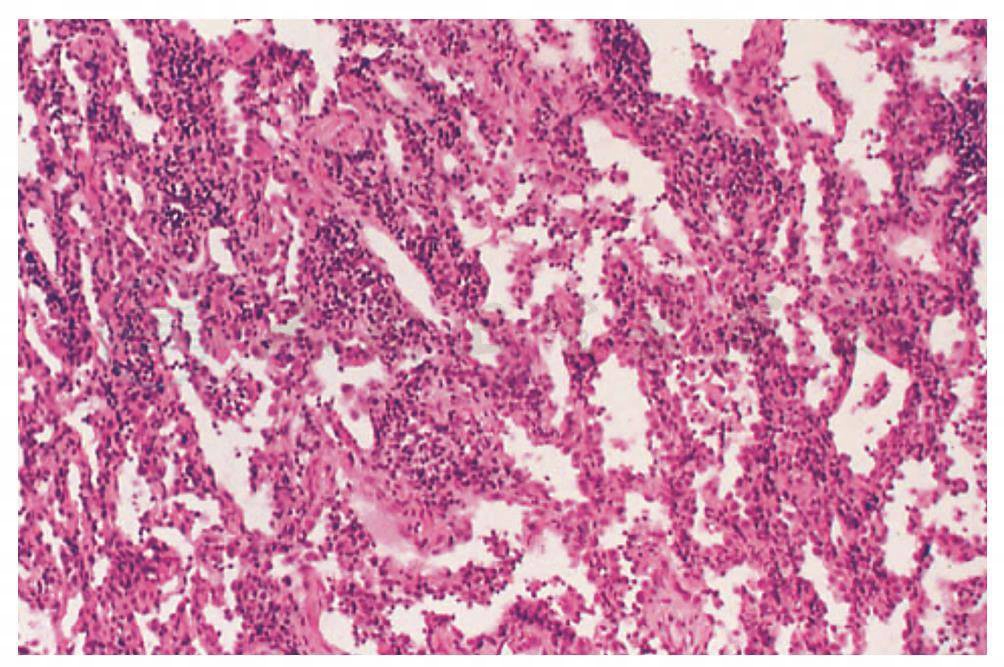
图1 类风湿关节炎合并NSIP,肺间质中显示淋巴浆细胞浸润和少许胶原沉积
(引自:Cosgrove GP,Schwarz MI.Pulmonary manifestations of the collagen vascular diseases//Fishman AP.Fishman’s Pulmonary Diseases and Disorders.4th ed.New York:McGraw-Hill,2008:1195)
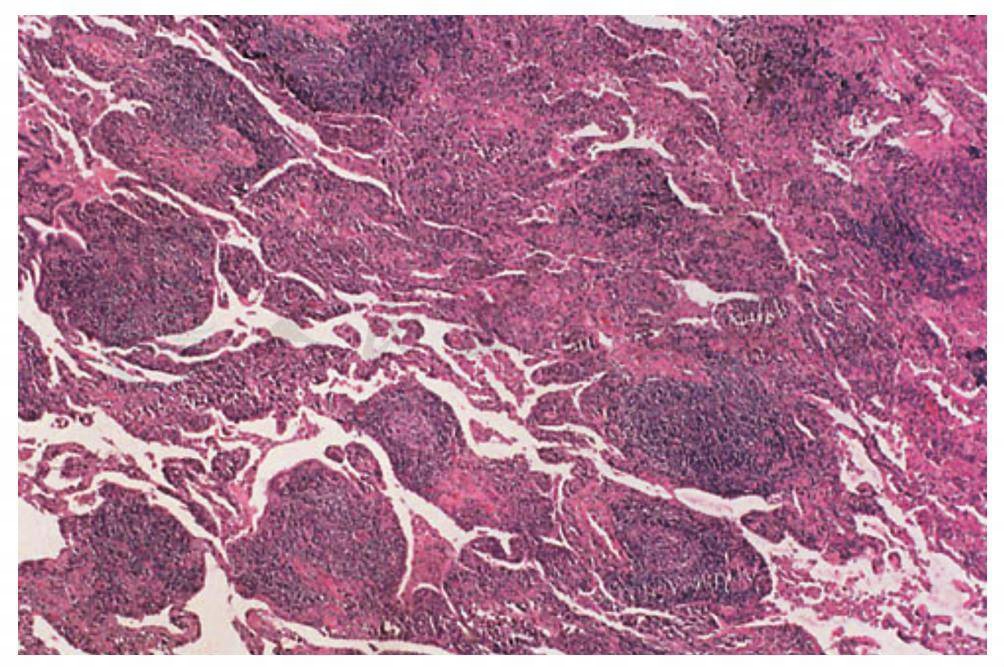
图2 原发性干燥综合征合并LIP,显示稠密的淋巴细胞、淋巴滤泡和肺间质增宽
(引自:Cosgrove GP,Schwarz MI.Pulmonary manifestations of the collagen vascular diseases//Fishman AP.Fishman’s Pulmonary Diseases and Disorders.4th ed.New York:McGraw-Hill,2008:1195)
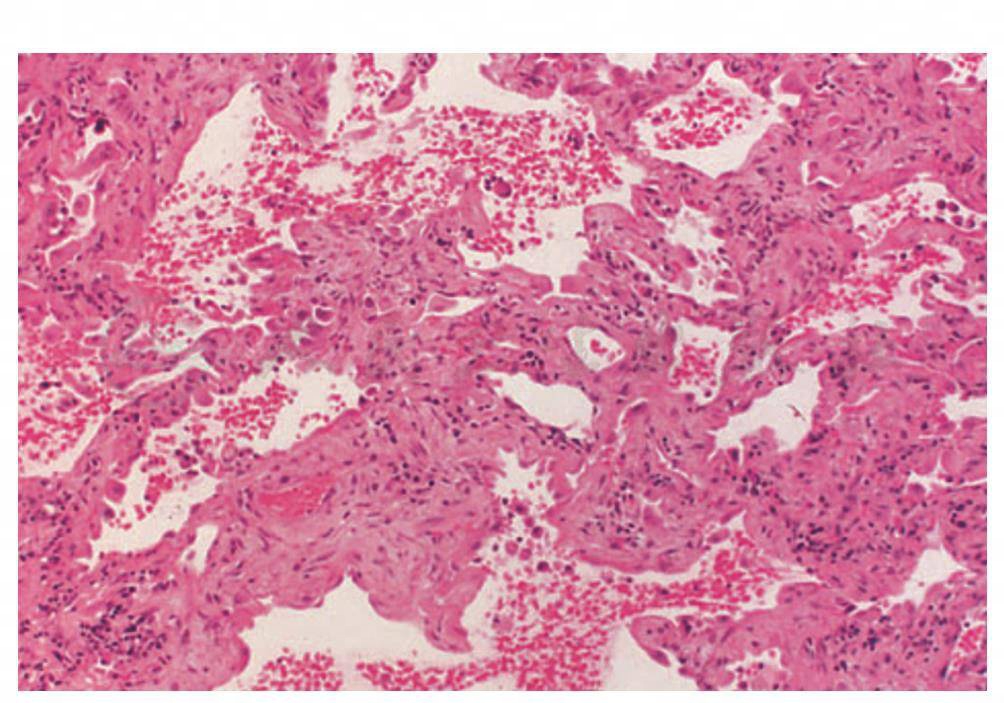
图3 类风湿关节炎合并UIP,显示肺间质增宽,伴有不同程度的单核细胞浸润和胶原沉积
(引自:Cosgrove GP,Schwarz MI.Pulmonary manifestations of the collagen vascular diseases//Fishman AP.Fishman’s Pulmonary Diseases and Disorders.4th ed.New York:McGraw-Hill,2008:1196)
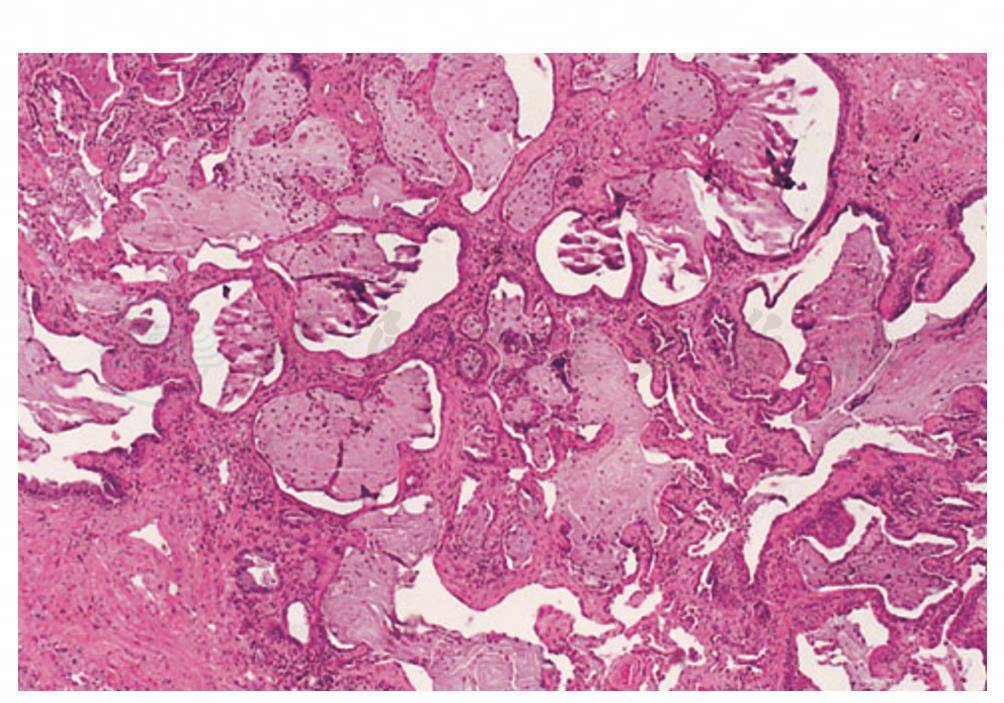
图4 硬皮病合并进展性UIP(蜂窝肺),正常的肺泡组织被大量的纤维组织所替代以及化生的上皮细胞,充满产生浓缩黏液的囊性物质
(引自:Cosgrove GP,Schwarz MI.Pulmonary manifestations of the collagen vascular diseases//Fishman AP.Fishman’s Pulmonary Diseases and Disorders.4th ed.New York:McGraw-Hill,2008:1196)
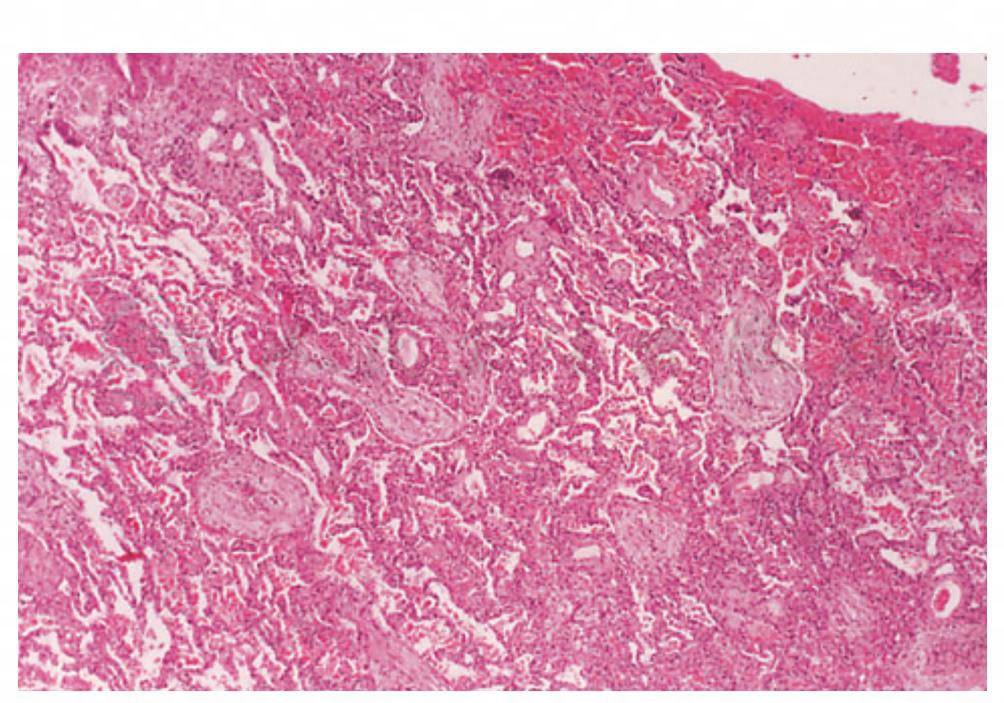
图5 类风湿关节炎合并BOOP,显示肺间质内单核细胞浸润,但无胶原沉积,也无肺泡管和肺泡内成纤维细胞浸润和早期的胶原产生
(引自:Cosgrove GP,Schwarz MI.Pulmonary manifestations of the collagen vascular diseases//Fishman AP.Fishman’s Pulmonary Diseases and Disorders.4th ed.New York:McGraw-Hill,2008:1196)
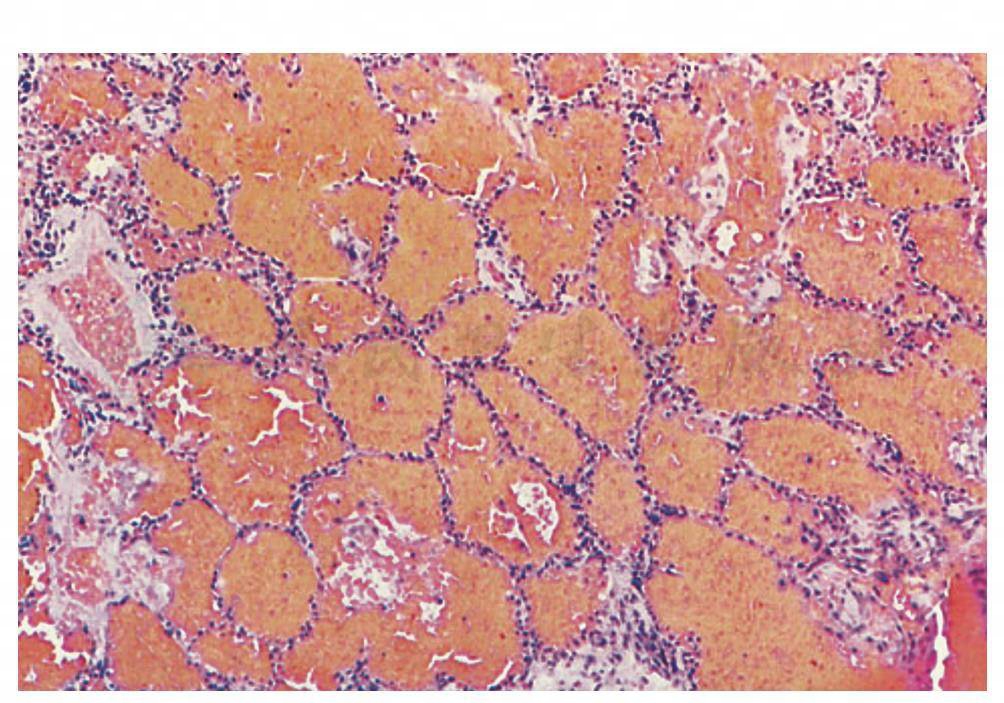
图6 SLE患者合并弥漫性肺泡出血,除了Ⅱ型肺泡上皮细胞增生外,几乎没有肺间质改变,肺泡内充满红细胞
(引自:Cosgrove GP,Schwarz MI.Pulmonary manifestations of the collagen vascular diseases//Fishman AP.Fishman’s Pulmonary Diseases and Disorders.4th ed.New York:McGraw-Hill,2008:1197)
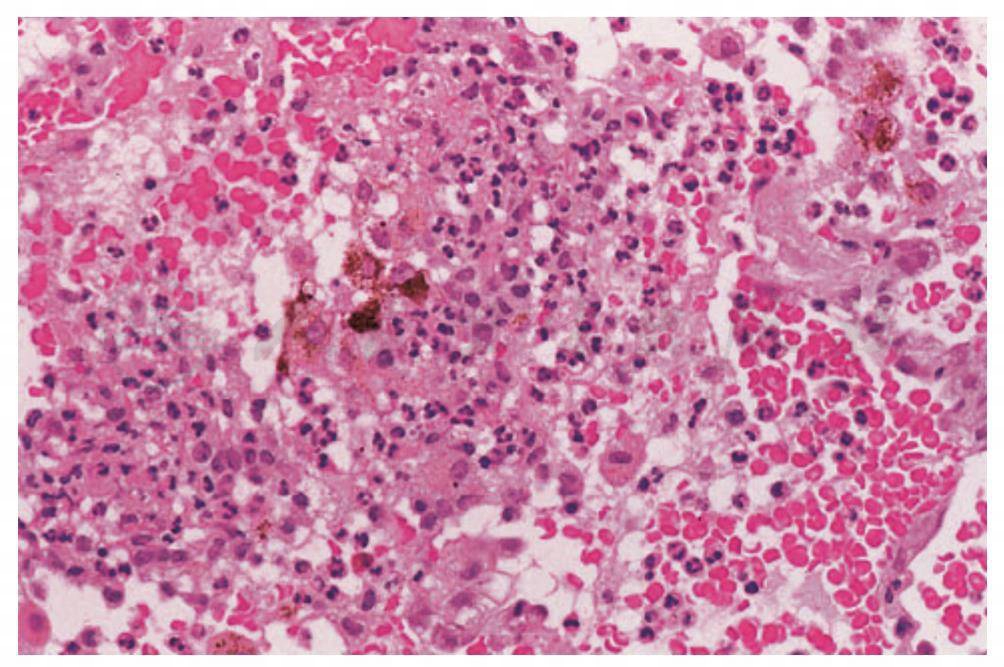
图7 SLE患者肺毛细血管的低倍镜表现,由于炎症细胞的急性和慢性浸润造成肺间质增厚。肺泡腔内充满红细胞和中性粒细胞
(引自:Cosgrove GP,Schwarz MI.Pulmonary manifestations of the collagen vascular diseases//Fishman AP.Fishman’s Pulmonary Diseases and Disorders.4th ed.New York:McGraw-Hill,2008:1197)
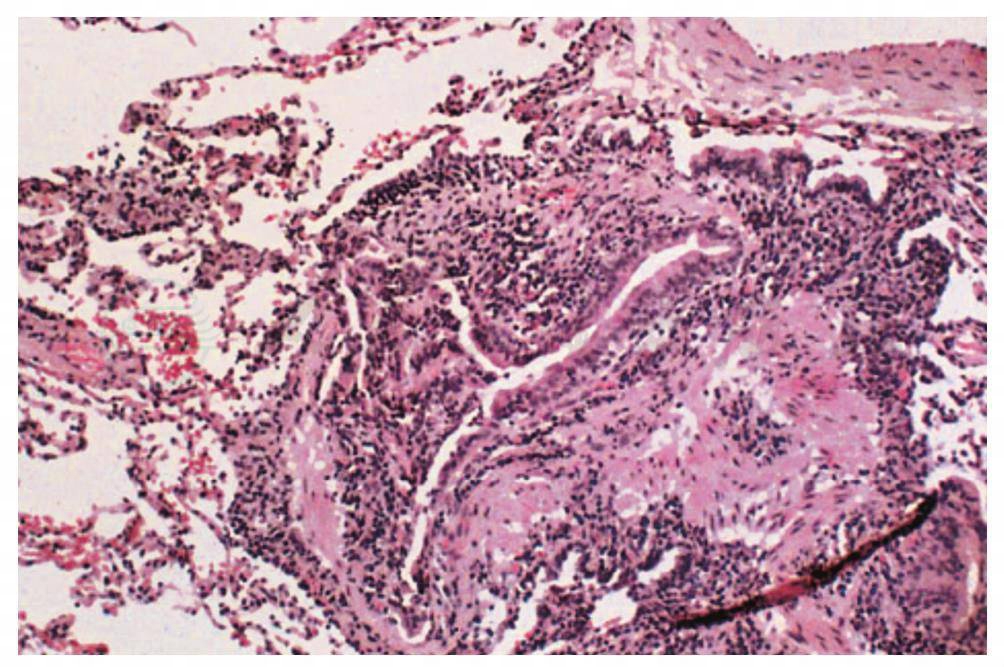
图8 类风湿关节炎合并闭塞性细支气管炎,由于纤维性向心性缩窄和严重的慢性炎症,细支气管管腔直径明显缩小
(引自:Cosgrove GP,Schwarz MI.Pulmonary manifestations of the collagen vascular diseases//Fishman AP.Fishman’s Pulmonary Diseases and Disorders.4th ed.New York:McGraw-Hill,2008:1197)
(五)肺实质结节
RA和SS可发现非感染性的炎性肺实质结节。在RA中,这类结节称为坏死性结节或者类风湿结节。这些损伤可发生在胸膜和肺实质,其实质等同于皮下类风湿结节。在肺实质这些结节通常位于小叶间的间隔和胸膜下肺实质。坏死性结节内包含有栅栏样的间质细胞、巨细胞和其他单核细胞环绕纤维蛋白样的碎片。SS病例中圆形结节阴影常称为假性淋巴瘤,偶可被常规普通胸片检查发现。假性淋巴瘤被认为是淋巴细胞间质性肺炎的一种局灶类型,是由淋巴细胞和组织细胞的浸润以及肉芽肿形成的阴影所构成。假性淋巴瘤存在潜在向恶性病变转化的危险性,以及可出现其他类型的淋巴细胞间质性肺炎。
结缔组织疾病是继发性间质性肺疾病的首要基础疾病,对患有结缔组织病的患者出现呼吸系统症状时应及时评价其肺部病变。尤其需注意,某些结缔组织疾病患者的肺部病变,可能在出现结缔组织疾病症状之前,有些甚至出现在其基础疾病若干年前,即肺部表现在先,结缔组织疾病症状出现在后。肺部病变的状态或病程与基础结缔组织疾病本身的程度无关,独立进展。因此,对患有CTD的患者进行针对ILD的常规检查,正越来越多地受到重视。尤其是那些与肺部病变高度相关的结缔组织疾病,如SSc等。临床上通常需要根据影像学检查、肺功能试验、支气管肺泡灌洗(BAL)和肺活检的结果综合判定。某些血清标志物也可用于进展性肺纤维化的早期检测。
(一)胸部影像学
1.胸片
在CTD肺间质受累的检测上价值有限,约有4%~10%的CTD患者合并肺间质病变初期胸片表现为正常。
2.胸部HRCT
CTD-ILD的胸部HRCT主要表现:①线状阴影:小叶间隔肥厚;②网状阴影;③蜂窝:囊泡聚合,壁厚;④磨玻璃样阴影;⑤小结节;⑥支气管扩张等。其中磨玻璃样阴影是指病变部位的血管影可透视的淡片状阴影,为可逆性病变,具有重要的治疗学意义。
与胸片相比,胸部HRCT的优点为:①薄层1~2mm,更能清楚地显示肺的微细结构和轮廓,能显示肺的次级小叶,可进一步明确胸片上易混淆的表现,对肺间质病变的有无、影像学特征及其分布检出敏感性较高,是诊断肺间质病变所必不可少的。②可重建影像:如矢状位、冠状位。③呼气相HRCT对评价肺部与气流受限相关病变时尤为实用,如SS患者的细支气管周围和(或)间质性淋巴细胞浸润病变的检出。④HRCT为无创性,可反复检查,是CTD-ILD进行病程随访和评价治疗效果的最实用检查方法,能观察病变全貌。⑤有利于指导有创操作如肺活检的部位。⑥能识别出多种ILD病理亚型,尤其对鉴别UIP和非UIP病变的评价极有价值。HRCT对非UIP的特异性仅为40%,敏感性88.8%。对UIP的特异性为90%,敏感性62%~78.5%。对CTD诊断明确且HRCT有典型表现的ILD患者的诊断无需开胸肺活检,这对于不能接受肺活检的患者UIP和NSIP的鉴别更为有用。⑦对一些组织病理学类型对预后及治疗影响不大、不需常规进行肺活检的CTD-ILD亦有意义。⑧HRCT能识别大部分的CTD-ILD,包括:SSc、SS、AS、SLE和 RA等。因此当 CTD疑诊 ILD时HRCT可作为一种筛查手段。⑨肺部受累是导致CTD患者的重要死亡原因,HRCT的另一个潜在的用途可协助预测患者的预后。
当HRCT表现不是某种CTD的已知的典型HRCT表现时,而必须考虑其他的鉴别诊断,包括药物性肺损伤、感染(尤其是免疫系统受抑制的患者)、支气管肺泡细胞癌以及以血管为中心的和以支气管为中心的病变时,应当考虑进行肺活检。HRCT和肺功能试验是检测、随访和评估CTD-ILD治疗反应的有效无创性方法。
(二)肺功能检查
在系统性疾病中,肺功能试验是临床评价肺实质病变的重要检查之一。肺功能参数包括肺总量(TLC)、肺活量(VC)、第一秒用力呼气容积(FEV1)和一氧化碳弥散量(DLCO)。结缔组织疾病合并间质性肺疾病患者肺功能异常的主要表现为限制性通气功能障碍,肺活量(VC)、用力肺活量(FVC)、最高呼气峰流速(PEF)、肺总量(TLC)和弥散(DLCO及DLCO/VA)均下降。其原因包括通气受限、弥散障碍、V/Q不匹配和骨骼肌无力等。其中DLCO是肺纤维化病变严重度的重要指标和疾病预后可靠的预测因素。然而,肺功能试验在肺间质病变的评价方面也存在局限性。如DLCO减少可能反映进展性间质纤维化,也可能是肺血管疾病,如果不伴肺容量减少,则孤立性肺血管疾病可能性较大。
(三)临床运动试验
心肺运动试验中可观察到肺间质受累的典型反应:①有氧代谢能力(耗氧量)的下降;②异常的肺气体交换(血氧饱和度下降、动脉血氧分压降低、肺泡动脉血氧梯度增加和无效腔通气增加);③异常的通气反应(高通气伴潮气量轻度增加);④异常的心血管反应(血氧饱和度降低、心率减慢或增快和心电图异常)。曾有报道对胸片、肺功能甚至HRCT表现正常的ILD患者,心肺运动试验能观察到早期异常的改变。肺间质病变早期即可出现运动性低氧血症和(或)肺泡-动脉氧压差的改变,对于不便或不能耐受运动试验检查的患者,可通过6分钟步行试验,用脉搏血氧饱和度仪监测动脉血氧饱和度、低氧血症及6分钟内行走距离进行评估。
(四)支气管肺泡灌洗
支气管肺泡灌洗(BAL)在CTDILD的诊断和分期中的作用还没有得到证实,其临床价值在于除外感染、结核、肿瘤、肺泡蛋白沉积症、药物反应、肺泡出血、嗜酸性粒细胞性肺炎、外源性过敏性肺泡炎等其他弥漫性肺实质疾病。尽管支气管肺泡灌洗液(BALF)的成分对CTDILD的诊断不具有特异性,但许多间质性肺疾病都有特征性的细胞学分类改变。UIP的BALF中以淋巴细胞不增加为特征,可与非UIP鉴别。隐源性机化性肺炎(COP)和细胞性NSIP的BALF中淋巴细胞增加,而CD4/CD8 T淋巴细胞比值降低。AIP的BALF以中性粒细胞增加为特征,部分病例有淋巴细胞增加;DIP中BALF有嗜酸性粒细胞增加,也有部分病例淋巴细胞增加;LIP病初BALF有淋巴细胞增加,末期为中性粒细胞增加。特发性间质性肺炎(IIP)BALF鉴别要点亦基本适用于CTD-ILD。
(五)肺活检/病理
多数病例根据临床、HRCT、肺功能均能确诊,对诊断困难者应行肺活检。目前肺组织病理学仍然是ILD诊断的金标准。
1.经支气管镜肺活检(TBLB)
TBLB做为活检手段已广泛应用于肺部疾病检查。约40%~85%的患者可根据TBLB明确诊断。但因TBLB为盲检且取材小,对于肺纤维化严重病例常因取材不理想,不能提供可靠的诊断依据。在ILD诊断中的价值远不如HRCT大。但其有创伤小、易操作、可重复性强等优点,并可除外结核、肿瘤、肉芽肿等疾病,仍有重要作用。TBLB一般应多次多部位取材,选择至少2~4个部位进行活检。对诊断困难者,可选择外科肺活检。
2.外科肺活检
外科肺活检包括开胸肺活检(OLB)和电视胸腔镜肺活检(VTLB),因后者损伤小,多被优先选择。对于病变均一的疾病,无需特定部位,1处取材即可。而对于CTD-ILD病变部位不同标本各异时,需慎重选择取材部位,应避开纤维化蜂窝部位。支气管周围病变建议选择病变进展部位楔状切除。肺尖、中叶、舌叶等非特异性纤维化病变多的部位不宜取材。
3.病理
CTD-ILD病理类型主要为 NSIP、UIP、COP、DAD和LIP。1项80例SSc患者的肺组织学研究中,NSIP占78%(62/80),UIP占8%(6/80)。PM/DM中以NSIP、COP为主,SS中LIP为特征性组织学改变,RA以UIP为主。一般认为CTD-ILD的UIP组织学类型的预后较IIP-IPF好,可能因为成纤维细胞灶较少,SSc-UIP和SSc-NSIP的预后无差别。
由于病理为一时所见,很少能观察整个病程的演变,且为局部所见,不能充分把握肺整体病变。CTD-ILD中不同疾病可能出现同一种肺病理类型,一种疾病也可能在不同阶段有不同的病理表现。因而,单纯靠肺病理不能确定其病因时,结合临床判断很重要。
(一)自身免疫反应与组织损伤
自身抗体与特定疾病或某些症状的密切相关性,提示自身免疫反应与发病相关,如Goodpasture综合征患者抗肾小球基底膜抗体(anti-GMB)在病变局部的检出;ANCA相关性血管炎包括坏死性肉芽肿血管炎(NGV)、显微镜下多血管炎(MPA)和Churg-Strauss综合征,也可检测相应的自身抗体。
(二)自身抗体与疾病的相关性
抗核抗体ANAs是一组针对细胞内所有抗原成分(细胞核、细胞质、细胞骨架、分裂周期蛋白等)的自身抗体的总称,主要靶抗原为细胞核的核酸和核蛋白成分,形成了一个抗体谱(表3)。
表3 结缔组织疾病中的自身抗体
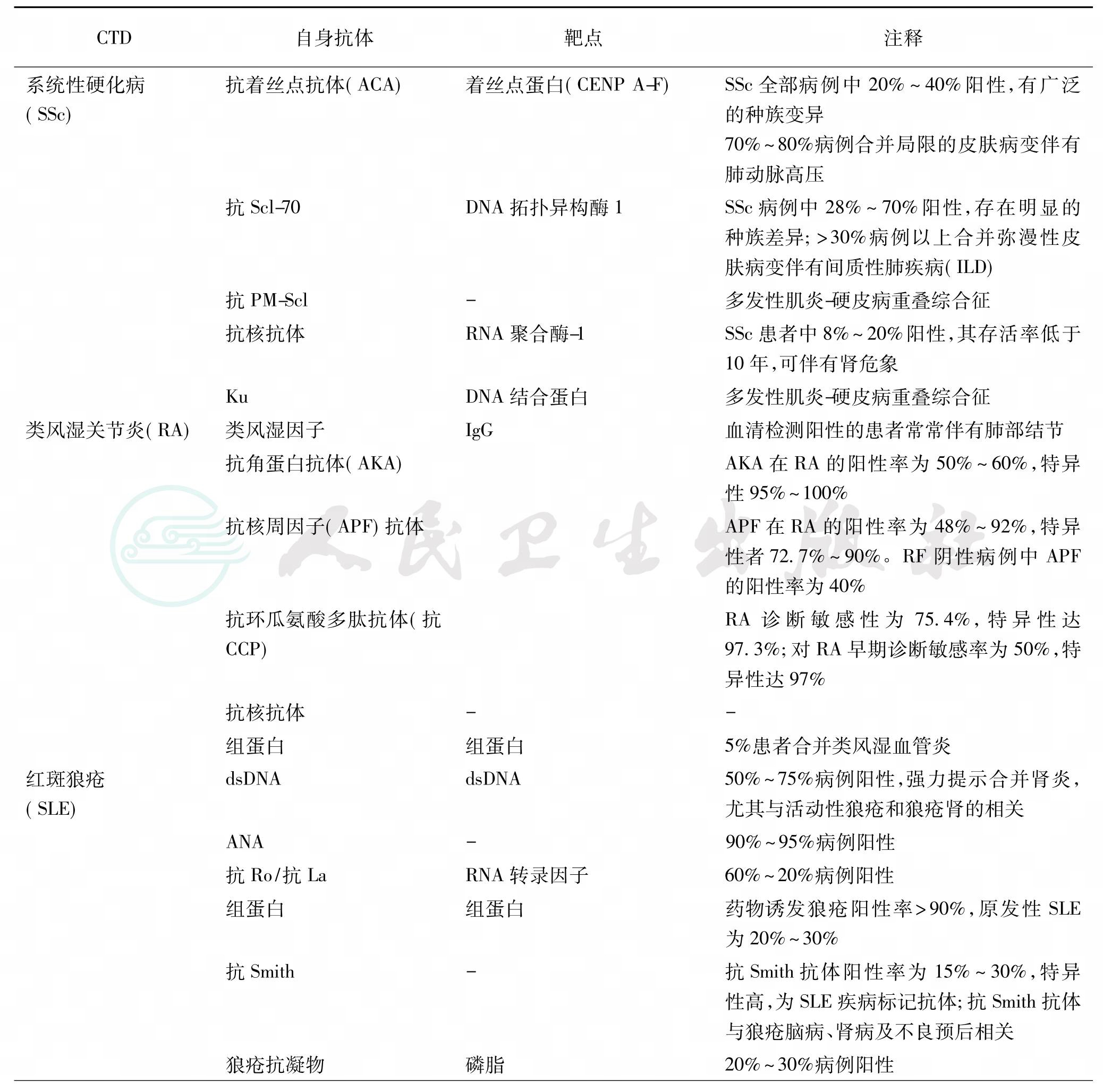
续表
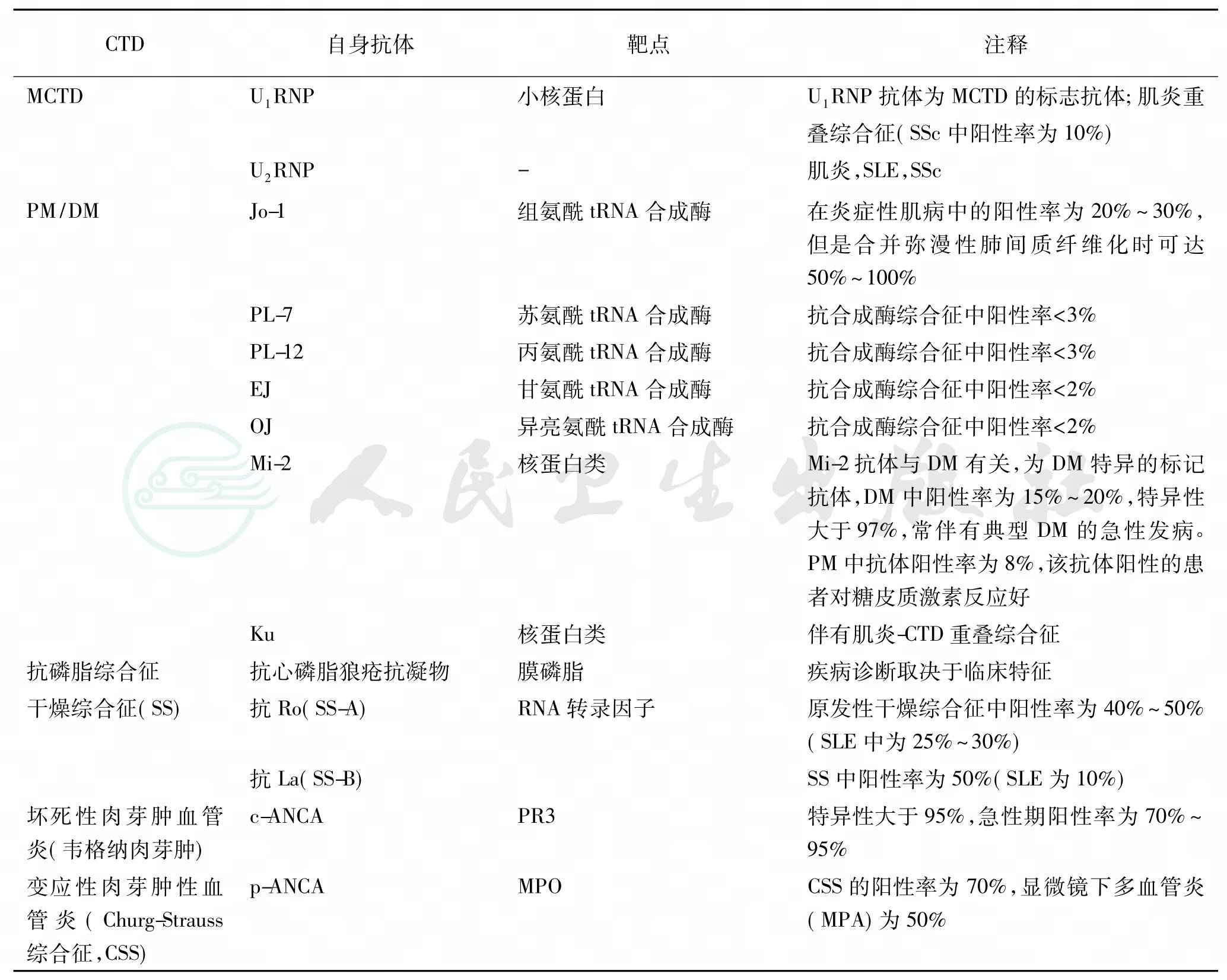
注:ANA:抗核抗体;dsDNA:双链DNA;CTD:结缔组织疾病;PM/DM:多发性肌炎/皮肌炎;SLE:系统性红斑狼疮;MCTD:混合结缔组织病;SS:干燥综合征;SSc,系统性硬化病
1.自身抗体与SSc
大于90%的系统性硬化病患者血清中出现ANAs。其中三个抗体最为重要,包括抗着丝点抗体(ACA),抗拓扑异构酶抗体(ATA)和抗RNA聚合酶抗体。不同的抗体表型与各自的临床表现密切相关。其中,ATA(又称抗 Scl-70)为 SSc的疾病标记抗体,特异性为100%,敏感性 40%。SSc患者的阳性率为 28%~70%,CREST 13%,PM/Scl综合征12%,而局限性SSc一般为阴性。SSc合并肺纤维化患者该抗体阳性率升高至30%~70%,提示发生肺纤维化的危险性及预后不良。不同的自身抗体有不同的敏感性和特异性,可能与疾病相关。SSc患者不同抗体的阳性率约为ANA 90%;ACA在局限性SSc阳性率为70%~80%、弥漫性SSc阳性率为>30%;抗Scl-70阳性率为28%~70%;ACA为CREST的标记抗体,阳性率为50%~90%。
2.自身抗体与PM/DM
自身抗体中的抗Jo-1抗体即抗组胺酰-tRNA合成酶抗体是抗合成酶抗体家族中的主要成员(占75%),其在 PM病例有较高的检出率(20%~30%),是PM特异的标记抗体,如合并ILD则阳性率可增加(达50%~100%),特异性大于95%。DM的阳性率5%,不伴肌炎者无阳性检出。抗Jo-1抗体的遗传学标志是HLADR3,HLA-DR3阳性者抗Jo-1抗体的检出率64%,阴性者仅22%。其他抗合成酶抗体的阳性率则很低,均小于5%,如抗PL-7抗体、抗PL-12抗体、抗-KS抗体和抗Jo-1抗体等。抗Mi-2抗体与DM有关,为DM特异的标记抗体,特异性大于97%。PM患者该抗体阳性率为8%,DM患者的阳性率为15%~20%。该抗体阳性的患者对糖皮质激素反应好。75%患者抗核抗体(ANA)阳性,50%患者类风湿因子(RF)阳性。当合并其他结缔组织疾病时亦可出现相应特异性抗体,如伴发SLE出现抗nRNP及抗Smith抗体阳性,伴发SSc出现抗Scl-70抗体,伴发SS或SLE出现抗SSA和抗SSB抗体阳性,10%的肌炎患者抗PM-Scl抗体阳性,其50%合并硬皮病。
3.自身抗体与RA
RA患者的血清和关节液中可检测出多种自身抗体,如RF、抗角蛋白抗体(AKA)、抗核周因子(APF)、抗环瓜氨酸肽(CCP)和抗胶原抗体,上述抗体通过与自身的IgG结合,形成免疫复合物,激活补体,引起自身免疫反应,导致关节组织的破坏。炎症细胞和趋化因子参与了RA的病理过程。
(1)类风湿因子(RF)
类风湿因子是一个针对IgG的Fc段产生的免疫球蛋白(Ig)。RF可以表现为各种亚型的免疫球蛋白Ig(IgG、IgM、IgD、IgA及IgE)。血清中检出的类风湿因子多为IgM类型。RF在RA的诊断敏感性较高,特异性较低。RF水平与关节外病变如皮肤结节、间质性肺炎和血管炎相关。血清中含有高效价类风湿因子的RA患者,较血清阴性患者的临床表现更严重。IgG-RF具有高亲和力和高度特异性,是在T淋巴细胞辅助下经特异性诱导抗原或超抗原作用产生的。RA患者血清和关节液中还可检测出多种抗胶原抗体,其中Ⅱ型胶原抗体最为重要。
(2)抗角蛋白抗体(AKA)/抗核周因子(APF)抗体
为抗口腔黏膜细胞抗原得到的抗体。多数RA患者中该抗体阳性。APF和AKA为针对同一抗原,即人口腔上皮细胞胞质内的透明角质蛋白颗粒的抗体,瓜氨酸是抗filaggrin(上皮细胞分化终末阶段的骨架成分)相关抗体识别的主要抗原决定簇。APF在RA患者的阳性率为48%~92%,特异性者72.7%~90%。RF阴性者APF的阳性率为40%。抗角蛋白抗体(AKA)在 RA患者的阳性率为50%~60%,特异性95%~100%。通常IgM-RF和CCP同时阳性者,RA诊断特异性为98%。IgG-RF阳性率较低但诊断特异性强,IgM-RF特异性差,但与IgA-RF同时阳性者提示RA。
(3)抗环瓜氨酸多肽抗体
即anti-citrullinated肽(CCP)抗体,RA诊断的敏感性为75.4%,特异性高达97.3%。尤其对RA的早期诊断的敏感率为50%,特异性高达97%。抗citrullinated肽抗体与RF间无相关性。
4.自身抗体与SLE
几乎所有的SLE患者血清中都能检测到ANAs。ANAs包括抗细胞核抗原ENA抗体或者抗双链DNA抗体的各种亚型。其中抗dsDNA抗体的敏感性跨度很大,文献报道为50%~75%不等,特异性很高约为97.4%。抗Sm抗体阳性率为15%~30%,特异性极高,二者均为SLE的疾病标记抗体。抗Sm抗体与狼疮脑病、肾病及不良预后有关,常与U1RNP抗体同时出现,dsDNA尤其与活动性狼疮和狼疮肾相关。抗RNP抗体可以在SLE和MCTD的患者血清中检测到。抗核糖体抗体(anti-P)可在SLE患者血清中出现,而且特异性也很高。抗组蛋白抗体可以在SLE患者和药物性狼疮患者中出现。而药物性狼疮患者其他的抗核抗体一般均为阴性。抗SSA/Ro以及抗SSB/La抗体可以出现于SLE患者和SS患者的血清中。LE因子为针对脱氧核糖核酸的自身抗体,活动性狼疮50%~60%可检出该抗体,部分MCTD亦可阳性。抗磷脂抗体阳性者常伴严重的出血性肺泡炎,可见血管内凝血和内皮损伤。
5.自身抗体与干燥综合征(SS)
抗SSA和抗SSB抗体均属IgA型,与SS密切相关,也可出现于部分SLE患者。抗SSA抗体识别的抗原为细胞质内的小RNA相连的60kD和52kD的蛋白质成分。这两种蛋白都属于核糖核蛋白复合物。对52kD起作用的抗体80%来自SS患者血清,对60kD起作用的抗体往往来自SLE。约85%SS同时具有对52kD和60kD起反应的抗体。抗SSB抗体阳性者均具有抗SSA抗体。抗SSA和SSB抗体对SS的诊断有重要意义。原发性干燥综合征中抗SSA抗体的阳性率为40%~50%(SLE中为25%~30%),抗 SSB抗体的阳性率为 50%(SLE为10%)。
6.自身抗体与MCTD
抗U1RNP抗体为MCTD的标志抗体,为IgG型,与特定的抗原表位识别相关,其抗原决定簇位于U1-A蛋白的RNA结合部位。而SLE患者抗U1RNP抗体为IgG和IgM,不识别该抗原决定簇。抗核抗体也增高,但抗体水平与疾病的活动性不成比例。抗U1RNP抗体能和U1RNA反应,抗U1RNA抗体和疾病的活动性及典型的临床表现相关。因此,抗U1RNA抗体亦被认为是MCTD的特异性标志。
7.自身抗体与血管炎
c-ANCA为针对PR3的抗体,坏死性肉芽肿血管炎的特异性大于95%,急性期阳性率为70%~95%。p-ANCA为针对MPO的抗体,Churg-Strauss综合征的阳性率为70%,显微镜下多血管炎(MPA)为50%,其与肺泡出血密切相关。
(一)糖皮质激素和免疫抑制剂
尽管糖皮质激素存在较多的不良反应,但因其强有效的抗炎及免疫抑制作用,仍被广泛地用于结缔组织疾病及合并症的治疗。其他免疫抑制剂有环磷酰胺、硫唑嘌呤、甲氨蝶呤(MTX)。这些药物具有细胞毒性和较多严重的不良反应,尤其MTX能导致肺损伤,有时很难与基础疾病和肺部感染相鉴别。另外,由于环孢素(cyclosporin A)和他克莫司(tacrolimus)对T细胞的强有力的、特异的抑制作用,临床亦有治疗作用,但需要仔细监测血药浓度,以预防和减少不良反应。目前仍是以糖皮质激素为中心,免疫抑制剂、细胞毒性药物为辅助的治疗方法(表4)。随着疾病分类和发病机制研究的不断深入,针对参与炎症反应的特异性细胞因子和基因靶向治疗的生物制剂有了新进展,为临床治疗提供更有效的药物。
表4 结缔组织疾病肺部表现免疫抑制治疗的常用药物

续表

(二)细胞因子调节治疗
1.肿瘤坏死因子(TNF)-α阻滞剂
已广泛用于对MTX治疗耐受的RA患者的治疗。已有3种TNF-α阻滞剂:依那西普(etanercept)、英利西单抗(infliximab)和阿达木单抗(adalimumab)目前在临床应用。这3种药物具有相同的安全性和有效性。TNF-α阻滞剂与MTX效果好于单用。尤其对肺部受累的RA患者有益。因有英利西单抗发生RA相关的纤维化肺泡炎恶化的报道,使用时应当谨慎。不良反应为注射局部反应和上呼吸道感染和过敏反应。对潜伏性结核感染的患者,有必要进行预防性抗结核治疗。
2.白介素-1、白介素-6、白介素-12和白介素-15
与安慰剂相比,白介素-1受体拮抗剂(IL-1Ra,anakinra)和IL-6受体抗体能显著改善RA患者的临床症状。
(三)抗纤维化药物
在CTD-ILD中,血管、炎症和纤维化进程之间具有相互作用,并受多种重要细胞因子的调节,这些介质决定或维持肺间质成纤维细胞的纤维增生特性。在肺纤维化中,抑制基质合成成纤维细胞的功能是重要的治疗目标。包括阻断关键细胞因子和生长因子的治疗方法正在各疾病模型中接受评估。
1.抗转化生长因子-β
转化生长因子(TGF)-β配体的内源性抑制因子的过量表达,能够阻断TGF-β配体活性,包括抗TGF-β1(CAT-192)的重组抗体和针对TGF-β1和TGF-β1~3具有特异性的同功抗体。重组受体-IgG融合蛋白在动物模型中已取得疗效。
2.内皮素拮抗剂
内皮素(ET)配体有促纤维化作用,这些作用由2种主要高亲和力ET受体——ETA和ETB调节。ET的拮抗剂,包括双重特异性受体阻滞剂波生坦,能抑制细胞外基质产生过剩、基质降解酶降解和肌成纤维细胞分化。同时还使培养的硬皮病肺成纤维细胞的生化表型正常化。波生坦常用剂量62.5mg,每日2次。其他如:西他生坦(sitaxentan)和安贝生坦(ambrisentan)等药物也正在临床研究中。
3.抗CCN-2单克隆抗体
CCN-2是一种重要的调节物,可调节TGF-β的作用。CCN-2的过量产生是激活的基质过量产生成纤维细胞的标志。在硬皮病患者的纤维化肺组织和痰中能够观察到CCN-2的水平升高。阻断CCN-2的单克隆抗体的临床试验已开始进行,以评价其对肺纤维化的作用和安全性。
4.干扰素-γ
干扰素-γ(IFN-γ)是由活化的Th1细胞产生的细胞活化因子,抑制成纤维细胞增殖及胶原产生。已发现IFN-α是有效的,重组干扰素已作为抗纤维化药物。IFN-γ能下调肺纤维化的标志物,可能对治疗肺纤维化有效。
5.N-乙酰半胱氨酸(N-acetylcysteine,NAC)
抑制TGF-β1活性、成纤维细胞增殖及胶原产生。2005年欧洲呼吸学会(ERS)公布 184例 IPF临床观察结果口服大剂量[NAC 1800mg/d+泼尼松0.5mg/kg+硫唑嘌呤2mg/(kg·d)]疗程12个月,抑制了DLCO的减少。对CTD-ILD的疗效需临床对照试验的尚需进一步证实。
6.吡非尼酮(pirfenidone)
是一种羟基吡啶低分子量化合物,在实验动物中对纤维化有抑制作用。107例IPF的研究观察到急性加重显著减少,VC、TLC增加,DLCO、PaO2得到改善,对CTD-ILD的疗效需进一步观察。
7.其他抗纤维化药物
环磷酰胺是一种广谱免疫抑制剂,美国以158例SSc患者为对象进行了多中心、随机、双盲、安慰剂对照的临床研究,口服环磷酰胺大于或等于2mg/(kg·d),治疗和随访各1年的研究结果证实,对SSc-ILD有效。
(四)肺移植
目前肺移植已成为终末期肺或心肺疾病患者的一种治疗方式。根据国际心肺移植登记学会的报告,目前全世界40%的移植手术是针对肺气肿、17%是针对特发性肺纤维化(IPF)进行的。包括结缔组织疾病在内的系统性疾病引起的肺纤维化,如硬皮病等,仅占全部肺移植的4.4%。慢性排斥反应是影响长期存活率的重要因素。系统性疾病和终末期肺纤维化的患者可能能进行肺移植,移植后的结果与因其他疾病移植的结果相近。术前糖皮质激素治疗并非肺移植禁忌证。
(五)康复治疗
肺功能恢复训练是对患有慢性呼吸系统疾病患者进行系统的、多学科的、以患者为中心的康复治疗。作为整体治疗的一部分,康复治疗的目标包括:减轻症状、最大程度恢复肺功能、提高生活质量和减少医疗保健成本。通过稳定或逆转呼吸系统疾病的症状和并发症来实现这些目标。ILD患者是康复治疗的最佳候选者。因为这些患者通常有气短、干咳、活动耐量减低、体重下降、不适和乏力,这些症状都影响健康状态,康复训练可改善患者的运动能力和健康状态。
康复治疗项目,包括运动训练、营养支持、心理咨询、职业疗法和患者教育可能改善生理和心理及健康状态。然而,目前康复治疗在CTD-ILD患者中却很少应用。













