英文名称 :diffuse alveolar hemorrhage
弥漫性肺泡出血(diffuse alveolar hemorrhage,DAH)是指多种状态所致的来自肺泡毛细血管的红细胞聚集在肺泡内的临床病理综合征,也是可导致急性呼吸衰竭、引起生命危险的危重疾病过程。虽以往临床上认为该病较少见,但近来发现其发病率正在不断增加。该病来势凶险,危及生命,症状复杂,相关基础病往往被忽视,多系统受累的临床表现不典型,因而需对其进行早期识别,及时诊断,采取积极有力治疗措施以减少其病残和死亡率。
临床出现肺出血时通常有两个来源:即起源于支气管血管,以及肺血管和肺的微循环。支气管源的出血多见于肺的局部因素,由原发性肺部疾病如支气管扩张症、肺结核、肺梗死、动静脉畸形、肺肿瘤等所致。肺来源的出血则是来自大、中、小肺血管,主要由全身性血管炎所致,大多数涉及肺微循环,影响微循环的血管炎称为肺毛细管炎,是引起肺出血的主要原因。弥漫性肺泡出血首先须和肺部疾病引起的局灶性肺出血鉴别(图1)。
弥漫性肺泡出血以咯血、贫血、进行性低氧血症三联征为其临床特征,伴双侧弥漫性肺内渗出的胸部影像改变。其基础组织病理学改变包括肺泡内出现红细胞和纤维蛋白,最终在48~72小时后形成带有含铁血黄素形成的巨噬细胞聚集和弥漫性肺泡出血相关的组织病理学改变,即肺泡毛细血管炎、淡血性肺出血(bland pulmonary hemorrhage)、弥漫性肺泡损伤和其他各种组织学改变,其中最主要表现是肺毛细血管炎。
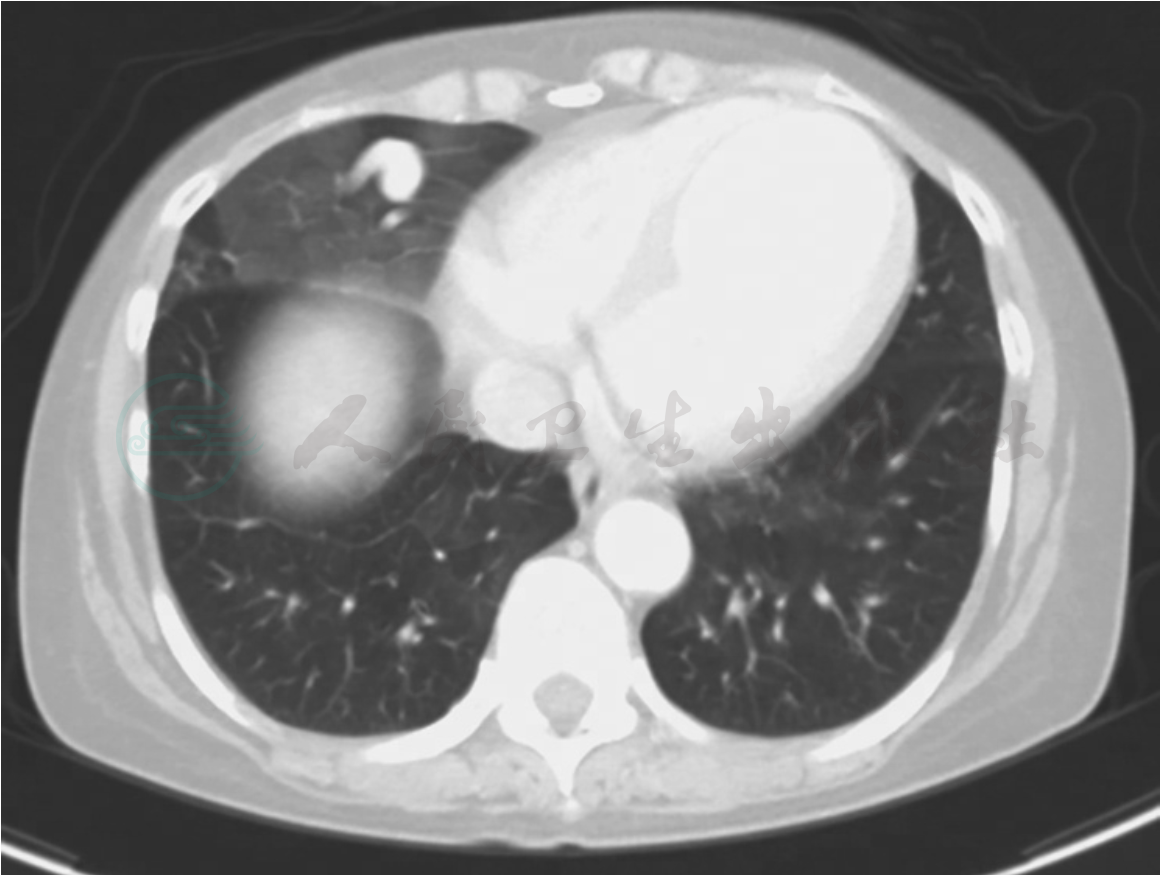
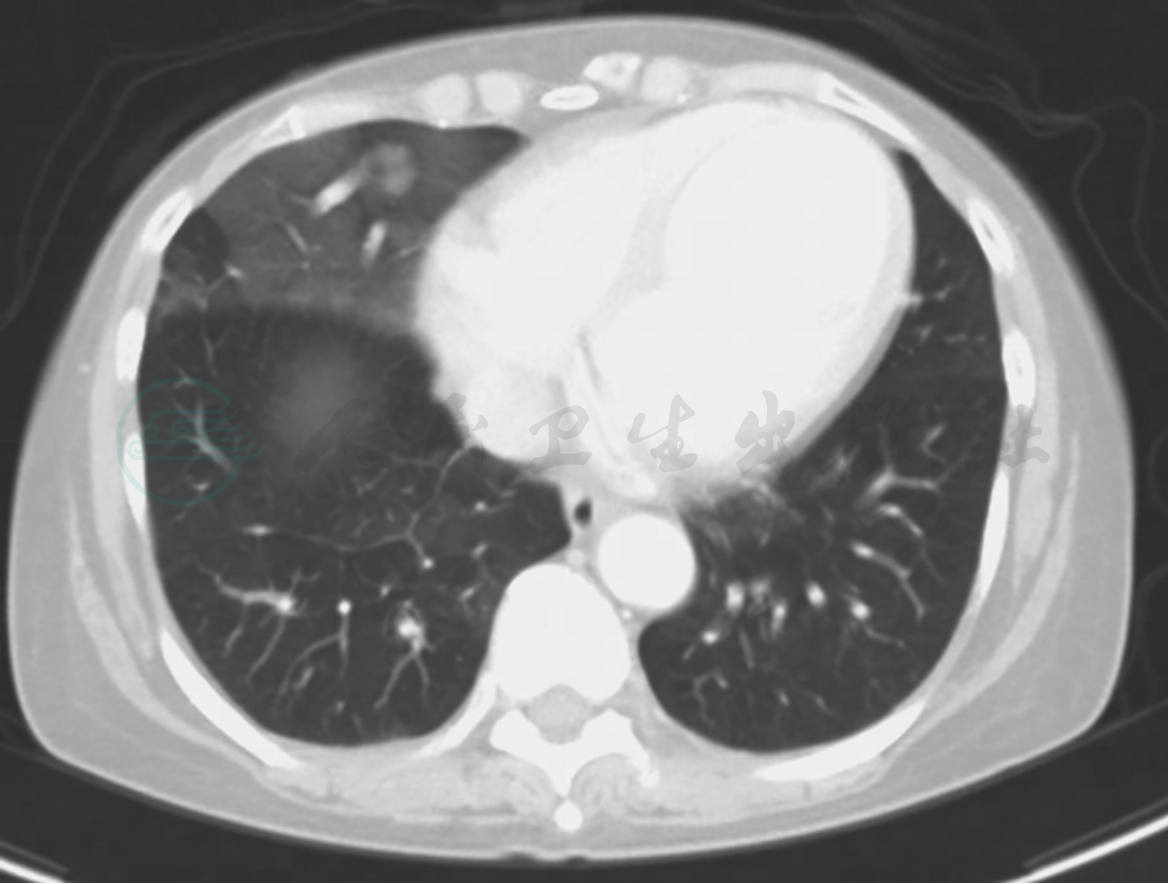
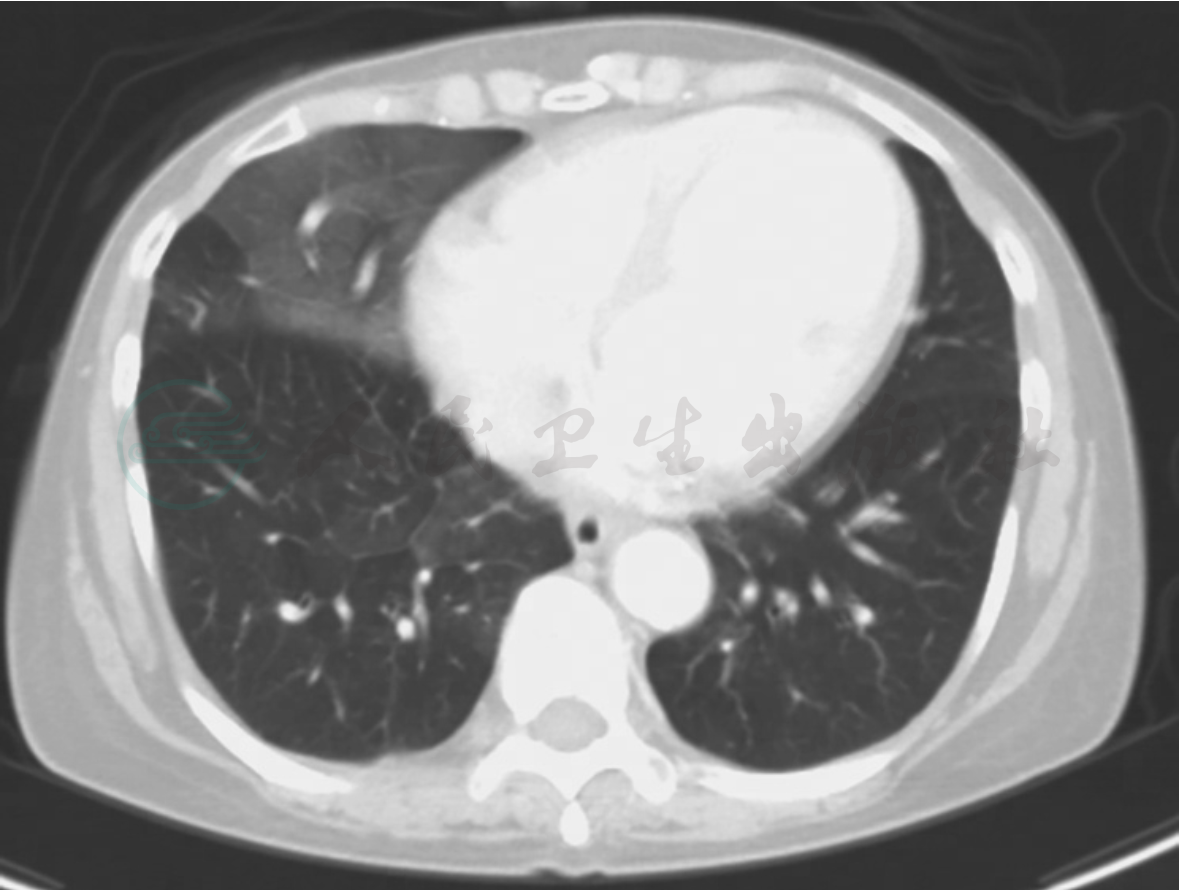
图1 动静脉畸形引致肺局部出血
所有引起弥漫性肺泡出血的病因均具有一共同特征,即形成对肺泡微循环结构的损伤。它可局限于肺,如吸入性损伤、弥漫性肺泡损害,也可和全身性疾病相关,如抗中性粒细胞胞浆抗体(ANCA)、抗肾小球基底膜抗体相关性血管炎疾病或结缔组织疾病。
已报道的病因按发病学和组织学分类,可分为如下几种。
(一)肺毛细血管炎
ANCA相关性肉芽肿性血管炎,镜下型多血管炎,孤立性肺毛细血管炎,系统性红斑狼疮,结缔组织疾病,肺抗磷脂综合征,混合型球蛋白血症,贝赫切特综合征,过敏性紫癜,Goodpasture综合征,寡免疫肾小球肾炎,免疫复合物相关性肾小球肾炎,药物性肺毛细血管炎,急性肺移植排斥反应等。
(二)淡血性肺出血
特发性肺含铁黄素沉积症,Goodpasture综合征,二尖瓣狭窄,工业品、药物相关淡血性肺出血(青霉胺,氧化物),肺静脉阻塞病,肺毛细血管瘤病,继血性障碍系统性红斑狼疮,多发性骨髓瘤。
(三)弥漫性肺泡损害
骨髓移植,细胞毒性药物治疗,放射治疗,毒物吸入,系统性红斑狼疮。其他尚有微生物感染,毒物或药物中毒(如酸酐类、可卡因、D-青霉胺等),二尖瓣狭窄,凝血异常(如血小板减少、抗凝药物过量),原发性肺含铁血黄素沉积症,肿瘤及放化疗,骨髓移植,造血干细胞移植,艾滋病等。少数患者病因不明。
主要表现在呼吸道的血管炎疾病以ANCA相关肉芽肿血管炎,显微镜下多血管炎,Churg-strauss综合征,贝赫切特综合征,寡免疫肾小球肾炎,原发性冷球蛋白血症,孤立性肺血管炎多见;系统性自身免疫性疾病则以肺出血肾炎综合征(Goodpasture综合征),系统性红斑狼疮,免疫复合物相关性肾小球肾炎多见。近年来,随着造血干细胞移植在临床中应用,弥漫性肺泡出血也有增多,大约发生在5%异体或自体移植受体中,在造血干细胞移植过程中发生的是特指非感染性的肺泡出血,有报道其死亡率可达50%~100%。
本病发病机制尚不清楚,可能有多种机制以单一或联合形式参与发病的过程。
1.毛细血管应力衰竭
肺泡-毛细血管形成的血液气体交换膜由血管内皮、间质和肺泡上皮组成。它受三种力的作用:肺毛细血管经壁的环状张力,肺泡的表面张力和肺泡扩张相关的肺泡壁纵向引力。在肺泡内压过度增高和过度充气情况下可出现肺泡应力衰竭,引起淡血性肺出血和通透性增高性肺水肿。
2.免疫调节
通常认为弥漫性肺泡出血是以肺微血管炎或肺毛细血管炎形式存在的血管炎所致,是基础免疫调节过程的结果,涉及相应基础疾病的各种免疫反应。约50%患者可见肺泡壁IgG、补体C3或免疫复合物颗粒样沉积。也可能不存在毛细血管炎。。
3.弥漫性肺泡损害
由于毒性物质和药物所致的肺泡上皮的直接损害。
弥漫性肺泡出血相关的组织学改变包括肺泡毛细血管炎、淡血性肺出血、弥漫性肺泡损害和混杂的组织学变化,其中肺毛细血管炎是最主要的。
1.肺毛细血管炎
1957年由Spencer首先描述,是弥漫性肺泡出血最常见的组织学类型,有特定的组织病理学表现,包括以中性粒细胞为主的细胞在肺泡间隔(肺间质)浸润、肺泡和毛细血管壁纤维蛋白样坏死和白细胞破碎。中性粒细胞通过释放氧自由基和胞浆酶,破坏肺泡毛细血管基底膜和肺泡壁。随着坏死过程,这些结构的连接性出现丢失,红细胞从毛细血管渗出,进入到间质和肺泡腔。纤维蛋白也从损伤的毛细血管释出,可见毛细血管壁和间质的纤维蛋白样坏死。当中性粒细胞受到破坏时,细胞出现片段化和固缩化,核残质聚积在间质和肺泡腔内。
此时还可见肺泡毛细血管血栓形成,肺泡Ⅱ型上皮细胞增生,肺泡内机化进行性肺炎,肺泡间质单核细胞浸润。在弥漫性肺泡出血进入吸收期时,在间质和肺泡巨噬细胞中出现含铁血黄素沉着。
毛细血管炎和肺血管炎的区别在于肺血管炎是涉及任何大小的肺血管的炎症,而肺毛细血管炎则仅局限于肺微循环(肺泡毛细血管,细动脉和细静脉)。但在全身血管炎和结缔组织病时,均可见到两者。
2.淡血性肺出血
其特征是出血进入肺泡腔,但不伴有在肺毛细血管炎中见到的肺泡结构炎症或坏死。组织病理学改变包括肺泡充满红细胞和Ⅱ型上皮细胞增生。反复弥漫性肺泡出血时则可见间质纤维化。
3.弥漫性肺泡损害
肺泡损害可导致弥漫性肺泡出血。其特征肺实质和间质性水肿伴Ⅰ型肺泡上皮细胞损伤,肺泡腔出血,肺泡透明膜形成。慢性和反复性肺泡出血则导致肺泡间隔增厚,胶原沉积及纤维化,纤维蛋白,免疫球蛋白和补体沉积于肺泡腔。
弥漫性肺泡出血在明确诊断同时,必须及时尽快积极治疗,诱导原发基础疾病缓解,不容延误。
(一)大剂量糖皮质激素
由于弥漫性肺泡出血大部分病因与免疫相关,故治疗仍以糖皮质激素和免疫抑制剂为主。在尽可能排除感染因素后,较多作者建议危重病例采用高剂量糖皮质激素(静脉应用甲泼尼龙1g/24h,或相当药物3~5天)。如病情缓解,可改甲泼尼龙80~120mg/d,随病情好转,逐渐减量为1~2mg/(kg·d)。单用皮质激素疗效不佳者,可联合应用环磷酰胺冲击治疗,剂量为750~1000mg/m2,静脉滴注,3~4周1次,根据肾功能受损状态,随后调整剂量,并需观察白细胞变化,为防止对膀胱的毒性作用,可加用疏乙磺酸以减轻刺激。对急性期患者加用环磷酰胺等免疫抑制剂的疗效仍有争议,有作者认为可改善预后;亦有作者观察到加用环磷酰胺反而增加病死率。
(二)诱导缓解
可应用环磷酰胺和利妥昔单抗诱导原发基础疾病缓解。
许多相关基础系统性自身免疫过程需要加用环磷酰胺诱导缓解。由于其起效慢,立即控制炎症作用不强。因此多在疾病过程稳定,病情缓解后改维持量1~2mg/(kg·d),疗程根据病情及缓解情况而定,一般两个月左右。
利妥昔单抗(美罗华,ritaximab)是嵌合性抗CD20的单克隆抗体,由于B细胞可产生致病性自身抗体,使免疫复合物形成,疾病持续。应用利妥昔单抗可使B细胞消耗,使维持单核细胞的细胞因子减少,免疫复合物减少,使基础疾病达到缓解。
其他免疫抑制剂如环孢素A、硫唑嘌呤、甲氨蝶呤亦可选用。
(三)血浆置换
价值尚待评估。对疑及ANCA相关肉芽肿血管炎或抗基底膜病可能时,可考虑应用血浆置换,有利于清除血浆抗体,保护肾功能,但对其疗效仍有争议,如增加感染机会及增加自身抗体合成,产生“反跳现象”。
(四)其他
Ⅶa因子,是维生素K依赖的丝氨酸蛋白酶,可触发一系列凝血反应,增强在出血处活化血小板表面的血栓素哮喘,达到止血。
静脉注射免疫球蛋白或丙种球蛋白,对肺血管炎治疗、人类淋巴细胞单克隆抗体治疗肉芽肿类疾病均有一定疗效。伴肾功能衰竭者可血液透析。应积极纠正凝血功能失调。感染所致的弥漫性肺泡出血者应积极控制感染。活动期肺泡出血患者应尽快控制肺泡出血。对呼吸窘迫、严重低氧血症、呼吸衰竭者应充分供氧,尽早机械通气。













