英文名称 :pulmonary Langerhans’cell histiocytosis
肺朗格汉斯细胞组织细胞增生症(pulmonary Langerhans’cell histiocytosis,PLCH)是以肺脏单器官朗格汉斯细胞增生浸润为特征,形成多发的细支气管旁间质结节和囊腔的一种慢性进展性肺疾病。PLCH为罕见病,通常在中青年人发病,无性别差异,与吸烟密切相关,是一种吸烟相关性间质性肺疾病,其自然病程不同于多个系统受累的朗格汉斯细胞组织细胞增生症(Langerhans’cell histiocytosis,LCH)。
目前没有PLCH发病率和患病率的准确资料。Caensler和Carrington分析502例弥漫性肺疾病外科肺活检的肺脏组织病理,其中嗜酸性粒细胞肉芽肿17例,占3.4%,提示PLCH可能是一类罕见的疾病。比利时一项回顾性研究显示,5年间20个肺科中心的间质性肺疾病360例中,PLCH占3%。日本流行病学研究估计男性和女性PLCH年患病率分别为0.27/10万和0.07/10万。PLCH患者早期症状轻微,戒烟后疾病有自限倾向,临床诊断时有可能漏诊,发病率和患病率会被低估。
本病通常在30~50岁发病,无明显性别差异。PLCH发病与吸烟密切相关,90%~100%PLCH发生于现吸烟者或戒烟者。戒烟后PLCH患者的胸部影像可以好转,终末期PLCH接受肺移植的患者如果继续吸烟,PLCH可能再发。尽管PLCH发病与烟草吸入有关,吸烟量与PLCH疾病的严重程度没有相关性。多数PLCH患者是重度吸烟者,吸烟史较短的患者也可以发生PLCH。绝大多数成人PLCH是散发病例,其发病与基因的关系尚不清楚。多数PLCH在高加索人发病,非洲裔美国人和其他种族的发病相对较少。
目前全球有11亿吸烟者,每年导致近500万人死于吸烟相关的疾病。我国是世界上最大的烟草生产国和消费国,烟草生产量占世界总量的1/3,吸烟者多达3.5亿,占全球吸烟总人数的1/3。这些庞大的吸烟人群是罹患吸烟相关肺脏疾病的潜在人群。随着HRCT的广泛应用和诊断意识的增强,我国陆续报道了PLCH病例。
PLCH肉芽肿具有破坏和重塑周围肺实质的特性,其机制尚不清楚。PLCH特征性的表现为CD1a+细胞(朗格汉斯细胞)大量聚集,形成疏松的细支气管中心性肉芽肿,侵入肺泡腔形成囊腔破坏肺实质。从外周血募集骨髓造血前体细胞,在相应组织中进一步分化为朗格汉斯细胞。PLCH病变周围可见生长因子,如粒细胞-巨噬细胞集落刺激因子(GM-CSF)和趋化因子(CCL20和CCL2),促进上述分化作用。局部的新生血管生成与细胞黏附分子的作用有关,可以促进朗格汉斯细胞、T淋巴细胞和其他炎症细胞聚集。肉芽肿的CD1a+细胞呈现出不同表型,可见不同类型的细胞膜标志物。这些标志物与通常见到的树突状细胞暴露于多种病原体后发现的标志物相似。Langerin是新发现的朗格汉斯细胞标志物,能够诱导朗格汉斯细胞内Birbeck颗粒形成,对细胞具有高度的选择性。LCH病变范围内langerin(CD207+)细胞的特异性基因表达与未成熟的髓样树突状细胞前体相一致。此外,CD1a+细胞介导的T淋巴细胞的细胞毒作用可能存在障碍,因此CD1a+细胞不是组织破坏的唯一原因,LCH肉芽肿中金属蛋白酶参与了肺实质损伤,白细胞介素(IL)-17参与组织重塑。同时,Notch1信号通路的激活介导朗格汉斯细胞发挥作用。
近来的研究证实,PLCH是一种烟草烟雾引起的不同临床表型的炎症性髓样肿瘤。BRAF基因编码蛋白属于一种细胞内Ras-Raf丝裂原活化蛋白激酶,BRAF基因突变见于增殖性恶性肿瘤,包括恶性黑色素瘤、结肠腺癌、乳头状甲状腺癌和肺腺癌等。BRAF激酶活化导致细胞外信号调节激酶磷酸化,使MAPK信号传导通路持续活化,影响细胞生长和增殖。28%~40%PLCH患者肺组织检测到BRAF V600E基因突变。具有BRAF V600E基因突变的PLCH患者,累计烟草暴露量高于基因突变阴性者。
组织细胞增生症(histiocytosis)代表了一大类异质性的组织细胞增生性疾病,其中既包括侵袭性恶性肿瘤,如组织细胞淋巴瘤,也包括淋巴结的单纯性反应性组织细胞增生。
1868年德国的医学生Paul Langerhans偶然地发现了人类皮肤中的朗格汉斯细胞。朗格汉斯细胞是一种特殊的组织细胞,分化于单核巨噬细胞系,作为抗原呈递细胞发挥作用。以朗格汉斯细胞增生和浸润造成器官功能障碍为特征的一组疾病称为LCH。1941年Farber发现三种疾病,即莱特勒-西韦病(Letterer-Siwe disease)、汉-许-克综合征(Hand-Schüller-Christian disease)和骨骼或肺脏嗜酸性粒细胞肉芽肿,有着相似的朗格汉斯细胞组织细胞增生和浸润的组织病理表现。莱特勒-西韦病是一种致死性的系统性疾病,多发生于3岁以下的幼儿,成人罕见,累及皮肤、淋巴结、骨骼、肝脏和脾脏,气胸是其常见的肺脏并发症。汉-许-克综合征是一种多灶性疾病,多于儿童发病,成人罕见,通常累及肺脏和骨骼,常见的三联征包括骨质破坏、眼球突出和尿崩症。嗜酸性粒细胞肉芽肿指单个器官受累的LCH。1951年,Friedman首次报道了2例以肺脏受累为主要表现的LCH。1953年Lichtenstein将上述三种疾病命名为“组织细胞增多症X”,“X”意为该病的病因和发病机制不清楚。
为了阐明朗格汉斯细胞在此类疾病中的核心作用,1997年世界卫生组织组织细胞/网状组织细胞增生委员会(WHO Committee on Histiocytic/Reticulum Rell Proliferations)提出用“朗格汉斯细胞组织细胞增生症”一词替代“组织细胞增多症X”。LCH通常累及的器官包括骨骼(特别是颅骨和中轴骨)、肺脏、中枢神经系统(特别是下丘脑区域)及皮肤(表1)。
表1 朗格汉斯细胞组织细胞增生症的简单分类

PLCH肺脏大体标本表现为双侧多发结节伴不同程度的囊腔。单结节病变罕见,也可见支气管内的肿块。双上肺叶受累显著,肺底部不受累。结节的形状不规则,边缘呈星状。终末期表现为致密的纤维化和囊腔改变,呈蜂窝肺。
低倍镜下,肺组织中散在的以细支气管为中心的星状间质性结节是PLCH主要的组织病理学特征(图1),病变时相不均一,结节(多数直径为1~5mm)、囊腔和纤维斑痕同时存在。结节由混合的细胞群构成,不同数量的朗格汉斯细胞、嗜酸性粒细胞、淋巴细胞、浆细胞、成纤维细胞和细胞质含有烟尘颗粒的吸烟者巨噬细胞。少数病例结节不明显。
朗格汉斯细胞外观均一,细胞质呈弱嗜伊红染色,有明显的沟状核膜(图2),细胞核S100阳性,细胞表面CD1a抗原呈阳性(图3)。电子显微镜下,朗格汉斯细胞内可见五层棒状的特殊结构,称为Birbeck颗粒。
终末期PLCH以显著的纤维斑痕为特征,有不同直径的囊腔样改变,形成蜂窝肺和斑痕旁肺气肿,病变以双上叶为著。胸部影像中的结节影,对应的组织病理改变为星状间质性结节,囊腔影为扩张的细支气管。结节和囊腔周围的肺脏可见吸烟所致的呼吸性细支气管炎和“脱屑性间质性肺炎样反应”,即肺泡腔内吸烟者肺泡巨噬细胞的聚集。肺气肿也比较常见,呈气腔扩大伴纤维化。
当患者发生气胸时,胸膜可以表现为反应性嗜酸性粒细胞胸膜炎,以间皮细胞增生、慢性炎症和嗜酸性粒细胞浸润为主,为非特异性病理表现。终末期患者可以伴有肺动脉高压,主要与肺小动脉和肺小静脉受累有关,血管壁可见中膜增厚和内膜增生,肺朗格汉斯细胞可能通过产生细胞因子和生长因子参与肺血管重建(图4)。
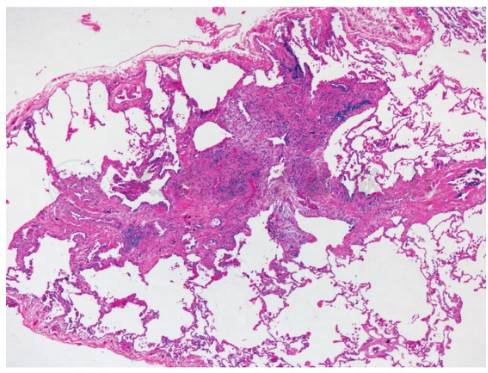
图1 朗格汉斯细胞组织细胞增生症病理学改变(HE染色)
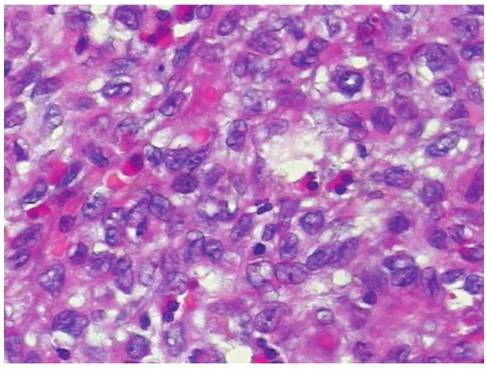
图2 朗格汉斯细胞外观均一,细胞质呈弱嗜伊红染色,有明显的沟状核膜
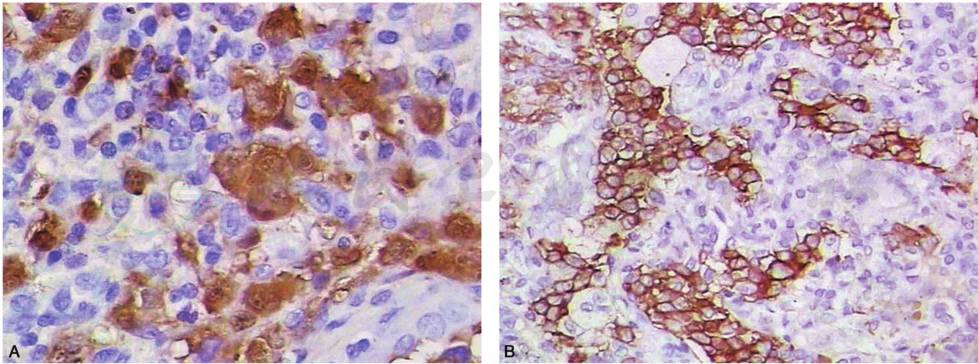
图3 朗格汉斯细胞细胞核S100阳性(A),细胞表面CD1a抗原呈阳性(B)
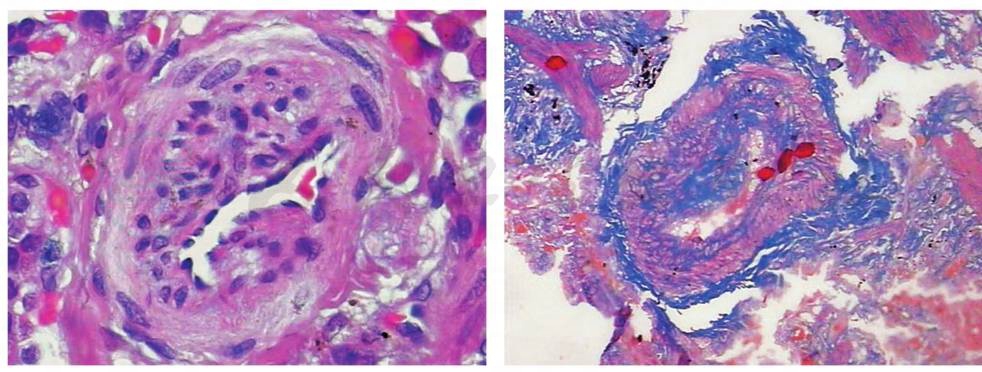
图4 肺朗格汉斯细胞可能通过产生细胞因子和生长因子参与肺血管重建
(一)X线胸片
PLCH早期,X线胸片表现为双肺对称性边界不清的小结节或网结节间质浸润,以双中上肺为著,肋膈角通常不受累(图5)。囊状改变是疾病特征性的改变,既可以是主要病变,也可以与小结节影同时存在。疾病晚期,小结节影减少,囊状改变逐渐占优势。PLCH终末期可见多个直径在2cm以上相邻的囊腔,不易与肺气肿或淋巴管平滑肌瘤病相鉴别(LAM)。X线胸片可见直径在5~10mm多发的环形阴影。与多数间质性肺疾病导致肺容积缩小不同,PLCH患者X线胸片示肺间质改变,但肺容积正常或扩大。极少数PLCH患者X线胸片显示孤立性肺结节。胸腔积液罕见。合并肺动脉高压的患者,X线胸片示右下肺动脉干增宽,肺动脉段膨隆,以及右心扩大表现。极少数早期患者,X线胸片正常。
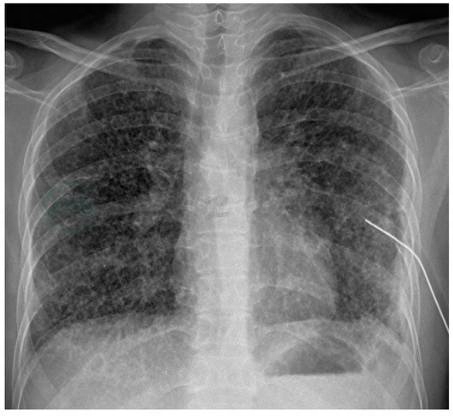
图5 朗格汉斯细胞组织细胞增生症早期的X线胸片表现
(二)胸部HRCT
胸部HRCT可以更好地显示PLCH的病变形态和分布特点,是临床诊断PLCH的重要依据。主要病变形态有囊腔改变和小结节影。早期病变以小叶中心性结节为主,多数是直径1~5mm的微结节,也可以见到直径大于1cm较大的结节,伴少量囊腔改变(图6)。随着疾病进展,囊腔逐渐增多。这些囊腔大小不等,可孤立存在,也可相互融合。囊壁厚薄不规则、直径大小不一,呈弥漫性分布,以中上肺野为著,不累及肋膈角(图7和图8)。晚期可以出现均匀遍布全肺的囊腔影,类似于小叶中央型肺气肿。其他HRCT改变包括磨玻璃样渗出影,线状影,偶见胸腔积液和肺门淋巴结增大。胸部HRCT动态观察发现,在一定时间内结节影逐渐出现空洞并向囊性变进展。也有部分患者戒烟后,囊腔改变和结节影,能吸收好转。
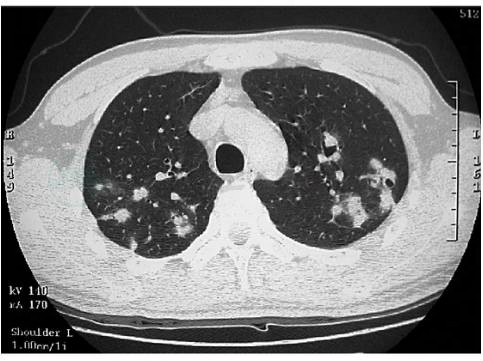
图6 朗格汉斯细胞组织细胞增生症早期的HRCT表现
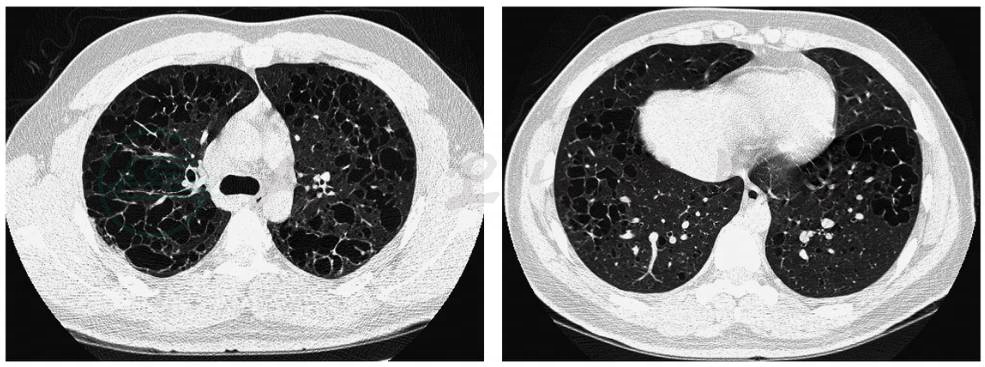
图7 朗格汉斯细胞组织细胞增生症进展期的HRCT表现
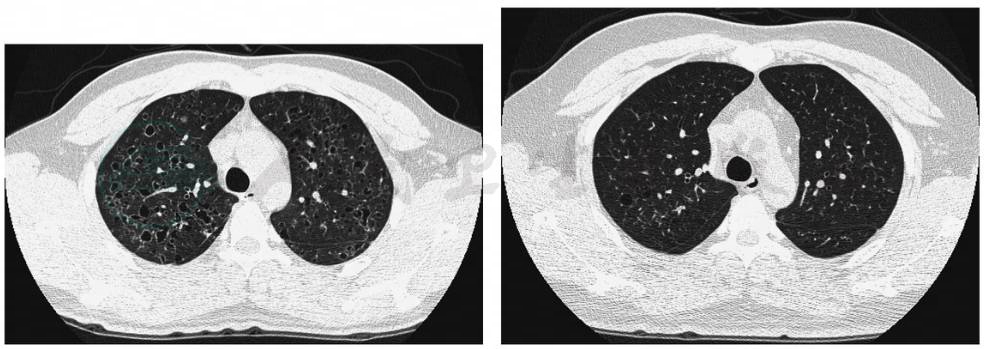
图8 朗格汉斯细胞组织细胞增生症进展期的HRCT表现
(三)正电子发射计算机断层显像(PET/CT)
18氟脱氧葡萄糖PET/CT用于肿瘤的诊断和分期,有助于评价多系统LCH和多灶性骨病,对PLCH的诊断价值需要进一步研究。45%(5/11例)PLCH患者经PET/CT检查呈阳性,肺脏可见显著的炎症性结节,其中3例为多器官受累,包括肺脏、骨骼和肝脏。PLCH早期肺脏炎症性结节病变和厚壁囊腔在PET/CT显像呈阳性,标准摄取值(SUV)为2.0~18.2;肺脏多发薄壁囊腔病变在PET/CT显像呈阴性。PET/CT显像不是PLCH患者的常规检查手段,无法鉴别PLCH肺脏的良性结节和恶性肿瘤。
(一)常规实验室检查
没有特异性,对诊断缺乏帮助。外周血嗜酸性粒细胞、血清血管紧张素转换酶在正常范围。部分患者红细胞沉降率轻度增快。
(二)肺功能
PLCH患者肺功能可以表现为阻塞性、限制性或混合性通气障碍。疾病早期,肺总量和呼气流速通常在正常范围。随着病情进展,部分患者表现为限制性通气功能障碍,肺总量降低,与肺纤维化相关;少数患者出现气流受限和肺过度充气、残总比增高。胸部HRCT囊腔病变的程度与肺功能异常具有相关性。80%~90%PLCH患者可见肺一氧化碳弥散量(DLCO)显著下降。动脉血氧分压与肺脏受累的程度相平行。终末期患者出现6分钟步行试验的步行距离减少。
(三)支气管肺泡灌洗液(BALF)细胞学分析
有助于诊断,BALF中细胞免疫化学朗格汉斯细胞(CD1a+)大于5%(正常范围<1%),提示PLCH的诊断。约50%患者的CD1a+细胞比例增高,CD1a比例正常不能除外PLCH。支气管镜下气管、支气管无异常发现。由于PLCH病变呈灶状分布,经支气管镜肺活检(TBLB)诊断阳性率较低,为10%~40%。
(一)非药物治疗
1.戒烟
PLCH病程具有异质性,约40%的患者在诊断后2年的随访期间,表现为气流受限或DLCO显著下降;随访5年,约50%患者出现肺功能障碍,发展为慢性阻塞性肺疾病和/或肺纤维化;10%~20%患者在诊断早期病情较为严重,逐渐进展为呼吸衰竭和慢性肺源性心脏病。吸烟与PLCH进展和复发关系密切,患者必须戒烟。75%PLCH患者在戒烟后6~24个月自然缓解或病情稳定。值得注意的是,X线胸片对肺部病变诊断的敏感性低于胸部HRCT,可能低估肺脏囊性变的范围和程度,早期文献报告的“自然缓解”,可能与采用X线胸片诊断有一定关系。
2.氧疗
有低氧血症的PLCH患者,建议长程家庭氧疗。
3.气胸的治疗
并发自发性气胸的PLCH患者,通常需要胸腔闭式引流。反复发作气胸、经胸腔闭式引流术仍然漏气者,可以采取胸膜固定术。进入肺移植等待名单的患者,应避免进行胸膜切除术。
4.肺移植
PLCH伴呼吸衰竭或肺动脉高压是肺移植的适应证,1、2和5年的生存率分别为63.6%、57.2%和53.7%,移植肺脏中20%(8/29例)再发PLCH,与持续烟草暴露有关。
(二)药物治疗
1.糖皮质激素
症状严重,影像学或肺功能恶化者,可以口服糖皮质激素。泼尼松的初始剂量为每天0.5~1.0mg/kg,之后逐渐减量,连续服用6~12个月。但激素的疗效尚未得到随机对照临床试验证实。吸入糖皮质激素和/或支气管扩张剂有助于缓解支气管痉挛和治疗慢性阻塞性肺疾病。
2.威罗非尼(vemurafenib)
是一种BRAF丝氨酸-苏氨酸激酶(包括BRAF V600E)突变抑制剂,目前用于治疗晚期转移性或不能切除的黑色素瘤。威罗非尼有可能成为BRAF V600E基因突变阳性、戒烟后病情仍进展的PLCH患者的治疗选择。
3.克拉屈滨(cladribine)
化学名为2-氯脱氧腺苷,是一种嘌呤核苷类似物,对淋巴细胞和单核细胞具有直接的细胞毒性作用,是多系统LCH的二线治疗药物,对PLCH患者也具有改善作用。3例病情进展的PLCH患者接受皮下注射克拉屈滨每天0.1mg/kg,每月5天,连续4~5个月,能够明显地改善呼吸道症状和肺囊腔病变。评价克拉屈滨治疗PLCH疗效和安全性的Ⅱ期临床试验正在开展。
4.其他化疗药物
长春新碱、甲氨蝶呤、环磷酰胺和依托泊甙也用于对激素治疗没有反应的LCH多器官受累者。放疗可以减轻骨骼受累的症状,对肺脏病变无效。
5.肺动脉高压的药物治疗
肺动脉高压是PLCH的并发症之一,29例PLCH合并肺动脉高压患者,经右心导管测定肺动脉平均压为(45±14)mmHg,估计1、3和5年生存率分别为96%、92%和73%。应用内皮素受体拮抗剂、磷酸二酯酶5抑制剂或联合治疗,少数患者吸入伊洛前列素,可以稳定病情。













