英文名称 :diffuse panbronchiolitis
弥漫性泛细支气管炎(diffuse panbronchiolitis,DPB)是以两肺弥漫性呼吸性细支气管及其周围的慢性炎症为特征的气道疾病。因DPB炎症病变广泛累及双肺,故称为“弥漫性”,而“泛”是指病变累及呼吸性细支气管的“全层”及波及其周围组织。1969年日本学者Yamanaka根据病理学改变发现DPB是一种与慢性支气管炎和肺气肿不同的疾病。1975年Homma根据临床、影像学及病理特征提出DPB是一种独立性疾病。1983年Homma等在CHEST杂志首次报道了DPB。1996年我国首次报道了明确诊断的DPB。目前认为DPB发病多集中在东亚地区,欧美报道病例极少且其中半数以上为亚裔移民,因此推测DPB发病可能与种族遗传有关,以亚洲人发病多见。
DPB临床表现主要为持续性咳嗽、咳痰、活动时呼吸困难。约80%以上的DPB患者合并或既往有慢性鼻窦炎。胸部CT或肺高分辨CT显示两肺弥漫性小叶中心性颗粒样结节状阴影对协助诊断具有重要意义。肺功能检查主要为阻塞性通气功能障碍,但早期出现低氧血症,而弥散功能通常在正常范围内。实验室检查血清冷凝集试验效价升高,多在1∶64以上。DPB病理学特点是呼吸细支气管区域的淋巴细胞、浆细胞、组织细胞等细胞的浸润,淋巴滤泡的形成以及呼吸细支气管壁及其周围的泡沫细胞的聚集。如不能及时治疗,DPB可发展为支气管扩张、反复肺部感染、呼吸衰竭、肺动脉高压、肺心病,甚至死亡。DPB是一种可治性疾病,治疗首选红霉素、克拉霉素或罗红霉素等14元环大环内酯类,其疗效显著。如果早期诊断、早期治疗,DPB是可以治愈的。
DPB的病因至今不明。其发病可能与以下因素有关:人种特异性及遗传因素、慢性气道炎症、免疫系统功能障碍、慢性气道感染机制等。
(一)人种特异性及遗传基因
1.HLA基因
近年研究表明DPB发病以东亚人(蒙古系人种)居多,有明显的人种差别且部分患者有家族发病倾向。研究表明,在人体白细胞抗原(HLA)Ⅰ类抗原中,日本DPB患者HLA-B54阳性率为62.3%,正常对照组仅为11%,提示DPB发病与编码HLA-B54抗原的B*5401基因具有高度相关性。然而在韩国 DPB患者 HLA-A11阳性率为53.3%,正常对照组为17.5%。因此,Keicho等提出了DPB疾病易感基因的假说:推测DPB易感基因位点可能位于人第6染色体短臂6p21.3的HLA-B和HLA-A基因之间。此外研究发现,属于HLAⅡ类基因的TAP(transporter associated with antigen processing)基因外显子变异也可能与DPB疾病相关。
2.其他基因
最近研究推测DPB可能与黏蛋白基因MUC5B及MUC5AC基因多态性及基因异常表达及有关,是导致DPB患者气道高分泌,大量咳痰的原因之一。此外,白介素-8(IL-8)基因也可能参与DPB发病。
3.鼻窦支气管综合征(sinobronchial syndrome,SBS)
是指慢性鼻窦炎同时伴有下呼吸道炎性病变的慢性气道疾病,如囊性纤维化、原发性纤毛不动征等疾病。SBS的发病机制可能与遗传、环境因素、免疫功能及鼻腔形态结构、宿主呼吸系统防御缺陷等密切相关。由于DPB是呼吸性细支气管及其周围的慢性炎症而且大部分患者伴有慢性鼻窦炎,故有人认为DPB也是一种SBS。此外,部分DPB患者家族成员患有慢性鼻窦炎或SBS,故认为DPB可能是一种多基因遗传倾向的疾病。
(二)慢性气道炎症
1.中性粒细胞
部分DPB患者支气管肺泡灌洗液(BALF)中性粒细胞、中性粒细胞趋化因子以及蛋白水解产物明显增高。聚集在气道内的中性粒细胞释放的炎症因子及炎性介质等可能参与气道的炎症反应。经过红霉素治疗后DPB患者BALF中升高的中性粒细胞数逐渐降至正常。
2.淋巴细胞
DPB患者BALF中淋巴细胞绝对数明显高于正常对照组,CD8+细胞百分比和总数及CD4+细胞总数高于对照组,但CD4+/CD8+比值明显下降。应用14元环大环内酯类抗生素治疗后,淋巴细胞总数和CD8+细胞数下降,CD4+/CD8+比率上升。提示淋巴细胞是DPB发病的重要细胞成分以及淋巴细胞有可能促使慢性气道炎症的发生。
3.树突状细胞(DC)
在DPB患者细支气管上皮和黏膜下组织中DC数量明显高于正常对照组,尤其黏膜下组织表达CD83+抗原的DC增多明显,推测CD83+通过其抗原递呈能力,刺激黏膜下浸润的淋巴细胞,导致呼吸性细支气管及其周围的慢性炎症,DC在DPB黏膜免疫反应中起了重要的作用。
4.炎症因子及炎症介质
DPB患者 IL-8、白三烯 B4(LTB4)等升高提示本病存在慢性气道炎症病变。DPB患者肺组织IL-8,IL-1β、黏附分子(SL-选择素,SE-选择素,SP-选择素)等均有过量表达。
(三)免疫系统功能障碍
血冷凝集试验效价升高以及部分患者IgA增高被认为DPB可能是免疫学相关疾病。DPB的病理学特征为呼吸性细支气管壁有淋巴细胞、浆细胞、组织细胞浸润,常伴有淋巴滤泡形成等可能与免疫功能异常有关。DPB可伴发类风湿关节炎、成人T淋巴细胞白血病、溃疡性结肠炎等疾病也提示可能是免疫学相关疾病。
(四)慢性气道感染机制
DPB患者晚期痰培养多为铜绿假单胞菌且均有气道分泌物增多,可能是气道严重受损和晚期DPB继发的支气管扩张所致。铜绿假单胞菌是DPB的发病原因还是继发的感染尚不清楚。这种现象与囊性纤维化合并支气管扩张极其相似。此外,由停滞于患者气道黏膜上的铜绿假单胞菌以及由细菌产生的弹性硬蛋白酶和一些炎症介质所构成的生物膜可能是造成气道上皮细胞的损伤和气道炎症的原因。最近有学者认为DPB可能与人体T淋巴细胞病毒-1(human T-cell lymphotropic virus type 1,HTLV-1)感染有关。HTLV-1感染后与DPB在临床病理学表现上极其相似,提示DPB可能是HTLV-1感染后的慢性肺部表现,然而,HTLV-1感染相关的细支气管炎却与DPB不同,因此DPB是否与HTLV-1感染有关尚不明确。
(一)肉眼所见
肺脏表面及切面可见弥漫性分布的浅黄色小结节,结节大小较均匀,直径约2~8mm,位于呼吸性细支气管区域,以两肺下叶多见。通常显示肺脏过度充气(图1a)。
(二)镜下所见
病理学特点是双肺弥漫性分布的以呼吸细支气管为中心的细支气管炎及细支气管周围炎,病变累及呼吸性细支气管全层。典型病例在呼吸性细支气管区域有淋巴细胞、浆细胞、组织细胞等细胞浸润,常伴有淋巴滤泡的形成以及在呼吸性细支气管壁全层及其周围的肺泡管及肺泡间质可见泡沫细胞聚集,可导致呼吸细支气管壁增厚、管腔狭窄(图1b)。在DPB病情进展期可见肉芽组织充填于呼吸性细支气管腔内,导致管壁狭窄或闭塞、继发性细支气管扩张和末梢气腔的过度充气。
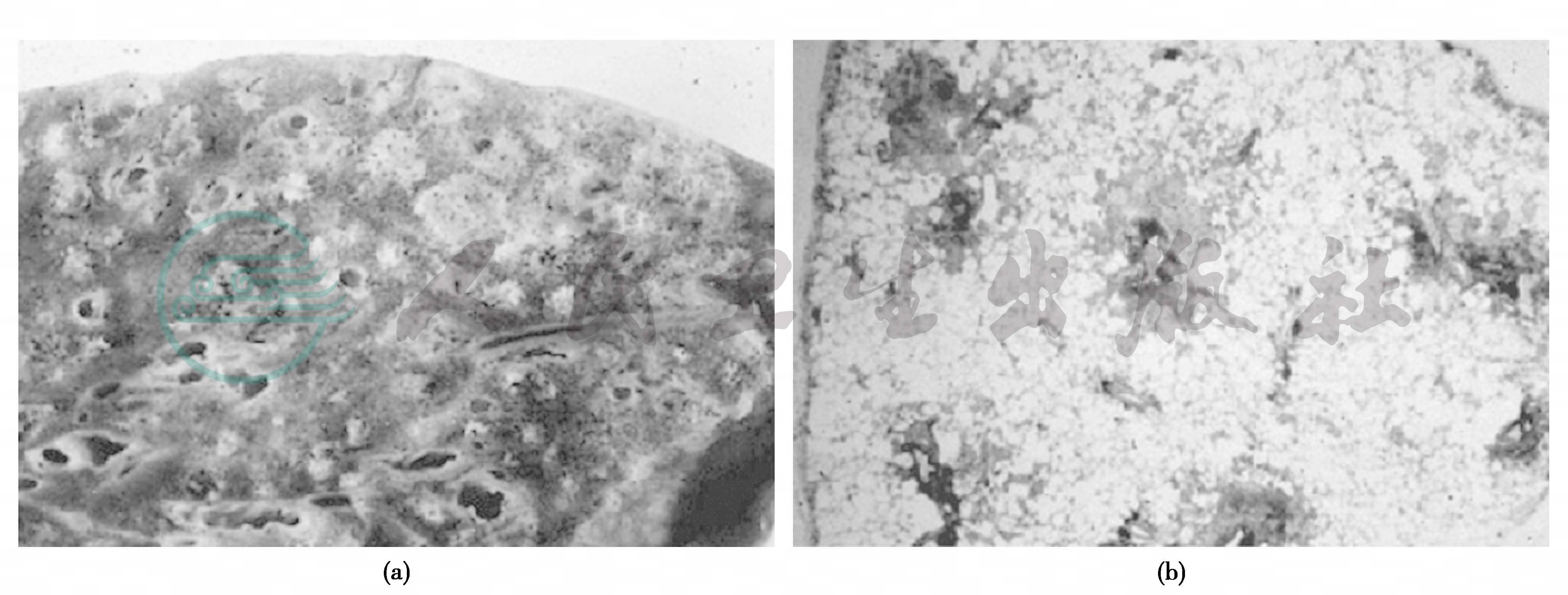
图1 弥漫性泛细支气管炎肺实体和病理切片改变
(a)肺脏切面可见弥漫性分布的浅黄色小结节。(b)小结节是由增厚的呼吸性细支气管壁及炎症细胞和泡沫细胞构成
(一)胸部X线/肺部CT
胸部X线可见两肺弥漫性散在分布的颗粒样小结节状阴影,以下肺野多见(图2)。随病情进展,胸部X线常可见肺过度充气(图2)。晚期患者可见支气管扩张的双轨征。肺部CT或胸部高分辨CT(HRCT)的典型表现为两肺弥漫性小叶中心性颗粒样结节状阴影(图2),此外,可在结节附近侧端有分枝“Y”字形树芽征。颗粒样小结节的边缘模糊,其直径在2~5mm,多在2mm以下。肺部CT或HRCT如存在上述特征性改变对诊断DPB具有重要意义。肺部CT显示的颗粒样小结节状阴影为呼吸性细支气管区域的炎性病变所致,随着病情加重或经大环内酯类抗生素治疗后,小结节状阴影可扩大或缩小乃至消失。因此,肺部CT也有助于评估病情变化和治疗效果。
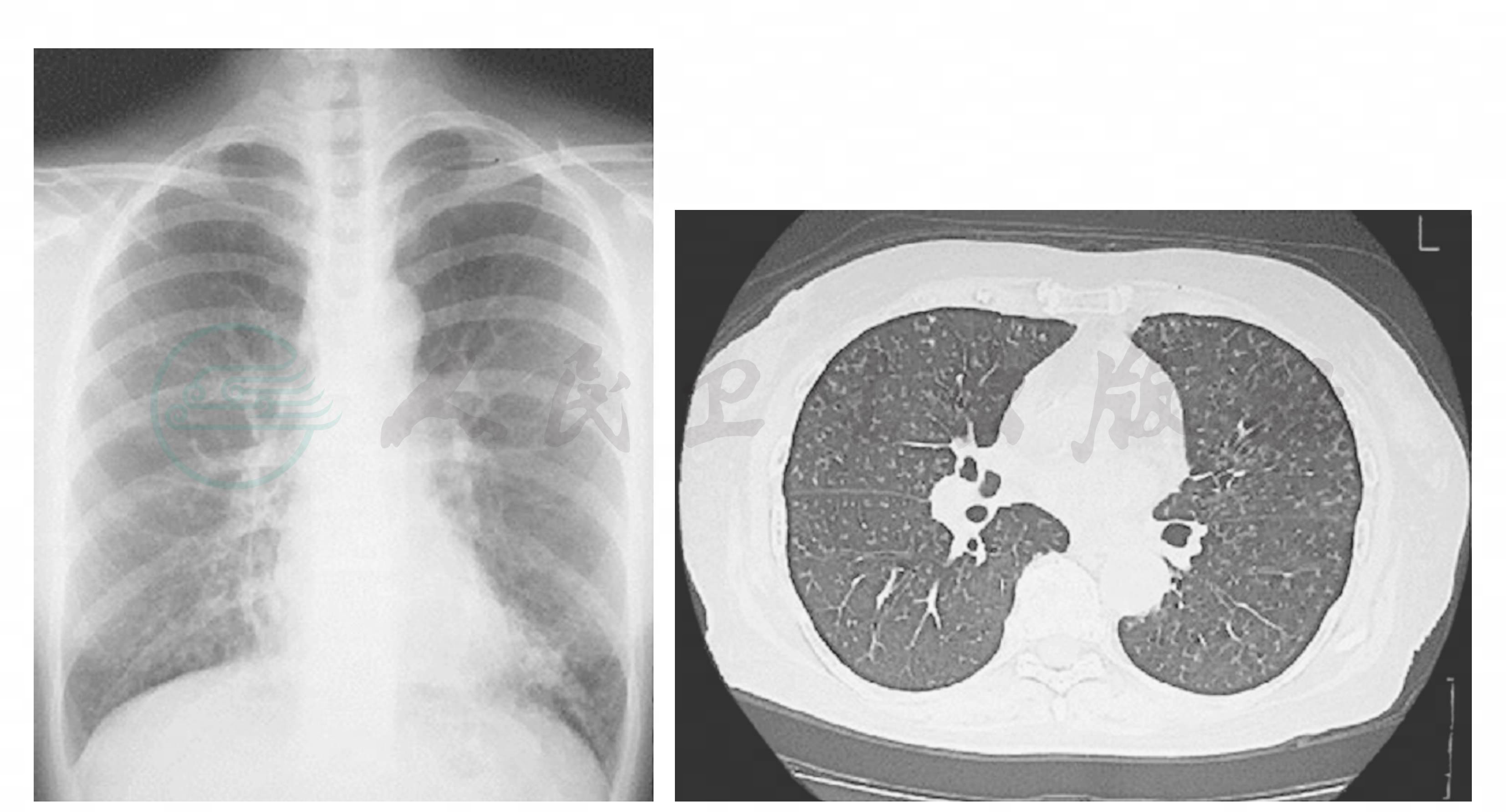
图2 DPB影像学典型表现
胸部X线:双下肺弥漫性小结节状阴影伴肺过度充气。胸部高分辨CT:两肺弥漫性小叶中心性颗粒样结节状阴影
(二)慢性鼻窦炎的检查
对疑诊DPB患者应该常规进行鼻窦X线片或鼻窦CT检查,如确定存在鼻窦炎,将有助于DPB诊断。
(三)肺功能检查及血气分析
病初主要为阻塞性通气功能障碍或混合性通气功能障碍,随疾病进展,部分患者可伴有轻、中度的限制性通气功能障碍。一秒用力呼气容积与用力肺活量比值(FEV1/FVC)<70%,肺活量占预计值的百分比(VC%)<80%。病情进展可伴有残气量占预计值的百分比(RV%)>150%或残气量占肺总量的百分比(RV/TLC%)>45%,但弥散功能和肺顺应性通常在正常范围内。动脉血氧分压(PaO2)<80mmHg,早期出现低氧血症,晚期可有高碳酸血症。久而久之可导致肺动脉高压、肺心病。重症患者常死于慢性呼吸衰竭。
(四)实验室检查
约90%日本DPB患者血清冷凝集试验效价升高(1∶64以上),但支原体抗体多为阴性。部分患者可有血清IgA增高,外周血CD4+/CD8+比值上升,γ-球蛋白增高,血沉增快,类风湿因子阳性,抗核抗体滴度升高。部分患者可有血清HLA-B54或HLA-A11阳性。痰细菌学检查可发现起病早期痰中多为流感嗜血杆菌,肺炎链球菌,肺炎克雷伯菌或金黄色葡萄球菌,晚期多以铜绿假单胞菌感染为主。痰培养早期铜绿假单胞菌阳性率为55%,晚期可达到82%。BALF中细胞总数及中性粒细胞增高,CD4+/CD8+比值降低。
(五)病理检查
病理检查学是确诊DPB的金标准。如果肺活检能发现典型的DPB病理学改变即可确诊。经支气管镜肺活检(TBLB)方法简便且安全,但由于DPB病变主要位于呼吸性细支气管及周围区域,所以TBLB常因标本取材少,不一定能取到呼吸性细支气管病变而影响病理诊断。如欲提高检出率,应在TBLB检查时,取3~5块肺组织。如TBLB仍不能确诊,必要时应行胸腔镜下肺活检或开胸肺活检,可提高本病的确诊率。
DPB是一种可治性疾病,治疗首选红霉素、克拉霉素或罗红霉素等14元环大环内酯类药物,其疗效显著。
1984年日本学者工藤翔二等首次报道了红霉素治疗对DPB患者有效。成为红霉素疗法开端的病例为54岁男性,病理组织学诊断为DPB,虽然积极地进行了各种治疗,但病情仍继续恶化,于是患者自行中断来院治疗。2年后,该患者再次到工藤门诊就诊时,患者的自觉症状几乎消失,胸部X线恢复正常,PaO2从55mmHg上升到85mmHg。经了解,患者在这期间,就诊于当地诊所,其处方用药之一即为红霉素600mg每日1次口服。以本病例为契机,工藤等开始了对DPB的红霉素小剂量长期疗法的临床试验。研究结果表明18例DPB患者接受红霉素每日600mg治疗6个月至3年后,临床症状、肺功能明显改善、PaO2上升,以及60%患者胸部影像学颗粒状结节状阴影消失。
在发现红霉素等14元环大环内酯类药物治疗DPB具有显著疗效之前,日本学者一直认为DPB是一种慢性感染性和慢性阻塞性疾病,并使用口服糖皮质激素、支气管扩张剂、祛痰药和头孢菌素等抗生素进行治疗,但这种治疗方案的预后始终不佳,大多数患者病情逐渐恶化,20世纪70年代DPB的5年生存率是63%,然而,由于发现红霉素等14元环大环内酯类药物治疗DPB具有显著疗,1985年DPB的5年生存率达到92%,预后有了显著的改善。文献报道15元环大环内酯类药物阿奇霉素对DPB似乎有效,但其最佳使用方法及疗程尚待进一步研究。需要强调16元环大环内酯类药物,如交沙霉素等对DBP治疗无效。
目前红霉素、克拉霉素或罗红霉素等14元环大环内酯类药物已成为DPB的基本疗法,如能早期应用效果更佳。2000年日本厚生省重新修改了DPB的治疗指南。
(一)治疗方案
1.一线治疗方案
红霉素250mg,每日2次。疗效多在治疗后在用药后2个月至3个月出现,因此,应在治疗后2~3个月内检查患者的临床症状、肺功能及影像学等,确定是否有效,如有效,可继续使用红霉素,用药至少需要6个月。服药6个月后如果仍有临床症状应继续服用红霉素2年。如服用红霉素2~3个月无效者或出现红霉素的副作用或药物相互拮抗作用可选择使用二线治疗方案(克拉霉素或罗红霉素)。如二线治疗3个月以上仍无效者应考虑是否为DPB患者。应谨慎排除其他疾病的可能。用药期间应注意复查肝功能等。最近有发现极少数DPB患者对红霉素治疗无效,其原因尚不清楚。目前已有人在开发无抗菌活性而只具有抗炎作用的新型红霉素衍生物-EM703。
2.二线治疗方案
克拉霉素250~500mg/d,每日分1次或2次口服;罗红霉素150~300mg/d,每日分1次或2次口服。用药期间应注意复查肝功能等。
(二)停药时间
1.早期DPB患者
经6个月治疗后病情恢复正常者可考虑停药。
2.进展期DPB患者
经2年治疗后病情稳定者可以停药。停药后复发者再用药仍有效。
3.伴有严重支气管扩张或呼吸衰竭的DPB患者
治疗需要2年以上或需长期用药。
(三)DPB急性发作期治疗
如果DPB患者出现发热、黄脓痰、痰量增加等急性加重情况时,多为铜绿假单胞菌等导致支气管扩张合并感染,此时应加用其他抗生素,如β-内酰胺类/酶抑制剂或头孢三代或氟喹诺酮类(环丙沙星或左氧氟沙星)或碳青霉烯类抗生素,也可根据痰培养结果选择抗生素。此外,根据患者情况可给予对症治疗,如祛痰剂、支气管扩张剂及氧疗等。
(四)合并症治疗
如果患者出现肺心病及右心功能不全,应给予治疗右心衰竭。如合并低氧血症或呼吸衰竭,应考虑长期氧疗,而严重呼吸衰竭者有可能需要机械通气治疗。
关于应用糖皮质激素治疗DBP问题,无论过去和现在,普遍认为其疗效不佳。最近Adams等报道一例经病理确诊的DPB患者在使用吸入及口服糖皮质激素后症状持续恶化,但使用红霉素500mg每日2次,治疗6个月后症状、肺功能及胸部CT均明显改善。
虽然红霉素等14元环的大环内酯类药物治疗DPB取得了显著的疗效,但其治疗作用机制尚不完全清楚。最近研究表明大环内酯类药物治疗DPB的作用机制并非抗细菌感染,而可能是通过抑制炎症反应,阻断慢性气道感染的“恶性循环”。然而目前仍不清楚为什么糖皮质激素也具有抗炎作用,但其治疗DBP疗效差。目前认为大环内酯类药物治疗DBP有效可能与以下机制有关:①抑制黏蛋白以及阻断氯离子通道以抑制水的分泌,减少气道过度分泌;②抑制中性粒细胞活性及其与血管内皮和气道上皮的黏附,阻断气道上皮细胞、肺泡巨噬细胞、中性粒细胞分泌IL-8等细胞因子及炎症介质,减少中性粒细胞在气道黏膜的聚集;③抑制淋巴细胞的增生和活化,促进单核-巨噬细胞的成熟和分化;④抑制铜绿假单胞菌在支气管管壁上的生物膜的形成,抑制细菌产生的过氧化物及弹性蛋白酶等毒性代谢产物,减小其对基底膜的黏附作用,减少气道上皮的损伤。
综上所述,作为独立的呼吸系统疾病,DPB具有以下6个特征:①从形态和病变的部位以及影像学表现来看是“弥漫性肺疾病”;②从肺功能来看是“阻塞性肺疾病”;③多数患者晚期合并铜绿假单胞菌感染提示为“慢性气道感染症”;④血冷凝集试验效价持续增高提示为“免疫学相关疾病”;⑤大部分患者合并慢性鼻窦炎提示DPB为“鼻窦支气管综合征”;⑥HLA抗原关联上显示是与遗传因素相关的人种特异性的“多因子疾病”。DPB患者如果能得到早期诊断和治疗,其预后良好。目前在我国临床医生对本病认识仍不够充分,仍有一些误诊、漏诊病例,治疗仍有欠规范。今后亟须提高对DPB的认识,此外,应尽快进行我国DPB的流行病学调查,建立我国DPB患者的临床诊断标准和治疗指南。













