目前,异基因骨髓干细胞移植(hematopoietic stem cell transplantation,HSCT)及肾脏、肝脏、心脏、肺脏、小肠等实体器官移植(solid organ transplant,SOT)技术已经日臻成熟,但影响移植术后受者存活率的两大主要因素,依然是排斥反应和感染。HSCT及SOT术后,受者需要长期使用免疫抑制剂来预防和治疗排斥反应,而长期免疫抑制剂的使用,使受者的细胞免疫及体液免疫功能低下,继发各种病原体感染的风险显著增加,尤其在术后早期、大剂量免疫抑制剂使用期或再次冲击治疗时期。自从2015年,我国成立了规范的器官获取组织后,公民逝世后器官捐献逐渐成为移植受体得到脏器的重要来源。来源于捐赠的供体,死亡前绝大部分在ICU入住,接受气管插管等生命脏器辅助支持,供体本身携带的病原体成为受体感染的主要原因之一。严重的感染不仅损害移植物功能,而且显著增加SOT受者的死亡率,使实体器官移植面临更大的挑战。回顾性研究显示,SOT术后,1年内的死亡原因中,由于感染导致的比例达到41%;而前瞻性研究显示,未来的几年,这种比例将更加升高,达到53%。由此可见,全面进入器官捐赠时代后,SOT术后面临感染的形势将更加严峻。SOT术后约有40%的围手术期死亡的原因是感染,或其他并发症同时合并感染。感染的病原学之中,细菌感染是最常见的;感染的部位方面,以肺部感染最常见。细菌感染可以单独反复发生,或者与其他病原体混合感染。
围手术期的肺炎多为院内获得性,以HAP为主,病原体以细菌为主。高危因素主要包括:①受体和供体呼吸道的耐药病原体的存在,尤其是肺移植或心肺联合移植受者;②供体肺在离体后、植入前缺血时间过长;③受体的年龄、基础疾病影响,如老年移植受者(>60岁)、有糖尿病、高血压、肝功能受损等合并疾病者;④大剂量免疫抑制剂的使用,尤其是术前采用免疫诱导治疗者;⑤单肺移植受者;⑥移植术后出现严重并发症(肾功能不全、胆道感染或梗阻等);⑦留观ICU时间与气管插管时间过长(≥72小时)、再次手术;⑧术前90天内使用过抗生素治疗;⑨近期住院时间大于5天等。
术后远期的肺炎,以CAP相对多见,病原体以病毒较常见,其次为细菌及真菌,高危因素主要包括:粒细胞减少或缺乏,再次冲击治疗或增强免疫抑制剂的使用,老年移植受者(>60岁),有糖尿病、高血压、肝功能受损等合并疾病者,单肺移植受者,既往有耐药菌定植或曲霉菌定植者等。
相对于普通患者,移植受者的肺部感染往往存在以下特点:①机会性感染常见;②混合感染多见,病原体复杂;③移植术后早期的细菌感染,以多耐药菌常见;④严重程度高;⑤病情进展迅速;⑥病死率高;⑦精准化诊断相对困难;⑧治病原耐药率高,可供选择的治疗用药相对较少;⑨治疗反应差,疗效慢。其感染的程度往往比较严重,一旦发生感染,病情进展迅速,也容易并发腹腔内感染甚至血流感染,且病死率高。而SOT受者感染后的临床症状、体征可能不典型或者延迟出现,感染相关指标往往无明显升高或升高不显著;另外,患者对气管镜检查、CT及B超引导穿刺等有创辅助检查的耐受性差;因此,对病原学的精准化诊断带来一定困难,从而影响抗感染药物的选择,使治疗难度显著增加。另外,多种药物的同时使用使得药物之间的相互作用复杂、药物不良反应及对肝肾功能的影响等因素又进一步增加了治疗难度。而移植受者免疫力的低下、低蛋白血症、糖尿病等因素的影响,使受者对抗感染治疗的反应慢,需要更长疗程。
肺部感染在全球的发病率和死亡率高,无论在发达国家还是发展中国家,肺部感染都是导致死亡的重要原因之一。据世界卫生组织对所有人群的调查显示,肺部感染是世界上最常见的感染性死亡原因,每年导致近3 500万人死亡,重症肺炎的病死率可高达30%~50%。而SOT受者作为免疫受限人群,肺部感染的风险更高,而且这种高风险状态伴随终身。但是,不同的术后时间、不同的器官移植类型,感染的特点及严重程度有所不同。所有的SOT术后早期(术后30天内),肺部感染是受者死亡的主要原因之一,尤其是肺移植术后及心肺联合移植术后。肺移植术后的30天至1年内,细菌感染不仅始终是导致受者死亡的首位原因,而且其比例显著高于其他死亡原因。SOT术后早期,细菌感染是最常见的,死亡率也最高,随后的第2~3个月病毒感染率显著增加,之后依次是真菌、分枝杆菌、寄生虫等特殊病原体感染率显著增加。
HSCT及SOT术后,各个脏器的感染率增加,包括手术部位、手术器官及血流感染,但肺部的感染率不仅显著高于其他脏器,而且肺部感染主要以原发感染为主。肺部感染高发的主要原因为肺脏本身属于与外界相通的开放性器官,各种病原体容易侵犯气道黏膜屏障,尤其是在围手术期、大剂量免疫抑制剂的使用、患者所处的环境为院内医疗场所时。而肺移植及心肺联合移植术后,肺部感染的发生率更高,主要原因为:①肺移植及心肺联合移植手术过程中的暴露、术后来源于供体肺及气道的病原体均是受体感染的主要感染源之一;②手术操作本身对气道黏膜屏障的破坏、气道黏膜肿胀、吻合口水肿,使气道分泌物引流不畅,而气道分泌物本身就是细菌良好的培养基;③疼痛刺激、神经受损等多种因素,使受者咳嗽、咳痰能力下降,痰液引流不畅,痰液作为细菌良好的培养基,引流不畅即可导致肺部感染率显著增加;④手术使得相应的神经组织如膈神经、迷走神经、喉返神经等受到一定损伤,气道纤毛的摆动能力显著下降、对黏液和病原微生物的清除能力下降等多种因素,使肺移植术后肺部感染率更高。
HSCT及SOT术后肺部感染导致的肺炎,有多种分类方法。按照严重程度,分为重症肺炎与非重症肺炎;按照病原体分类,可以分为细菌性肺炎、病毒性肺炎、真菌性肺炎等;按照肺部受累的面积,分为大叶性肺炎、小叶性肺炎、支气管肺炎等。目前常用的分类方法主要是按照罹患感染的场所,分为社区获得性肺炎(community acquired pneumonia,CAP)和院内获得性肺炎(hospital acquired pneumonia,HAP)。但是,术后时间、器官移植类型不同,感染的特点及严重程度也有所不同。移植术后早期(1个月内),细菌感染是最常见的病原体,随后细菌感染的发病率逐渐下降,而病毒、真菌、特殊病原体、寄生虫等感染的发病率依次逐渐增加。因此,结合移植术后患者的肺部感染的特点,临床上常采取几种分类方法结合,利于诊断及治疗。
细菌感染是移植术后早期最主要的病原体,包括HSCT及SOT,尤其是SOT围手术期。随着抗菌药物的广泛应用,细菌的耐药性也不断增强。在过去的20多年,出现了许多新的多重耐药、广泛耐药甚至全耐药的“超级细菌”,给移植医学带来了巨大的挑战。与普通细菌相比,耐药菌感染后相关并发症多、死亡率高。移植受者作为免疫缺陷人群,一旦患者发生多耐药菌感染,死亡率高达40%以上。
1.肺部细菌感染的常见病原体
(1)围手术期及术后早期:
无论HSCT还是SOT受者,围手术期及术后早期的肺炎多为HAP,因感染来源主要为院内获得性,其菌种以多重耐药的革兰氏阴性杆菌常见。根据中国耐药细菌监测网的数据,除了肠科杆菌属中的大肠埃希菌外,非发酵糖的革兰氏阴性杆菌占所有分离菌株的24.1%,其中最多见者依次为鲍曼不动杆菌(38.3%)、铜绿假单胞菌(36.0%)、嗜麦芽窄食单胞菌(11.9%)。另外,近年来革兰氏阳性球菌的分离率逐年上升(图1A),最多见者依次为金黄色葡萄球菌、肠球菌属和凝固酶阴性葡萄球菌。其中,甲氧西林耐药菌株的分离率逐年增加;2017年国内的数据显示,金黄色葡萄球菌的平均检出率达到35.3%,凝固酶阴性葡萄球菌中甲氧西林耐药株占比为80.3%。甲氧西林耐药株对大环内酯类、氨基糖苷类和喹诺酮类等多数抗菌药物的耐药率均显著高于甲氧西林敏感株。针对免疫缺陷人群,甲氧西林耐药菌株,尤其是耐药金黄色葡萄球菌(MARSA)的感染不容忽视。
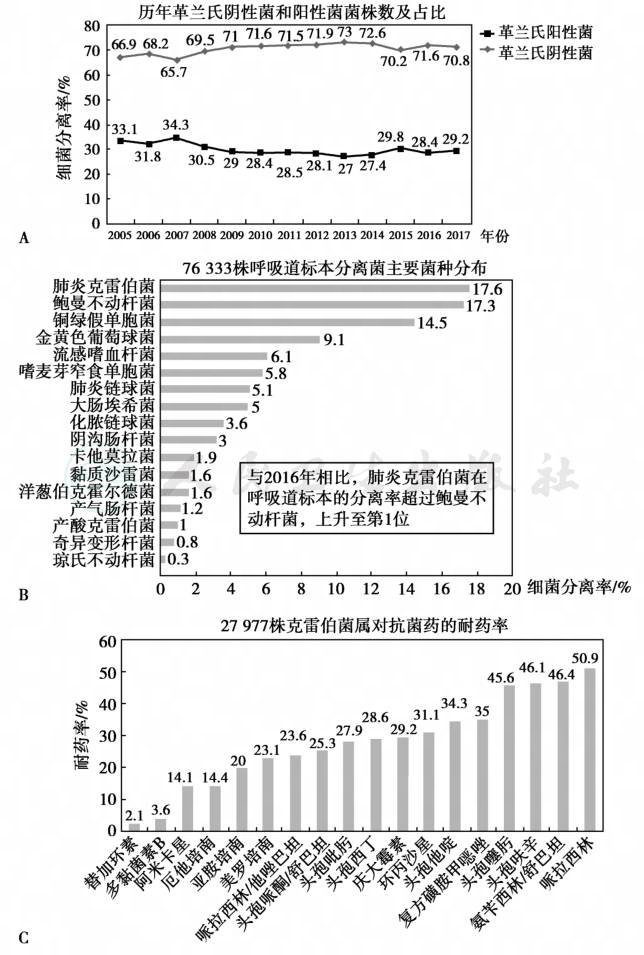
图1 我国肺炎克雷伯菌感染情况
A.近年来革兰氏阳性球菌的分离率逐年上升;B.肺炎克雷伯菌的分离率跃居首位,替代了既往多年鲍曼不动杆菌占有的首位;C.肺炎克雷伯菌对抗生素的耐药情况。
近年来,碳青霉烯类耐药的肠科杆菌属(CRE)的分离率及感染率逐年上升。CRE主要包括克雷伯菌属、肠杆菌属、沙雷菌属、变形菌属等。其中,碳青霉烯类耐药的肺炎克雷伯菌感染的发生率显著增加。根据我国耐药细菌监测网的数据,该细菌每年的分离率呈稳步上升趋势:从2005年的3%左右上升到了2017年的24%,上升幅度高达8倍。而2017年的呼吸道分泌物中,肺炎克雷伯菌的分离率跃居首位,替代了既往多年鲍曼不动杆菌占有的首位(图1B)。而且,其对多种抗生素的耐药率也显著上升(图1C)。
(2)术后远期:
移植受者在术后中远期的肺炎大多为CAP,因感染来源主要为社区获得性,但也有部分受者因排斥反应、肝肾功能异常、心血管疾病、CAP等并发症返回医院治疗期间,继发获得HAP。对于CAP患者,根据不同的人群,常见的感染菌群也有所不同。对于年轻、免疫抑制的程度相对较轻、无基础肺疾病、一般情况良好、无需收住医院者,常见的感染细菌为流感嗜血杆菌、需氧革兰氏阴性杆菌、金黄色葡萄球菌、卡他莫拉菌等。而对于年老或具有基础肺疾病者、需要收住院但非重症者,常见细菌为流感嗜血杆菌、混合感染、需氧革兰氏阴性杆菌、金黄色葡萄球菌等。上述需要收住院且需要收住ICU诊治的重症者,常见的感染菌为需氧革兰氏阴性杆菌、嗜肺军团菌、肺炎克雷伯菌、金黄色葡萄球菌、诺卡菌等。对于有结构基础肺病的患者或单肺移植的患者,铜绿假单胞细菌感染也较常见。
2.肺部细菌感染的治疗原则
移植受者罹患肺炎的概率显著高于普通人群,无论是CAP还是HAP;而且,其严重程度也高于普通人群。因此,一旦诊断为肺炎,应尽早给予相应治疗。主要治疗原则包括早期足量的抗菌药物治疗、免疫抑制剂的调整、对症支持治疗等。
(1)抗菌药物的治疗原则:
抗菌药物起始治疗应尽早开始,在确立临床诊断并安排合理病原学检查及标本采样后,根据患者年龄、基础疾病、临床特点、实验室及影像学检查,疾病严重程度、肝肾功能、既往用药及药物敏感性情况,尽早开始抗菌药物治疗。具体策略如下:
1)在围手术期及术后早期,抗生素的使用应该建立在以下3项基础之上:①供体的病原学证据;②受体的临床感染症状及体征;③受体的病原学依据。
2)病原学的结果回报之前,根据当地的流行病学、患者的基础疾病状态,予以能够覆盖常见病原体的广谱抗生素。之后,病原学结果回报后,再根据药敏结果对原有的经验性广谱抗生素进行调整,改为针对性的目标抗生素。
3)尽量根据药敏结果选择敏感抗菌药物,当所有药物均不敏感时,选择与最低抑菌浓度(MIC值)较接近敏感折点的药物。
4)多耐药阴性菌的治疗不仅需要增加抗生素的剂量,而且需要联合用药,但同时注意根据患者的年龄、肝肾功能及体表面积进行相应调整。
5)根据PK/PD原理设定给药方案,如增加给药剂量或次数、延长抗菌药滴注时间等。
(2)免疫抑制剂的调整:
目前SOT术后免疫抑制的维持治疗,通常采用经典的三联药物维持,即细胞周期抑制药物,最常用的是霉酚酸酯类;钙磷酸酶抑制剂,以环孢素A或普乐可复最常用;小剂量的糖皮质激素。一般来说,对于发生明确感染的移植受者,尽量降低免疫抑制剂的强度,尤其是重症感染。免疫抑制剂的调整,首先考虑减少或暂停细胞周期抑制药物;然后考虑降低钙磷酸酶抑制剂的强度。而对于重症感染、尤其是脓毒血症、血流动力学不稳定或感染性休克患者,糖皮质激素还可以短期增加剂量、静脉使用,以减轻急性炎症反应对组织的损伤。在重症感染的急性期,可予以0.5~1mg/kg静脉使用3~5天,随后恢复至发病前的维持剂量。
(3)移植受者MDR细菌感染的抗生素选择推荐:
移植受者的MDR细菌感染,主要为革兰氏阴性杆菌。如培养结果为鲍曼不动杆菌,则应该选择以下列几种药物为基础的联合用药原则,包括以舒巴坦或其合剂为基础的联合、以多黏菌素为基础的联合或以替加环素为基础的联合。对于铜绿假单胞菌导致的感染,建议依据抗菌药物敏感性,选择一种抗菌药物以明确治疗。在泛耐药铜绿假单胞菌广泛流行的机构,日常药敏试验建议包含多黏菌素类。不动杆菌属导致的感染,如果仅对多黏菌素类敏感,可以静脉给予多黏菌素B或多黏菌素E;如果是重症肺部感染或同时伴有严重肺部感染,可以同时辅助吸入多黏菌素E。但由于多黏菌素价格昂贵且肾毒性大,因此,权衡利弊使用。近年来,由于碳青霉烯类等广谱抗生素的普遍使用,呼吸道标本培养到嗜麦芽窄食单胞菌的概率显著升高,故首先要判断是定植菌还是耐药菌,一旦判断嗜麦芽窄食单胞菌是真正的责任致病菌,由于其导致的肺部感染或其他部位的感染,抗感染治疗一般首选复方磺胺甲𫫇唑,其他可以选择的药物有替卡西林克拉维酸、头孢哌酮舒巴坦、氟喹诺酮类、替加环素、多黏菌素等。厌氧菌感染一般选择青霉素(脆弱拟杆菌除外)、甲硝唑、克林霉素,严重者可以选择碳青霉烯类。如培养结果为阳性球菌中的MRSA,一般选择万古霉素、利奈唑胺、替考拉宁或替加环素,如果培养结果为VRE,一般选择利奈唑胺或替考拉宁等。具体抗生素的选择根据药敏结果,剂量根据PK/PD原理。
(4)移植受者细菌性肺炎的支持治疗:
移植受者的细菌性肺炎的支持治疗包括呼吸支持、器官功能支持、维持内环境稳态、营养支持、康复支持等。
病毒感染是移植术后主要的感染病原体之一,包括多种常见的呼吸道病毒及机会性感染病毒。前者主要包括流感病毒、呼吸道合胞病毒、冠状病毒、鼻病毒、腺病毒等。后者主要包括巨细胞病毒(cytomegalovirus,CMV)及水痘-带状疱疹病毒。移植受者的病毒感染中,以CMV感染最常见。CMV是一类常见的疱疹病毒,在人类血清中的阳性率为30%~97%。免疫功能正常的人感染CMV后通常表现为短时间的发热或无症状,此后CMV会在多种细胞中呈终身潜伏状态,成为再次活化的储存,携带者成为易感人群。机体免疫状态良好时,CMV感染者大多数呈隐性感染,移植受者处于免疫抑制状态,术后继发CMV感染的概率远远高于正常人。机体免疫状态良好时,CMV感染者大多数呈隐性感染。SOT受者处于免疫抑制状态,术后继发CMV感染的概率远远高于正常人群。CMV肺炎不仅是SOT受者常见的感染性并发症,也是重要的死亡原因之一。CMV容易侵犯移植物,可能与移植物内存在异常的免疫应答反应有关。CMV感染后对人体的危害包括直接效应和间接效应两个方面。直接效应方面,主要仅病毒感染本身对靶器官的损害,如CMV肺炎。间接效应方面,由于CMV具有调控免疫系统的能力,CMV感染可以诱发移植物功能丧失、全身微血管病变及冠脉病变等。
1.CMV肺炎的高危因素
移植术前供体(D)及受体(R)血清CMV-IgG是对SOT受者进行CMV感染危险度分层的主要指标。风险程度依次为:D+/R->D+/R+>D-/R+>D-/R-。因此,D+/R-受体人群,属于极高危人群。另外,免疫抑制的程度对CMV感染也有影响;一般来讲,免疫抑制越强,罹患CMV感染的概率就高,CMV感染的程度也越重。抗淋巴细胞球蛋白类制剂如抗胸腺球蛋白或OKT3的使用,使CMV感染的风险增加3~4倍。与他克莫司相比,mTOR抑制剂(依维莫司、西罗莫司)的替代使用可以降低CMV病的发生率。其他疱疹科病毒或EBV、HHV-6、HHV-7等病毒感染属于协同高危因素。
2.CMV肺炎的诊断标准
SOT受者CMV肺炎的主要诊断标准如下。
(1)符合SOT宿主因素。
(2)具有CMV肺炎的特异性临床表现,如:①发热;②咳嗽;③气促或呼吸困难;④肺功能FEV1≤80%基础值;⑤需要氧气支持或原有基础上对氧气的需求增加。
(3)有典型的胸部影像学改变:胸部X线片以细小网格影及小结节影为主要表现的间质性肺炎的表现,胸部CT表现为毛玻璃阴影、直径<1cm的小结节影,缺乏大的结节影及有支气管充气征的实变阴影。急进型及缓进型CMV肺炎的影像学表现分别见图2和图3。
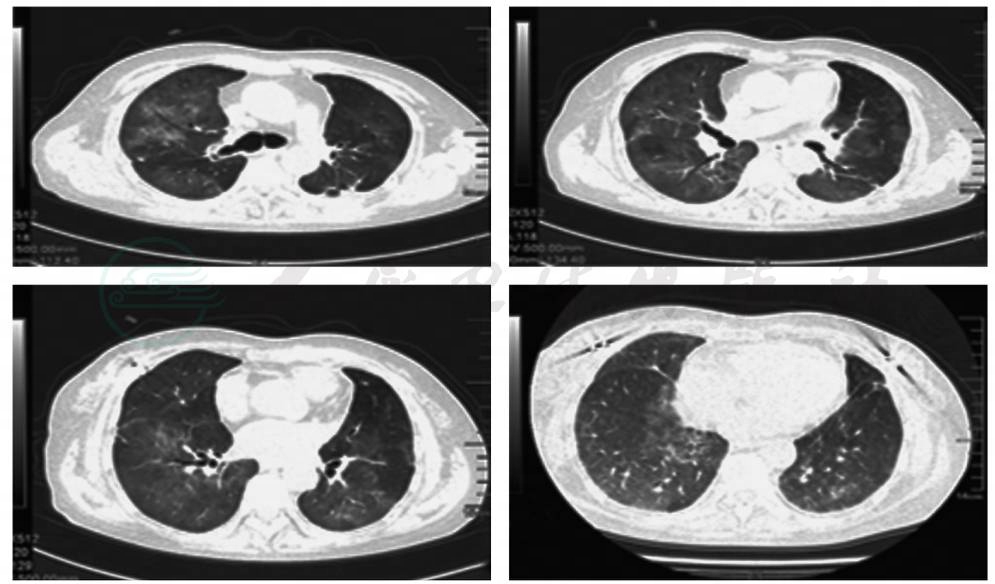
图2 急进型CMV肺炎的影像学表现
急进型CMV肺炎的影像学表现:双肺主要表现为两肺广泛毛玻璃样阴影,伴有双肺多发粟粒样小结节影(来自双肺移植术后患者的胸部影像学,其血液、BALF液和痰液标本中CMV-DNA检测均阳性,肺组织活检证实有CMV包涵体)。
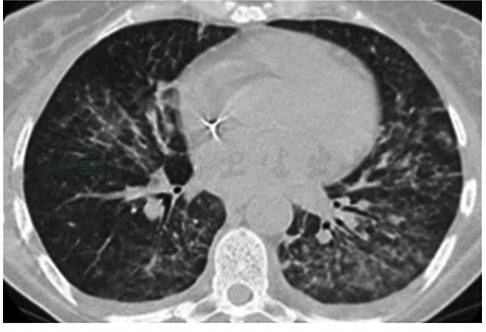
图3 缓进型CMV肺炎影像学表现
双肺主要表现为弥漫性间质性肺炎、间质纤维化。
(4)血清中CMV-PCR阳性,伴支气管肺泡盥洗液(BALF)中CMV-PCR阳性或CMV培养阳性。
(5)具有CMV综合征的临床表现,如白细胞或血小板减少、关节或肌肉疼痛等。
(6)如果同时有肺活检,组织病理发现CMV包涵体,并排除其他原因如急性排斥反应导致的肺炎。
上述诊断标准中,如果满足前5项诊断标准中任何1条及第6条标准,即可诊断;或全部符合前4条诊断标准。
3.移植受者CMV肺炎的预防
如无预防措施,SOT术后3个月之内就可能发生典型的CMV感染;如果接受了CMV感染的预防治疗,感染的发生时间可以被推迟。预防性用药一般选用更昔洛韦静滴或缬更昔洛韦口服,所有用药剂量均根据肾功能进行调整。口服更昔洛韦的生物利用度低,而且对于活跃的CMV复制,口服治疗可能会导致耐药性的出现,故不推荐口服更昔洛韦预防或治疗。阿昔洛韦不能用于CMV感染的预防。对于移植受者,CMV感染的预防方案有两种,即普遍预防和抢先治疗。分述如下:
(1)普遍预防:
针对所有SOT受者,在处于病毒感染风险期给予一段时间的抗病毒药物。在肺移植和心肺联合移植受者中,针对D+/R-这类极高危人群,建议口服预防用药时间为半年以上。然而,随着预防时间的延长,骨髓抑制显著增加,尤其是对于中国人群,所以限制了其长期用药。
(2)抢先治疗:
对体内检测出早期CMV复制但无相关临床症状的患者应用抗病毒药物,以阻止疾病的进展。抢先治疗是预防CMV肺炎的有效预防措施,尤其是针对极高危患者。抗病毒治疗期间,建议每周一次的PCR或pp65抗原分析进行监测CMV病毒载量,直至连续两次转阴。有些中心用的是混合方案,先普遍预防一段较短的时间,如果出现CMV检测阳性,再抢先治疗。
4.移植受者CMV肺炎的治疗
总治疗原则:一旦怀疑或确诊为CMV肺炎时,适当减少免疫抑制剂的剂量。治疗分为诱导治疗及维持治疗。具体疗程应该个体化,主要根据临床表现及CMV病毒负荷量的清除程度。
(1)诱导治疗:更昔洛韦静滴,起始治疗剂量为每次5mg/kg,每12小时一次,持续2~4周;或至少持续至血液中CMV-PCR检测连续2次均为阴性(每周一次)后,才考虑改为口服。
(2)维持治疗:初期以静脉更昔洛韦治疗的受者,治疗2~3周,或一旦临床及病毒学上得以充分控制后,可以改为更昔洛韦剂量减半或缬更昔洛韦口服持续治疗,直到连续2次检测CMV-PCR转为阴性后,再持续治疗2周。
(3)CMV肺炎的治疗应该持续到临床症状消失、实验室检测持续转为阴性。
(4)对于更昔洛韦耐药的CMV肺炎,需要以足量膦甲酸钠单独治疗或与更昔洛韦联合治疗;治疗用药期间密切检测CMV-PCR。对于伴有危及生命的CMV肺炎及或伴有其他形式严重疾病的患者,可以在现有抗病毒治疗方案的基础上加用IVIg或CMV特异性免疫球蛋白。目前国外市场上的使用的包括cytotect或cytogam,国内尚无药品。
在移植受者中,侵袭性真菌病(invasive fugal disease,IFD)已成为死亡的重要原因。近年来,由于新型免疫抑制剂及各种预防策略的应用,移植受者真菌感染的模式已发生显著变化,真菌的耐药性增加了临床治疗难度,严重影响了受者的预后。
1.移植受者IFD的流行病学特点
国内及欧美流行病学研究显示,IFD的发生率依据移植器官的种类和免疫抑制程度、各移植中心的环境及预防性药物的使用情况等因素而不尽相同。就肺移植术后人群来讲,伴有有气道吻合口疾病的患者,其真菌感染的发生率高于无气道吻合口病变的患者。对于肺移植术后,IFD病原以曲霉最多见;而其他实体器官如肝、肾、心脏、胰腺、小肠等SOT受者,IFD病原以念珠菌最多见,其次为曲霉菌、隐球菌、非曲霉菌(除外毛霉)、地方性真菌、毛霉及耶氏肺孢子菌等。但无论是肺移植还是其他实体器官移植,一旦发生肺病真菌感染,最常见的病原体仍然是曲霉。对于HSCT受者,念珠菌的血流感染较多见,而肺部原发的真菌感染病原体仍以曲霉为主。
2.移植受者IFD的诊断
鉴于我国目前没有器官移植相关的IFD大规模循证医学资料,诊断标准参照联合发布的IFD修订定义,并参考我国《血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则(第四次修订版)》和《重症患者侵袭性真菌感染诊断与治疗指南》中所推荐的诊断标准和方法,沿用分层诊断体系,以宿主因素、临床特征和微生物学或组织感染真菌病理学依据3项指标为诊断要素,保留了原有的确诊(proven)、临床诊断(probable)和拟诊(possible),增加了未确定(undefined)的诊断。
(1)确诊:
1)深部组织真菌病:
至少符合一项宿主因素,一项临床标准、一项微生物学标准和一项病理诊断依据。
2)真菌血症:
①血液真菌培养出现念珠菌、酵母菌阳性或获得性霉菌(不包括曲霉菌属和除马尔尼菲篮状菌以外的其他青霉属)阳性;②同时临床症状及体征符合相关致病菌的感染。
(2)临床诊断:
至少符合一项宿主因素,一项临床标准和一项微生物学标准。针对曲霉感染,对于移植受者,BALF的半乳甘露聚糖抗原(GM)检测对侵袭性肺曲霉病的诊断价值高于血液,不推荐血液GM作为常规筛查的工具。针对移植术后高危患者,血清G试验可以作为侵袭性肺曲霉病的支持诊断,但不是特异性检测手段。
(3)拟诊:
至少符合一项宿主因素,一项临床标准,缺乏微生物学标准。
(4)未确定:
至少符合一项宿主因素,临床证据及微生物结果不符合确诊、临床诊断及拟诊IFD标准。
(5)IFD的影像学表现:
怀疑IFD时,推荐做高分辨率胸部CT,其敏感度高于胸部X线片。移植受者曲霉病的主要临床类型为侵袭肺曲霉病及支气管肺曲霉病。其典型表现为片状空腔实变,有时伴有小结节。图4A、B为不同类型的肺曲霉病的典型影像学表现。随着SOT的发展和进步,肺念珠菌病的报道逐渐增多。原发性肺念珠菌病罕见,继发性肺念珠菌病主要来自血行播散。胸部CT检查可提高阳性率,但没有特异性,主要表现为双肺多发结节、斑片状或融合性实变区、磨玻璃样渗出影及光晕征。图5为肾移植术后曲霉感染的影像学表现。图6A、B为肺念珠菌病的影像学表现。隐球菌病的诊断主要依靠病理,其影像学表现缺乏特异性,主要表现为肺部结节影。图6C为肾移植术后患者肺部隐球菌病影像学表现。
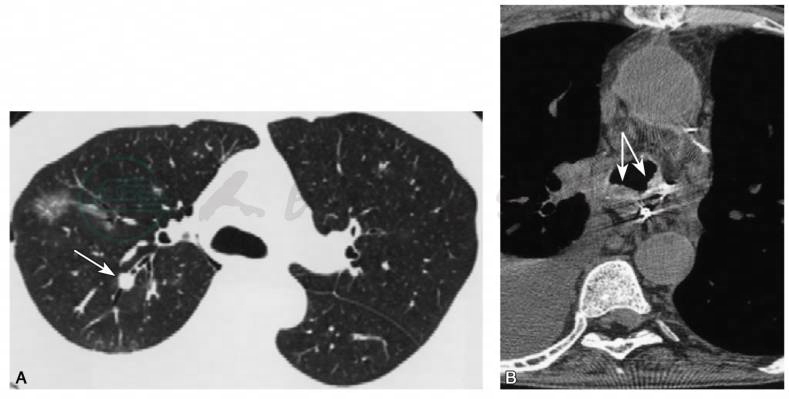
图4 SOT受者肺曲霉病及支气管-肺曲霉病的HRCT的不同表现
A.肺移植术后患者,CT显示片状空腔实变伴有小结节(箭头所示);B.心脏移植术后患者,支气管肺曲霉病,轴向CT显示细支气管周围结节(箭头所示),与支气管肺曲霉病表现一致,通过气管镜诊断为曲霉菌感染。
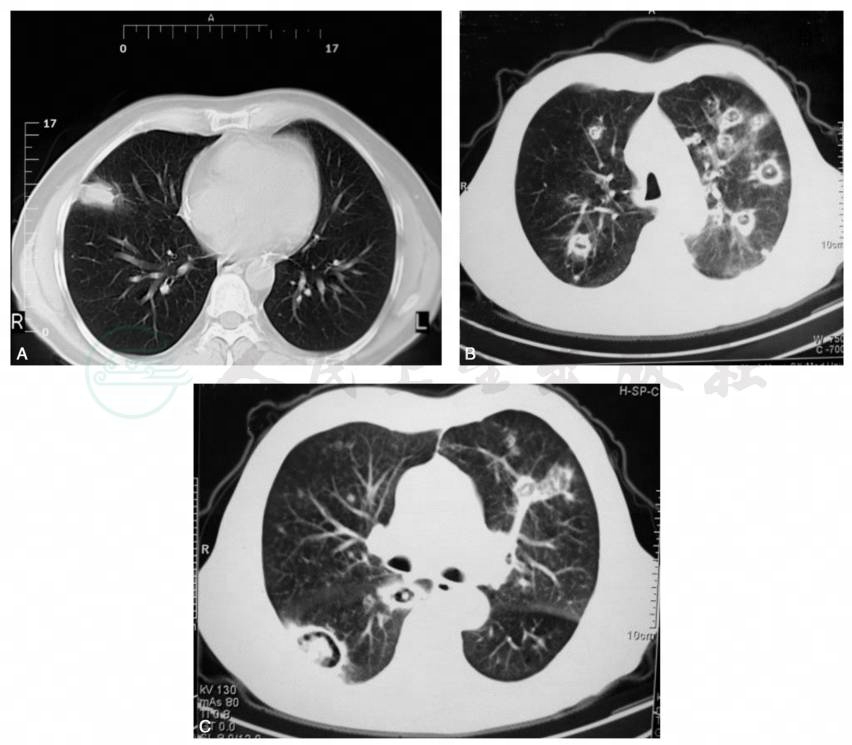
图5 来自肾移植术后曲霉感染的影像学演变过程
A.远端支气管实变和结节;B.小叶中心结节伴有晕轮;C.几天至几周的治疗后演变成空腔。
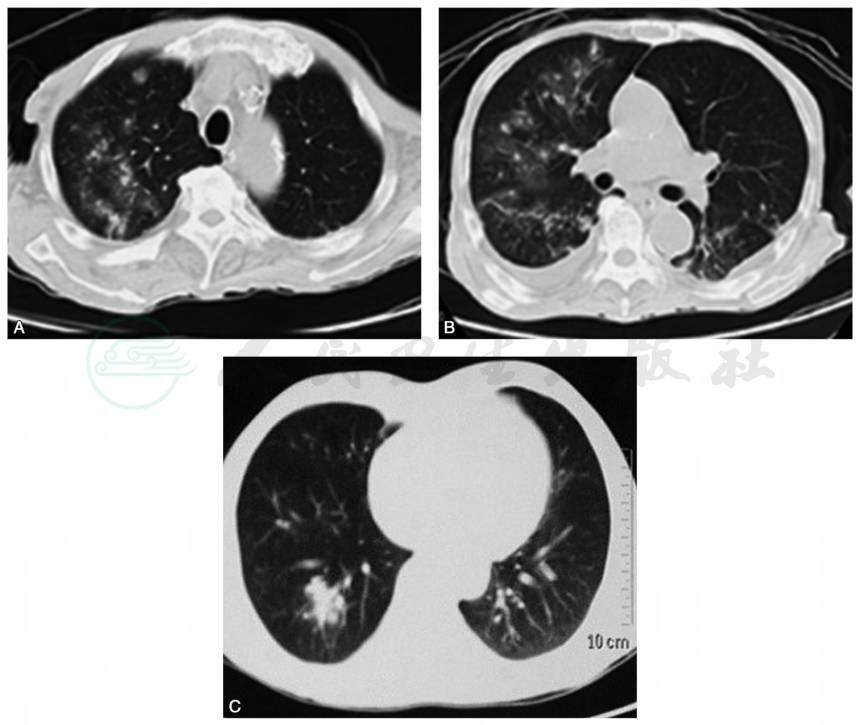
图6 肺念珠菌病和隐球菌病的影像学表现
A、B.肺念珠菌病主要表现为双肺多发结节、斑片状或融合性实变区、磨玻璃样渗出影及光晕征;C.肺隐球菌病在CT表现为肺部结节影。
3.移植受者IFD的预防
鉴于移植受者的免疫功能低下状态,一旦发生IFD,病情进展迅速,不但影响移植物功能,重者甚至威胁受者的生命。由于目前临床上缺少快速、特异的诊断手段,合理的预防措施更为重要,以期达到降低IFD的发病率和病死率。预防策略包括普遍预防及药物靶向预防;前者是针对所有的移植术后患者进行的预防措施,后者是移植受者在某些特定情况时所采取的具有针对性的药物防范措施。肺作为与外界相通的器官,吸入真菌孢子是最常见的感染途径,因此,主要针对吸入途径进行预防。
(1)普遍预防:
对于所有的移植受者,真菌的普遍预防策略主要包括严格控制医院内和医院外的环境因素。
针对院内患者,主要策略包括:①尽量提供单人病房,避免医院内及周围建筑、施工、装修等,避免绿色鲜花及植物等入室,减少真菌孢子接触的机会;②减少不必要的侵入性操作,尽早拔除各种留置导管,缩短静脉通道保留时间等;③在进行强化抗排斥治疗期间(如大剂量糖皮质激素冲击、单克隆或多克隆抗体的应用)的患者,应置于防护环境中以降低霉菌的暴露,并根据个体差异、高危因素,酌情予以药物预防。
对于院外患者:①减少门诊IFD高危患者的霉菌暴露,包括避免修剪花园、禁忌进行播种施肥等园艺活动,避免密切接触装修或施工现场;②肺移植中心应进行IFD感染案例的常规监测。
(2)靶向预防:
SOT受者的靶向预防应该根据不同的器官移植类型和高危因素,选择与免疫抑制剂相互作用小、安全、高效、低毒的药物。肺移植术后真菌感染的概率更高。实体器官移植术后常见的真菌包括曲霉菌、念珠菌、隐球菌、毛霉等。相对于其他实体器官移植,肺移植术后最常见的真菌感染类型是曲霉菌,其次为念珠菌、足放线菌、隐球菌、毛霉等。研究显示,肺移植术后的真菌感染类型中,曲霉感染占首位,而HSCT及其他器官移植术后,念珠菌是常见的真菌感染类型,尤其是长期使用广谱抗生素、中央静脉插管、肾替代疗法的受者。无论是SOT还是HSCT受者,如果是原发于肺的真菌感染,曲霉仍然是首位的病原菌。因此,对于SOT术后,抗真菌药物的预防需要根据不同器官受者的类型进行选择。
对于肺移植和心肺联合移植受者,针对高危人群,建议采用抗真菌药物进行靶向预防;预防的主要目标病原菌为曲霉菌,其次为念珠菌和足放线菌。高危人群主要包括:①肺移植或移植后存在曲霉菌定植者;②在取出供体肺脏后发现真菌感染证据的;③术前或术后存在鼻窦真菌感染的证据者;④单肺移植者;⑤气道并发症患者如早期气道出血、吻合口裂开者;⑥CMV感染,尤其是CMV肺炎者;⑦大剂量糖皮质激素冲击或其他免疫抑制剂的使用;⑧获得性低丙蛋白血症(IgG<400mg/dl)。针对上述高危人群,予以靶向预防。药物选择:建议系统性使用唑类药物预防,泊沙康唑被推荐是肺移植术后预防用药的一线用药,还可以选择其他系统性抗真菌药如伏立康唑、伊曲康唑或氟康唑,也可以同时局部用药,如两性霉素B雾化吸入。预防用药可以持续至移植后3~4个月。对于两性霉素B雾化吸入,两性霉素B脂质体和脱氧胆酸盐单体比较,两种药物均表现出相似的耐受性、肾安全性及血清药物浓度。药物剂量在接受呼吸机治疗的患者中通常不进行调整。
对于存在高危因素的心、肝、肾、小肠、胰腺等肺外SOT受者及HSCT受者,预防性使用的抗真菌药物包括棘白菌素类或伊曲康唑或泊沙康唑、两性霉素B脂质体等。
4.移植受者并发IFD的治疗
移植受者发生IFD时,多数处于免疫功能低下和危重状态,治疗中应根据移植器官特点选择治疗用药。
(1)治疗策略及药物:
IFD的治疗分为拟诊治疗、临床诊断治疗、确诊治疗三级。目前临床应用的抗真菌药物有多烯类、三唑类、棘白菌素类和氟胞嘧啶,各类药物的适应证、常用剂量有所不同。与普通人群相比,移植受者的IFD进展迅速,而受者由于免疫功能受抑制,其临床特征表现滞后,抗体反应迟缓,因此,应重视及时把握恰当的治疗时机。
1)拟诊治疗:
又称经验治疗。当诊断证据不足且高度怀疑IFD时,为避免不必要的致命性并发症,降低病死率,在充分、全面衡量移植受者的整体状况后,可以根据以往的经验给予受者适当的抗真菌治疗。
2)临床诊断治疗:
又称先发治疗,针对临床具有宿主因素、环境因素或临床特点的高危移植受者进行连续监测(影像学和微生物学相关项目),发现阳性结果,立即开始抗真菌治疗,以避免因免疫反应低下而延误治疗时机,同时避免经验治疗带来的用药过度和滥用。
3)确诊治疗:
又称为目标治疗,是针对明确的真菌种类选择抗真菌药物进行特异性抗真菌治疗。
4)补救性治疗:
补救性治疗常用于部分病情较重患者,单药初始治疗失败或疗效较差,严重基础疾病患者,严重、持续粒细胞缺乏患者。换用或联合用药选择,如棘白菌素联用伏立康唑或两性霉素B联合棘白菌素药物。
(2)不同IFD的抗真菌治疗:
1)侵袭性念珠菌病的治疗:
①念球菌血症:非中性粒细胞减少或粒细胞缺乏患者,使用棘白菌素类药物进行初始治疗(卡泊芬净的负荷剂量为70mg/d,米卡芬净的负荷剂量为100mg/d),对于可疑唑类和棘白菌素类药物耐药的念珠菌感染患者,推荐使用两性霉素B脂质制剂[3~5mg/(kg•d)],尤其是肾移植受者,但是要考虑两性霉素B的肾毒性。对于病情不重、没有氟康唑耐药株出现的非中性粒细胞减少患者,可以选择氟康唑静脉注射或口服,首剂800mg[12mg/(kg•d)]作为负荷剂量,然后改为400mg[6mg/(kg•d)]的维持剂量,作为棘白菌素类药物的替代治疗。中性粒细胞减少或粒细胞缺乏患者,移植受者一旦出现念珠菌血症,需要使用棘白菌素类药物或两性霉素B脂质体进行治疗。必须每天至少进行1次血培养,连续3次结果为阴性,才能确认念珠菌血症治愈。单纯性念珠菌血症,确认治愈后再治疗14天,对于病情复杂的患者,则需更长时间。②肺移植出现吻合口气管支气管念珠菌感染的患者,推荐使用雾化两性霉素B脂质体,每天2~3次,每次5mg氧气雾化吸入,使用支气管镜清除杂物;联合使用棘白菌素类治疗。③念珠菌心内膜炎患者,无论是原发还是人工瓣膜,均推荐1周内(甚至更早)进行手术治疗。④眼部念珠菌感染,尚没有菌株药物敏感试验结果时,推荐应用两性霉素B脂质体单药或联合5-氟胞嘧啶治疗,不推荐棘白菌素类;如敏感患者推荐使用氟康唑或伏立康唑;若感染累及玻璃体,则应在全身系统治疗的基础上行玻璃体切割术或玻璃体内注射两性霉素B。
2)侵袭性曲霉病的治疗:
①对于SOT受者,在高度可疑侵袭性曲霉病时,应早期进行抗真菌治疗。②伏立康唑[负荷剂量为6mg/(kg•d);或200mg/12h,维持剂量为4mg/12h]或两性霉素B脂质体[3mg/(kg•d)]作为初始治疗。但SOT受者需要长期使用的钙调磷酸酶抑制剂(CNI)类药物,与唑类抗真菌药物之间具有相互作用,CNI类药与唑类药品会互相提高对方的血药浓度及药物曲线下面积。因此,使用唑类药物时,必须根据药物浓度对二者的剂量进行相应调整。初始使用唑类药品时,将CNI类药物的剂量在原有基础上减少1/3,之后根据伏立康唑的血清药物浓度及CNI类浓度进行剂量调整,伏立康唑血浆浓度应保持在1~4mg/L。③对于病情危重的患者,推荐伏立康唑注射给药,以保证生物利用度,对于肾功能受损或病情稳定的患者,可口服给药,并监测血浆浓度。用药过程中注意肝毒性的监测,尤其是肝移植者,并注意其与免疫抑制剂的相互作用。④如患者无法用伏立康唑(如肝毒性、严重的药物相互作用、无法耐受及对三唑类过敏等),则使用两性霉素B。⑤如果病情严重(肺炎或播散性疾病),在保证伏立康唑有效浓度的基础上,可选用伏立康唑加卡泊芬净联合治疗。单药初始治疗失败的患者,采用抗真菌药物联合治疗。
3)侵袭性肺隐球菌病的治疗:
①扩散性肺浸润、急性呼吸衰竭或伴有脑膜炎、播散性疾病,诱导治疗采用两性霉素B脂质体3~4mg/(kg•d)。巩固治疗采用氟康唑400~800mg/d,连用8周。维持治疗采用氟康唑200mg/d,疗程为6~12个月。②局灶性肺部感染或无症状患者偶然发现的肺隐球菌病:采用氟康唑400mg/d[6~8mg/(kg•d)]治疗,疗程为6~12个月。
无论是HSCT还是SOT受者,由于长期免疫抑制剂的使用,SOT术后的受者作为免疫受限人群,细菌、真菌、病毒等各种病原体感染的风险均显著增加。但是,术后时间、器官移植类型不同,患者的感染的特点及严重程度也有所不同。因此,对于此类患者肺部感染的诊治,要根据患者的术后时间、器官移植类型,结合患者的年龄、基础疾病、合并症、免疫状态、当地的流行病学等情况综合考虑,尽量予以精准化诊治,提高治愈率。













