英文名称 :hepatic sinusoidal obstruction syndrome
中文别名 :肝小静脉闭塞病
本病1920年在南非首次被报道,因为当时肝脏病理多有小叶中央静脉闭塞,1954年被正式命名为肝小静脉闭塞病(veno occlusive disease of the liver,VOD)。近年来发现其病理基础是肝窦内皮损伤而非小叶中央静脉受损,遂更名为肝窦阻塞综合征(hepatic sinusoidal obstruction syndrome,HSOS)。本病多与恶性血液系统疾病患者接受大剂量化疗药物或造血干细胞移植以及服用含有野百合碱的草药相关。临床表现多以黄疸、触痛性肝脏肿大、腹水、水钠潴留为主要表现。既往临床医师缺乏对本病认识,极易被误诊、漏诊。伴随造血干细胞的广泛开展以及对本病认识的深入,近年来该病例报告逐渐增多,引起临床上对本病关注日益增加。
(一)病因
1.造血干细胞移植、化疗药物及放疗
目前HSOS已经被看作是造血干细胞移植以及其间应用大剂量化疗(尤其是环磷酰胺、白消安+环磷酰胺;卡莫司汀+环磷酰胺+依托泊苷即VP16,长春新碱)和放疗(全身以或肝脏局部)所致的多脏器损伤中的肝脏表现,这一损伤过程中是通过多种细胞因子来介导的。本病是造血干细胞移植的常见并发症,报道中本病发病率最高达70%,是导致移植相关死亡的主要原因之一。
2.野百合碱/吡咯双烷生物碱中毒
据文献报道,世界上约有3%的有花植物,即6000余种植物中含有野百合碱/吡咯双烷生物碱,但主要集中于以下4个科:菊科的千里光属、橐吾属、泽兰属、菊三七属和蜂斗菜属;紫草科的所有属;豆科的猪屎豆属和野百合属;兰科的羊耳蒜属。据初步统计,我国的中草药中有38种属于这类植物,其中临床常用的有野百合、千里光、猪屎豆、西门肺草、琉璃草、毛束草、款冬叶、聚合草及土三七(菊叶三七)等。在不发达国家中野百合碱是导致HSOS的重要致病因素。在我国服用土三七引起的HSOS最为常见,土三七为菊科菊三七属植物菊叶三七的根及全株,中医认为该药有散瘀止血、解毒消肿的作用,常用于跌打损伤、蛇咬伤及外伤出血等。樊艳华等统计国内自1980年至2009年共有102例相关报道。
3.免疫抑制剂
硫唑嘌呤、6-巯基嘌呤、环磷酰胺等免疫抑制剂也被证实与本病有关。在自身免疫病以及肝肾移植患者使用硫唑嘌呤、6-巯基嘌呤导致HSOS有较多相关报道。
(二)危险因素
1.造血干细胞移植前危险因素
包括女性,高龄,一般情况差,存在病毒性肝炎、肝硬化、肝功能损害等基础病,转氨酶升高,白蛋白降低以及胆碱酯酶活性下降等肝脏基础病变,合并其他肿瘤(尤其是肾母细胞瘤),肝脏多发转移瘤,腹部接受放疗,移植前发热,移植前使用广谱抗生素,曾经使用过万古霉素,阿昔洛韦等药物以及第二次进行造血干细胞移植的患者。
2.造血干细胞移植后危险因素
使用避孕药、细胞毒药物(白消安以及烷化剂作用最显著)、预防和治疗移植物抗宿主病(graft-versus-host disease,GVHD)用药(甲泼尼龙及甲氨蝶呤会增加HSOS的风险)、单抗奥唑米星治疗、全身放疗。此外,同种异体干细胞移植发生HSOS的风险明显高于自体骨髓移植患者。
3.与移植无直接关联的危险因素
包括腹部放疗联合使用化疗药物,病毒性肝炎患者使用氟烷作为麻醉剂,在淋巴母细胞性白血病使用硫鸟嘌呤治疗。
在20世纪50年代初,最早报道是在牙买加的土著人在服用“千里光”后发生本病,实际上类似病例在南非已经有报道,以后印度、埃及、以色列、美国亚利桑那州等相继有因误服含有吡咯烷类生物碱的植物导致本病的报道。在不同地域HSOS发病率不同,在牙买加、非洲部分地区、中东和印度发病率高,在牙买加慢性肝病中本病比例可高达30%。
不同病因导致的HSOS病理表现相似,肝窦淤血扩张,病变多见于小叶中心区域(Ⅲ区),并可连接成为充血带。肝窦周围可见大量红细胞以及渗出物沉积并可导致肝窦壁破裂。小叶中央静脉内皮细胞变圆,可出现内膜出血。可以出现小叶中央静脉闭塞和纤维化,其程度与病情相关,肝细胞变性不明显(见图1)。
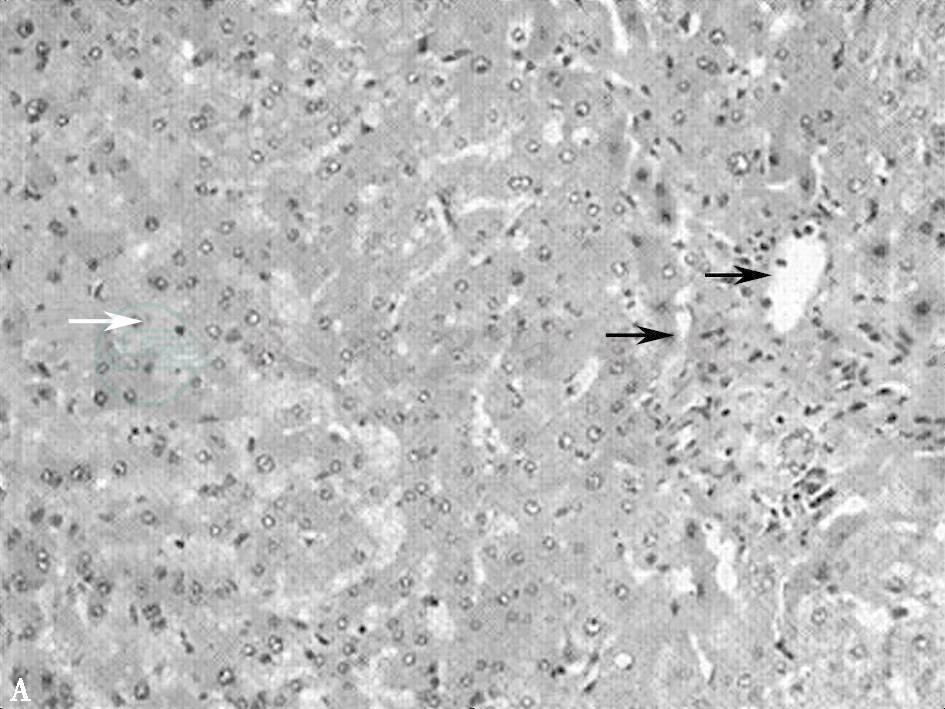
图1A 肝窦阻塞综合征病理图
肝窦阻塞综合征病理图(×100)
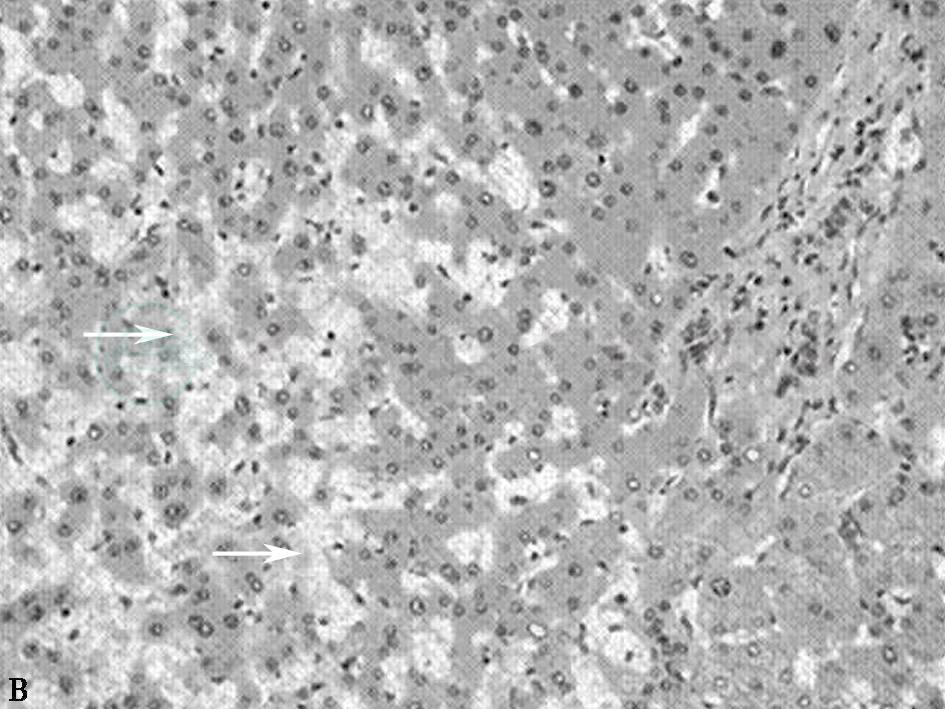
图1B 肝窦阻塞综合征病理图
肝窦阻塞综合征病理图(×400)。白色箭头所示为肝血窦扩张、淤血;黑色箭头所示为汇管区
本病发病机制目前尚未完全明确,中心环节是肝窦内皮受损致使红细胞和基质沉积于窦内皮下随之激活凝血系统最终导致肝细胞坏死。肝窦是肝脏细胞和血液之间进行物质交流的重要界面。为肝脏实质细胞提供营养和氧气,清除血液内的有害物质。内皮细胞可以在血管活性物质的调控下调节肝血窦内血流。由于其直接暴露在门静脉血流中的毒素和药物之下,肝窦内皮细胞易受毒物和药物损伤。
在大鼠动物模型中研究者发现野百合碱与肝窦内皮细胞基质内肌动蛋白丝结合使其解聚,后者在细胞基质中起骨架作用,失去骨架的内皮细胞发生卷曲、肿胀,内皮上的窗孔消失。内皮细胞的损害使红细胞穿过窦周间隙使内皮细胞与窦周间隙分离。窦周间隙基质的分解加重了这种损害。伴随着小叶微血管的损害出现了肝实质细胞的受损、胶原沉积以及继发的纤维化导致小叶中央静脉闭塞。对内皮细胞的损伤引起免疫因子的释放(TNF-α、IL-1)形成恶性循环,加重肝脏损伤,同时促进了凝血系统的激活。
人类HSOS的发病机制目前尚不完全明确。在接受化疗药物或者使用含有吡咯双烷生物碱的药物治疗后,肝窦内皮受损,随后受损细胞合成细胞因子(TNF-α,IL-1等),引发级联反应并激活凝血系统,最终导致肝脏细胞坏死,在这个过程中贯穿始终的病理改变是肝窦内皮受损以及随之出现的肝窦内皮下大量基质和红细胞沉积,引起肝窦腔狭窄并导致肝脏淤血。炎症因子的激活以及肝窦上皮细胞内还原型谷胱甘肽的耗竭是疾病进展的重要环节之一。在人类和大鼠模型中均会出现凝血功能异常,但其在发病机制中的作用和地位目前尚不明确。
影像学检查对于本病诊断帮助很大。但多普勒彩超在肝小静脉闭塞病中的诊断价值有限,一般表现为肝脏肿大,以右肝为主,肝内回声分布不均匀,腹腔积液。门静脉血流速度减低,肝静脉变细、血流缓慢,但下腔静脉血流正常,无阻塞。但超声难以将本病与其他肝病有效鉴别,可用于本病的治疗过程监控。增强腹部CT可见本病特征性表现:由于肝小静脉回流受阻,肝窦、门静脉系压力相继增高,造成肝内门静脉血流的灌注不足,肝脏强化峰值降低和延迟,以及肝小叶淤血、坏死和水肿区的无或低灌注,肝脏组织形成明显的密度对比,CT平扫可见肝大,密度减低。增强期可见肝动脉呈代偿改变,血管增粗扭曲,肝脏可以有轻度不均匀强化(图2)。门静脉期可见“地图状”改变、肝静脉显示不清、下腔静脉肝段明显变扁,下腔静脉、门静脉周围“晕征”或“轨道征”。延迟期:肝内仍有斑片影及地图样低密度区存在(图3)。多普勒超声检查可见门静脉血流减少或者出现逆流的现象,肝静脉血流减少,胆囊壁水肿等征象高度提示本病。
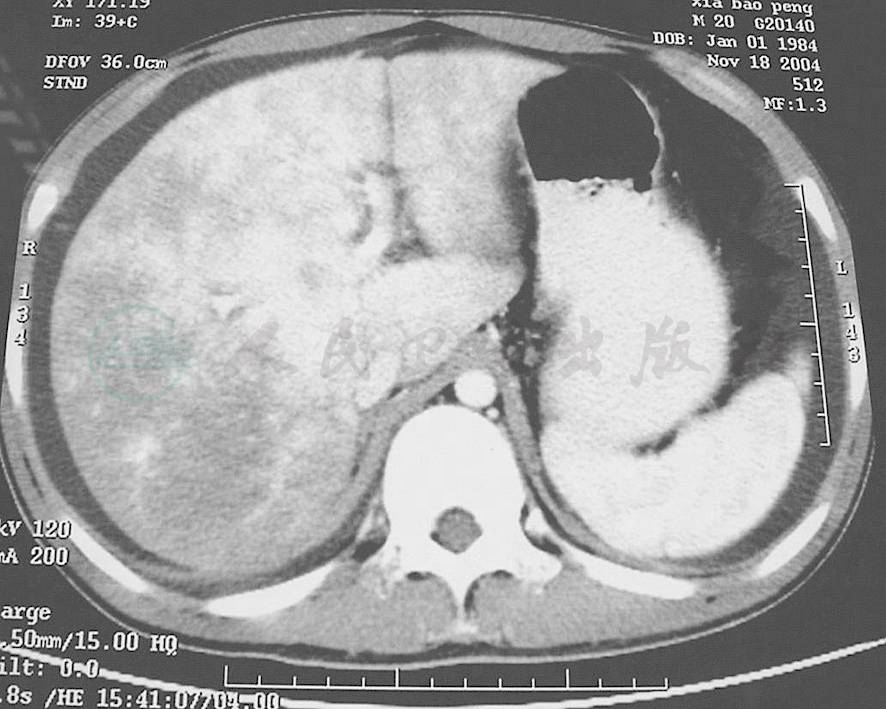
图2 肝窦阻塞综合征CT增强造影-静脉期
肝脏周围少量腹水,肝脏密度不均匀,可见斑片状强化,肝静脉不显影,下腔静脉受压变细
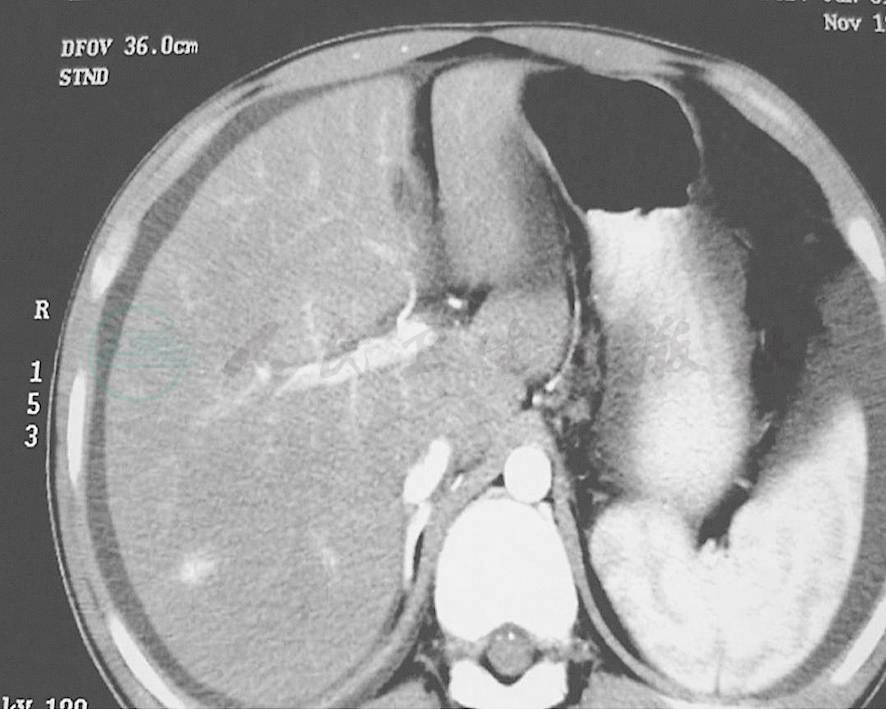
图3 肝窦阻塞综合征CT增强造影-延迟期
肝脏周围少量腹水,肝脏密度不均匀,呈斑片状,“地图”状改变,肝静脉未显影
经颈静脉插管测定肝静脉嵌塞压和肝静脉压力梯度对于本病诊断意义重大。肝静脉压力梯度> 10mmHg的标准用于诊断本病的特异度可以达到91%,作为排除诊断准确率可以达到86%,但其敏感性只有52%。
如临床诊断本病存在困难,建议行肝脏穿刺明确诊断(病理特点详见病理学部分),但常规超声引导下经皮行肝活组织检查出血风险大,建议经颈静脉或者股静脉进行肝组织活检。肝脏病理活检发现典型病理改变是确诊本病的金标准。
(一)支持对症治疗
避免使用损害肝肾的药物,严密监测肝肾肺功能;营养支持治疗;限制水钠摄入并可以使用利尿剂来减少水钠潴留,维持液体平衡在对症支持治疗中占重要位置,对于大量腹水影响呼吸的患者可以放腹水缓解症状;血小板减少患者可酌情输注血小板;必要时可以使用呼吸支持治疗和血液透析治疗。
(二)去纤苷
去纤苷(defibrotide,DF)是一种最早从牛肺提取出的单链多聚脱氧核糖核苷的钠盐,是腺苷受体的激动剂,具有抗血栓、抗炎症和抗缺血的特性。DF作用机制尚不完全明确,目前认为是通过提高内皮表面前列腺素E2、前列腺素I2、血栓调节蛋白以及内生tPA的水平,同时降低组织纤维蛋白溶酶原激活剂抑制物的活性,改变血小板活性,刺激纤维蛋白的溶解作用。口服及胃肠外途径均有应用,最高剂量800mg/d。DF已经在多个治疗和预防HSOS临床试验中证实有效,虽然本药具有降低凝血酶原活动度、促进纤溶以及抗血小板的作用,但在使用过程中未发现增加出血风险以及其他明显毒副作用。在2002年一个多中心研究中,88例干细胞抑制术后出现严重HSOS合并多脏器功能衰竭的患者中使用DF[通过静脉输注,剂量5~60mg/(kg·d),平均使用15天],最终36%的患者获得完全缓解,35%患者生存时间超过100天(既往统计严重HSOS的100天死亡率大于90%)。2009年Richardson等对102例HSOS患者进行了静脉应用去纤苷6.25mg/kg,每日4次,24%的患者获得完全缓解,而对照组为9%(P=0.013)。目前推荐成人和儿童HSOS患者治疗用量为25mg/(kg·d)。但本药目前尚未上市,关于本药的最佳使用剂量以及用药风险尚未完全明了,需在将来大规模临床应用中积累经验。
(三)糖皮质激素的应用
在临床中人们也尝试使用糖皮质激素来治疗本病,但目前尚无随机对照研究。2008年Al Beihany等对48例HSOS患者进行了回顾性研究,患者均符合西雅图标准,接受0.5mg/kg甲泼尼龙静脉治疗,这些患者接受治疗10天内,胆红素下降均超过50%,58%(28/48)的患者移植后存活超过100天。2013年Myers等对9例严重HSOS患儿(8例合并继发于HSOS的多脏器功能衰竭)使用甲泼尼龙500mg/m2静脉治疗,6例患者在接受激素治疗10天内胆红素下降50%,四例患者同时使用去纤苷,最终整体存活率78%。在重症患者的治疗中使用糖皮质激素的同时务必要警惕感染的风险。
(四)抗凝治疗
人重组组织型纤溶酶原激活物(recombinant human tissue plasminogen activator,rt-PA)是通过DNA重组技术生产的含有人类组织型纤维蛋白溶酶原激活剂氨基酸序列的肽段。本药是一种类似于链激酶溶栓药物,但超敏反应发生率明显低于链激酶。半衰期较短,约为40分钟。本药将与纤维蛋白结合的纤溶酶原转化成有活性的纤溶酶,导致纤维蛋白和血块溶解。在临床上主要通过静脉输注来治疗血栓性疾病。使用剂量一般为100mg,65kg以下使用不应超过1.5mg/kg,全部剂量给药时间应不少于1.5小时或3小时(取决于不同的给药方案)。
有报道rt-PA对于确诊的HSOS有效。具体用量为t-PA 0.2mg/(m2·d),静脉输注持续4小时以上。但其安全性和最佳剂量还有待进一步研究。t-PA和低分子肝素联合使用在大宗病例报道中已经被证实有效,但大大提高了致死性出血的风险,在出现多脏器功能衰竭的患者中尤其明显。因在使用过程中使致死性大出血可能性明显增加,目前不推荐临床应用。抗凝血酶Ⅲ和蛋白C在临床实验中未能证明有效。
(五)经颈静脉肝内门体分流术
经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt,TIPS)以及手术分流虽然有助于腹水的治疗,但不能改善HSOS的预后,故不建议采用。
(六)肝移植
在个案报道中肝移植可以成功地治疗HSOS,对于预后良好的疾病而进行造血干细胞移植的HSOS的患者可以行肝移植治疗。













