英文名称 :Barrett esophagus
中文别名 :巴雷特食管
Barrett食管(Barrett’s esophagus,BE,巴雷特食管)由英国心胸外科医师Norman Barrett于1950年首次报道。我国最新的Barrett食管共识意见将其定义为胃食管反流病(GERD)的并发症,内镜下可见食管鳞状上皮与胃柱状上皮的交界线(齿状线,又称Z线)相对于胃食管结合部上移≥1cm,病理证实食管下段的正常复层鳞状上皮被化生的柱状上皮所取代,其化生可为胃底上皮样化生、贲门上皮样化生以及特殊肠型化生,其中伴有肠上皮化生的BE发生癌变的风险较大。巴雷特食管腺癌的癌前病变是指可以发展为癌的一种病理变化,主要指BE黏膜从无异型增生到低级别异型增生,到高级别异型增生,最后到食管腺癌。
BE的常见病因及危险因素主要有:遗传、年龄> 50岁、男性、白种人、肥胖、吸烟、GERD以及蔬菜和水果摄入较少等。近期的一项研究旨在根据人口统计学和生活方式数据,并结合个人的遗传特征预测BE和食管腺癌的风险。研究者共收集了3 288例BE病例、2 511例食管腺癌患者和2 177例对照,分析评估受试者的GERD症状、年龄、性别、吸烟习惯以及肥胖。与以往研究结果相似,上述因素为BE的危险因素。
1.遗传因素
BE的发病存在一定的遗传易感性。流行病学研究提示,GERD和BE具有家族聚集性。一项队列研究显示,与对照组相比,BE患者的一级或二级亲属更易发生BE(24% vs. 5%,P < 0.005)。在校正年龄、性别和体重指数后,家族史的存在与BE 密切相关(OR = 12,95%CI:3.3~44.8)。有研究在家族性BE患者的2号、12号和19号染色体上发现了共同的遗传区域,但没有筛选出特异的候选基因,也没有确定单个致病基因。Fecteau等发现了非特异性基因FBE-1的变体,可作为家族性BE的潜在遗传易感因素。此外,研究还发现了与BE发病相关的多种潜在致病基因,如Cyclin D1、谷胱甘肽S-转移酶等。也有报道,VSIG10L与家族性BE易感性有关。全基因组关联分析发现Hedgehog通路在BE发病机制中起重要作用。
2.年龄和种族
BE多见于中年人。美国的一项研究发现年龄64岁以上人群胃镜筛查BE检出率为16.7%,382例荷兰人群研究发现BE的平均年龄为53岁。英国一项20~59岁男性群体研究发现,年龄每增加1岁,BE检出率增加7.4%。不同种族BE的发病率有较大的差异。BE和食管腺癌均在高加索男性中高发,男性非洲裔美国人中发病率较低。BE在亚洲人群中如日本和新加坡并不多见。
3.性别
男性比女性多见,可能是受性类固醇激素的影响。性类固醇激素参与炎症过程,其受体蛋白在食管组织中有表达支持上述观点。一项研究分析了美国男性BE患者的性类固醇激素水平,发现BE的发生与体内游离睾酮及游离二氢睾酮(DHT)浓度呈强正相关。因此推测,雄激素可能促进了BE的发展,而雌激素对BE具有保护作用。
4.肥胖
肥胖增加患BE的风险。Corley等采用病例对照研究发现,腰围是BE形成的独立危险因素,支持腹部肥胖增加胃食管反流,增加发生BE的风险。
5.吸烟与饮酒
Cook等的研究发现,吸烟与BE的发生有关。未有证据表明饮酒与BE的发生有关。
目前没有确切的人群BE患病率。瑞典的一项研究通过对1 000名普通成人进行内镜检查,共发现103名患者有柱状上皮,其中16名确诊为BE(1.6%)。一项美国733例连续病例尸检研究中,BE的发现率为0.95%。
近年来,GERD发病率呈上升趋势,BE是GERD的并发症,其发病率随着GERD发病率的升高而升高。BE最多见于白种人,黑种人和亚洲人相对少见。欧美等西方国家发病率高于亚洲地区。2002年一项依据荷兰初级保健数据库进行的纳入了50万例患者的大型研究中,上消化道内镜检查时首次被诊断为BE的比例为40.5/1 000。在西方国家,内镜下BE的检出率为1.6%~10.3%,而在亚太地区,其检出率为0.17%~3.70%。多项针对欧洲人群的研究显示,BE的发病率为1%~2%。我国一项纳入1 030名受试者的胃肠道疾病的研究,BE的检出率为1.8%。
BE是指食管下段的正常复层鳞状上皮被化生的柱状上皮所取代,但为何鳞状上皮会转变成柱状上皮,以及如何转变的,具体机制尚未完全阐明。有人提出可能与下面机制有关,包括鳞状干细胞从食管黏膜下腺体增殖,或从食管旁的胃细胞延伸而来。一项用p63基因敲除小鼠进行的研究发现,化生的前体细胞存在于鳞柱上皮交界处。食管远端损伤中,这些连接细胞在没有突变的情况下迅速扩展并替代鳞状黏膜。BE动物模型中,IL-1β过度表达,SCJ逐渐出现炎症,化生甚至异型增生。还有研究提示,脂肪细胞释放的细胞因子IL-6和IL-8在肠化过程中起着重要作用。
BE中所特有的肠化生到底起源于何种细胞备受关注。如前所述,食管、近端胃或骨髓细胞被认为是BE潜在的细胞来源。然而,食管、胃或骨髓通常并不存在肠道细胞。因此,BE的化生似乎是一种细胞重编程的过程,转录因子在此过程中发挥关键作用。目前有研究显示,许多信号通路和转录因子在BE发生过程中发挥重要作用,如Hedgehog、NF-κB 和 Akt信号通路,以及 SOX9、FOXA2、CDX2和SOX2等转录因子。
此外,近年来越来越多的证据表明,氧化应激诱导的DNA损伤在BE的发病过程中诱导食管上皮细胞凋亡。有学者发现在食管上皮细胞中内源性PARP1呈现高表达,其高表达影响氧化性DNA损伤修复,从而在BE形成过程中诱导食管上皮细胞死亡。还有研究发现,基因缺失、变异及染色体异常在BE的发生、发展中发挥重要作用。
BE的发生还与胃食管解剖结构异常、食管胃动力异常、酸反流等关系密切。BE节段的长度与酸暴露的程度相关,与pH < 4的时间百分比、酸反流的次数、卧位时食管近端酸暴露程度呈正相关。还有研究提示,胆红素反流测定值越高时BE的发病率越高。
病理检查可以确立BE诊断、评估异型增生和癌变风险(图1)。不同国家对BE的定义不同,病理诊断标准也不同,主要区别在于是否需要病理确认存在肠上皮化生。我国最新的专家共识意见把BE定义为食管下段的正常复层鳞状上皮被化生的柱状上皮所取代,长度≥1cm,可伴或不伴有肠化生。其中伴有肠化生者属于食管腺癌的癌前病变。化生是指一种发育成熟的组织转变为另一种形态结构组织的过程,化生并非由已分化的细胞直接转变为另一种细胞,而是由该处具有多向分化功能的未分化细胞分化而成,并且只能转化为性质相似的而不能转化为性质不同的细胞。
BE在组织病理学上可分为无异型增生BE、不确定异型增生BE、低级别异型增生BE、高级别异型增生BE、黏膜内癌。化生上皮的组织学类型包括胃底型、贲门型和肠化型。胃底型与胃底上皮相似,可见主细胞和壁细胞;贲门型与贲门腺相似,有胃小凹和黏液腺,无主细胞和壁细胞;肠化型为化生肠型黏膜,表面有微绒毛和隐窝,杯状细胞是特征性细胞。从组织学类型上,Barrett食管异型增生可以分为腺瘤样异型增生和小凹型异型增生两种主要类型。
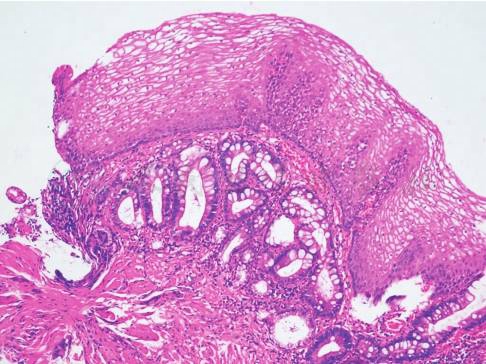
图1 Barrett食管病理
HE染色:表面被覆鳞状上皮,黏膜下层内见胃黏膜腺体,大部分腺体肠上皮化生
引自:消化病学.第1版.ISBN:978-7-117-28772-2.主编:.图2-2-2
Barrett食管通过肠化生-异型增生-肿瘤的演变过程导致食管腺癌,也是目前已知食管癌的主要发生途径之一。关于Barrett食管柱状上皮的来源目前有几种看法:①来源于鳞状上皮的基底细胞;②来源于食管贲门腺体细胞;③来源于胃黏膜或原始干细胞。关于Barrett食管肠化生细胞的来源尚不明确,目前存在两种观点:一种认为肠上皮化生细胞是由一种分化成熟的细胞转化为另一种细胞;另一种观点认为肠化生细胞是由食管或从骨髓募集于食管的干细胞分化而来。
(一)一般内镜检查
一般内镜检查具有直观、准确、可靠的优点,还可进行活组织检查结合病理组织学检查。正常食管黏膜呈均匀的粉红偏灰白色,而BE黏膜则是远端食管中出现类似胃黏膜的橘红色柱状上皮,一般情况下黏膜光滑,与食管正常黏膜分界清楚,病变严重者可有黏膜充血水肿糜烂,甚至溃疡(图2)。
(二)其他内镜技术

图2 Barrett食管内镜下表现
A.距门齿35cm食管四壁见舌状红斑,周围黏膜正常;布拉格分级C0M4;B.Barrett食管伴发反流性食管炎B级
引自:消化病学.第1版.ISBN:978-7-117-28772-2.主编:.图2-2-3
色素内镜可以显示普通内镜检查时不易发现的病灶,还可进行靶向活检。推荐对于可疑BE和食管腺癌宜采用靛胭脂或冰醋酸(浓度为1.5%~2.0%)喷洒染色,使病变显露,从而进行靶向活检,提高诊断率。对比染色剂,喷洒后可使黏膜表面结构更加清晰,靶向活检可增加巴雷特食管高级别上皮内瘤变以及早期癌的检出率。根据染色后的不同形态表现,可将黏膜表面形态分为脊状/绒毛型、环形、不规则形/扭曲型。窄带成像技术结合放大内镜观察BE上皮,有助于提高肠化生和异型增生的检出率,提高对BE的诊断准确率。超声内镜检查对于BE癌变,尤其是早癌患者有利于评估肿瘤浸润的深度及周围淋巴结转移的情况。内镜智能分光比色技术(FICE)、高清智能电子染色内镜等电子染色内镜可以清晰显示贲门柱状上皮结构以及小肠化生上皮的绒毛结构。
(三)影像学检查
CT、PET-CT可用来判断BE腺癌的N分期,但其敏感性及特异性不高。美国综合癌症网络(National Comprehensive Cancer Network,NCCN)食管癌指南建议,在诊断食管癌过程中做EUS检查前行CT和/或PET-CT,以此来判定对肿大的淋巴结是否需要行超声引导下的细针穿刺(EUS-FNA)活检。
BE的治疗原则是控制胃食管反流、消除症状,以及预防或治愈高级别异型增生(高级别上皮内瘤变)、早期食管腺癌。治疗方法主要从改变生活方式、药物控制胃食管反流症状、抗炎治疗与内镜下治疗,必要时行抗反流手术、食管切除术等外科治疗。
(一)一般治疗
改变生活方式多被认为对BE是有益的,如抬高床头、睡前3小时不进食、减轻体重、戒烟酒等。我国最新的BE共识指出:咖啡、浓茶等可使食管下括约肌松弛,增加患者的反流症状,所以生活中应尽量避免此类饮食。
(二)药物治疗
1.抑酸治疗
表1 不同学术组织对BE的诊断标准

注:AGA:American Gastroenterological Association;BSG:British Society of Gastroenterology,ACG:American College of Gastroenterology;ESGE:the European Society for Gastrointestinal Endoscopy
引自:消化病学.第1版.ISBN:978-7-117-28772-2.主编:.表2-2-2
抑酸药物是BE最主要的治疗药物,但只能缓解症状不能阻止反流。目前尚无证据显示哪一类药物可以使化生的柱状上皮逆转或者有确切的证据证明可以预防其癌变,因此不推荐预防性使用质子泵抑制剂(PPI)来预防食管异型增生和食管腺癌。除了PPI外,抑酸药物还包括H2受体拮抗剂,可通过阻断壁细胞上的H2受体,抑制基础胃酸和夜间胃酸的分泌,从而减少酸暴露;但持续作用比较短暂,且在使用2周后可出现受体耐受现象,抑酸作用降低。
2.其他药物
可以辅以黏膜保护剂、促动力药、抗酸药物等。黏膜保护剂主要是可减少反流物对消化道黏膜的刺激,减轻症状并保护黏膜的目的。促动力药可促进胃排空,防止胃及十二指肠内容物反流至食管,从而减轻食管炎症。抗酸药物为弱碱性物质,口服后在胃内直接中和胃酸,使胃蛋白酶活性降低,减轻胃液对黏膜的侵袭作用。
3.药物预防
流行病学研究表明,阿司匹林、非甾体抗炎药、他汀类药物与降低食管腺癌风险有关,但目前尚无高质量的随机对照试验证实上述药物的作用,且服用这些药物存在一定的相关风险。一些间接证据提示,阿司匹林可作为BE的化学预防剂。流行病学研究发现,服用阿司匹林的患者食管癌发病率较低。此外,阿司匹林和非甾体抗炎药可能对多条肿瘤发病机制中的信号通路具有抑制作用。然而阿司匹林的不良反应较大,可出现脑出血和消化道出血,甚至危及生命。因此,目前不推荐使用这些药物预防Barrett食管癌变。
(三)内镜治疗
现阶段内镜下治疗是逆转BE的主要措施,也是大多数指南推荐的方法。目前我国最新的BE诊治共识指出,内镜治疗的适应证包括异型增生(上皮内瘤变)的BE、早期巴雷特食管腺癌。治疗方法包括内镜下根治切除、内镜下毁损。
1.内镜下根治切除治疗
内镜下根治切除治疗包括内镜下高频电圈套切除术、内镜下黏膜切除术(EMR)和内镜黏膜下剥离术(ESD)。胃食管结合部的0~Ⅰp型腺瘤性病变和息肉等可应用高频电圈套器切除术。
(1)EMR:
EMR对治疗伴有异型增生的BE及其早期腺癌是安全、有效的,应作为临床一线治疗的方法。EMR技术也多种多样,包括标准EMR、透明帽辅助法黏膜切除术、结扎式EMR术以及分块黏膜切除术等。各种EMR操作步骤虽然略有不同,但基本原则与操作技巧基本一致,主要依据病灶具体情况而选取。EMR可准确判断病变的类型、浸润的深度,并可以根据这些判断有无转移的可能性,其病理结果有助于指导制订患者未来的治疗方案。但EMR对较大病变无法整片切除,逐片切除所获得的标本不能对切缘情况做出准确评价。亦有研究显示,EMR局部复发率较高。
(2)ESD:
ESD是在EMR基础上发展而来的,最早在日本用于治疗表浅的胃肿瘤。ESD可对直径≥2cm的病灶进行完整切除,有利于术后的病理评估,更好地确定治疗的疗效以及是否需要进一步治疗。但食管的操作空间比较小、食管黏膜层较薄、黏膜下层血管丰富等,食管ESD治疗难度较大。其主要并发症包括出血、穿孔及狭窄。随着器械及技术的发展,还出现了隧道式黏膜剥离术,一般用于长度在4cm以上的环周型病变,可克服经典ESD切除后无法对切缘进行精确评估的缺点,但术后容易出现食管狭窄。
2.内镜下毁损治疗
消融技术主要包括光动力疗法、射频消融、冷冻消融、氩离子束凝固。
(1)光动力疗法(PDT):
是利用光敏剂选择性存留在恶变组织中,通过选择合适波长的光促进细胞活性氧物质的生成,进而杀死靶细胞。由于成本较高和相关的不良反应,PDT目前很少使用,但PDT在伴有高级别上皮内瘤变的BE中预防癌症的有效性较好。在一项多中心研究中,77%的BE病例通过PDT根除了高级别上皮内瘤变,在5年随访期内85%的病例维持缓解。有报道称PDT治疗后发生食管狭窄的比例高达36%,因此限制了其应用。
(2)射频消融(RFA):
主要是通过高频振荡、离子振动、传导电流和欧姆耗损转变为热能,使细胞破坏,组织凝固(图3)。有报道称RFA对伴有或不伴有高级别异型增生的BE有较好的疗效。也有观点认为,对于可见的高级别异型增生和黏膜内肿瘤病变患者,应首先接受黏膜切除术或黏膜剥离术,然后再进行射频消融。与PDT相比,RFA的耐受性更高、费用更低、不良事件发生率更低。除胸痛是RFA术后比较常见的症状外,还可能出现食管狭窄、呕吐等。
(3)冷冻消融(CSA):
是治疗BE的另一种有效消融方式,主要通过在BE黏膜表面喷洒液氮或液态二氧化碳,使黏膜冷冻坏死,消除靶组织。其中液氮或二氧化碳以非接触方式喷洒,以通过反复冷冻和解冻诱导细胞凋亡。一项随访24个月的回顾性研究中,绝大多数BE患者通过冷冻消融治疗达到高级别上皮内瘤变的完全根除。前瞻性研究中,冷冻消融治疗根除高级别上皮内瘤变的成功率为81%~94%。目前认为,以下情况冷冻消融优于RFA疗法:食管腔过小或过大,RFA球囊无法与食管壁充分接触;迂曲食管;治疗后BE远端食管狭窄。RFA治疗后予以冷冻治疗是一种安全的治疗方法。

图3 RFA治疗Barrett食管
引自:消化病学.第1版.ISBN:978-7-117-28772-2.主编:.图2-2-4
(4)氩离子束凝固(APC):
是一种非接触性单极电装置,当氩气探头与组织达到合适的距离,氩气即被高频电活化、离子化,将电离子通过电极传输到组织表面,产生热效应。研究显示,APC的疗效优于PDT,且其并发症较少。
(四)外科手术
常用的治疗BE的外科手术包括抗反流术和食管切除术。但值得注意的是,抗反流手术虽然能在一定程度上改善BE患者的反流症状,但不能影响其自然病程,远期疗效有待证实。因此,BE本身并不能作为抗反流手术的指征。
对已证实有癌变的BE患者,原则上应进行手术切除。此外,如果内镜治疗后切除标本的侧切缘阳性者,应追加内镜或外科手术。有以下任意1条者均建议追加外科食管癌根治手术:
1.切除标本基底切缘阳性。
2.浸润至黏膜下层500μm以上(SM2期及更深)。
3.脉管侵袭阳性。
4.低分化及未分化癌。
Barrett食管筛查是指对有可能发生Barrett食管的高危人群进行检查,确定其是否伴Barrett食管、异型增生或食管腺癌。不推荐对所有具有反流症状的人群进行内镜筛查,但在伴有慢性胃食管反流症状和多种癌症危险因素(至少具有以下3项因素:年龄≥50岁、白种人、男性、肥胖)的患者中进行筛查。若患者的一级亲属(≥1名)有Barrett食管或食管腺癌病史,则也应接受Barrett食管筛查。
对Barrett食管患者进行定期随访,目的是早期发现异型增生和癌变,随访的时间根据异型增生的程度而定。对不伴异型增生者应每2年复查一次,如两次复查后未检出异型增生和早期癌,可将复查时间延长至3年;伴轻度异型增生者,第1年应6个月复查一次内镜,若异型增生及病情进展,可每年复查一次。伴有重度异型增生者,有两个选择:①建议内镜或手术治疗;②密切随访,每3个月复查一次胃镜,直至检出黏膜内癌。













