英文名称 :angioneurotic edema
中文别名 :急性神经血管性水肿;Quincke水肿
神经血管性水肿(angioneurotic edema)是指发作性皮肤或黏膜及黏膜下的局限性水肿。通常发生在皮肤的水肿不伴有疼痛和瘙痒感,而发生于消化道黏膜的水肿可出现腹痛、腹泻或肠梗阻,同时咽喉黏膜的水肿还可出现吞咽及呼吸困难,严重者可导致窒息死亡。虽然神经血管性水肿的确切发病机制尚不十分清楚,但随着分子生物学和免疫学研究的深入,既往所强调的自主神经功能障碍学说已逐渐淡出人们关注的焦点,因此检索近年文献时就可以发现血管性水肿(angioedema)已替代了神经血管性水肿。因本病于1882年由Heinrich Irenāus Quincke首次报道,所以亦称Quincke水肿。主要病理改变为局限性真皮、皮下疏松组织及黏膜的细胞肿胀和组织间隙的渗出性水肿,形成胶原纤维束的分离;毛细血管扩张和通透性增加,在血管周围形成大量淋巴细胞、嗜酸性粒细胞和中性粒细胞的多形性浸润。
神经血管性水肿的病因复杂,有3/4的患者不能找到确切的原因。目前认为其发病与遗传因素、食物和食品添加剂、药物、感染、自身免疫、肿瘤、内脏和全身疾病、内分泌、精神性因素、物理或化学因素等密切相关。
1.遗传因素:遗传性血管性水肿的发病与遗传因素有关。
2.食物和食品添加剂:进食某些食物,如蘑菇、核桃、蛋类、牛奶、鱼、虾、蟹和其他海味等,容易引起本病。加入食品中的色素、调味品、防腐剂,以及食物中的天然或合成物质(包括酵母、水杨酸和安息香酸衍化物)也能引起本病。食物中的假变应原是慢性神经血管性水肿的主要诱发因素。
3.药物:药物引起的神经血管性水肿主要是指肾素‐血管紧张素‐醛固酮系统阻滞剂(RRES)所诱导的血管性水肿(REA)。这类药物包括血管紧张素转换酶抑制剂(ACEI)或血管紧张素受体阻滞剂(ARB),因抑制了缓激肽的降解而导致血管性水肿。其次是青霉素,也是常引起本病的药物。其他药物还有吗啡、可待因、哌替啶、多黏菌素等。
4.感染:寄生虫及微生物感染均可引起机体的免疫反应,导致本病的发生。其中常见的寄生虫感染有蛔虫病、钩虫病、血吸虫病、丝虫病、疟原虫病等;常见的病毒感染有肝炎、传染性单核细胞增多症和柯萨奇病毒感染等;常见的细菌感染有齿槽脓肿、扁桃体炎、化脓性乳腺炎、败血症等;常见的真菌感染有白色念珠菌病、癣菌疹等。此外,螺旋体、支原体、衣原体感染亦可引起神经血管性水肿。
5.吸入物:吸入物中常引起过敏反应的物质有花粉、真菌孢子、动物皮屑、羽毛、尘螨、挥发性化学物品和其他空气传播的过敏原。多数情况下这些物质并不引起机体的过敏反应,一般是过敏体质的人吸入这些物质后机体产生过敏反应,出现神经血管性水肿。
6.昆虫叮咬:如虱子、跳蚤叮咬皮肤,以及黄蜂、蜜蜂等的毒刺刺入皮肤而引起的变态反应,可引起神经血管性水肿。
7.内分泌疾病及其他系统性疾病:多种系统性疾病可以引起神经血管性水肿,尤其是慢性的神经血管性水肿,如糖尿病、甲状腺功能亢进症、月经不调、肾病、胆病、白血病、淋巴瘤、溃疡性结肠炎、白癜风、震颤麻痹等。
8.精神因素:情绪波动、精神紧张、抑郁等可诱发本病。有研究发现,黏膜肥大细胞和感觉神经末梢之间有密切关系,精神因素可以诱导血中的组胺和肥大细胞特异性酶的浓度升高。
9.物理或化学因素:如冷、热、日光和机械刺激,以及摩擦压迫和某些化学物质的刺激等,可诱发本病。
本病可发生在任何年龄,但遗传性血管性水肿以青少年为多。根据世界流行病学的统计,遗传性血管性水肿的发病率大约为1∶10000~1∶50000,多伴有家族史,常常连续几代人受累,但约有20%无阳性家族史。获得性血管性水肿(AAE)以中老年为多,多伴有其他过敏性疾病,有过敏体质或过敏疾病的人(如过敏性鼻炎或哮喘等),其发病率是普通人的3~5倍。女性患者的发病率要高于男性。常发生于30~40岁,女性在40~50岁发病率最高。
1.过敏反应性:部分血管性水肿主要是机体对食物、药物、昆虫、植物花粉、寒冷、日光照射和环境中某些物质的过敏反应有关。有文献报道,过敏性血管性水肿占血管性水肿发生率的大多数,其中因食物过敏所占为41.7%,各种药物主要是非甾体抗炎药为39.6%。病理变化主要由重复抗原刺激产生出相当量IgE抗体并介导Ⅰ型超敏反应,又称为速发型超敏反应。IgE具有与肥大细胞和嗜碱性粒细胞相结合的特性,从而激活肥大细胞和嗜碱性粒细胞发生脱颗粒现象,被排出的颗粒释放出一些生物活性介质,如组胺、嗜酸性粒细胞趋化因子、白三烯、血小板活化因子和前列腺素等,这些生物活性介质可引起毛细血管和毛细血管后微静脉的扩张,使血管壁和淋巴管的通透性增加,随着液体的外渗而产生皮下和黏膜下的水肿。因这类血管性水肿主要是由组胺等血管活性介质所介导,因此又有人称此类血管性水肿为组胺类血管性水肿,其发病机制则有别于非过敏性血管性水肿。过敏性血管性水肿常合并有慢性荨麻疹,因此也有人认为二者具有相同的发病机制和病理过程;但也有学者强调这两种疾病的临床表现还是有区别的,不应将这两种疾病相互混淆。另外,有过敏体质或过敏疾病的人如过敏性鼻炎或哮喘等,其发病率是普通人的3~5倍。
2.遗传性血管性水肿(HAE):发病率较低,根据世界流行病学的统计大约为1∶10000~1∶50000。属于常染色体显性遗传,由于调控C1抑制剂的基因突变,而导致C1抑制剂的合成数量减少或功能缺陷所致。目前已经知道有150种基因突变。根据C1抑制剂的数量减少或功能缺陷的不同,将HAE分为两型:HAEⅠ型(约占85%),通常是C1抑制剂合成数量低于正常的50%,甚至低于5%~30%;HAEⅡ型(约占15%),虽然C1抑制剂的含量正常,但功能低下。C1抑制剂是一种丝氨酸蛋白酶,主要参与调控补体和激肽释放酶的激活。当C1抑制剂因功能或数量有缺陷时,就可使补体系统和激肽释放酶异常激活,结果增加了血管的通透性和缓激肽‐激肽的大量生成。缓激肽是一种血管活性物质,它可使血管内皮通透性增加,血浆外渗从而形成血管性水肿。HAE多见于青少年发病。
3.获得性血管性水肿(AAE):AAE是由于非遗传性的C1酯酶抑制剂(C1‐I NH)缺陷所致,以成年人或老年人发病为多见。根据发病机制的不同也分为两型:AAEⅠ型主要合并于全身性的疾病,如感染、炎症、创伤、中毒、肝硬化和恶性肿瘤等,尤其更常见于淋巴瘤、血液病或淋巴细胞增生性疾病。这种类型的血管性水肿的形成原因是由于全身性疾病导致C1抑制剂的大量耗竭所致。AAEⅡ型主要合并于自身免疫性疾病,如风湿性关节炎、甲状腺炎、肾小球肾炎、过敏性肠炎和系统性红斑狼疮等,其形成原因是由于自身存在抗C1抑制剂抗体,而导致C1‐I NH功能和含量的下降。
4.肾素‐血管紧张素‐醛固酮系统阻滞剂(RRES)所诱导的血管性水肿(REA):特指服用血管紧张素转换酶抑制剂(ACEI)或血管紧张素受体阻滞剂所导致的血管性水肿。血管紧张素转换酶(ACE)的主要生理作用一方面是增加血管紧张素Ⅱ的生成,另一方面是减少缓激肽的降解。当临床使用这类药物治疗高血压时,虽然通过抑制血管紧张素转换酶减少了血管紧张素Ⅱ的产生而达到降低血压的目的,但由于同时抑制了缓激肽的降解,使得其功能和数量增加而加大了血管性水肿产生的概率。这类药物的最大不良反应就是容易引起干咳,其形成原因也正是缓激肽增加的缘故。
神经血管性水肿的病理改变是真皮和皮下组织的水肿,受累区域的胶原束广泛分离,毛细血管扩张,血管周围可有淋巴细胞、嗜酸性粒细胞和嗜中性粒细胞,组成多形性浸润。
1.血象
过敏性血管性水肿在急性期血常规检查白细胞数量轻度增加,表现淋巴细胞或嗜酸性粒细胞增加。
2.血浆免疫球蛋白
血浆免疫球蛋白的含量增加,尤其以IgE的含量增加为主。
3.C4蛋白
测定血清中补体C4蛋白的含量,这是一项具有特殊意义的检查。非遗传性血管性水肿的患者,其指标常常低于正常值的30%以下。
4.C1酯酶抑制剂含量及功能的测定
这是一项特异性的检查,如低于正常的50%以下,结合临床可确定诊断。
5.C1酯酶抑制剂抗原的测定
即C1q抗原的测定,该项检测对获得性血管性水肿的诊断具有临床意义。
1.去除病因:对每位患者都应力求找到引起发作的原因,并加以避免。若是感染引起者,应积极治疗感染病灶;若是药物引起者,应停用过敏药物,如RAE应立即停止服用ACEI或ARB类的降压药物;因创伤、炎症或肿瘤所致者应积极治疗原发病,其中有部分患者在去除致病因素后可以自行缓解或消退;由食物过敏引起者,找出过敏食物后,则忌食之。
2.畅通呼吸:上呼吸道和咽喉部的急性黏膜水肿,应密切观察呼吸道是否通畅,一旦发现呼吸道的梗阻,就应立刻给予吸氧、气管插管或气管切开,防止因窒息而死亡。
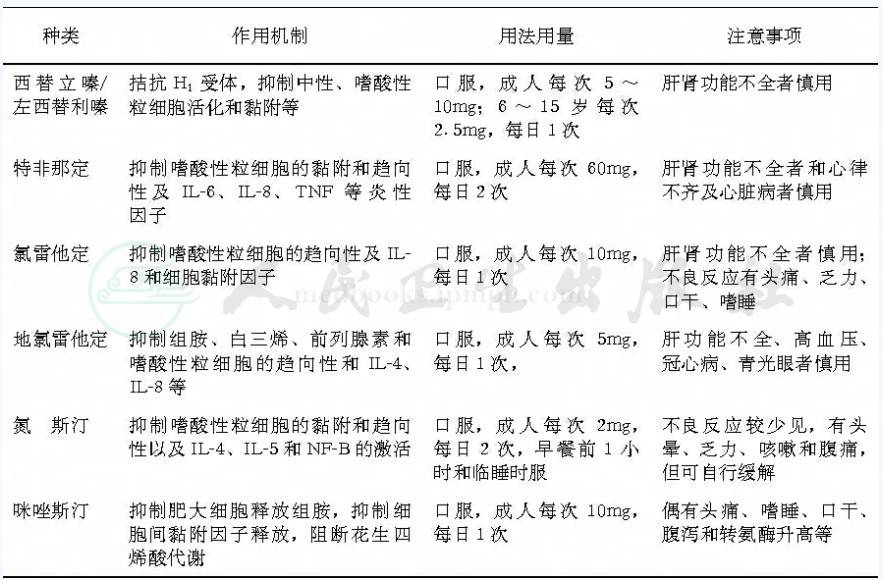
3.抗组胺类药物:过敏性血管性水肿首选抗组胺类药物,因这类药物适用于IgE介导的各种变态反应性疾病。根据国际上大宗的临床随机对照研究表明,应将第二代的抗组胺药物作为一线首选用药(一级证据,A级推荐),此类药物作用快,持续时间长;另外,由于不易通过血‐脑屏障而对中枢神经系统无影响和抗胆碱作用轻微,所以镇静、嗜睡、口干和便秘等不良反应很少发生。对于以往一些传统的第一代抗组胺药,虽然这些药物对过敏性血管性水肿亦有一定疗效,但因疗效相对差,不良反应大而不再被临床所推荐,这类药包括氯苯那敏、苯海拉明、氯马斯丁、右氯苯那敏和哌啶类化合物如赛庚啶及阿扎他定等。第二代抗组胺药物的种类及用法见表1。
表1 第二代抗组胺药物
4.抑制肥大细胞脱颗粒作用,减少组胺释放的药物
(1)硫酸间羟异丁肾上腺素:为β2肾上腺受体激动剂,在体内能增加cAMP的浓度,从而抑制肥大细胞脱颗粒。剂量为每次2.5~5mg,每日3次。
(2)酮替芬:每次最大剂量为1mg,每日3次。通过增加体内cAMP的浓度,抑制肥大细胞脱颗粒,阻止炎症介质(如组胺、慢反应物质等)的释放。其抑制作用较色甘酸钠强而快,并可口服。
(3)色甘酸钠:能阻断抗原‐抗体的结合,抑制炎症介质的释放,成人每次20mg,每日3次吸入。若与糖皮质激素联合应用,可减少后者的用量,并增强疗效。
(4)曲尼司特:通过稳定肥大细胞膜而减少组胺的释放。每次100mg,每日3次。
5.拟交感神经作用药物:用于严重的急性血管性水肿,尤其是有过敏性休克或喉头水肿时。常用肾上腺素0.5~1mg(制成0.1%溶液)皮下或肌内注射,如效果不好可改用4~8mg溶于5%葡萄糖注射液500ml内缓慢静脉滴注。对唇黏膜的血管性水肿,可直接用肾上腺素喷雾吸入,能取得一定疗效。对慢性血管性水肿、伴发的咽喉水肿有效。因其能减少组胺释放,所以能迅速缓解喉头水肿及支气管平滑肌痉挛。也可选用异丙肾上腺素和麻黄碱。
6.非特异性抗过敏疗法及其他疗法:钙制剂作辅助治疗用。钙离子能增加毛细血管的致密度,降低血管的通透性,减少渗出,从而缓解症状。可用10%葡萄糖酸钙注射液10ml,每日1次,静脉注射;组胺球蛋白是促使体内产生抗组胺抗体的药物,对慢性神经血管性水肿有较好效果,可肌内注射或穴位注射,每次2~4ml,每周1次;利血平每次0.25mg,每日3次,口服;转移因子1U皮下注射,每周2次,共6~10次,对慢性神经血管性水肿有一定疗效。
7.糖皮质激素:不论何种病因所致的血管性水肿,在急性期,都可以选择应用皮质激素,尤其咽喉部的急性水肿发作应早期静脉给予皮质激素。成人剂量,可以选择地塞米松5~10mg,每日1次;或甲泼尼龙40~80mg,每日1次,或200~1000mg,每日1次冲击疗法,一般应用3~5日。亦可口服泼尼松5~10mg,每日3次。
8.C1酯酶抑制剂:非过敏性血管性水肿,不论HAE还是AAE以及RAE,其治疗原则基本一致,抗组胺药物对这类血管性水肿是无效的。糖皮质激素对这类血管性水肿的疗效也不肯定,但在急性期还是建议应用,尤其早期难以鉴别是否是过敏性还是非过敏性时。对于局限性单次发作,可以不用立即给予药物治疗,但对于急性多发性或频繁发作以及特殊部位的严重水肿患者,推荐立即给予静脉输注C1酯酶抑制剂,按每千克体重1次给予10~30U;或成人1次推注500~1000U,通常在2小时内即可发挥有效作用。如果观察30~60分钟后无效,可以再追加1次500U C1酯酶抑制剂。目前C1酯酶抑制剂是针对非过敏性血管性水肿的最有效药物,尤其对发生在颌面部、咽喉部以及消化道的HEA或AEA有特殊疗效,但其缺点就是价格较为昂贵。其他治疗还可以选择应用雄激素类药物如口服达那唑,每日100~200mg,这类药物不论对急性期治疗还是远期预防都有很好的疗效。未来即将有3种很有希望的新药问世,现正开展多国家、多中心的Ⅲ期临床试验以观察疗效。第1种为基因重组C1酯酶抑制剂(rhC1‐I NH),作用更为专一性,并且不良反应减少;第2种为特定的血浆激肽释放酶的抑制剂(艾克兰肽,Ecallantide),可以直接通过抑制激肽释放酶,使缓激肽和激肽的生成减少;第3种为具有特殊选择性的缓激肽受体拮抗剂(艾替班特,Icatibant),并且对其他肽类递质受体无影响,如血管紧张素Ⅱ、P物质和神经激肽递质等受体。
患者自我调护对于减少复发非常重要。中医认为情志内伤、冲任失调,可诱发本病,故应调节情志,调摄冷暖,避免汗出当风;忌食辛辣、海鲜、羊肉等“发物”;食品添加剂如色素、防腐剂、香精等也是引起反复发作的诱发因素,应尽量避免食用。现代医学已发现食物、药物、昆虫、植物花粉、寒冷、日光照射和环境中某些易过敏物质可为过敏原,在日常生活中应避免接触。居室应简洁干净,室内装修宜简单环保;养成良好的生活习惯,不养花、不养宠物、不用香水及杀虫剂,尽量避免接触易致敏的物质。













