英文名称 :herpes simplex virus encephalitis
中文别名 :急性坏死性脑炎或出血性脑炎;急性包涵体脑炎
单纯疱疹病毒性脑炎(herpes simplex encephalitis,HSE)是单纯疱疹病毒(herpes simplex virus,HSV)引起的急性中枢神经系统感染。常侵犯大脑颞叶、额叶及边缘系统,引起脑组织出血性坏死病变,故HSE又称急性坏死性脑炎或出血性脑炎,也称急性包涵体脑炎。
人类早在古希腊时期即认识到HSV感染,并用疱疹(herpes)形容皮肤病灶。 Goodpasture(1925年)将人唇疱疹内容物接种于家兔角膜,成功造成实验性脑炎。Smith(1941年)从新生儿脑炎脑组织发现HSV感染的核内包涵体(intranuclear inclusions),并分离出 HSV。 Zarafonetis等(1944年)发现成人首例单纯疱疹病毒性脑炎,证实颞叶核内包涵体并分离出HSV,病变分布与新生儿HSV脑部感染弥漫性斑片状分布不同。
HSV是一种属于疱疹病毒科的大型双链嗜神经DNA病毒,分为1型(HSV-1)和2型(HSV-2),该家族的其他成员包括水痘-带状疱疹病毒(varicella-zoster virus,VZV)、Epstein-Barr病毒(EB)、巨细胞病毒(cytomegaloviral,CMV),以及人类疱疹病毒-6、-7 和-8 等。 约90%的人类 HSE由 HSV-1引起,6%~15%是 HSV-2所致。儿童期发病HSE多为病毒新近感染,绝大多数新生儿HSE系HSV-2引起,母亲分娩时生殖道分泌物与胎儿接触是新生儿感染的主要原因。
HSV病毒的核心为双链线状DNA,不同疱疹病毒DNA组成有很大差异,衣壳直径为100~110nm,有162个壳粒,排成链线状的20面体,每角上有5个壳粒,衣壳周围紧贴一层无定形球状物质,称壳皮。壳皮又有外膜包被,为典型类脂双层膜,上有短的突起。完整病毒颗粒直径为200~300nm,外膜含多胺类、脂质及糖蛋白,糖蛋白具有的独特抗原性与各病毒株特异性有关(Whitley,1997)。
根据病毒复制的基因表达特性,将疱疹病毒分为三型:①α-HV型(立即早期型):繁殖周期极短,迅速破坏宿主细胞,潜伏于感觉神经节,包括 HSV-1、HSV-2和VZV;②β-HV型(早期型):只侵犯人类器官,繁殖周期较长,有形成巨细胞性能,潜伏于分泌腺、单核巨噬细胞(特别是淋巴细胞)及肾脏,CMV属于此型;③γ-HV型(晚期型):可感染某些靶细胞,常潜伏于淋巴样组织,可在体外淋巴母细胞中复制,EBV属于此型。
HSV可通过黏膜或受损皮肤进入人体,随后感染感觉神经元,并通过快速逆行轴突运输进入背根神经节神经元中,但HSV如何进入CNS仍不清楚,通过嗅觉或三叉神经的逆行运输似乎是最合理的解释,因为这样符合HSE脑炎病例中额叶和中颞叶的优先受累的临床特点。已知HSV可以在感觉神经元,包括三叉神经节中长期存活,被重新激活感染的可能性较大。
关于HSE与自身免疫性脑炎相关性,近年研究表明HSE可导致神经系统免疫功能异常,10%~25%的患者在病毒感染数周或数月后出现复发症状(Sköldenberg et al,2016;Lim et al,2014),以儿童多见,如亨廷顿病、意识水平下降和癫痫发作等(Schleede et al,2013),但大多数复发患者CSF中未能检测到HSV-1病毒存在(Sköldenberg et al,2016;Alsweed et al,2018)。 这些患者通常抗病毒治疗无效,应用糖皮质激素反而使症状得到缓解,表明可能是自身免疫性炎症介导。最近一项包括51例新发HSE患者的前瞻性观察研究显示,27%的患者在HSE后发生了自身免疫性脑炎(Armangue et al,2018)。HSE后的自身免疫性脑炎涉及各个年龄段患者,女性占优势。HSE后自身免疫性脑炎患者血清或CSF抗NMDAR抗体高达64%,其余可见抗-GABABR抗体。此外,大多数4岁以下患儿出现舞蹈-手足徐动症、意识水平下降、癫痫发作和行为学改变,>4岁患儿和成人主要表现为行为异常和精神症状,很少舞蹈-手足徐动症、癫痫及意识障碍(Armangue et al,2018)。 MRI和 CSF 常规检查无异常(Armangue et al,2018)。成年或青少年患者应用糖皮质激素、静脉滴注免疫球蛋白、环磷酰胺或利妥昔单抗等疗效明显优于幼儿,幼儿预后较差。
单纯疱疹病毒是全球的散发性病毒性脑炎病原体之一,尚未发现动物传播媒介,人群间密切接触是HSV唯一的传染途径,发病无明显地区性和季节性。原发感染多见于儿童或青春期,无明显的症状,病毒有潜伏特性。15岁以下的人群血清抗体阳性率为50%,成人达90%,男、女发病率无差异。有人认为,20岁以下和40岁以上是两个发病高峰,但半数以上病例在20岁后起病,提示HSE多由内源性病毒激活引起,生活贫困地区发病率较高。全世界HSE年发病率为0.1/10万~0.4/10万,其中约1/3是青少年和儿童(Jorgensen et al,2017)。HSV占所有的CNS病毒感染的10%~20%。成人病例发病年龄多在50岁以上,大多数 HSE由 HSV-1引起,约10%由HSV-2引起,HSV-2通常发生在免疫受损的个体和新生儿(Singh et al,2016;Mateen et al,2014)。
肉眼可见HSE脑部病变广泛分布,颞叶和额叶受累显著,可累及邻近边缘叶,双侧半球病变常不对称,早期呈充血、出血及软化急性炎症改变,额颞叶脑膜浑浊、充血,约2周后发生坏死和液化。
镜下皮质及皮质下出血性坏死和血管周围白细胞套状聚集,以淋巴细胞和单个核细胞为主,急性期可见中性粒细胞,2~3周后出现坏死和继发炎症反应,蛛网膜下腔弥漫性血管周围单个核细胞浸润、胶质增生及卫星状噬神经细胞现象(〗satellitosis-neuronophagia),出血性坏死变得更广泛。晚期常见少突胶质细胞受累和星形细胞增生。约50%的患者神经细胞和胶质细胞内出现核内包涵体,支持病毒感染的诊断。核内包涵体(Cowdry A型)为嗜伊红均质性,被一层透明的不染色带包围,外围有薄层染色质,原位PCR检测为病毒抗原。与成人病例不同,新生儿型HSV-1脑炎病变累及全脑(图1)。
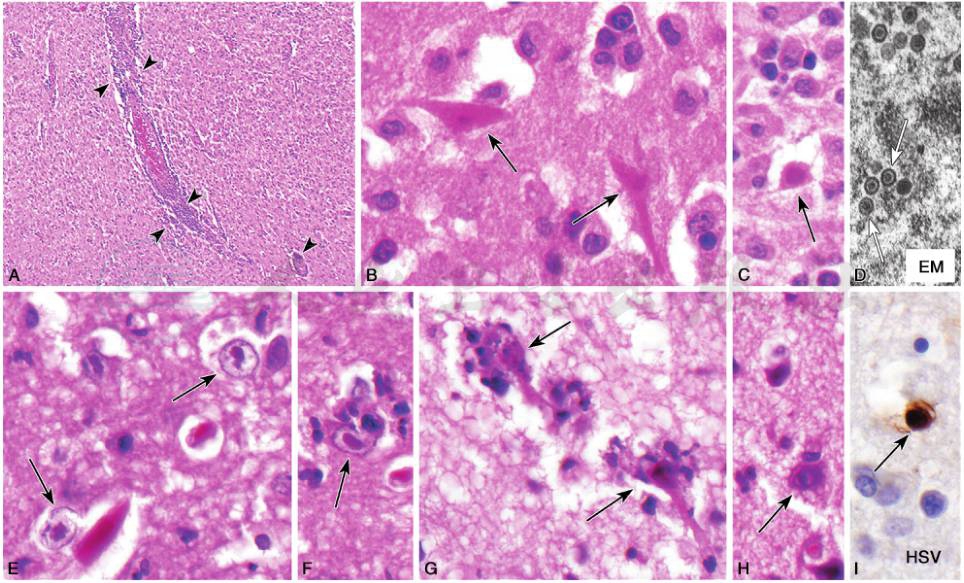
图1 两例单纯疱疹病毒脑炎(HSE)
病例1:男性,16岁,患HSE脑炎,右侧颞叶皮质出现坏死(A~D)(病例由得克萨斯州达拉斯市UT西南医学中心Dennis K.Burns博士提供)。A.低倍镜显示,在大量的泡沫样巨噬细胞背景中可见血管周淋巴细胞套(箭头),提示组织坏死[20×,苏木精和曙红染色(HE)];B.高倍镜显示,萎缩的锥体神经元可见明显区分于细胞质和核的嗜酸性小体增多(箭头)(400×,HE);C.光滑的嗜酸性粒细胞内可见核内病毒包涵体和区分于细胞质和核的嗜酸性小体(箭头)(400×,HE);D.电子显微镜(EM)病毒核衣壳环绕致密的DNA核心(箭头)
病例2:男性,27岁,罹患HSV脑炎,诊断通过脑活检和电子显微镜技术证实(E~I)(由得克萨斯州达拉斯市UT西南医学中心Charles L.White博士提供)。E.有经典的Cowdry A型核内包涵体的神经元(箭头);F.神经元中Cowdry A型包涵体及嗜神经现象(箭头);G.具有平滑的核内病毒包涵体的2个神经元的嗜神经现象(箭头)。H.具有非经典Cowdry A型包涵体神经元(箭头),包涵体仅占细胞核的一部分(E~H:HE);I.HSV免疫组织化学显示核深染(箭头)(E~I:400×)
1.周围血象
一些患者可见白细胞增多症或白细胞减少症,白细胞计数正常与HSV脑炎诊断并不矛盾;近半数病例可有急性血小板减少症(Singh et al,2016)。
2.CSF检查
绝大多数HSV脑炎患者CSF淋巴细胞数轻中度增多,(10~200)×106/L,偶可见到CSF细胞数正常的(<5×106/L),蛋白增高(500~1 000mg/L),葡萄糖正常(Singh et al,2016;Sili et al,2014)。
3.脑脊液病原学检查
通过聚合酶链反应(PCR)鉴定CSF中病毒DNA是确诊HSE的有效方法,诊断灵敏度>95%,特异性>99%,可视为替代脑活检的HSE诊断的“金标准”(Steiner et al,2012),但在感染早期的数日内可能出现假阴性结果(Singh et al,2016),在3~5天后需复查PCR检测,因抗病毒治疗1周也可能使PCR变为阴性(Weil et al,2002)。
4.脑脊液免疫学检查
(1) ELISA 检测 HSV 抗原:P/N≥2∶1为阳性,早期检测脑脊液HSV抗原阴性可作为排除本病的依据。
(2) ELISA、免疫印迹法(Western blotting)和间接免疫荧光检测HSV特异性IgM、IgG抗体,病程中2次或2次以上抗体滴度呈4倍以上增高有确诊价值。抗体通常出现于发生HSE后8~12天或更晚,持续到30天内,血清/CSF IgG抗体比值<20∶1提示该抗体为鞘内合成(Aksamit,1997)。 HSE发病2周后 PCR检测 HSV-1 DNA可转阴,可检测CSF特异性抗体(Roos,1998)。
5.脑组织活检
镜下可见特征性的出血性坏死病变;电镜可见细胞核内包涵体中病毒颗粒坏死区及邻近的少突胶质细胞及神经细胞核内有多个包涵体。PCR或原位杂交可检测脑组织标本病毒核酸。HSV病毒分离与培养特异性高,但耗时长,脑活检不易接受,已逐渐被淘汰。
6.脑电图检查
叠加的周期性放电,单侧的、独立双侧的或广泛慢波背景是HSE特征性EEG(McGrath et al,1997)。对疑诊或确诊HSV脑炎的患者,建议检测脑电图,也可进行连续的视频EEG监测,额颞部缓慢的周期性放电可能有助于将HSE与其他脑炎区分开来(Tan et al,1997),但HSE无特征性的脑电图。
7.影像学检查
(1)脑CT检查:
90%以上的患者CT可见局灶性低密度灶,多在颞叶皮质,有占位效应如中线移位和线性增强,但发病1周内多为正常。
(2)脑MRI检查:
有助于HSV-1脑炎诊断,可显示特征性病变,如在T2WI和FLAIR像可见内侧颞叶、岛叶和下额叶高信号病灶,显示脑组织炎性水肿,FLAIR像敏感性更高(图2,图3)(Bradshaw et al,2016)。HSV-1脑炎MRI变化非常典型,如无典型变化,其临床诊断会受到质疑(Chow et al,2015)。脑组织炎性水肿可影响一侧或双侧半球,约30%的病例丘脑受累,但一般不孤立存在。颅内出血非常少见,HSV-2感染略有增加。约3/4的病例可见脑实质增强,通常是轻度的,有时伴有轻度软脑膜增强。
疑诊HSE时,须进行弥散加权成像(DWI)和表观扩散系数(ADC)检查,HSE早期的敏感指标是弥散受限(图4)(McCabe et al,2003)。 弥散受限发生的部位与FlAIR发生变化的部位相同,但DWI信号的变化可能先于FLAIR的变化出现。此外,DWI变化的存在可能预示更差的预后(Singh et al,2016)。
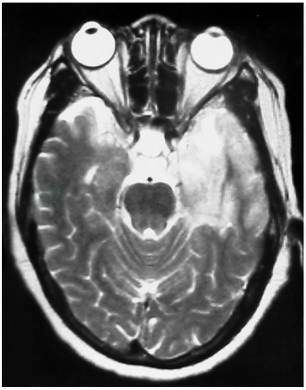
图2 单纯疱疹病毒性脑炎患者MRI检查,T2WI显示左颞叶片状高信号病灶
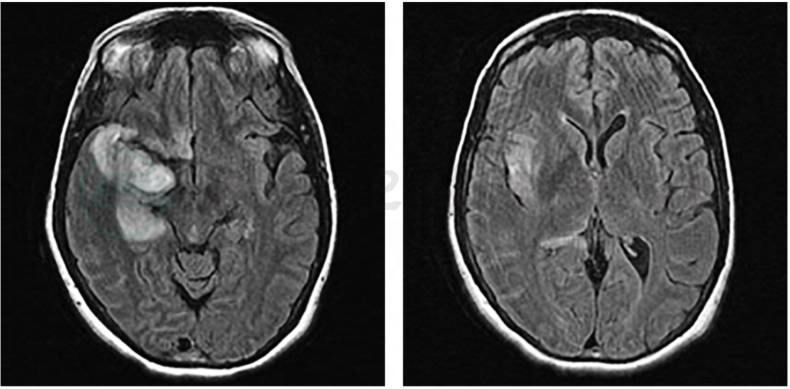
图3 FLAIR序列显示HSV-1脑炎患者的典型炎症性改变
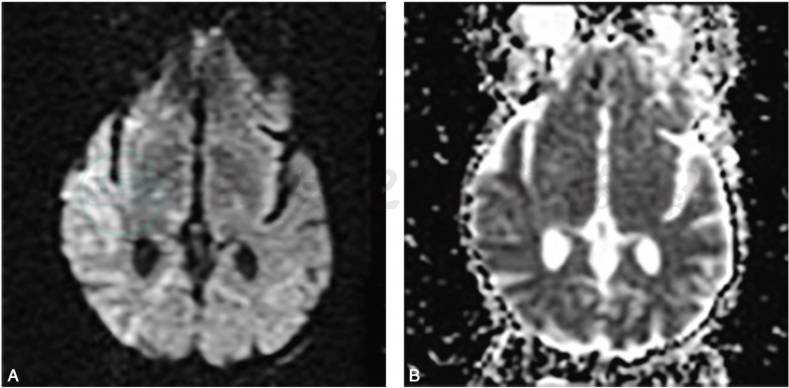
图4 HSV-1脑炎患者的MRI弥散加权图像
A.DWI像;B.表观弥散系数(ADC)序列。严重HSV-1脑炎患者早期弥散受限
HSV-2感染的神经影像学特点更加的不典型(Singh et al,2016)。免疫功能正常的患者可能在与HSV-1感染相似的部位表现为轻度水肿。但总而言之,其MRI影像的特征是多变的,可能是非典型的、更广泛的或完全无异常的,特别是在免疫受损的人群中这种情况更为常见(Tan et al,2012)。
早期诊断和早期治疗是降低HSE死亡率的关键,主要是抗病毒药病因治疗,辅以对症治疗。
1.抗病毒药 阿昔洛韦(acyclovir)也称无环鸟苷,是一种鸟嘌呤衍生物,是治疗HSE有效的药物,临床疑诊的病例也可应用。静脉注射阿昔洛韦对治疗HSV脑炎非常有效(Solomon et al,2012),与6个月时死亡率降低显著相关(Whitley et al,2015)。 它的血-脑屏障透过率约50%,能够抑制细胞内病毒复制DNA,具有抗HSV作用。延迟给予阿昔洛韦是HSV脑炎患者预后不良的最常见可改变危险因素。因此,只要HSV脑炎处于鉴别诊断阶段,就应立即启动阿昔洛韦治疗。常用剂量为15~30mg/(kg•d),分 3 次静脉滴注,或 500mg静脉滴注,1次/8h,1~2小时滴完,连用14~21天。病情严重可延长治疗时间。该药物是通过肾小球滤过和肾小管分泌经肾脏清除的,因此需要在肾功能不全患者中调整剂量(表4),但肝功能不全患者则不受影响。肾小管中阿昔洛韦的沉淀可引起阻塞性尿路病,所以阿昔洛韦应该缓慢输注(超过1~2小时),并且患者在治疗期间必须保持给予充足的液体(在输注药物过程中同时给予静脉输液并保持尿量>50~75ml/h)。阿昔洛韦过量可引起神经系统的不良反应,包括震颤、肌阵挛和意识内容及意识水平的改变。在免疫功能正常的患者中,很少出现阿昔洛韦的耐药的情况,但在免疫功能低下的患者可能会出现,特别是在骨髓移植后的患者中(Danve-Szatanek et al,2004),在这种情况下可选择二线药物。二线药物包括静脉注射膦甲酸(40mg/kg,每8或12小时一次,静滴时间不得小于1小时,连用14~21天或直至治愈)和静脉注射更昔洛韦[用量 5~10mg/(kg•d),或 250mg,静脉滴注,1 次/12h,1 小时以上滴完,一个疗程14~21天]。这两种抗病毒药物也经由肾脏清除,因此,当肾功能受损时需要调整剂量。
表4 根据肾脏功能调整静脉注射时阿昔洛韦的剂量
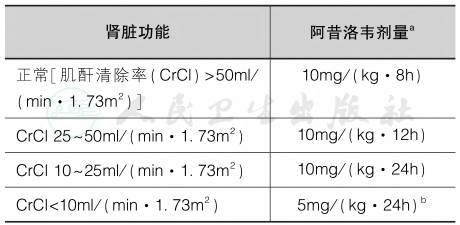
注:a使用理想体重计算。b对间歇性血液透析患者,每次透析后再给予2.5~5mg/kg剂量;对于连续血液滤过患者,每24小时给予2~5mg/kg剂量;对于腹膜透析患者,透析后每24小时给予2.5mg/kg,无需额外剂量。
尽管在评估阿昔洛韦作为HSE一线治疗疗效的临床实验中,设计了10天的疗程来验证其效果,但目前的(Whitley et al,2015;Skoldenberg et al,1984) 指南中仍推荐坚持使用更长的时间(14~21天)以降低HSE的复发率(Gnann et al,2015)。尽管一些专家提倡只有在复查CSF以确认其中没有可检测到的病毒,并且HSV的PCR检测结果为阴性后方可停用阿昔洛韦,但大多数临床医生认为只要患者对药物反应良好,在进行了足疗程的治疗后,无须再次复查CSF即可停药。
2.免疫治疗 可应用有广谱抗病毒活性的干扰素,对宿主细胞损害小。α-干扰素60×106IU/d,肌内注射,连用30天;亦可用IFN-β1a 6×106IU肌内与鞘内注射联合用药。或用干扰素诱生剂,如聚肌胞苷酸(Poly:C)、聚肌鸟苷酸(PolyG:C)、青枝霉素、麻疹活疫苗等,可使人体产生足量的内源性干扰素。
3.中药治疗 病毒性脑炎已积累丰富的经验,根据温病辨证施治,以清热解毒、芳香化浊等法为主,常用清营汤、银翘散、石膏汤等加减,可配合紫雪丹、安宫牛黄丸或羚羊钩藤汤等加强退热镇惊之效。上述方剂中大青叶、板蓝根、银花、连翘、黄连、黄芩、柴胡、紫草、贯众和佩兰等有不同程度抑制病毒作用,也可用单味中药如大剂量(100~200mg/d)板蓝根煎服或板蓝根注射液静脉滴注。
4.糖皮质激素可作为HSV脑炎的辅助治疗,可减轻脑水肿(包括细胞毒性和血管源性水肿,激素能部分减轻后者),并可能预防继发的自身免疫性脑炎;但目前尚无支持的临床数据。
5.对症和支持疗法 高热可物理降温。癫痫发作、精神错乱及躁动不安患者应控制痫性发作,使用镇静剂或地西泮等治疗。严重脑水肿及颅内压增高可用脱水药,早期应用甲泼尼龙500mg/d冲击治疗,连用3~5天。重症昏迷患者注意维持营养、水及电解质平衡,保持呼吸道通畅,加强护理,防治压疮、肺炎及泌尿系感染等并发症。恢复期积极采取理疗和康复治疗,促进神经功能恢复。













