随着科学技术日益进步,生活水平不断提高,人类的平均寿命日趋延长。人口老龄化在全球范围内正在加速,1985年法国65岁以上人口的比例已超过7%,成为世界上第一个老龄化社会的国家。在我国平均寿命由建国前的30余岁增加到目前的70岁左右,超过60岁的老人在总人口中的比例在1982年为7.6%,2000年我国与全球同步宣告进入老龄化社会,2005年我国已有老年人口1.44亿,其中高龄老人(≥80岁)1600万,预测到2025年将增至19.2%。人口老龄化和个体的衰老将成为社会中一个严峻的问题,我国已把高速老龄化社会作为21世纪的一个重要国情认真对待。
21世纪中国的人口老龄化发展趋势将分为三个阶段:①快速老龄化阶段(2001~2020年):我国将平均每年增加596万老年人口,年均增长速度将达到3.28%,将超过总人口年均0. 66%的增长速度。2020年,老年人口将达到2.48亿,其中80岁以上老年人口将达到3067万人。②加速老龄化阶段(2021~2050年):预计2023年,老年人口将达到2.7亿,与0~14岁少儿人口数量相等。2050年,老年人口总量将超过4亿。③稳定高龄老龄化阶段(2051~2100年):老龄化水平将稳定在31%左右,老年人口规模将稳定在3亿~4亿,约为少儿人口数量的2倍,80岁及以上高龄老人将占老年总人口的25%~30%,进入高龄老龄化的平台期。从衰老的进程来看,按年龄,老年期可区分为三个阶段,即初老期或老年前期、老年期和长寿期。1982年联合国老龄问题世界大会提出以60岁为老年期的开始年龄,我国与此一致。2001年世界卫生组织曾提出年龄划分标准:44岁以下人群为青年人,45~59岁人群为中年人,60~74岁人群为老年前期或准老年期,75岁以上人群为老年人,90岁以上人群为长寿老人。随着老龄化迅速发展,年龄划分标准尚有待于重新界定和认可。
老年期疾病及其特点
现有的临床流行病学资料已证明,在相同基础疾病的情况下,高龄是一个独立的危险因素。高龄人群具有“三最”特点:即最高患病率、最高伤残率和最高医疗资源利用率。2007年底中国统计局公布:60岁以上老年残疾人有4416万,占老年人总人口的53.24%。目前,心脑血管病、恶性肿瘤、糖尿病等患病率随年龄增长而增加,这些疾病是导致高龄老年人口高患病率、高伤残率和高医疗利用率特点的重要因素。人类受体内外因素的影响而引起疾病,但不同年龄时期,疾病的种类和表现也不同。老年期疾病包括三类:一是发生在生命的各个阶段,如感冒和一般性感染;二是从中年起病,延续到老年期,如高血压和慢性支气管炎;三是在老年期起病,为老年期特有疾病,如老年性痴呆、老年性白内障。血液系统疾病也是如此,一些血液病可发生在各个年龄阶段,如缺铁性贫血,另一些则多在老年前期或老年期起病,如慢性淋巴细胞白血病、多发性骨髓瘤等。老年期疾病的特点为多病性、不典型性、发病快、病程短、易发生意识障碍、容易引起水和电解质紊乱、容易发生全身衰竭、容易发生后遗症和并发症、对治疗的反应也与年轻人不同,容易发生药物不良反应(占“药物不良反应”15%~27%,通常比一般成年人高3倍以上)。老年病人的诊断由于其:①多病性,使疾病的表现复杂,因此不能满足于一种疾病的诊断,应尽力寻找可能并存的疾病;②衰老变化使老年人对疾病的反应迟钝;③衰老变化与疾病相混杂,易将疾病的表现误为衰老的自然进程,因而较年轻人复杂。应根据老年病人的特点进行病史采集及体格检查。
人类在衰老过程中,血液系统也和其他生理系统一样有一系列改变,由于老年人个体的差异,如个人的基本健康状况、生活条件、社会环境及所从事的职业不同,使有关研究在这方面尚未达到完全共识。但以下一些衰老过程中血液系统的变化,多数学者认识是一致的:①随着年龄的增加,造血的红骨髓容量减少。青壮年在应激状态下(如外伤、手术等大量出血),平时不造血的黄骨髓可转变为造血的红骨髓,使机体造血功能增强,恢复人体正常所需的血细胞,而在老年人这种应激能力明显减低。②老年人胸腺、脾脏和扁桃体的重量下降,主要是由于淋巴细胞减少。此外,全身淋巴结中淋巴滤泡也减少;T、B淋巴细胞发生功能变化,抗原刺激下免疫球蛋白产生明显减少,可能导致老年人免疫功能减低,易发生各种感染或肿瘤。③血液循环中丙种球蛋白增加可使血沉加快。④血小板黏附性和集聚性增加,老年人多有动脉硬化,易激活血小板,这可能是老年人易发生血栓和栓塞的部分原因。
老年人中常见或有多发倾向的血液病
在红细胞系统疾病中,有缺铁性贫血、巨幼细胞贫血、再生障碍性贫血、红细胞外因素所致溶血性贫血、真性红细胞增多症及继发性红细胞增多。白细胞减少症及粒细胞缺乏在老年人中也较常见。在出血性疾病中,有血小板减少性紫癜、血管性紫癜等常见病。在血液系统肿瘤中,除各年龄组均可发生的肿瘤外,一些血液肿瘤在老年人中有多发倾向,应引起老年保健的注意。如慢性淋巴细胞白血病,1/3病人发病年龄在60岁以上,30岁以下罕见。多发性骨髓瘤多数发病年龄在60岁左右,40岁以下发病少见。原发性巨球蛋白血症和重链病发病也多在40岁以上。淋巴瘤的第二个发病年龄高峰在40岁以后。骨髓增生异常综合征,一组与白血病密切相关的造血功能异常或造血功能紊乱症侯群,其发病也以老年人居多。至于一些血液系统疾病为何在老年人中多发,原因尚不清楚,可能与老年人免疫功能低下及老年人的多病性易发生一些继发性血液系统缺陷有关。
1.老年贫血的治疗
治疗原则与一般血液病人相同,但由于老年人各脏器有不同程度衰退,同时伴有其他器官疾病,造血组织应激能力差,对迅速发生的贫血耐受能力低,即使是中等度贫血,也可以出现很严重的临床症状。对缓慢发生的贫血,则可能由于其他疾病掩盖贫血症状,有时血红蛋白已降得很低才被发现。老年贫血多继发于其他疾病,约占80%。常见的原发病有肿瘤、感染、慢性肾功能不全,各种原因所致的急性或慢性失血,代谢性疾病及药物反应也可致继发性贫血。多种原因所致的贫血在老年人中常见,在治疗上单一用药也很难出现效果。积极的支持治疗,包括脏器功能的保护、改善贫血、防止出血及控制感染等十分重要;对Hb<80g/L患者采用小量多次输血,输血时适当给予利尿药,以防心衰,出血患者适当应用肾上腺皮质激素,感染时应立即用大剂量广谱抗生素等;促红细胞生成素的补充在老年患者也很重要。
2.老年白细胞和单核-巨噬细胞系统疾病的治疗
(1)白细胞减少和粒细胞缺乏症
白细胞减少的原因各个年龄组相似,在老年组任何严重的感染均可能引起白细胞减少,而在年轻人白细胞减少通常是由于病毒性疾病。影响精神的药物、心血管药物以及抗生素在老年组最常引起白细胞减少。由于老年人服用多种药物,因而他们更易发生白细胞减少。老年人白细胞减少症的临床症状并不比一般成年人重,治疗原则与一般成人相同,但由于老年人的特点,在治疗方面应更积极。一旦发现此类病人,应尽可能住院进行保护性隔离。在高龄患者,由于其多病性,反应迟缓,一些器官平时就有慢性感染存在(如呼吸道、牙龈、外阴等部位的慢性感染),在粒细胞缺乏的情况下,难以避免发生严重感染,此类病人在诊断时即使未发现明确感染灶,也应予以预防性抗生素治疗。若已有明确感染,即使临床表现不重,也应予以强有力的抗生素治疗,如抗细菌感染治疗效果不满意,应加用抗真菌药物。同时应用重组粒细胞集落刺激因子(rhG-CSF)或粒-单核细胞集落刺激因子(rhGM-CSF)150~300μg,分两次皮下注射,直至粒细胞上升至0.5×109/L以上,减量观察后停药。老年人粒细胞缺乏时应用粒细胞输注和肾上腺皮质激素治疗应慎重,因其副作用的出现可能使治疗变得更为复杂,故一般不用。若发生感染性休克,在使用其他抗感染治疗的同时,短暂应用地塞米松静滴也能收到较好效果。此外,老年人常有贫血、白蛋白减低、免疫能力低下、重要脏器功能不全等情况存在,因而在上述治疗的同时,积极的支持治疗也很重要,如加强重要脏器的保护、纠正贫血、补充白蛋白、静脉输注丙种球蛋白、给予胸腺肽等也是治疗成功的关键。
(2)急性白血病的治疗
普遍认为年龄≥65岁的老年患者治疗强度要较成年AL减量,而在60~65岁时可按成人剂量治疗。老年急性白血病中难治性白血病发生率高(细胞遗传学异常发生率高、治疗相关白血病多、常有血液系统疾病病史、高MDR1基因表达、合并症多等)。由于老年患者的特点,其耐受强化疗的能力降低;由于造血功能的年龄相关性缺陷,化疗后的增生不良持续时间长;危及生命的感染发生率高;重要脏器发生年龄有关的病变(如肾脏、肝脏、心血管和呼吸系统);同时患多种疾病的频率高;与年龄有关的抗肿瘤药物药代动力学改变导致强化疗的血液和血液外毒性增加;免疫功能发生年龄相关性下降;异基因和自体干细胞移植过程的适宜性和(或)可行性减少;社会家庭、认识上的问题阻碍了强化疗方案的实施等诸多因素,因而治疗用药上与成人有所不同。有内科基础疾病的患者其平均生存期、平均完全缓解持续时间均短于无内科基础疾病的患者。正是因为这些特点决定了老年白血病患者往往原发耐药或是治疗后缓解维持时间短,容易复发,成为难治或复发性白血病。
支持治疗:白血病发展过程中或化疗过程中,可出现一系列并发症,有些并发症甚至严重威胁病人生命,导致治疗失败甚或死亡,因此积极防治并发症是白血病治疗中一个十分关键的问题。
白血病的化学治疗十分重要,但由于老年患者自身的发病特点如多病性等为白血病的治疗增添困难,治疗的同时要从大内科的角度,兼顾患者的各个脏器功能情况,注重脏器功能的保护,给予强有力的支持治疗,使化疗得以顺利进行。在治疗时加用胸腺肽、白细胞开始下降时给予人免疫球蛋白、集落刺激因子等可有效防止感染,减少并发症发生;有文献报道化疗前30分钟静脉滴注阿米福汀(一种正常细胞的广谱保护剂)可减轻化疗引起的骨髓抑制以及肾脏受损;糖尿病患者应用糖皮质激素时注意监测血糖,调整降糖药物,避免血糖的大幅度波动;蒽环类药物应用前后给予保护心肌等,均可有效减少治疗相关并发症。
老年ALL的治疗:老年急淋病人与儿童急淋相比长期生存少。通常将老年急淋病人定义为高危,原则上采用成人ALL治疗方案,但要适合于老年人的特点,通常包括长春新碱、泼尼松以及其他药物(柔红霉素、环磷酰胺、L-ASP、口服VP16或羟基脲、LD-AraC等)组成的联合方案,方案中药物种类不宜过多,一般以2~3种为宜,药物剂量也要偏小,可为成人的1/2~2/3。多数老年病人在治疗缓解后的第一年内复发,目前尚无标准的联合化疗方案;对于Ph+的ALL加用格列卫400~600mg/d可有一定效果。最为重要的是在治疗中需结合患者体质情况、脏器功能状态和化疗反应因素随时调整治疗方案,强有力的支持治疗尤为重要。
老年AML的治疗:由于老年AML自身的生物学特征(细胞起源于原始的造血干细胞),诊断时多系受累和三系增生不良的发生率高;前驱血液疾病高发性,如诊断AML之前有全血细胞减少;克隆性缓解发生频率高,CR期短,复发率较高;白血病细胞的干细胞样表型;预后不良的核型出现频率高,如-7/7q-,-5/5q-,11q或11p异常,+8,复杂或多发的细胞遗传学异常;预后良好核型出现频率低,如t(8;21)、t(15;17)、inv(16);MDR-1表达频率高,白血病细胞将药物泵出的能力较高以及老年患者多病性等特点,对化疗耐受力下降,易致感染、出血和心、肝、肾、肺功能衰竭。国外文献报道CR率不足50%;无复发生存时间平均少于12个月。其不良的临床结果主要是由于白血病本身内在的生物学差异,但也与宿主的因素有关,如对强化疗耐受性降低,并且与病人年龄相关的患病状态有关。治疗上对一般情况好,无严重并发症的应采用经典的DA或IA等方案化疗;对一般状况差,有重要脏器功能病变的或由MDS转化而来者,则采用减量温和方案治疗LDAra-C(Ara-C剂量为10~20mg/m2,连用15~21天,持续皮下或静脉滴注。其CR率为10%~70%,相差颇大)等,能有效抑制病情进展并诱导缓解。但无论采用何种方法,强有力的支持治疗必不可少。由于其在临床和生物学上的异质性,老年AML治疗意见尚不统一,归纳起来包括至少姑息治疗[适宜于进展缓慢的AML患者(冒烟型白血病),这些病例可以给予支持治疗和(或)单药化疗(如羟基脲控制白细胞增多,或单用去甲氧柔红霉素),其总生存率较接受强化疗组明显延长];缓和的联合化疗[多数学者主张对老年人AML应采用减量的缓和的诱导治疗,达到并维持CR,以期能减少早期死亡并改善存活。主要予口服药物联合化疗,如ETI(IDA+VP16+TG)或TAD(TG+ARA-C+DNR),CR率分别为ETI 60%,TAD 23%;平均生存期分别为ETI 9.9个月,TAD 3.7个月。LD-ARA-C 10mg/m2Q12h×14~21天可使32%~35%获得CR,多数患者发生骨髓增生低下。近年来Decitabine也可以单用并成功地治疗老年AML,其缓解率与LD-ARA-C相近];标准强烈化疗(由于减量的缓和联合化疗和LD-Ara-C对老年AML疗效均不理想,近年来也有不少作者主张采用强烈的联合化疗。用药基本上与成人一致,但血液学和血液以外的毒性明显增加,CR率为40~65%)。缓解后治疗意见尚不统一。大多数老年患者不能耐受强的巩固治疗,可用缓和的联合化疗,HD-ARA-C不能获得像年轻人一样的效果。亦可采用小剂量阿糖胞苷[10~20mg/(m2·d)],或小剂量三尖杉碱(0.5~1mg/d)静脉滴注6-TG口服等治疗。
(3)恶性淋巴瘤
老年NHL与年轻人NHL预后并无真正差异,只是老年患者更易发生结外病变。不同的NHL组织表型在各个年龄组有不同的发病趋势:Aviano总结1988~1995年950例NHL中,年龄≥70岁的占28.5%;随年龄增长,低度恶性NHL发生率增高,在15~34岁组和65~74岁组分别为16.6%和32.4%,而在≥75岁时其发病率又随之下降为23.2%;中度恶性NHL在老年人更易发生,65~74岁组和≥75岁时分别为46.6%和49.4%;高度恶性淋巴瘤发生率随年龄增加较低中度恶性淋巴瘤明显下降;B细胞淋巴瘤随年龄增加比例显著增大。在无造血细胞生长因子支持下,标准剂量的多药联合化疗与减量化疗相比较,前者常伴随较高的治疗毒性死亡率。老年患者显示很高的淋巴瘤相关死亡率。用交替的联合化疗方案治疗老年患者其平均反应延续时间短。老年HD进展期患者预后较年轻人差,因为他们不能耐受大剂量的放化疗。在NHL除老年人较易发生结外病变外,其临床表现和预后老年人与年轻人并无真正的区别,主要和疾病的内在因素有关。
目前普遍认为,在NHL患者年龄在70岁以内时,能够耐受标准剂量的CHOP方案化疗。HD化疗方案可选用ABVD方案,还可试用CEP方案或EAC方案,剂量酌减。多数老年人仅能耐受常规最适化疗剂量的30%~50%。化疗持续6~12个月,或至少在获得CR后2个月。老年患者的生存期与获得CR有关,因而与实际给予的抗肿瘤药物适宜剂量有关;化疗强度对老年进展期淋巴瘤获得持久的CR和治愈十分重要,但老年患者常因其全身状况而不能接受全量化疗,所以加强支持治疗十分重要。对于高龄NHL患者,可在支持治疗基础上给予脂质体多柔比星(阿霉素)为主的联合治疗同样可以取得很好的治疗效果,患者耐受性较好,安全性可以得到保证,可以使高龄患者化疗的毒副作用达到优化。
(4)其他
如慢性白血病、骨髓增生性疾病、多发性骨髓瘤的治疗、巨球蛋白血症、μ-重链病等的治疗原则与成人相同,在老年患者,积极的支持治疗十分重要。可根据其个体状态调节用药剂量和时间,如Fludarabine可每周用1~3次;单克隆抗体(抗CD20抗体,美罗华)对难治的进展期慢淋或并发自身免疫性溶血性贫血或血小板减少性紫癜的老年患者剂量可以从100mg/d起应用。但有些治疗在老年患者应慎重,如静脉放血对老年有心、脑血管疾病的真性红细胞增多症者应慎重,每次不超过100~300ml,而放射性核素32P治疗适用于需经常放血、长期应用骨髓抑制药无效,以及肝肾功能尚好的老年患者等。老年骨髓瘤患者由于其骨髓耐受性差,化疗方案宜和缓,常用者MP方案、M2方案,难治性或复发MM者可选用硼替唑米联合方案、VAD方案、CBE方案或EADP,对老年人不能耐受较强化疗者也可用反应停100mg/d,地塞米松40mg/d×4d/月。在孤立性骨髓瘤手术切除肿瘤后、对症治疗、难治性病例可用放射治疗。
3.出血性疾病
一般来讲,老年人凝血缺陷治疗上与其他年龄组一致。紫癜可在伴有或不伴有血小板异常时发生,老年人最常见的紫癜是非血小板减少性紫癜包括老年性紫癜、维生素C缺乏性紫癜、高球蛋白血症性紫癜、药物性紫癜、感染性紫癜等。血小板减少性紫癜包括原发性(自身免疫性)血小板减少性紫癜和继发性血小板减少性紫癜,治疗原则同成人,但老年人发病常较隐匿,并且与其他疾病无明显关系,病程通常为慢性的和间歇性的,在血小板计数相同情况下,其出血严重程度明显高于年轻患者,大剂量维生素C、秋水仙碱以及氨苯砜治疗老年性ITP,单独应用氨苯砜剂量为75mg/d,用药前需排除G6PD缺乏症;老年人由于易患感染,常服用多种药物,肿瘤发生率高,因而继发性血小板减少较常见,治疗上主要针对原发病。其他如输血后紫癜、血小板功能障碍性疾病等在老年人也较常见。凝血机制障碍性疾病包括获得性因子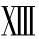 缺乏症、获得性纤维蛋白原缺乏症、获得性循环抗凝物质增多综合征(FⅧ的抑制物,FⅡ及FⅦ抑制物,FⅪ、FⅫ、F
缺乏症、获得性纤维蛋白原缺乏症、获得性循环抗凝物质增多综合征(FⅧ的抑制物,FⅡ及FⅦ抑制物,FⅪ、FⅫ、F 及纤维蛋白原、纤维蛋白稳定或纤维蛋白聚合抑制物,FⅤ抑制物)。由于老年患者的多病性,常与所伴随的免疫反应或免疫反应疾病如系统性红斑狼疮、类风湿关节炎、溃疡性结肠炎、支气管哮喘、恶性肿瘤、多形性红斑、药物反应等有关,治疗上同成人,应积极治疗原发病。
及纤维蛋白原、纤维蛋白稳定或纤维蛋白聚合抑制物,FⅤ抑制物)。由于老年患者的多病性,常与所伴随的免疫反应或免疫反应疾病如系统性红斑狼疮、类风湿关节炎、溃疡性结肠炎、支气管哮喘、恶性肿瘤、多形性红斑、药物反应等有关,治疗上同成人,应积极治疗原发病。













