易栓症(thrombophilia)是指易于发生血栓的一种高凝状态,即患者血栓形成(thrombosis)的易感性增加。易栓症患者通常存在遗传性(先天性)或获得性易栓危险因素,其中部分患者有临床血栓事件发生,有些患者可能只存在易栓危险因素,不一定发生血栓事件。
(一)遗传性易栓症
1.遗传性天然抗凝蛋白缺陷症
主要包括抗凝血酶(AT)、蛋白C(PC)和蛋白S(PS)的缺陷。首例遗传性AT缺陷症、PC缺陷症和PS缺陷症分别报道于1965年、1981年和1984年。这些天然抗凝蛋白缺陷的杂合子发生血栓的危险性比正常人高约10倍,其中以AT缺陷症的危险性最高。抗凝蛋白缺陷症的纯合子极为罕见,患者往往于出生后不久死于血栓形成。在高加索人群中,约10%的深静脉血栓患者存在某种天然抗凝蛋白的缺陷,以AT缺陷为主。不同人种中这3种蛋白缺陷的检出率以及与血栓的相关性存在差异。2006年,笔者通过对近3500名健康汉族人进行筛查,这3种抗凝蛋白活性缺乏的检出率约为4.5%,明显高于高加索人群(1%),但有趣的是,基因缺陷的检出率为0.43%,与高加索人群非常接近。尽管缺乏大规模流行病学调查结果的最终证实,天然抗凝抑制物的缺陷似乎是亚洲人种最常见的遗传性易栓因素。在汉族深静脉血栓患者中,天然抗凝蛋白缺陷的检出率高达50%,而且以PS缺陷为主,与日本、韩国、泰国等亚洲国家的报道相似。
2.遗传性凝血因子缺陷症
常见的有抗活化的蛋白C症(APC-R)和凝血酶原G20210A。APC-R主要是由于FⅤ基因的突变,生成凝血活性正常而对活化的蛋白C(APC)的降解作用不敏感的变异型FⅤ。变异型FⅤ不易被APC降解,故血浆中FⅤa水平升高,导致血栓危险性升高。最常见的APC-R基因缺陷为FⅤLeiden,占所有APC-R的90%。FⅤLeiden最初报道于1994年,是FⅤ基因第1691位的点突变(G→A),导致FⅤ蛋白分子第506位的精氨酸被谷氨酰胺取代,表现出APC-R。其杂合子者静脉血栓的危险性升高3~8倍,纯合子者升高50~80倍。FⅤLeiden是高加索人群中最常见的遗传性易栓缺陷,人群总检出率高达5%,个别欧洲地区的检出率可达15%,纯合子的检出率竟然达1/5000,在静脉血栓患者中的检出率平均为20%。相比之下,截至目前,FⅤLeiden在中国(汉族人群)、日本、韩国、泰国等亚洲国家的检出率几乎为零。是否亚洲人群中存在与APC-R相关的其他类型的FⅤ基因突变?1998年Williamsson等报道了与APC-R相关的一个新的FⅤ突变(精306-苏),命名为FⅤCambridge。其后,香港的一篇报道称43例中国血栓患者中有2例为FⅤCambridge,而40名健康对照者中也有1人存在FⅤCambridge,而在其他亚洲国家未见相应报道,因此,FⅤCambridge虽可导致APCR,但是否为血栓危险因素尚待证实。2010年,我们报道了1例遗传性APC-R伴深静脉血栓形成的家系,并发现该家系中的APC-R者均存在FⅤ基因G2172→C突变,而APC-R阴性者则否,但该突变是否与汉族人群APC-R有关以及是否为血栓危险因素也需进一步证实。
凝血酶原G20210A是凝血酶原第20210位的核苷酸发生突变(G→A),生成异常凝血酶原,1996年由荷兰的Poort等首先报道。与FⅤLeiden相同,凝血酶原G20210A突变在高加索人群中相当常见,检出率达2%~6%,而在亚洲各国人群中,除个别报道外,检出率几乎为零。凝血酶原G20210A携带者血栓危险性升高约3倍,在西方静脉血栓患者中,检出率约为6%。
具有高血栓倾向的遗传性凝血因子缺陷症还有异常纤维蛋白原血症。90%以上的异常纤维蛋白原是由于点突变所致,目前报道的突变类型已逾330种。大多异常纤维蛋白原血症的患者无症状,而有些类型的异常纤维蛋白原虽然形成的纤维蛋白与组织型纤溶酶原活化物(tPA)的结合正常,但纤维蛋白介导的纤溶酶原活化存在异常,导致高血栓倾向。有静脉血栓史的患者中先天性异常纤维蛋白原血症的检出率约为0.8%。目前还没有异常纤维蛋白原血症患者中确切的血栓发生率,估计高达10%~20%。但许多学者认为,异常纤维蛋白原血症的携带者大多在合并其他遗传性或获得性易栓症下才发生血栓。
因子Ⅻ在体内无启动凝血的生理作用,因子Ⅻ严重缺乏常因纤溶活性降低伴有血栓倾向,尤其是静脉血栓栓塞。
3.遗传性纤溶蛋白缺陷症
主要涉及纤溶酶原、组织型纤溶酶原活化物(tPA)和纤溶酶原活化物的抑制物(PAI)。纤溶酶原或tPA的缺陷可降低纤维蛋白溶解,致高血栓倾向。在有静脉血栓栓塞的患者中纤溶酶原缺陷的检出率达0.38%,几乎与抗凝血酶缺陷的检出率(0.47%)相当。但目前还没有遗传性tPA缺乏与血栓形成相关的确切证据。PAI与血栓的关系也存在争议。
4.血小板糖蛋白基因多态性
近几年来人们已认识到血小板糖蛋白基因多态性可能是高血栓倾向的遗传性危险因素。糖蛋白Ⅱb/Ⅲa(GPⅡb/Ⅲa)是血小板膜上的纤维蛋白原受体。如果GPⅢa基因第二个外显子的第1565位核苷酸发生T→C突变,使蛋白质第33位的亮氨酸变为脯氨酸,可引起GPⅡb/Ⅲa的构象改变,其结果是血小板的促凝活性增强,或血小板更容易被激活,导致高血栓倾向。但在总人群中,它似乎并非动脉血栓的重要危险因素,与冠心病的关系也很微弱。另外,血小板膜上的胶原受体GPⅠa/Ⅱa、整合素α2β1的多态性也可能与血栓相关。
5.血型
1969年Jick等首先报道ABO血型与静脉血栓形成有关,非O型者静脉血栓的危险性比O型者高2~4倍。非O型者vWF和FⅧ水平升高,可能与静脉血栓危险性升高有关。Leiden易栓症研究组(LETS)发现,以OO表型为参照,几乎所有非OO表型(包括A1A1,A1A2,A1O1/A1O2,BB/BO1/ BO2,A1B/A2B)的危险性均呈2倍升高。非OO表型者若同时为FⅤLeiden携带者,血栓危险性比单纯非OO表型者高23倍(95%CI 9.1~59.3)。
6.变异型亚甲基四氢叶酸还原酶
MTHFR 677T是亚甲基四氢叶酸还原酶(MTHFR)基因变异型的一种,该基因携带者常有轻度同型半胱氨酸水平升高。在高加索人群中,MTHFR 677T变异型很常见,纯合子携带者就占总人群的10%,但同型半胱氨酸水平仅轻微升高,因此,对血栓危险性的影响很难估测。一项荟萃分析表明,MTHFR 677TT表型者与MTHFR 677CC表型相比,静脉血栓的危险性升高20%。
7.脂蛋白a(Lpa)水平升高
Lpa水平升高不仅是成人静脉血栓栓塞的独立危险因素,也使儿童的血栓危险性升高7倍左右。Lpa可抑制纤溶酶原与细胞表面的结合,减少纤溶酶的生成,使凝块溶解受抑。它还灭活组织因子途径抑制物(TFPI),从而增强组织因子介导的凝血活性。
(二)获得性血栓危险因素
1.年龄
年龄是最大的获得性危险因素,老年人静脉血栓形成的危险性比儿童高近千倍。可能的原因包括老年人活动减少、肌张力减低、慢性病增多、静脉受损、凝血因子活性增高等。
2.手术和创伤
手术相关的静脉血栓形成在国内已开始引起重视。如不采取预防血栓的措施,手术相关的静脉血栓发生率可达50%,由于大多无症状或症状轻微,易被忽视。不同类型手术的静脉血栓发生率相差较大,以骨科和神经外科手术的发生率为最高。髋关节和膝关节矫形术的血栓发生率为30%~50%,即使在预防性抗凝治疗下,仍在1%~3%。腹部手术可达30%,妇科和泌尿科手术也有较高的静脉血栓危险。严重创伤,尤其是头部创伤、脊髓损伤、骨盆骨折、下肢骨折,静脉血栓形成的危险性曾经高达50%~60%。手术和外伤导致血栓形成的主要原因是组织因子的释放、血管内皮损伤及术后制动等。
3.长时间制动
在瘫痪、久病和术后卧床、管形石膏、长距离司乘旅行等情况下,由于通过肢体肌肉活动,促进静脉回流的功能受到影响,导致血流淤滞,易发生静脉血栓。1954年,英国希思罗机场的一项研究发现:机场到达大厅猝死的发生率远远高于出发大厅,首次报道了长时间飞行与静脉血栓形成可能有关。此后的研究发现飞行距离与静脉血栓形成的发生率呈正比,飞行距离超过10000公里者的发生率是飞行距离在2500公里以下者的50倍。后来,长时间飞行后易发生静脉血栓的现象被称为“经济舱综合征”。2002年WHO启动了一项名为WRIGHT(WHO Research into Global Hazards of Traval)的研究,内容包括旅行相关静脉血栓形成的危险因素、机制和预防。其研究之一的MEGA研究将1851例初次发生深静脉血栓形成的患者与相匹配的同等例数对照者进行比较,证实旅行相关者的血栓危险性增加了3倍,FⅤLeiden、肥胖和口服避孕药的患者危险性更大。有资料表明,少数具有血栓危险因素的人,在机舱内轻微低氧状态下,会出现凝血系统的活化。德国的另一项研究表明,在1000名飞行超过8小时的人中,无症状血栓的发生率为2.8%,对照者为1%。
4.恶性肿瘤
法国的Armand Trousseau教授于1865年首次报道静脉血栓与肿瘤之间存在联系。次年,他因肿瘤引起的深静脉血栓栓塞辞世。为纪念他,后人将他提出的肿瘤相关性血栓性静脉炎命名为Trousseau综合征。目前,Trousseau综合征的定义已拓展为与肿瘤相关的血栓栓塞并发症,包括了静脉血栓栓塞、肝静脉闭塞性疾病、脑血管意外、心肌梗死、周围动脉闭塞、血栓性血小板减少性紫癜/溶血尿毒症综合征、多脏器功能不全综合征及DIC等。
恶性肿瘤患者中静脉血栓形成的发生率高达3%~18%。瑞典曾有一项研究显示,19%的静脉血栓患者在诊断的同时发现有恶性肿瘤,另有5%的患者在静脉血栓事件后1年内发现恶性肿瘤。有些患者可于肿瘤确诊前数年反复发生静脉血栓或血栓性静脉炎。一般认为,在各种恶性肿瘤中,以腺癌更易引发血栓。恶性肿瘤引起静脉血栓的机制有多方面,包括肿瘤组织释放组织凝血活酶样物质、肿瘤机械性阻塞静脉、患病后活动减少、手术、放化疗等。
5.口服避孕药和激素替代疗法
口服避孕药(OCs)问世于1959年,但1961年即报道了因子宫内膜异位症口服避孕药而发生肺栓塞的首例病例,1962年报道了首例口服避孕药的患者发生缺血性卒中,1963年报道了首例心肌梗死。研究证明,OCs包括小剂量OCs,静脉血栓形成的危险性增加4~8倍。大多数OCs包含一种雌激素和一种孕激素。将雌激素炔雌醇的剂量从150μg减少到15~20μg似乎未降低危险性。孕激素成分亦有增加血栓形成的危险,第三代孕激素去氧孕烯(地索高诺酮)和15-去氧高诺酮反而比第二代孕激素左炔诺孕酮引起静脉血栓的危险高2倍。另外,含有醋酸环丙孕酮的OCs比含第三代孕激素的OCs引起血栓的危险性还要大。
由于担心单用雌激素会增加子宫内膜癌的发生率,目前激素替代疗法(HRT)通常联合应用一种雌激素和一种孕激素。最近不少研究经表明HRT可使静脉血栓的危险增加2~4倍,是否增加动脉血栓的危险性,各家的研究结果不一。
OCs和HRT可使FⅦ、FⅨ、FⅩ、Ⅻ和F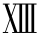 水平增加,多种抗凝蛋白水平降低,破坏了正常的止血平衡,从而导致血栓形成。
水平增加,多种抗凝蛋白水平降低,破坏了正常的止血平衡,从而导致血栓形成。
6.妊娠和产褥期
据估计,年龄小于35岁的妇女妊娠期间急性深静脉血栓的发生率为0.6/1000,年龄大于35岁者为1.2/1000,是同龄非妊娠妇女的10倍。有非妊娠期静脉血栓既往史或有静脉血栓家族史的妇女,妊娠期静脉血栓的危险性较高。但有趣的是,以往妊娠有过一次静脉血栓的妇女再次怀孕时静脉血栓的危险性并不高,尤其是初次血栓事件为一过性危险因素所致者。产褥期发生静脉血栓的危险性亦增加,且比妊娠期危险性更高。妊娠期下肢静脉回流障碍、多种凝血因子活性增高、活动减少等是易栓倾向的原因。遗传性易栓症的孕妇,血栓的危险性更高。例如,遗传性抗凝蛋白缺陷症的妇女,妊娠期或产后静脉血栓的危险性比正常妇女增加约8倍,FⅤLeiden的妇女其妊娠期或产褥期的血栓危险性为1/400~1/500。
7.抗磷脂抗体
抗磷脂抗体(APA)主要包括狼疮型抗凝物、抗心磷脂抗体和β2GP1。由抗磷脂抗体引起的一组相关的临床症候群称为抗磷脂抗体综合征(APS),是较常见的获得性易栓症。抗磷脂抗体可出现于系统性红斑狼疮等免疫系统疾病,系统性红斑狼疮患者抗磷脂抗体阳性率约为50%。抗磷脂抗体也可独立存在。抗磷脂抗体患者血栓形成的发生率30%~40%。血栓既可发生于动脉也可发生于静脉,但以静脉为主,占70%左右。抗磷脂抗体阳性患者发生静脉血栓的危险性比正常人高约10倍。在一些抗磷脂抗体阳性患者的血清中发现了针对PC、PS或凝血酶调节蛋白等抗凝蛋白的抗体,这也许能部分解释患者的易栓倾向。抗磷脂抗体还可能通过影响血小板活性、凝血或抗凝机制和血管内皮功能而诱发血栓形成。习惯性流产、胎死宫内、早产和胎儿发育迟缓是抗磷脂抗体相关的常见并发症。引起流产和死胎的机制可能是胎盘血管的血栓形成和胎盘梗死。在年龄小于45岁的急性心肌梗死患者中20%有抗磷脂抗体,且有明显的再梗死危险。50岁以下的脑动脉缺血事件患者中有40%左右有抗磷脂抗体。
8.肾病综合征(NS)
NS患者血液存在高凝状态已成共识,膜性肾病和微小病变是肾病综合征并发高凝状态最常见的病理类型。高凝状态与多种因素导致的凝血、抗凝和纤溶功能失衡有关。凝血功能亢进的表现以纤维蛋白原(Fbg)升高最为常见和明显,因子Ⅴ和Ⅷ的水平也有不同程度升高,常超过200%。长期应用肾上腺皮质激素和高脂血症可促进因子Ⅷ的活化。NS患者活动期血和尿中D-二聚体(D-Dimer)含量明显升高,体内补体系统活性增强,均提示凝血的活化。NS患者的抗凝活性常常降低,如血浆中AT水平降低、游离型PS缺乏。NS时常有血小板数量增高、黏附与聚集功能增强,纤溶活性多是减低的。以上改变均有助于血栓形成。NS患者血栓栓塞的发生率从6%到44%不等,静脉血栓较动脉血栓常见。
9.高凝血因子水平
凝血因子活性的正常水平范围较大,一般在50%~150%。凝血因子水平在90%普通人群水平之上视为高水平。高水平的凝血酶原、FⅧ、FⅨ、FⅪ以及高水平的凝血酶激活的纤溶抑制物(TAFI)可使静脉血栓的危险性增加2~3倍。高水平凝血因子的原因不详,但从家庭聚集现象和有些凝血因子随年龄增长而增长来看,可能为遗传性和获得性因素综合所致。
10.高同型半胱氨酸血症
在高加索人群中,同型半胱氨酸水平轻度升高者(>18μmol/L)占5%~10%,中国汉族人群中的情况与之相似,接近10%。升高的原因可以是前述的MTHFR 677T基因变异型,但大多是获得性因素所致,如叶酸或维生素B6或维生素B12摄入不足,胱硫醚β-合成酶缺乏者极为少见。
11.D-二聚体水平升高
最近认为血浆中D-二聚体水平持续升高是独立的静脉血栓栓塞危险因素。
在欧美国家,VTE的年发生率高达(1~1.5)/1 000人,发病率随年龄而增加。一旦患者发生过一次VTE,在停止抗凝治疗后易于复发,而且会造成慢性血栓后综合征、慢性肺动脉高压等并发症,影响患者生活质量。在我国,尽管缺乏准确的VTE流行病学资料,但有资料显示其发病率呈上升趋势。
易栓症一般分为遗传性易栓症(inherited thrombophilia)和获得性易栓症(acquired thrombophilia)两类(表1)。常见的遗传性易栓症有蛋白C(PC)缺陷症、蛋白S(PS)缺陷症、抗凝血酶(AT)缺陷症、因子V Leiden(FⅤLeiden)和凝血酶原G20210A突变等,是基因缺陷导致相应的蛋白数量减少和(或)质量异常所致,可通过基因分析和(或)蛋白活性水平测定发现。获得性易栓症有些是容易引发血栓的疾病,如抗磷脂综合征、肿瘤,还有一些则是易发生血栓的危险状态,如长时间制动、创伤、手术等。实际上,大多所谓的获得性易栓症似乎改称为获得性血栓危险因素或获得性易栓状态更为恰当。
表1 易栓症的分类

易栓症患者的血栓形成,既可表现为静脉血栓形成,也可表现为动脉血栓形成。其中以静脉血栓形成最为常见,也称为静脉血栓栓塞(venous thromboembolism,VTE),主要包括深静脉血栓形成(deep venous thrombosis,DVT)和肺栓塞(pulmonary embolism,PE)。DVT发生的部位,以下肢深静脉最为常见,也可发生于其他部位的深静脉。DVT(尤其近端DVT)发生后,如果不及时治疗,可进一步引起PE。PE是一种致命性疾病,有报道其致死率可高达30%。
(一)易栓症的治疗原则
1.预防血栓形成重于血栓治疗
如前所述,若仅存在一种血栓危险性相对较低的易栓症,无论是遗传性还是获得性,一般不引发血栓。因此,避免几种易栓症并存,主要是避免获得性血栓危险因素,对于预防血栓形成至关重要,如避免长期制动、肥胖、口服避孕药和绝经后激素替代疗法等。当获得性血栓危险因素不可避免时,或遇血栓危险性相对较高的获得性易栓状态时,如妊娠、外伤、血栓高危手术、具有血栓高风险的内科患者(如:肿瘤、APS)等,应酌情给予预防性抗凝治疗。
2.血栓治疗应区分轻重缓急
易栓症若发生VTE,急性期治疗的主要目的是控制DVT进展、防止发生PTE和纠正血流动力学异常。一旦疑诊VTE,只要无禁忌,不要等待确诊,应立即开始肝素抗凝治疗。有溶栓治疗指征的患者仅约10%,主要适用于急性静脉性坏疽和大块PTE伴血流动力学异常和低氧血症的患者,不宜滥用。溶栓治疗有时需在安置下腔静脉滤网后进行,以免血栓脱落引发新的PTE。有些下肢DVT的患者可在安置了下腔静脉滤网后进行导管引导下血栓内直接溶栓。有些情况下可考虑手术取栓。如果急性VTE有抗凝、溶栓的禁忌,应安置下腔静脉滤网,防止致死性PTE的发生。急性期后的治疗则以防止DVT和PTE复发和避免并发症为主。应坚持按预期抗凝强度和疗程进行抗凝治疗。静脉栓子不断脱落的髂静脉血栓和下肢深静脉血栓患者可考虑安置下腔静脉滤网,防止反复发生PTE。应避免血栓复发的各种诱因。DVT的主要远期并发症为静脉瓣功能损伤后患肢水肿和皮肤营养不良,应注意患肢养护。反复PTE的并发症主要为肺动脉高压和右心功能不全。
(二)VTE治疗的注意事项
1.抗凝药物的选择
由于口服抗凝药华法林起效慢,且给药后依赖维生素K的抗凝蛋白(PC和PS)水平首先降低,造成给药初期一过性高凝状态,可出现血栓栓塞加重的现象,尤其是PC和PS缺陷症的患者。故抗凝治疗一般首先采用未分组肝素(UFH)或低分子量肝素(LMWH),使用肝素数日后重叠使用华法林,待PT的国际正常化比值(INR)达到预期水平后停用肝素。利伐沙班(Rivaroxaban)是一种新型的因子Ⅹa抗凝药,几乎具备了抗凝药物应有的所有优点:不通过抗凝血酶直接抑制因子Ⅹa,而且不但抑制游离的因子Ⅹa,还抑制与纤维蛋白结合的因子Ⅹa;没有肝素诱导的血小板减少症(HIT)的风险;可以口服给药,且胃肠道吸收很少受食物和其他药物的影响;吸收快,给药后2~4小时血药浓度即可达到峰值;固定剂量,无需监测;出血风险相对较轻。因此,该药有望成为今后长期抗凝治疗的主流药物。
2.抗凝治疗的疗程和强度
易栓症患者第一次发生VTE,如果为一过性获得性因素(如手术、外伤等)所诱发,一般抗凝治疗3~12个月。一般情况下,若存在下述情况,血栓复发的危险性较高,如无禁忌证,应接受长疗程抗凝治疗,甚至终生抗凝治疗:①存在一种以上易栓缺陷;②遗传性抗凝蛋白缺陷;③获得性易栓危险因素持续存在(如肿瘤、抗磷脂综合征);④非常见部位血栓形成;⑤复发性血栓形成;⑥超声检查发现DVT持久残留;⑦D-二聚体水平或FⅧ水平持久升高;⑧安置了永久性下腔静脉滤网。
华法林的有效治疗范围较窄,强度稍高,出血并发症即增多,强度稍低,血栓复发的危险性便增高。目前主张的华法林口服抗凝标准强度为INR目标值2.0~3.0。对于无上述血栓复发危险因素者,也可考虑低强度(INR目标值1.5~2.0)华法林抗凝。如果在标准剂量下出现血栓复发,应加大华法林的抗凝强度(INR目标值>3.0)或换用其他注射或口服抗凝药物。
3.抗凝蛋白缺陷症患者的抗凝
肝素是通过增强抗凝血酶的抗凝活性起抗凝作用的。有些AT缺陷症的患者对肝素耐药,需用大剂量。肝素耐药的部分原因为用药数日后AT水平进一步减少,可减少约30%。AT浓缩物对克服肝素耐药有效。国内无AT制剂上市,遇肝素耐药时,可输注新鲜冰冻血浆,补充AT。已知或疑似遗传性PC或PS缺陷症的患者,口服抗凝需在完全肝素化下开始,华法林应以相对低剂量开始,逐渐加量。
4.肝素诱导的血小板减少症(HIT)
是使用肝素所引起的一种严重并发症。其发病机制是肝素与血小板因子4(PF4)结合成为免疫原,诱导产生抗肝素- PF4抗体,也称为HIT抗体。HIT抗体通过和血小板上的受体结合激活血小板,导致血小板释放凝血酶原微粒,消耗血小板,使血小板计数减少。释放的微粒激活凝血酶原,引发血栓形成或加重已有血栓的症状。使用肝素(包括UFH和LMWH)抗凝的患者,均应定期复查血小板。如出现血小板较少、血栓表现加重而怀疑HIT时应立即停用肝素,换用直接凝血酶抑制剂等药物抗凝。磺达肝癸钠是人工合成的间接Ⅹa因子抑制剂,仅含有增强抗凝血酶所需的戊糖结构,诱导HIT抗体的抗原性极低,有可能成为初始抗凝治疗的首选药物。
(三)特殊情况下的抗凝治疗
1.恶性肿瘤
一旦出现VTE,治疗往往较困难。一般不主张溶栓,因为有促进肿瘤转移的潜在可能。抗凝治疗的出血并发症高于非肿瘤患者,而且VTE复发率也较高。肿瘤患者予华法林治疗尤为困难,原因有多种:纳差和呕吐,使INR难以维持在治疗范围;慢性弥散性血管内凝血和广泛肝转移;华法林与化疗药或抗生素相互作用,影响抗凝效果;因血小板减少和有创操作(如胸腔穿刺和腹腔穿刺)而必须终止抗凝;需经常取血查INR,而肿瘤患者静脉穿刺往往有困难。因此,有条件者可采用长期LMWH抗凝治疗。与华法林相比,LMWH的优点为无需实验室监测,出血的危险性低,血栓复发率低。
临床试验表明,肿瘤患者发生VTE后长疗程抗凝的血栓复发率低于短疗程抗凝。目前提倡:只要肿瘤未控制或已转移,应持续给予抗凝治疗。病情稳定的肿瘤患者,至少抗凝6个月或直到化疗或激素替代疗法结束。
2.抗磷脂综合征
无症状的单纯抗磷脂抗体阳性患者一般无需特殊治疗,可观察或给予小剂量阿司匹林。当接受较大手术时,应预防性给予肝素抗凝。继发于SLE等自身免疫性疾病的抗磷脂抗体阳性患者采用激素等免疫抑制剂治疗,常可使抗体减少或消失,是否预防性抗凝治疗尚无定论。
抗磷脂综合征患者一旦发生血栓栓塞并发症,停止抗凝治疗后血栓复发率高,一般主张除非患者怀孕,应长期口服抗凝,如为动脉血栓,还应加用血小板聚集抑制剂。口服华法林时,狼疮型抗凝物的存在可能会给INR值的调整带来困难,应该密切注意出血并发症或血栓复发。
初次怀孕的抗磷脂抗体综合征妇女,如无血栓形成既往史,不一定行预防性抗凝。既往有过流产的抗磷脂抗体综合征妇女再次妊娠时可酌情持续给予UFH或LMWH,预防流产。
3.围术期
高危手术,例如全髋或全膝置换术,手术前后应接受预防性抗凝治疗。预防性抗凝可采用肝素,尤其是LMWH,一般抗凝至术后7~10天。但美国的一项回顾性多中心研究表明,19586例接受全髋和24059例接受全膝置换术的患者术后3个月内DVT或PTE的发生率分别为556例(2.8%)和508例(2.1%),其中出院后诊断血栓栓塞的患者在全髋置换术后占76%,在全膝置换术后占47%,提示出院后仍需继续抗凝。但也有研究提示对于大多全髋或全膝置换的患者,术后预防性肝素抗凝超过7天并无益处。
术前已采用华法林抗凝的患者,于术前4天停用华法林一般可使国际正常化比值(INR)在手术日降至1.5或更低。术前一直采用肝素抗凝者一般于手术前一天晚上或手术当日停用肝素,但术前采用LMWH抗凝的患者手术麻醉时需注意以下几点:①脊髓穿刺应在停用LMWH后18~24小时以上进行;②单剂给药脊髓麻醉优于持续硬膜外麻醉;③接受持续麻醉的患者,硬膜外导管宜留置过夜,次日拔除;④术后恢复使用LMWH应在导管拔除后至少2小时。应密切观察脊髓压迫的早期体征,如进行性下肢麻木或无力、肠道或膀胱功能障碍,对于怀疑脊髓血肿的患者,必须尽快行诊断性造影和手术治疗以避免永久性瘫痪。
4.妊娠和产褥期
虽然妊娠期和产褥期静脉血栓的危险性增加,但若无其他血栓高危因素无需预防性抗凝。既往无VTE史的孕妇,如果有AT缺乏,应积极进行血栓预防,而有其他血栓危险因素,如PC缺乏、PS缺乏等,可严密随访,或给予预防剂量的LWMH或小剂量UFH,并在分娩后给予治疗剂量的抗凝。既往有过VTE史的孕妇,原则上都应给予预防剂量至治疗剂量的肝素抗凝。
因为有其他获得性易栓危险因素或遗传性易栓症而接受抗凝治疗的妇女,若怀孕需注意以下问题:①华法林能通过胎盘,有致畸(华法林胚胎病)和引起胎儿出血的可能。华法林胚胎病特指因妊娠6~12周服用华法林引起的胎儿畸形,发生率可达6.4%。胎儿的特征性异常包括鼻发育不良和(或)骨骺点状钙化。因此,口服抗凝的妇女出现计划外妊娠应立即停用华法林,改用肝素。UFH或LMWH均不能通过胎盘,对胎儿是安全的。正在接受口服抗凝的妇女拟怀孕时,最好先改为肝素抗凝再受孕。②妊娠头3个月禁用华法林,妊娠的最后1个月也不宜使用,以防分娩时胎儿颅内出血和产妇出血过多。目前,一般推荐整个妊娠期间持续使用肝素,避免使用华法林。有研究表明,出生前接触过香豆素类的儿童可出现神经系统功能的轻微障碍,而且智商较低(IQ<80)。但妊娠期持续使用肝素,孕妇存在出血、肝素诱导的血小板减少症(HIT)和骨质疏松等问题,后者使骨折的危险性增加。LMWH比普通肝素引起HIT和骨质疏松的危险性低。③UFH和LMWH不会分泌入乳汁,产后使用是安全的。华法林不会给母乳喂养的婴儿带来抗凝作用,也可用于产后抗凝。
5.肾功能不全时LMWH的使用
LWMH主要从肾脏排泄,此时需减量。必要时应根据FⅩa活性调整剂量。
6.肥胖患者使用LMWH的注意事项
LMWH一般按体重计算剂量。但体重过重者,尤其是超过100kg者,仍按体重计算会出现剂量不足或过量,宜根据FⅩa活性调量。













