英文名称 :mantle cell lymphoma
套细胞淋巴瘤(mantle cell lymphoma,MCL)是1991年Raffeld等首次提出来的一种独特的非霍奇金淋巴瘤类型,过去曾将该肿瘤命名为中间淋巴细胞性淋巴瘤(Rappaport),中心细胞性淋巴瘤(Kiel),弥散小裂细胞淋巴瘤(WF)。目前认为MCL的肿瘤细胞来自初级滤泡的幼稚的前生发中心细胞或次级滤泡的套区淋巴细胞,由非典型小淋巴细胞组成,广泛围绕正常生发中心,套区增宽,因而将这类肿瘤命名为套细胞淋巴瘤。它不仅可以显示套区形式,也可呈结节状、弥漫性及母细胞化等特点。WHO(2001)淋巴造血肿瘤新分类将MCL列为一种具有独特的形态学、免疫表型、分子遗传学及临床特点的B细胞淋巴瘤。2015年修正的欧美淋巴瘤分类(REAL)和WHO将MCL归类为特殊类型的淋巴瘤,具有高度侵袭性。
MCL比较少见,占所有成人非霍奇金淋巴瘤发病率的3%~5%,多为老年发病,男性居多,男女比例为2∶1至4∶1,平均发病年龄为54~68岁 (范围:35~85岁),临床过程多为侵袭性,60%~70%的患者确诊时已为Ⅳ期 (Ann Arbor分期),一般为不可治愈的淋巴瘤,中位生存期约3~4年。
1.遗传学异常
在淋巴系统恶性肿瘤的发生发展过程中染色体的易位 (chromosomal trananslocations,CTs)是一种十分常见的细胞遗传学异常,这种易位导致了癌基因表达失控或异常融合基因的形成。在MCL中70~75%的病例在Ig重链与细胞周期蛋白D1(CyclinDl)基因之间存在t(11;14)(q13;q32)异位,该易位使CyclinDl与IgH基因位点相连,使BCL-1和CyclinDl基因表达失控,引起细胞周期性失调,相应地引起其编码产物CyclinDl的过度表达,98%的病例都存在CyclinDlmRNA及其蛋白质的过度表达,极少数CyclinDl阴性表达的MCL罕见病例中,已证实过表达细胞周期蛋白D2或D3。
目前为止对于Cyclin D1过度表达是如何促进MCL的发生,其机制仍不是很清楚,但在正常情况下,Cyclin Dl在淋巴细胞和髓细胞中不表达,而在MCL病例中高表达,提示其在MCL的发病中起重要作用。Cyclin Dl对细胞周期的调节具有重要作用,过度表达会引起Gl期的缩短,机制可能为Cyclin Dl与细胞蛋白周期依赖性激酶 (Cyclin Dl-dependent kinases,CDKs,主要是CDK4和CDK6)结合并使其活化,该复合物能使肿瘤抑制基因Rb发生磷酸化,而后者只有在非磷酸化状态时与转录因子E2F结合后,才能发挥其生长抑制作用。磷酸化的Rb与E2F解离并失去抑制功能,从而促使细胞快速由G1期进入S期。此外,c-myc和p53基因的丢失或突变与Cyclin D1的过度表达有协同作用。
2.免疫异常
包括长期服用免疫抑制性药物等一些免疫功能异常的患者其患病率较一般正常人高。
1.组织学
MCL的瘤细胞起源于初级滤泡的幼稚的前生发中心细胞或次级滤泡的套区淋巴细胞,淋巴结和结外器官均可受累,原发性结外MCL发病率仅为4%~15%,而原发性结内MCL累及结外者较为常见,有两种基本的细胞学类型:经典型MCL和母细胞型MCL。
(1)淋巴结内MCL
①经典型MCL:瘤细胞可呈套区型、结节型或弥漫型增生,或混合存在。套区型MCL可见淋巴结正常结构被破坏,瘤细胞围绕正常生发中心使套区明显增宽,细胞层次增多;结节型MCL可见瘤细胞侵入并取代生发中心,使生发中心消失,形成似滤泡性淋巴瘤的滤泡样结节;弥漫型MCL可见淋巴结由单一弥漫的小至中等大淋巴细胞取代,结节消失。在经典型MCL中,尽管各病例的细胞形态表现有所不同,但肿瘤细胞形态较单一,由小到中等大的细胞组成,瘤细胞稍大于正常淋巴细胞,核轻度不规则或表面不光滑,染色质致密,核仁不明显,胞质少。未见转化大细胞和浆样分化。瘤细胞间见散在分布的滤泡树突状细胞、组织细胞,这些组织细胞的形态有一定的特异性,胞浆丰富、粉染,一般不见吞噬的细胞碎片。
②母细胞型MCL:是更具有侵袭性的MCL的变异型,出现母细胞化后,可见淋巴结正常结构破坏,被单一弥漫的小到中等大小的肿瘤细胞所取代并可见灶性或片状肿瘤细胞,胞质较丰富,核增大,核膜清晰,有中小核仁,像中心母细胞,也可出现形态不规则的大的瘤细胞,染色质分散,见小核仁,核分裂像多,类似淋巴母细胞,但不会像浆母细胞样分化。经典型MCL中核分裂像不多见,但在母细胞型中数量显著增加。
(2)淋巴结外MCL
50%~80%的MCL伴有骨髓浸润,浸润的模式可为小结节型、间质或小梁旁,部分尚可见弥漫性浸润。脾、胃肠道、韦氏环、肝和中枢神经系统等均可累及。脾受累见于30%~60%的病例,并可呈MCL的唯一受累部位,患者常有脾肿大,多见于套区型,切面可见弥漫分布的小结节,镜下多表现为白髓受累,被异型肿瘤细胞增生浸润,有时尚可见残留的生发中心,但边缘区常消失,在小的白髓小结内也可见残留的薄层边缘区并见瘤细胞浸润。10%~20%病例可有胃肠道的累及,胃肠道累及的表现是淋巴瘤样息肉病,可发生在胃肠道任何部位,多见于大肠,其特征是肠内多发性小息肉,甚至小到肉眼难以辨认,镜下为肠黏膜下多发性小结节。肝受累也较常见,外周血有侵犯者肝窦内也常可见瘤细胞浸涧。
2.免疫表型
(1)B细胞标记:在冰冻、石蜡切片中瘤细胞的免疫组织化学染色表现为瘤细胞恒定表达的B细胞标记,几乎都有sIgM表达,sIgD也常阳性。此外,约20%的病例出现sIgM和sIgD同时阳性。免疫球蛋白轻链κ:λ比值倒置,与其他B细胞淋巴瘤相比,MCL的λ轻链的表达占优势,λ轻链单克隆性增生见于约60%的患者,但残留生发中心表现为多克隆性增生。肿瘤细胞可表达一系列的全B细胞标记,如:CD19、CD20、CD22和CD79a,但很少表达CD23,也有报道极少数母细胞型MCL病例CD23阳性。
(2)Cyclin D1的过度表达是MCL常见的特异性标记,它是Bcl-1/PRADl 1基因编码产物的单克隆抗体,正常淋巴组织一般是不会检测到Cyclin Dl的表达。
(3)CD5是MCL的另外一个特征性的免疫标记物,几乎所有的病例均表达,这与B细胞慢性淋巴细胞白血病/小淋巴细胞淋巴瘤 (CLL/SLL)相似,并可用于与滤泡性淋巴瘤相鉴别。
(4)其他T细胞标记:少数病例中瘤细胞可出现T细胞标记如CD43和Leu-8阳性,但其他T细胞标记通常为阴性。
(5)Ki-67:一般情况下,Ki-67标记在经典型的MCL中是低表达,而在母细胞变异型时则是高表达,某些具有典型形态学特征的病例也可有较高的Ki-67表达。
(6)其他:滤泡性淋巴瘤相关的两个抗原CD10和bcl-6在MCL为阴性。在某些MCL病例,流式细胞仪偶可检测到CD10的表达。
目前对于新诊断和复发的套细胞淋巴瘤仍没有标准的治疗方案,晚期MCL用现有的治疗方法是不可治愈的。部分肿瘤学家认为MCL的治疗可以参照小淋巴细胞性淋巴瘤/慢性淋巴细胞性白血病和滤泡性淋巴瘤的治疗原则,对于无症状的患者只进行观察即可(watch and wait)。Martin P等回顾性分析从1997—2007年间初治的MCL患者,多因素分析显示,治疗的早晚并不能预示总生存率,甚至观察组的生存率更优于早期治疗组,推断在无症状的晚期MCL患者中,“watch and wait”是可行的。但更多的学者认为侵袭性淋巴瘤的治疗方案能够改善MCL的转归,应及早开始治疗或高剂量治疗,但遗憾的是,目前没有一种方案能治愈这种疾病。
(一)常规剂量化疗
常规的单药化疗和联合化疗都不能起到长期控制疾病的作用。Press等总结了524例用COP(环磷酰胺、长春新碱、泼尼松)或CHOP(环磷酰胺、多柔比星、长春新碱、泼尼松)治疗MCL的病例,总有效率84%,完全缓解率46%,中位无进展时间(DFS)20个月,中位生存时间36个月。在SWOG的研究中,用CHOP方案治疗MCL,中位DFS 20.5个月,中位总生存时间36个月,十年的无病生存率预计只有6%。在两个EORTC多中心的随机试验中,把64例MCL分为低度恶性组和中度至高度组,前者用COP伴或不伴α干扰素治疗,后者用CHVmPVB(环磷酰胺、多柔比星、替尼泊苷、长春新碱、泼尼松、博来霉素)或ProMACE-MOPP(环磷酰胺、多柔比星、替尼泊苷、氮芥、丙卡巴肼、长春新碱、泼尼松)治疗,结果发现,与COP治疗方案相比,两个以多柔比星为基本药物的治疗方案并没有产生明显的生存优势。
氟达拉滨单药治疗MCL疗效一般,联合烷化剂或蒽环类药物可提高疗效,Decaudin D等报道用氟达拉滨+CTX治疗MCL,总有效率为63%,完全缓解率为30%,DFS 4.8个月,中位生存时间17.5个月。
克拉曲滨单药或联合利妥昔单抗在初治MCL亦显示出不错的疗效,在北中癌症治疗组的一项研究中,单药克拉曲滨治疗初治MCL的ORR和PFS分别为81%和14个月。在另一项回顾性研究中,克拉曲滨联合利妥昔单抗治疗初治的MCL的ORR为87%(CR/CRu 61%),中位PFS和OS分别为37.5个月和85个月。
(二)强烈化疗
美国安德森中心报道用Hyper-CVAD/M-A(环磷酰胺、多柔比星、长春新碱、地塞米松;大剂量甲氨蝶呤和阿糖胞苷)治疗45例初治或难治复发的MCL,完全缓解率38%,部分缓解率55.5%。
(三)免疫化疗
利妥昔单抗不仅可以通过抗体或者补体途径杀伤肿瘤细胞,诱导肿瘤细胞的凋亡,而且还能增强肿瘤细胞对细胞毒药物的敏感性,同时与细胞毒药物之间无重叠毒性。2002年报告的R-CHOP方案治疗MCL的Ⅱ期临床研究,其ORR为96%,CR为48%,中位无进展生存时间PFS为16.6个月。德国一项随机研究比较了6~8个疗程的RCHOP和CHOP方案治疗122例Ⅲ~Ⅳ的初治MCL患者,R-CHOP组和CHOP组的有效率分别为94%和75%(P=0.015),CR分别为34%和7%(P=0.000 24),治疗失败时间(TTF)分别为21个月和14个月(P=0.013),PFS和OS在两组并无明显差别,无生存收益,大部分患者在2年内死亡。Neelapu,Grant等采用剂量调整的EPOCH方案联合利妥昔单抗(DA-EPOCH-R)序贯抗独特性疫苗治疗初治MCL 25例患者,ORR100%,CR率92%,中位PFS为24个月,中位OS为104个月。从以上的几个研究可以看出,R-CHOP样方案对MCL的有效率和CR率比单用CHOP样方案都有明显的提高,但对延长MCL患者的生存时间和增大生存收益的效果有待更多研究证实。2007年Schulz的一项荟萃分析显示,R联合化疗能提高MCL患者的OS(HR=0.60;95%CI=0.37~0.98)。在一项Ⅱ期临床研究中,100例MCL患者采用RHyper-CVAD/M-A方案治疗6~8个周期,平均追踪时间40个月,在97例可评价的患者中,总有效率是97%,其中87%的患者达到了CR,3年无病生存率和3年总生存率分别为64%和82%;在亚组分析中≤65岁与>65岁组CR分别为89%和84%(P>0.05),但3年无失败存活率(FFS)和OS率分别为73%和50%及86%、74%(P>0.05),且>65岁组的不良反应发生率明显增高。这一方案虽然有更高的CR和更长的生存期,但化疗造成的血液系统不良反应明显增加,尤其在年龄>65岁的患者里表现得尤为突出,因此这个方案不适宜作为老年MCL患者的标准方案。此外,不断出现的复发提示即使经过高剂量的诱导化疗,仍有一部分患者存在微小残留灶,需要维持或者巩固治疗;该研究中位随访时间为40个月,FFS率、OS率曲线均未出现平台,提示R-Hyper-CVAD/M-A方案可能仍无法治愈MCL。但近期的研究提供了相对乐观的结论。M.D.Anderson癌症中心采用R-Hyper-CVAD/M-A治疗97例MCL患者,ORR为97%,5年无失败生存率为48%,OS率为65%,更令人鼓舞的是,具有母细胞样变型患者7年生存率达到47%,因此认为R-Hyper-CVAD/M-A可有效治疗MCL,但有显著的血液毒性。在其他相关研究中,29例复发或者化疗抗拒的MCL患者采用R-Hyper-CVAD/M-A方案治疗6-8周期,ORR为93%,中位随访期为40个月,中位无失败生存时间为11个月,认为该方案对复发或者化疗抗拒的MCL患者有效;尽管该研究中无一例死亡,但74%患者出现3~4度中性粒细胞减少症,63%出现血小板减少症。
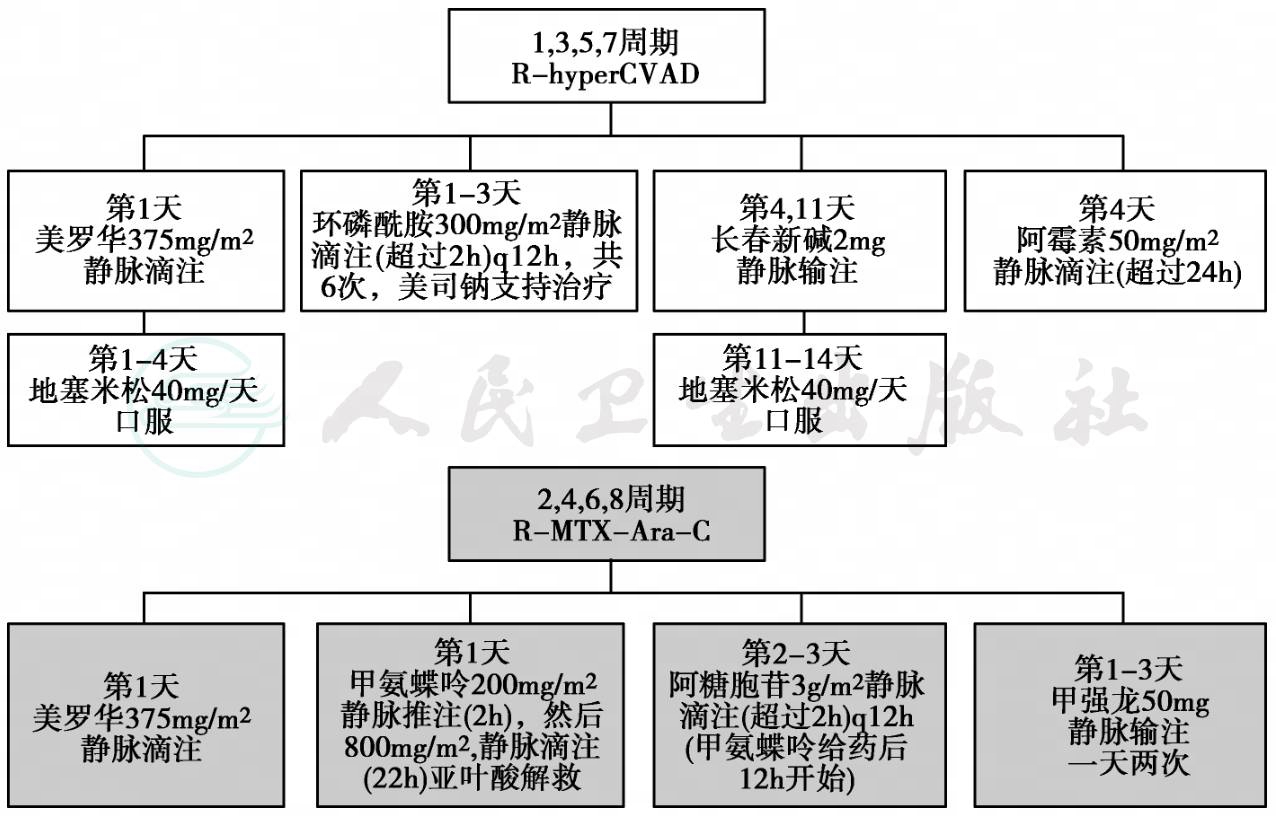
图1 R-Hyper-CVAD方案治疗套细胞淋巴瘤
上面2项研究虽然体现出R-Hyper-CVAD/M-A方案在MCL治疗中的优势,但其较严重的副作用限制了其在MCL患者中的广泛应用,有学者设计减剂量R-Hyper-CVAD方案,且并利妥昔维持治疗(每周一次连用4次,半年重复共享2年),此方案省略了甲氨蝶呤、阿糖胞苷及一半的长春新碱和地塞米松,结果22例患者ORR为85%,CR为70%,2年PFS为73%,尽管仍有明显的血液毒性作用,但为不能耐受R-Hyper-CVAD/M-A方案的患者提供了较好的治疗措施。
在另一项来自Delarue等的Ⅱ期研究中,对60例年轻晚期MCL患者采用3疗程R-CHOP序贯3疗程R-DHAP治疗后,有效的患者加自体干细胞移植巩固。R-CHOP后的总有效率93%,R-DHAP后的总有效率95%。中位无事件生存(EFS)83个月,中位OS没达到,5年OS为75%,优于此前未加R的研究结果(中位EFS为51个月),且无治疗相关的死亡,提示R联合含阿糖胞苷的化疗方案对MCL患者安全有效。
在Kluin-Nelemans等的一项研究中,对于年龄大于60岁不宜大剂量化疗的MCL随机采用R-CHOP或R-FC治疗,有效的患者序贯R或干扰素维持治疗直至进展,结果显示R-CHOP组ORR和中位OS均优于R-FC组(ORR 87%∶78%;OS 77个月∶43个月),且毒性反应低于R-FC组。提示对于老年初治套细胞淋巴瘤患者,RCHOP诱导方案优于R-FC。
在维持治疗方面,近年也有一些研究显示出不错的效果,高剂量化疗后利妥昔单抗作为巩固治疗的一种方式,其作用和效果也在积极地研究中。一项临床研究入组22例初治的MCL,经改良的Hyper-CVAD治疗后,予以利妥昔单抗维持治疗2年,ORR为77%,CR为64%,中位无进展生存时间PFS延长至37个月而毒性并未增加。德国低度恶性淋巴瘤研究小组发现,复发或难治性MCL患者经R+FCM治疗后,有效者再次随机分为利妥昔单抗维持组和对照组,维持组采用每4周的利妥昔单抗维持治疗3~9个月,结果显示维持治疗能够有效延长治疗反应时间。在随后的一项研究中,硼替佐米联合R-Hyper-CVAD方案治疗后序贯利妥昔单抗维持治疗30例初治MCL患者,中位随访42个月后,中位PFS和OS均未达到,3年PFS和OS分别为63%和86%。在另一项更大样本的Ⅱ期临床研究中(n=75),表明硼替佐米联合R-Hyper-CVAD方案ORR为95%,CR68%,44例患者诱导后采用利妥昔单抗维持治疗,3年PFS和OS分别为72%和88%。
IFN和IL-2在小样本的MCL试验中显示一定的疗效,大部分为回顾性研究,结果提示IFN和IL-2作为最初对治疗有效MCL患者的维持和巩固治疗可能具有一定疗效但缺乏足够的证据来推荐IFN和IL-2作为所有有效MCL患者的常规治疗。
(四)放疗和放射免疫治疗
MCL对放射治疗(radiation therapy,RT)较为敏感,通常用于对化疗耐药、不适合化疗或者免疫治疗以及早期的患者,总剂量在2000~2500cGy时即可见到肿瘤缩小,但放疗后通常大部分MCL患者出现复发或者广泛播散,因此长期缓解率低。一项回顾性分析显示,21例曾经接受过化疗的晚期或复发的MCL患者接受了局部区域放射治疗,结果显示局部ORR为100%,局部CR为64%,局部PR为36%,此研究仅表明了放疗可以提高局部控制率,但是否能改善长期生存率还需要更多的研究来证实。另一项研究表明,放射治疗能明显影响早期MCL患者的PFS,并能消除年龄对PFS的影响:26例初治MCL中,RT组11例单用局部放疗(IF-RT),4例联合化疗+IF-RT,2例单药化疗+IF-RT;非RT组2例单用联合化疗(CHOP方案),2例单药化疗(美法仑),结果5年PFS在RT组和非RT组分别为68%和11%,差异有统计学意义。全身照射(total body irradiation,TBI)在自体或异基因骨髓抑制诱导治疗的作用亦有研究。TBI是高剂量诱导治疗的重要部分,目前较少使用。
放射免疫治疗(radioimmunotherapy,RIT)是将放射性核素(131I和90Y)与抗CD20单克隆抗体结合后,选择性地将放射治疗集中于瘤细胞,在杀伤肿瘤细胞的同时减少对正常组织的放射损伤的一种治疗方法。美国MD Anderson癌症治疗中心报告了RIT作为Ⅱ期研究结果,15例曾经接受高剂量化疗或者干细胞移植失败的MCL患者,予以单药90Y-ibritumonab tiuxetan治疗,ORR率为33%,3例患者CR或者不确定完全缓解。托西莫单抗(tositumomab)是131I标记的CD20单抗,可对MCL进行局部照射,单用托西莫单抗(75cGy)ORR为83%,CR为50%,PR为33%。目前常用的研究方法是将RIT作为诱导、巩固治疗的一部分。托西莫单抗联合大剂量依托泊苷+CTX+Auto-SCT治疗复发或难治性MCL疗效颇佳:用法为托西莫单抗1.7mg/(kg·d)×1d,第11天依托泊苷(30~60mg/kg)+环磷酰胺(60~100mg/kg)+自体干细胞回输,结果显示没有治疗相关死亡,移植后CR和ORR分别为91%和100%,并有61%的患者取得了分子水平的缓解;移植后3年OS为93%,,PFS为61%。7例在HDT/ASCT后复发的患者应用大剂量131I-C2B2处理后行自体干细胞移植,结果6例患者存活时间超过3年,其中5例仍处于CR,其余2例分别在治疗后3个月、26个月时复发。虽然RIT治疗MCL取得了一些令人兴奋地结果,但目前尚处于临床试验中,同时因为同位素运输、贮存的困难,故RIT还未能作为常规治疗。
(五)造血干细胞移植
高剂量化疗联合造血干细胞移植作为MCL巩固治疗是关注的重点,已被广泛研究,越来越多的证据显示干细胞支持及移植物抗淋巴瘤(GVL)作用均有利治疗。
欧洲MCL联网组织的一项前瞻性随机对照临床试验显示,MCL患者经CHOP或CHOP类似方案化疗达到CR或者PR的随机分为ASCT巩固治疗组和干扰素维持治疗组,122例可评价疗效。两组CR率分别为81%∶37%,PR率为17%∶62%,中位PFS为39个月∶17个月,3年PFS分别为54%和25%(P=0.01),前者3年OS也高于后者(83%∶77%;P=0.01)。说明ASCT能提高MCL的生存。
2006年的ASCO会议上,Vose等报告了80例经过标准蒽环类方案或者Hyper-CVAD/MA(±利妥昔单抗)方案诱导化疗后达到CR或PR的患者,予以ASCT巩固治疗,Hyper-CVAD/MA组(32例)3年的PFS和OS达97%和78%,与标准的蒽环类诱导化疗相比有明显的差异,研究者认为在ASCT诱导化疗采用Hyper-CVAD/MA能改善MCL的长期无病生存率。最近有学者报告了类似的结果,Hyper-CVAD/MA+R方案诱导化疗加ASCT能明显改善MCL生存,13例患者经治疗后达CR的12例,3年无事件生存(event-free survival,EFS)率和OS均为92%。Maris等报道了氟达拉滨+全身照射预处理,33例患者中31例获得持续植入,ORR为85%、CR为75%和PR为10%,Kaplan-Meier几率分析,2年OS和DFS分别为65%和60%,2年复发和非复发病死率分别为9%和24%。
在Nordic MCL临床研究中,R联合剂量增强的CHOP(R-maxi-CHOP)与R联合大剂量阿糖胞苷(R-HDAra-c)交替应用治疗初治年轻MCL(≤65岁) (n=165),ORR和CR率分别为96%和54%。诱导治疗有效的患者进行HDT/ASCR(自体干细胞移植),6年PFS和OS分别为66%和70%。中位随访4年后无患者复发,继续随访超过6.5年时,中位EFS为7.4年,中位OS超过10年。
另一项来自欧洲MCL网络的大型Ⅲ期研究入组≤65岁MCL患者(n=391),随机分为两组,一组采用R-CHOP与R-DHAP交替治疗共6疗程,另一组采用R-CHOP治疗6疗程,有效的患者HDT/ASCR巩固治疗,两组CR率分别为39%和26%,中位TTF为未达到和49个月。HDT/ASCR后两组CR率类似(61%∶63%),但R-CHOP/R-DHAP组有更长的缓解期(84个月∶49个月)和更长的OS(未达到∶82个月,P=0.045)。提示诱导方案中含大剂量阿糖胞苷加上R-CHOP方案序贯HDT/ASCR可能带来生存获益。
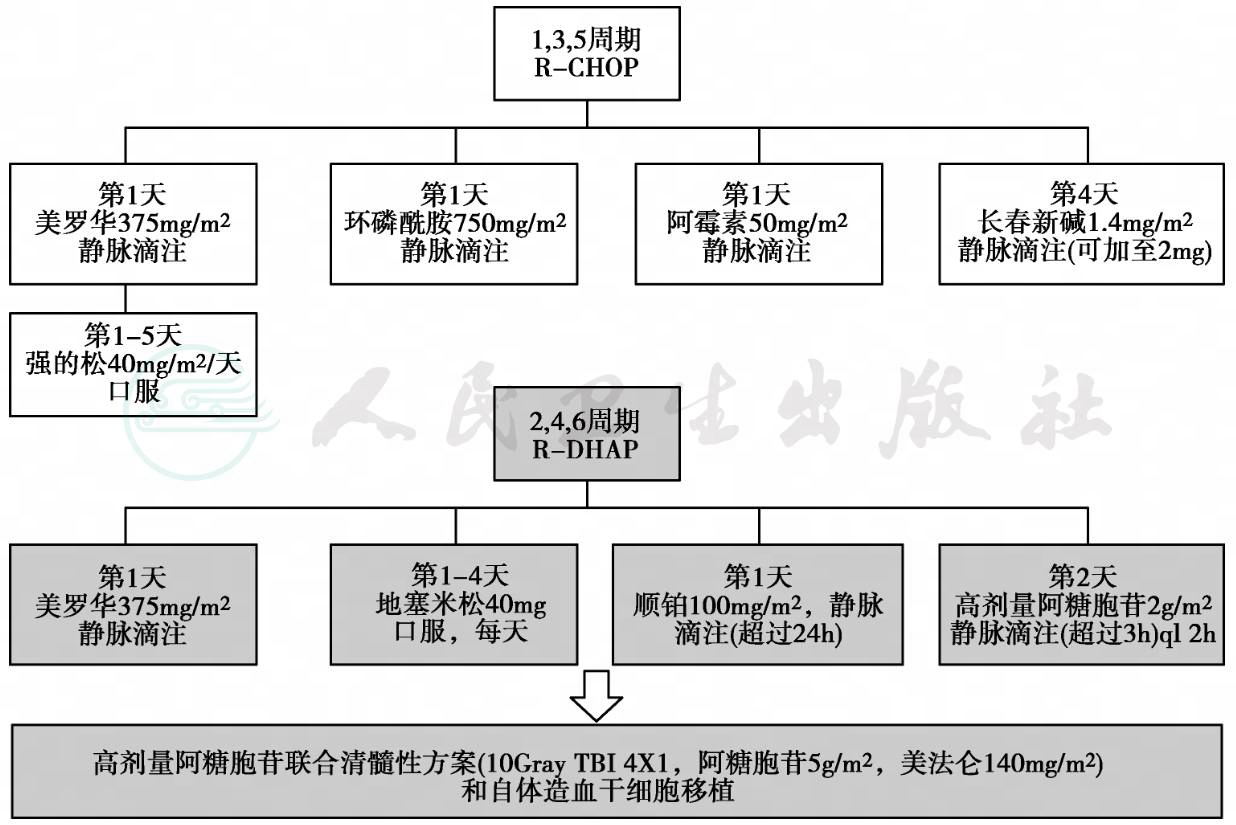
图2 R-CHOP/R-DHAP+高剂量阿糖胞苷治疗套细胞淋巴瘤
异基因造血干细胞移植(allogeneic haemopoietic stem cell transplantation,allo-HSCT,Allo-SCT)相关报道不多,但有其优势,它不存在采集物中瘤细胞污染的问题,而且可能具有潜在的移植物抗肿瘤作用(GVL)。有研究者曾比较了Auto-SCT和Allo-SCT治疗MCL的疗效,5年复发率分别为56%和21%,CR分别为73%和62%,中位随访时间为33个月,推断Auto-SCT治疗MCL复发率较高,究其原因,可能为大剂量化疗后未能清除的微量残留病灶所致。但另有研究报道50例MCl经干细胞移植(19例Allo-SCT,39例Auto-SCT),3年FFS为51%,EFS曲线在Allo-SCT组和Auto-SCT组无明显差异。
(六)MCL的新药治疗
1.蛋白酶体抑制剂——硼替佐米
目前硼替佐米单药治疗复发、难治性MCL的研究主要包括Goy等进行的5项研究,总有效率(ORR)为30%~50%,其中以PINNACLE研究规模最大,共纳入141例复发、难治性MCL患者,该研究是一项在美国、英国、德国等49个中心进行的Ⅱ期、前瞻、开放的单组临床试验,治疗方案是硼替佐米1.3mg/m2,第1,4,8,11天静脉推注;每21天为1个疗程,结果显示:总有效率(CR+CRu+PR)为33%,CR+CRu为8%;中位疾病进展时间(TTP)为6.2个月,有效患者或CR患者中位疗效持续时间分别为9.2和13.5个月,有效患者的OS率达94%。最近更新的结果报道显示,中位随访期63.7个月,总中位OS为23.5个月,1年OS率为69%;对于治疗有反应的患者,中位反应时间为9.2个月,中位OS为35.4个月,1年生存率为91%;不良事件少。硼替佐米与其他化疗药物具有协同性,且不增加毒性。硼替佐米+利妥昔单抗+地塞米松治疗复发难治性MCL的Ⅱ期临床试验(BORID)中,12例MCL患者被纳入该研究,结果显示CR3例(25%);PR6例(50%);SD1例,治疗期间发生的不良事件包括感染、周围神经性病变、疲乏(可控制);未出现严重的血液系统毒性反应。该研究结果表明,硼替佐米+利妥昔单抗+地塞米松对于复发MCL患者的疗效是有前景的,毒性反应易控制。法国GOELAMS研究小组的一项前瞻性研究表明硼替佐米可以作为老年MCL的一线治疗药物,39例65~80岁的初治MCL患者,采用RiPAD+C方案(利妥昔单抗375mg/m2,d1,硼替佐米1.3mg/m2,d1,4,8,11,多柔比星9mg/m2,civ,d1~4,地塞米松20mg/m2,d1~4,苯丁酸氮芥12mg/d,d20~29;35天重复),6个疗程后CR59%,ORR74%。
目前硼替佐米已被FDA批准用于治疗后复发的MCL,且已将其列入治疗复发和难治性MCL的快速跟踪计划(fast-track designation)。
2.免疫调节剂——来那度胺(lenalidomide)
来那度胺能干扰肿瘤血管生成及其微环境、增强NK细胞对肿瘤细胞的杀伤能力。是另一个治疗多发性骨髓瘤的药物被用于治疗MCL。虽然对其确切的作用机制知之甚少,但抗肿瘤作用已经在很多临床和基础试验中得到了证实,该药有一系列的抗血管生成及抗炎作用,这可能与细胞因子合成的变化有关。在NHL-002的亚组分析中,Habermann等应用来那度胺25mg治疗复发或难治的MCL15例,ORR为53%(CR 20%),中位PFS 6个月。在另一项NHL-003研究中亚组分析显示,单药来那度胺治疗54例MCL,ORR为43%(CR 17%)。该研究的更新数据显示单药治疗57例复发难治MCL的ORR为44%(CR/CRu 21%),PFS为9个月。来那度胺与Rituximab有较好的协同作用。
3.雷帕霉素(mTOR)衍生物——Temisirolimus,Everolimus
mTOR是一个丝苏氨酸激酶,在PI3K-AktmTOR信号通路中位于Akt的下游,控制着蛋白质的合成,血管新生和细胞周期的进程。mTOR抑制剂能够引起细胞周期阻滞,抑制肿瘤生长。Hess等采用雷帕霉素衍生物替西罗莫司(temisirolimus)单药治疗复发难治的MCL(n=162)的Ⅲ期临床研究分为三组,第一组temisirolimus 175mg/周连用3周后序贯temisirolimus 75mg/周;第二组temisirolimus 175mg/周连用3周后序贯temisirolimus 25mg/周;第三组由研究者自行从研究方案允许的治疗方案中选择。结果显示175/75-mg组的PFS显著优于研究者选择方案组(分别为4.8个月和1.9个月,P=0.0009),ORR同样优于研究者选择方案组(分别为22%和2%,P=0.0019),但OS无显著差异(12.8个月∶9.7个月,P=0.3519)。在另一项Ⅱ期研究(SAKK 36/06)中,Renner等用单药everolimus(RAD001)治疗复发难治的MCL 36例,结果耐受性良好,ORR 20%,中位随访6个月,中位PFS为5.5个月。目前应用较少
4.组蛋白去乙酰化酶抑制剂——SAHA
SAHA(suberoylanilide hydroxamic acid,vorinostat),是一种口服组蛋白去乙酰化酶抑制剂,可选择性诱导肿瘤细胞的分化和凋亡,在T细胞淋巴瘤治疗中显示了活性,与放疗及其他药物,如蒽环类抗生素、蛋白酶体抑制剂均有协同作用,对MCL的治疗作用正在研究中,近期研究显示SAHA能够显著下调Cycling D1。在临床研究方面目前数据不多,Ogura等的Ⅱ期研究中,单药vorinostat治疗4例复发难治的MCL,结果ORR为0。在另一项Ⅱ期临床研究中,vorinostat单药治疗复发难治的9例MCL,虽然1例患者稳定26个月,但ORR为0,中位PFS为5.9个月。
5.新的烷化剂——苯达莫司汀
苯达莫司汀是一种新的氮芥类烷化剂,与其他烷化剂不存在交叉耐药。一项苯达莫司汀联合米托蒽醌和R治疗复发或难治MCL的ORR89%,其中CR达35%。提示苯达莫司汀联合化疗可作为复发或难治MCL的治疗选择。另一项Ⅲ期多中心随机研究中,苯达莫司汀联合利妥昔单抗(BR)与RCHOP对比治疗初治惰性NHL和MCL,结果显示BR组PFS显著由于R-CHOP组(69.5个月∶31.2个月),且毒性反应小于R-CHOP组。
6.布鲁顿酪氨酸激酶(Bruton's tyrosine kinase,BTK)抑制剂——ibrutinib
ibrutinib是一种布鲁顿酪氨酸激酶(Bruton's tyrosine kinase,BTK)抑制剂。BTK与B细胞的信号通路相关,且在B细胞恶性疾病表现出明显的活性。Ⅱ期临床研究结果(n=115例)显示ibrutinib单药560mg持续治疗复发难治MCL直至进展,ORR68%,CR率21%,中位缓解时间17.5个月。中位PFS14个月,中位OS未达到。主要的3级毒性反应为中性粒细胞减少(11%),贫血(10%),肺炎(6%),腹泻(6%),疲劳(5%)和呼吸困难(5%)。基于这些数据,目前ibrutinib已被FDA快速批准用于既往至少接受过一个方案治疗的MCL,是现阶段值得持续关注的药场。
目前MCL的治疗还没有标准的治疗方案,治疗策略需要根据患者的年龄、危险分层和并发症情况制订。没有严重并发症的年轻患者一线应给予更强烈的化疗,R联合含HD-Ara-C方案诱导化疗缓解后行一线ASCT巩固。对于那些不适合行强烈化疗的患者也可以选择常规化疗(含蒽环,或苯达莫斯汀,或氟达拉滨加利妥昔单抗的方案)或调整剂量的R-Hyper-CVAD方案,但是,额外的巩固治疗(利妥昔单抗的维持,放射免疫治疗巩固)对维持这些患者缓解至关重要。对于惰性MCL,“观察与等待”优于立即治疗,化疗可选用R+苯丁酸氮芥方案。对于接受合适的一线治疗后复发的患者都可以考虑新药单用或联合常规化疗,其次可考虑行异基因造血干细胞移植。对于所有的患者,都可以考虑分子靶向治疗或新药的临床试验,可以是联合治疗或是序贯治疗。













