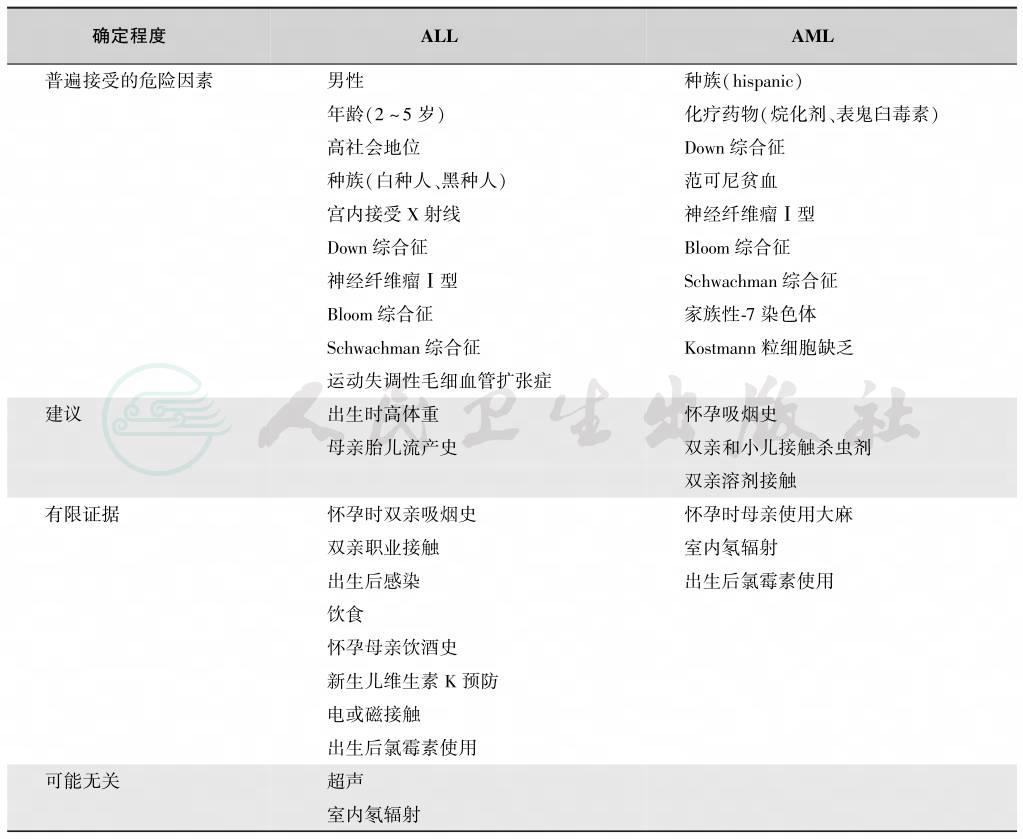
根据目前的认识,白血病的确切病因尚不明。本病尚不属于遗传性疾病,但在家族史中可有多发恶性肿瘤的情况。在大部分病例,遗传异常导致急性白血病主要是获得性的,而不是内在的。只有5%的白血病患者与内在遗传综合征有关。发病年龄以3~10岁为多见,美国儿童ALL发病年龄高峰为2~5岁,中国儿童ALL发病年龄高峰为3~9岁。男孩略多于女孩。本病病因未明,但与地域环境因素、电离辐射、化学接触、酗酒与吸烟以及与机体对某些病毒感染所致的特殊反应有关。此外,近年来通过微卫星不稳定、基因突变频率和一些易患生物标记研究发现,它可能是遗传学和环境因素共同作用的结果。儿童白血病致病的有关危险因素见表1。
表1 儿童白血病致病危险因素
对白血病病因的研究主要包括两个方面,与任何事物发生的缘由一样,即内因和外因,内因是发病的基础,外因是出发的条件。内因包括遗传因素、宿主内在的体质因素、免疫状态、营养状况等;外因涵盖外界环境的,如物理因素、化学因素、生物因素(感染)等。越来越明显的是上述各个方面的因素都是相互关联的,通常是各个因素互相作用,白血病是由多种因素引起的。每个病人的细胞类型各不相同。最近的研究表明,部分儿童白血病起源于胎儿时期,白血病相关基因的重排,或儿童白血病细胞免疫球蛋白重链基因存在于婴儿出血斑中。然而,白血病相关基因重排,比如TEL-AML1,对出血斑检出率要高于儿童白血病发病率。这表明了单纯的基因重排并不一定引起白血病,白血病的发生一定还有其他因素共同作用。
一、遗传因素
斯隆-凯特琳癌症中心(Memorial Sloan-Kettering Cancer Center)等处的研究者通过研究,首次揭示了和儿童白血病发病相关的一个风险基因突变。研究者Kenneth Offit表示,我们在未知领域中不断进行研究,如今这项研究发现给了我们一个新的窗口来理解引发儿童白血病的遗传因素,检测这种风险基因的突变就为我们在下一代中开发抑制白血病的疗法提供了很多希望和帮助。这种基因的突变最早是在凯特琳家族中发现的,该家族有很多不同代的成员都患有儿童急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL),后来在不同医院就诊的易于患白血病家族的个体中都发现了与前者家族一样的基因突变,研究者进行了一系列实验证实了这种突变会失去正常基因的功能,从而增加发展为ALL的风险。遗传性的基因突变一般位于基因PAX5上,该基因在一些B细胞癌症包括ALL的发病上扮演着重要的角色;而PAX5是一个调节许多基因活性的转录因子,其对于维持B细胞的功能至关重要;在研究者所研究的所有对象中,基因PAX5的拷贝都发生了缺失而引发了基因突变。研究者Offit希望将来的研究将可以确定ALL儿童中发生PAX5突变的概率,揭示PAX5基因的突变或可以帮助科学家开发靶向疗法来治疗其他非遗传形式的白血病(即PAX5基因突变也存在)。随后他表示,随着我们对引发癌症易感性或者诱发癌症产生的遗传元件的理解,我们将可以更精确地开发出靶向疗法来在第一时间有效地抑制癌症发生。
(一)家族遗传倾向
1876年,Hartenstein首次提出白血病发病的遗传因素,他观察到牛和母牛的淋巴细胞白血病,并认为它们之间是有遗传关联的。1931年,具有白血病/淋巴瘤高发病率的鼠的种族被发现,1935年发现近亲繁殖的种族淋巴细胞白血病发病率高达90%。外部的非遗传因素可能可以解释这种近亲繁殖有10%未发展成白血病。鼠类白血病的遗传基础所显示的证据可能可以推测到人类白血病家族遗传情况的研究。丹麦的Videbaek在1937年做了一项较大的研究报道了三户具有多发白血病病例的家族,并比较了白血病家族和健康家族,发现最大的不同是遗传因素。1957年,波士顿一项机构的研究却并不支持Videbaek的发现,但研究者认识到具有白血病多发病例的三个家族,有两个是与亲代同血亲的,提示在这些家族中可能存在隐性基因。尽管在1928年曾描述白血病在同胞中发生,但直到1964年MacMahon和Levy才揭示了白血病在同性别和单合子的同胞中具有很高的一致性。最近Ford等人的研究使用遗传标记显示了同胞之间的一致性可能与子宫内胎儿和胎儿之间的转移有关。上海交通大学医学院洪登礼教授在2008年的Science杂志上报道了在LSC方面的重要研究进展,并在国际上首先提出了前白血病干细胞(pre-leukemia stem cell,Pre-LSC)的概念,通过对同卵双胞胎进行分析被认为是研究白血病发生机制的最直接途径,白血病的二次打击学说认为遗传上的缺陷是造成白血病发生的第一次打击,对于同卵双生子而言,两者均具有相同的遗传背景,如果其中一个双胞胎已经发病,则通过共用胎盘可能会将前白血病克隆传递给另一个体,因而两者均经历了第一次打击,其发病与否是与第二次打击有关,这里的第二次打击是由于生后环境因素等诱发的新的遗传学方面的异常。他们选择一对4岁的同卵双胞胎女孩作为研究对象,其中一个在2岁时被诊断为TEL-AML1阳性的ALL,另一个仅携带有这种前白血病克隆而无明显的临床表现。研究发现:①双胞胎健康儿童和患儿的外周血中均存这样一群细胞CD34+/CD38-/CD19+;②根据CD10表达与否可以分为 CD10+和 CD10-两种,其中 CD10+/CD34+/CD38-/CD19+只存在于双胎中的患儿(LSC),而CD10-/CD34+/CD38-/CD19+在双胞胎中均可以见到(Pre-LSC);③LSC中TEL等位基因发生了缺失,而Pre-LSC中仍然存在野生型TEL等位基因。
除了家族发病率的增加和同胞之间发病的一致性,儿童白血病在染色体组成上的异常也在有家族背景的人群中增高进一步支持了遗传假说。1930年报道了唐氏综合征和急性淋巴细胞白血病的关系,后来1957年Krivit和Good揭示了具有这种21-三体染色体的儿童其白血病的发病率很高。在过去的40年中,发现儿童白血病和许多基因组成异常相关,包括原发性免疫缺陷病、染色体变异和遗传性肿瘤综合征。
1960年,Nowell和 Hungerford观察到 pH染色体与慢性髓细胞白血病的关系。1973年,Rowley发现了9;22号染色体易位。1982年发现人类同系的鼠类白血病9号染色体长臂上C-abl原癌基因易位至22号染色体长臂的断裂点集中区bcr形成BCR-ABL融合基因。同年,人类同系的鸟类白血病致癌基因(MYC)被证实8号染色体的易位能导致儿童B细胞淋巴瘤或白血病的发生。到20世纪80年代中期,有越来越一致的观点认为白血病是造血干细胞遗传的缺陷。更重要的是这种易位成为白血病基因/染色体重排的发病机制的研究模型。BCR-ABL融合基因编码的蛋白能增强酪氨酸激酶的活性,导致粒细胞异常转化和增殖。
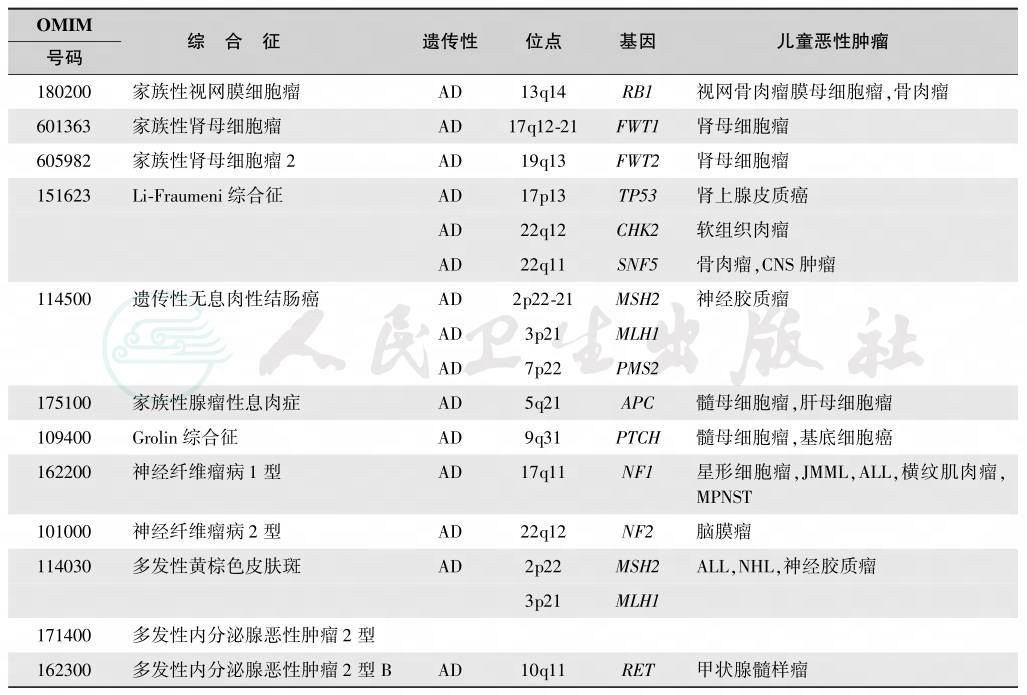
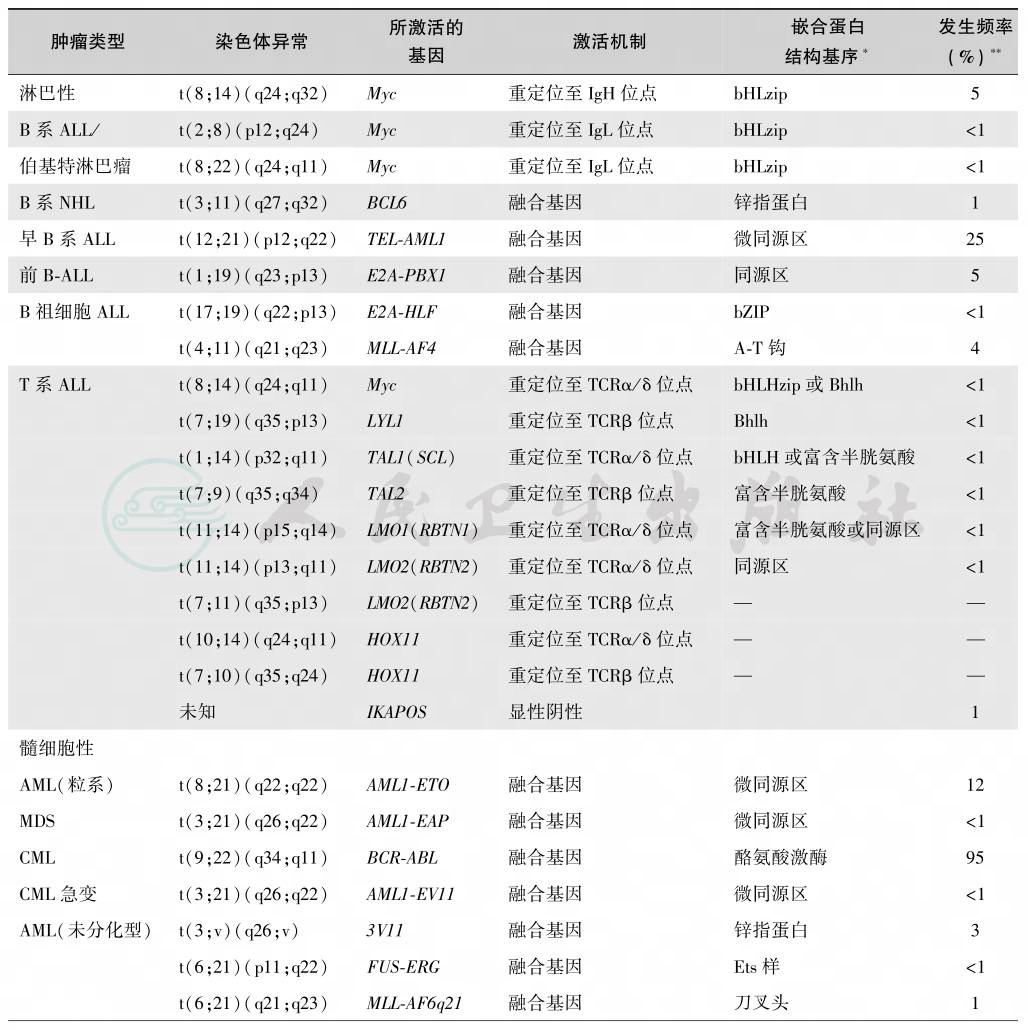
尽管大部分儿童白血病的发生机制尚未完全阐明,但一些原癌基因的突变的确与很多儿童恶性肿瘤相关,具体见表2。但遗传机制的建立,动物白血病原癌基因和致癌基因对人类白血病的作用,见表2。
表2 与儿童恶性肿瘤发生有关的家族性肿瘤综合征
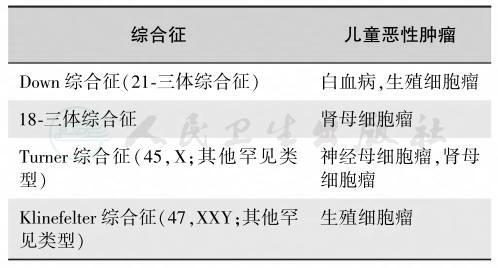
多种体细胞染色体异常与儿童恶性肿瘤有关,如表2所示。其中Down综合征占所有相关病例的绝大多数,Down综合征由于多出一条染色体21,而有可能诱发白血病。2%~3%的白血病患者有Down综合征。大多数研究发现与正常人群比较,Down综合征患者的白血病发生危险明显增加,其相对危险度约为20,并且年龄越小,危险性越大,0~4岁相对危险度为50,5~29岁相对危险度下降至10。另外,尽管病例数较少无法估计危险度大小,但许多证据表明Down综合征增加生殖细胞肿瘤发生危险。其他染色体异常如18-三体综合征、Turner综合征和Klinefelter综合征也发现增加了相关其他恶性肿瘤发生的危险,但仍需更多研究支持(表3)。与遗传因素关系密切的儿童肿瘤见表4,与儿童血液肿瘤发生密切相关的基因异常见表5。
表3 与儿童恶性肿瘤有关的多种体细胞染色体异常
引自:Charles A Stiller.Epidemiology and genetics of childhood cancer.Oncogene,2004,23:6429-6444
表4 与遗传因素关系密切的儿童肿瘤
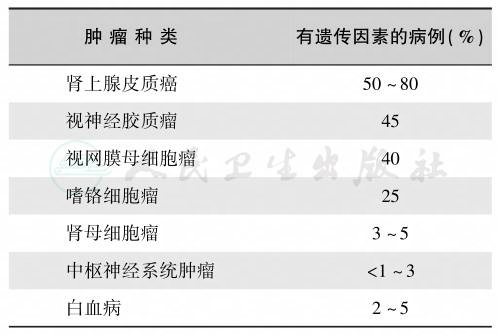
表5 与儿童血液肿瘤发生密切相关的基因异常
续表
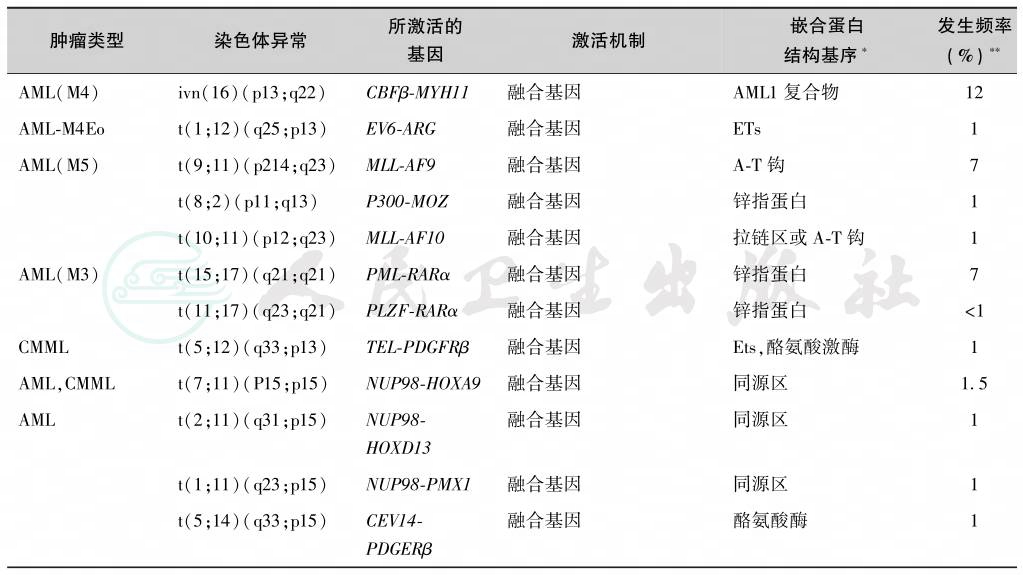
注:bHLHzip:碱性区/螺旋套螺旋/亮氨酸拉链结构域;bZIP:碱性区/亮氨酸拉链结构域;∗根据DNA与蛋白相互作用功能分析获得;∗∗该发生频率是根据各自分别占ALL或AML或CML病例的百分数
(二)免疫监管功能异常
不少先天性免疫缺陷综合征也有明显的儿童恶性肿瘤发病增高倾向,主要是淋巴瘤和白血病。但先天性免疫缺陷综合征较为罕见,只有0.1%的儿童恶性肿瘤与其有关。这些先天性免疫缺陷病包括Wiskott-Aldrich综合征、共济失调-毛细血管扩张症、重症联合免疫缺陷病、普通变异型免疫缺陷病、Duncan病等。其中共济失调-毛细血管扩张症最为明显,约10%患儿15岁前发生淋巴瘤或白血病。
单核苷酸多态性(single nucleotide polymorphism,SNP)或存在较不明显的DNA碱基或序列缺失、重复、染色体内易位等不易被当前常规检测方法所发现,这种变化或使患者免疫系统监视突变细胞的能力丧失而导致肿瘤的发生。
(三)父母年龄
研究报道父母亲任一方生育年龄越大,所生儿女发生ALL的危险越大,即使将Down综合征儿童排除在外,也得到同样结果。而母亲生育年龄较小与儿童白血病之间的关系则存在争议。表6为几个西方国家母亲年龄与儿童白血病分布之间的相互关系。
表6 儿童白血病和母亲年龄关系
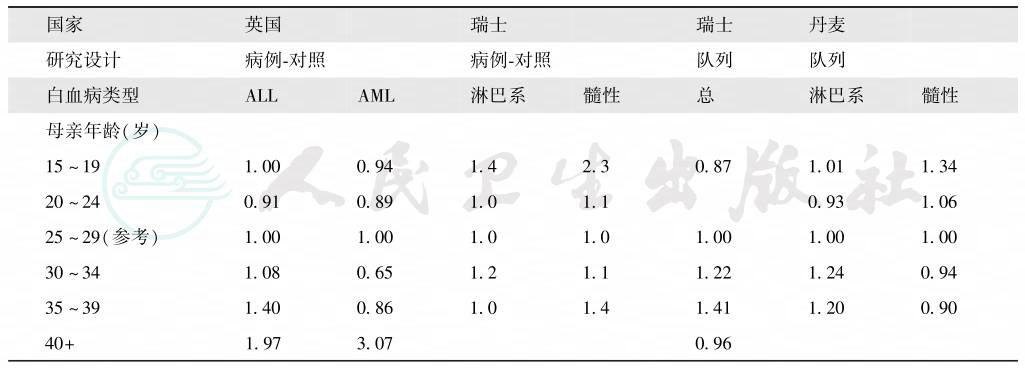
相对危险度:以25~29岁年龄组为基准
二、环境因素
(一)物理因素
尽管玛丽·居里接受的离子辐射有可能是导致她患白血病的病因,但直到1944年离子辐射对白血病的影响才被定量化。1952年,日本的研究发现暴露于原子弹轰炸地区儿童的急性白血病、淋巴瘤和骨髓瘤的发病率明显升高。Simpson等人报道了接受胸腺放射的儿童胸腺淋巴瘤、急性白血病及甲状腺癌的发病率升高。之后大量的研究发现出生以前或儿童时期暴露于放射诊断或放射治疗的儿童即使接受低剂量的放射线也能成为导致白血病发生的一个因素。最近的证据显示低剂量的射线可以导致造血干细胞逆转基因的不稳定,结果可造成不同的染色体异常,最终导致细胞分化的异常。
20世纪60~70年代人们做了许多努力来减少胎儿、新生儿和儿童时期暴露于离子辐射的机会,对于新生儿胸腺、皮藓、痤疮、良性肿瘤,甚至恶性疾病都减少了用放疗进行治疗。荧光方法被去除,医用放射设备的保护性进一步升级,放射诊断方法尤其是放射性核素方法减少或被超声诊断方法所替代。然而,由于原子核武器的持续存在,放射线仍然是白血病潜在的一个发病危险因素。
1.电离辐射和X线照射
电离辐射的致癌作用已被确定。早期应用放射治疗的儿童,也增加儿童患癌的危险。美国NCI最近有关儿童肿瘤研究也发现事故或放射治疗的高剂量电离辐射增加某些儿童恶性肿瘤的发生危险。孕期进行X线诊断性检查及父亲接受照射的儿童其肿瘤发生的危险性增加。目前孕期X线检查已绝大多数被超声检查取代,至今没有证据表明孕期超声检查与儿童恶性肿瘤有关。上海市肿瘤研究所曾进行的流行病学研究发现,孕期接受X线检查的母亲所生的子女患白血病的危险度会增高,而怀孕期超声检查与儿童恶性肿瘤发生无关,与其他人群中研究结果相一致。
环境中电离辐射也可能引起儿童恶性肿瘤,特别是白血病,但多项研究并没有发现核电站区域儿童白血病发病率升高。
2.非电离辐射
主要包括极低频电磁场和紫外线照射。自1979年Wertheimer等首次报道居住在高压电线周围的儿童白血病的发生率明显增加以来,人们对极低频电磁场(extremely low frequency electromagnetic fields,ELF-EMF)与儿童肿瘤的关系进行了大量的研究,但结果并不统一,甚至相反。多个病例对照研究资料综合分析结果显示频率为50~60Hz的电磁场暴露并没有增加儿童白血病的发生危险。
(二)化学因素
1928年,Delore和Borgomano报道了一例与苯中毒相关的急性白血病病例。之后大量的报道证实了苯能够导致骨髓发育不良及急性髓细胞白血病。最近我国发现了接触剂量与发生反应的量效关系。苯主要存在于吸烟的成人,而对儿童而言,电动车尾气、被动吸烟都是导致急性白血病潜在的危险。Smith发现苯的代谢产物酚能转化成醌,导致造血干细胞DNA双链的破坏,拓扑异构酶Ⅱ的抑制,有丝分裂纺锤体的破坏。
近年来,叶酸缺乏被认为与儿童急性白血病的发生有关。澳大利亚一项未经证实的病例控制研究认为保护性地对母体补充叶酸能降低儿童B-前体ALL发病的风险。无论在儿童还是成人,5,10-甲基还原酶基因多态性及酶活性的缺失可以减少一些类型ALL的发生。通过甲基转移的叶酸循环对嘌呤合成很重要,能抑制基因过早表达,并能使尿嘧啶转化成胸腺嘧啶。营养性叶酸缺乏损伤了甲基转运过程,有可能会导致急性白血病的发生。
从20世纪50年代开始对肿瘤进行化学治疗,到20世纪60~70年代广泛应用化疗进行抗肿瘤治疗,无论是对儿童还是成人,二次肿瘤如二次白血病的发生率都增高了。烷化剂药物的使用抑制拓扑异构酶Ⅱ,特别是依托泊苷和替尼泊苷被发现能通过MLL基因异常融合导致儿童急性白血病发生。这项观察与Smith对苯导致白血病发生的研究一致。最近的一项研究表明具有MLL融合基因的急性白血病患儿对抗苯醌中毒的酶功能降低。另外的研究揭示了白血病基因类型与母体暴露于烷化剂类药物的关系,数据显示无论是母体暴露于烷化剂类药物还是胎儿期基因的多态性都会导致儿童期白血病的发生。上海的研究发现服用氯霉素、合霉素会增加儿童患各种白血病的危险,发病率比对照组高2.4倍,并存在剂量-反应关系,而服用10天以上者可增加到10倍左右,鉴于明确的副作用,目前此类药物已很少应用。抗癌药物如环磷酰胺、白消安、亚硝脲等烷化剂可导致继发性白血病。
(三)环境污染
环境因素在肿瘤发病中起重要作用,包括物理因素、化学因素、生物因素等方面。但肯定的危险因素仍屈指可数,许多研究结果不一致,原因是儿童肿瘤较为少见,所研究的病例数少,以及判定儿童暴露水平较困难,特别是怀孕期甚至怀孕前这两个重要时期。
有关环境污染与儿童白血病关系的研究结果表明,儿童出生后生活在新油漆过的居室内发生ALL的危险性比对照组高,且随油漆房屋数量增加而升高。父母亲职业性暴露可能与儿童肿瘤发生有关,但以往研究结果缺乏一致性。“英国儿童肿瘤研究项目”的最近几项研究没有发现父母亲职业暴露增加儿童肿瘤发生的危险。
父母吸烟对儿童肿瘤的发病率影响也已引起广泛注意。美国NCI几项相关研究没有发现怀孕前母亲吸烟和儿童肿瘤发生有关,但父亲吸烟能够明显增加儿童患肿瘤的危险性,尤其是急性白血病和淋巴瘤,而且随着父亲吸烟量的增加,儿童发生ALL、淋巴瘤和所有肿瘤的危险性增加。同时,研究表明香烟中的致癌剂可以穿过胎盘屏障到达婴儿的肝脏,并可能诱导原癌基因或抑癌基因发生突变,且可以在新出生儿的尿液中检出与血红蛋白结合的香烟代谢产物。
(四)生物(感染)因素
当“白血”被认识时,曾经有一些观察认为这是严重感染的结果,但随着细胞显微镜技术的发展,发现白血病的白细胞和感染引起的白细胞完全不同。然而当时的兴趣仍然在感染病因上继续。1908年,Ellerman和Bang通过无细胞提取液感染家禽白血病,提出了病毒的问题,这是一项里程碑式的发现,打开了白血病病因病毒学研究的大门。1915年,Gross通过从白血病小鼠的无细胞提取液感染新出生的小鼠第一次证实了一种哺乳动物白血病病毒。接着,又有一些致白血病的病毒如致成人T细胞白血病病毒被单独从猫、牛、长臂猿和人类身上分离出来。所有这些都被证实是反转录病毒。这些单股的RNA病毒能产生DNA聚合酶和整合酶,这可以反转录RNA病毒基因组成DNA并能整合成细胞基因组。通过病毒产物能使细胞转染新生物。另外,还有两组大的疱疹DNA病毒与白血病相关:鸟类的Marek病毒与EB病毒,导致B细胞淋巴瘤/白血病。尽管EBV阳性和EBV阴性的B细胞淋巴瘤或白血病在基因重排和白血病假设机制中具有可比性,但病毒是否一定是致病因素仍然还须作进一步研究。
尽管对儿童白血病病毒的研究尚无最终结果,但仍有一些感染因素被证实对白血病发病有影响。然而,1917年Ward回顾了1457例急性白血病患者,得出的结论反驳了感染因素。1942年,Cooke从33个美国儿科中心收集了急性白血病患儿的信息,显示了年龄2~5岁是白血病的一个发病高峰,与麻疹和白喉的发病高峰相平行。他得出的结论是急性感染是导致儿童白血病的一个发病因素。1937年,英国Kellett也提出了感染假说。他提出,感染,尤其是播散性感染可能是致病的一个重要因素。与此同时,其他世界各地也有一些研究支持了感染假说,并发现较低收入家庭急性白血病的发病年龄更小,发病率更高。可以推测,这种情况和感染相关疾病如小儿脊髓灰质炎(小儿麻痹症)等相符,其中,过早的暴露和母体的免疫情况导致了疾病较早发生。Kinlen和他的同事描述了居住在农村附近的儿童急性白血病和非霍奇金淋巴瘤的发病率情况,他们发现较高的发病率与农村和郊区混合居住不适应相关,也许这可作为感染的证据。Greaves和他的助手更进一步完善了Kinlen的假说,他们的认识是建立在对儿童急性白血病生物学理论和国际流行病学数据的基础上。总之,儿童白血病感染作为致病因素目前仍然还是假说阶段。
因此,感染,特别是病毒,与某些儿童肿瘤发生有关。其中最典型的是与EB病毒有关的伯基特淋巴瘤(Burkitt lymphoma)、霍奇金病和鼻咽癌,与 T细胞淋巴瘤/白血病有关的人T细胞白血病病毒1型(HTLV-1),与乙肝病毒有关的肝癌,以及与HIV有关的卡波肉瘤,但这些肿瘤只占儿童肿瘤的一小部分。Burkitt淋巴瘤患儿的血清中可测到EB病毒抗体,其肿瘤细胞中也能找到该病毒的基因片段。除上述肿瘤外,有关病毒感染在儿童白血病病原学方面可能起的作用也引起了人们的关注。西方发达国家早期儿童ALL较不发达国家白血病的发病率高提示其可能与公共卫生状态有关的感染性物质有关。英国最近一项有关儿童肿瘤患者的大型研究发现富裕地区和偏远山区儿童恶性肿瘤发病率较高,富裕地区儿童发病率高提示生活在很干净环境中的儿童的免疫系统较弱;而偏远山区儿童发病率高则可能与可能致癌的病毒有关。
三、主要儿童恶性肿瘤的相关危险因素
尽管至今全世界已开展许多有关儿童肿瘤的病因学研究,但已知的危险因素仍然很有限,美国SEER列出了主要儿童恶性肿瘤明确的相关危险因素,如表7所示。其他许多怀疑的增加或降低儿童肿瘤发病的因素仍需进一步证实。
表7 主要儿童恶性肿瘤和已知危险因素列表
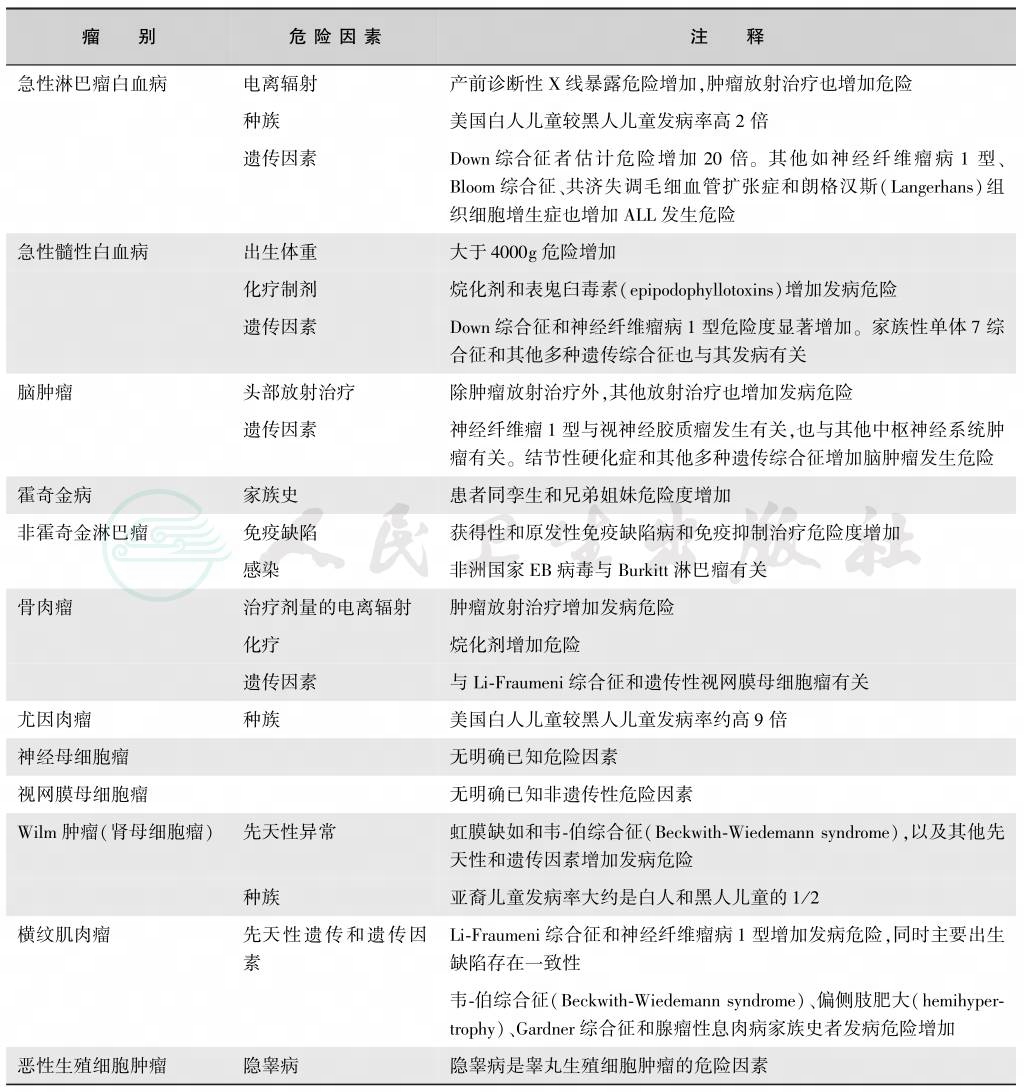
引自:Ries LAG,Smith MA,Gurney JG.Cancer incidence and survival among children and adolescents:United States,SEER program,1975-1995.National Cancer Institute,SEER Program.NIH Pub.No.99-4649.Bethesda MD,1999.
白血病(leukaemia)是儿童癌症中最常见的恶性疾病,约占所有癌症的30%。儿童白血病主要为急性白血病(acute leukaemia),约占95%,其中急性淋巴细胞性白血病(ALL)最常见,占75%~85%,而慢性白血病在儿童中较少见,低于5%。
15岁以下的儿童癌症中,约30%为白血病,其中急性白血病的发病率为每年3~4例/每十万名儿童。我国至今尚未建立国家级儿童肿瘤登记系统,因此确切儿童白血病发病率和每年新发病数据缺失,根据由上海市疾病预防控制中心发布的上海市恶性肿瘤报告(1986~1992年)0~14岁儿童白血病男性年发病率为36.2/100万,女性为24.3/年。
根据美国癌症流行病、终点监测登记系统(Survey of Epidemiology end Report,SEER)数据报告0~14岁儿童ALL年发病率为25.4/100万,AML年发病率为5.0/100万;而15~19岁年发病率分别为7.5/100万和4.3/100万。SEER数据提示,美国每年新增15岁以下儿童白血病5400例,其中4900例为ALL,急性髓系白血病(AML)500例。按中国人口是美国的4.5倍推算,我国每年新增15岁以下儿童ALL约为22000余例,AML2250例。图1为美国儿童(0~14岁)、青少年(15~19岁)各类癌症发病率,图2为ALL/AML发病率比及不同年龄发病率分布。
儿童白血病在男女中发病率有差异,0~14岁男性ALL发病率为43.6/100万,而女性为36.3/100万;但AML男女发病率差异较小,分别为8.3和7.4,见表8所示。
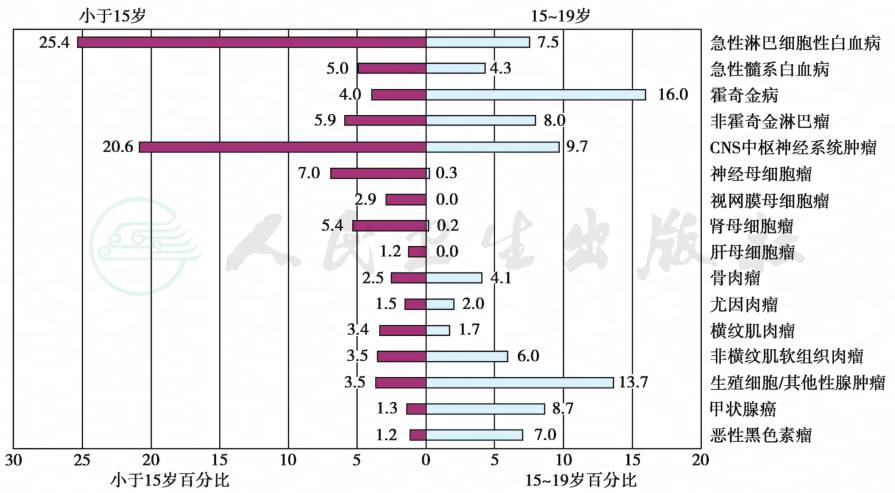
图1 美国SEER报告儿童与青少年各类癌症发病率
摘自:Philip A.Pizzo,David G.Poplack.Principle and practice of pediatric oncology,2016:2
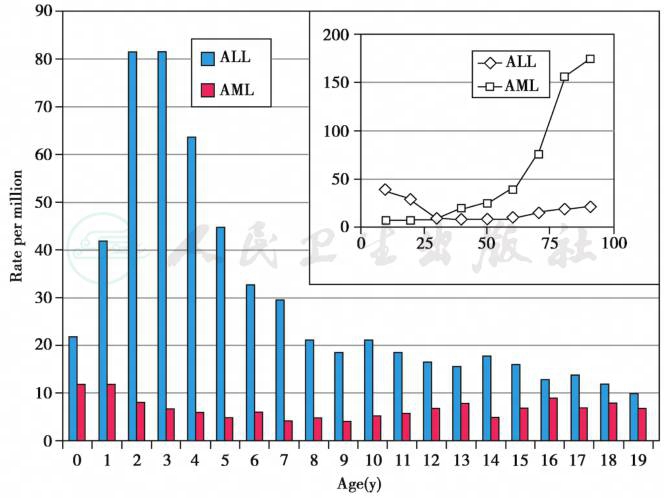
图2 美国SEER报告儿童ALL/AML不同年龄发病率及比例
摘自:Philip A.Pizzo,David G.Poplack.Principle and practice of pediatric oncology,2016:463
表8 儿童癌症发病率性别差异
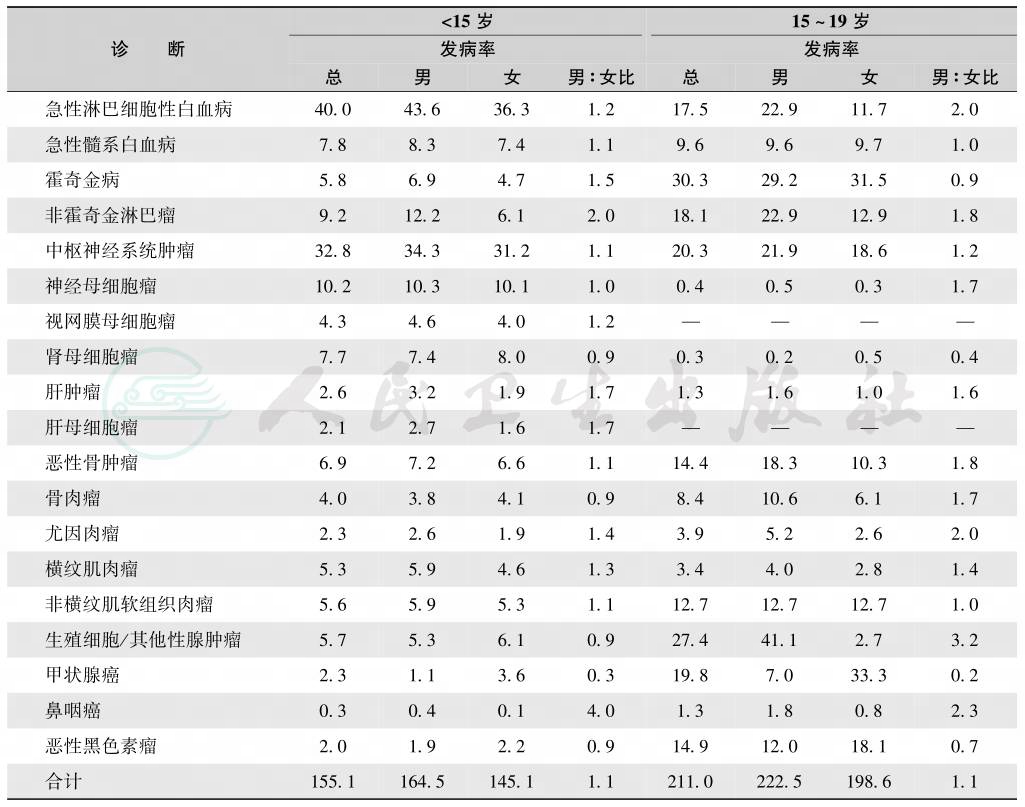
(摘自:Philip A.Pizzo,David G.Poplack.Principle and practice of pediatric oncology,2016:3)
根据SEER报告,儿童癌症总体的预后有随年龄增大而预后变差的倾向,但在白血病中不完全符合这一规律,小于1岁的婴幼儿ALL预后较大于1岁的学龄前和学龄期儿童差。但15岁以下的儿童ALL和AML预后均优于15~19岁的青少年。不同种族预后也有差别,美国亚裔ALL预后似优于其他族裔。图3为美国儿童不同癌症的5年生存状况,图4为美国不同民族ALL远期无事件生存(EFS)情况,我国由于没有健全的登记系统,因此缺乏远期EFS数据,如按国际标准统计,我国儿童白血病远期预后可能低于目前报告数据。
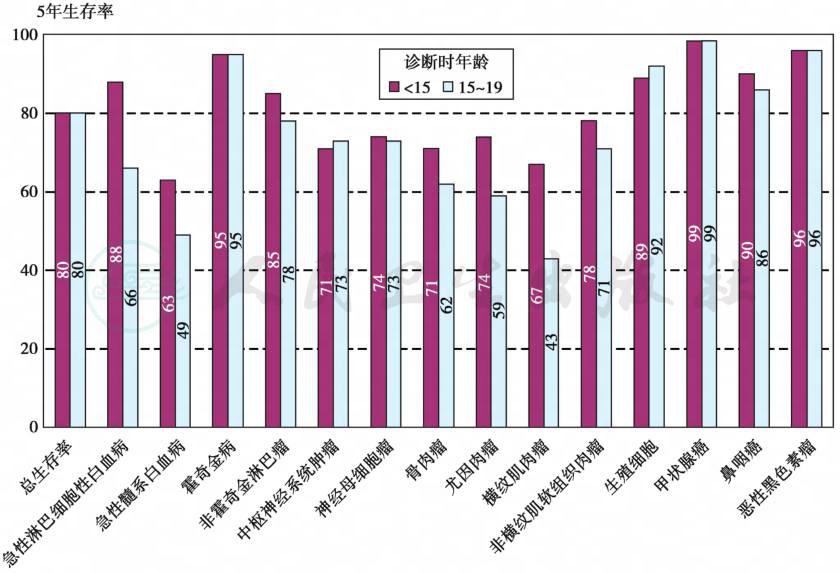
图3 SEER报告美国儿童不同癌症不同年龄组的5年生存状况
(摘自:Philip A.Pizzo,David G.Poplack.Principle and practice of pediatric oncology,2016:5)
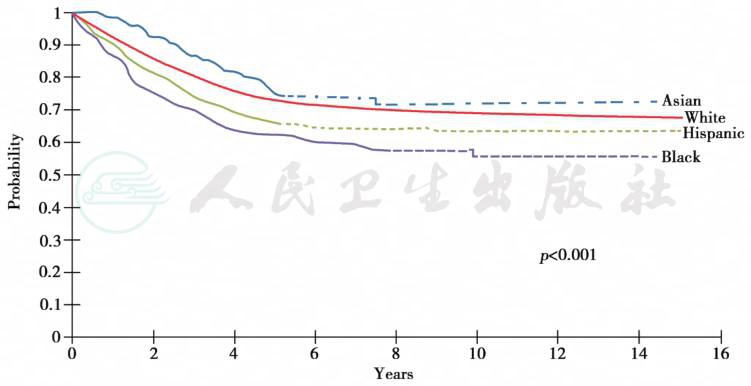
图4 美国儿童ALL不同族裔的5年生存状况
(摘自:Philip A.Pizzo,David G.Poplack.Principle and practice of pediatric oncology,2016:463)
白血病(leukemia)是一种起源于造血干祖细胞的恶性肿瘤,白血病细胞具有增殖和生存优势,可发生无控性的增生和积聚,影响骨髓的正常造血,在患者骨髓内可见大量特殊形态学表现的白血病细胞,例如异常颗粒增多的早幼粒细胞是急性早幼粒细胞白血病形态学诊断的主要依据,故而细胞形态学成为白血病诊断和分型的基础。
一、形态学检查
随着免疫学、细胞遗传学、分子遗传学、分子生物学等技术手段的不断发展,人们从不同角度对此类疾病的分类和界定也在不断完善,但是诸多血液系统恶性肿瘤和非恶性血液疾病的诊断仍离不开骨髓细胞形态学观察,通过光学显微镜进行细胞形态及细胞化学染色仍然是白血病诊断的基础方法。
形态诊断主要依赖于发病初期的骨髓和外周血涂片,按May-Grunwald-Giemsa或Wright-Giemsa常规染色,外周血和骨髓涂片分别计数分类200个和500个有核细胞,白血病细胞形态有时在外周血涂片更为典型,有助于诊断。白血病患者的骨髓增生活跃或者极度活跃,分类可见大量幼稚细胞,残余的正常造血成分较少。由于大量的白血病细胞积聚以及伴有骨髓纤维化或骨髓坏死,常常可导致常规骨髓穿刺取材不满意,这时需进行骨髓活检和骨髓免疫病理检查以明确诊断。细胞化学染色亦可增加诊断分型的客观性和正确率,细胞化学染色一般包括过氧化物酶(POX)、苏丹黑(SBB)、特异性酯酶(CE)、非特异性酯酶(AE)、碱性磷酸酶(ALP)和酸性磷酸酶(ACP)等。AE又包括中性酯酶(NAE)、酸性酯酶(ANAE)和丁酸酯酶(NBE),通常以α-醋酸萘酯为底物。
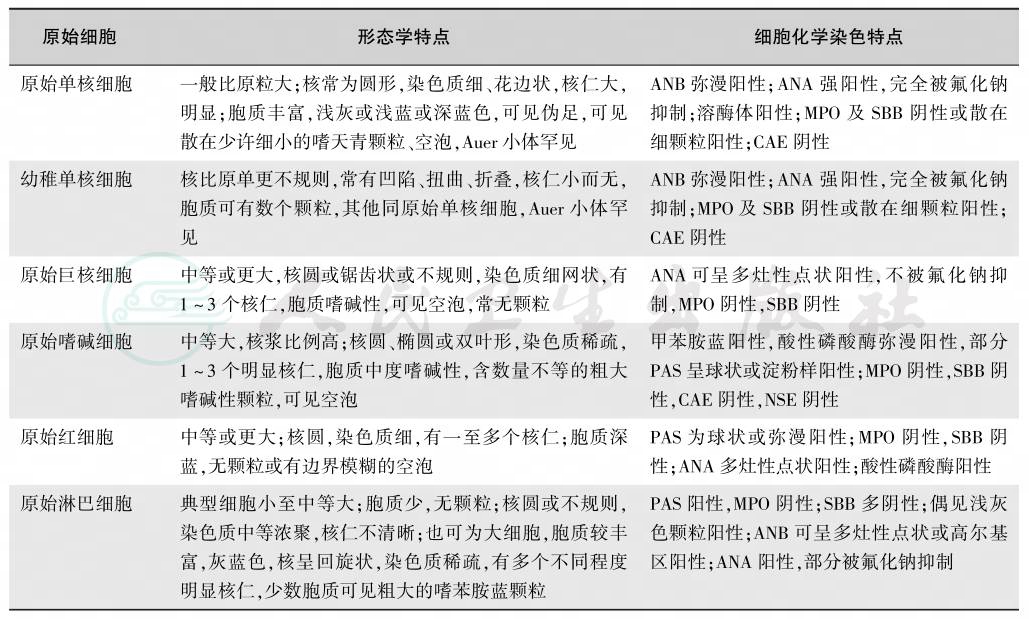
白血病细胞也就是所谓的恶性转化的原始细胞,是分化较早的髓系或淋系原始、幼稚细胞,包括原始粒细胞、异常早幼粒细胞、原始和幼稚单核细胞、原始巨核细胞、原始和幼稚淋巴细胞。除罕见的红系白血病外,原始细胞不包括原始红细胞,也不包括发育异常的成熟小巨核细胞。不同白血病原始细胞的形态及细胞化学染色特点见表9。
表9 不同白血病原始细胞的形态及细胞化学染色特点

续表
二、儿童白血病的分型体系
疾病的分型是其诊断、治疗及疗效判断的基础,应具有较好的重复性、准确性、实用性,这样才有助于选择最有效的治疗方案。白血病的诊断和分型主要依赖于白血病的形态学、免疫学、细胞遗传学和分子生物学特征,并据此判定白血病细胞的系列归属和分化阶段。
广义上,根据白血病细胞的成熟程度和自然病程可分为急性和慢性两大类,急性白血病(acute leukemia,AL)的细胞分化停滞于较早阶段,多为原始及早期幼稚细胞。急性白血病病情进展快,自然病程通常为数周或数月,而慢性白血病(chronic leukemia,CL)的细胞分化停滞于较成熟的幼稚细胞或成熟细胞,病情进展缓慢,生存期相对较长。另外,根据其受累细胞的免疫学来源,还可分为淋巴系、髓系和杂合(双表型或双克隆)白血病。
1976年,法-美-英三国专家组成了(French,American,British,FAB)白血病分型协作组,首先提出了AL的诊断分类标准并沿用至今。历经几十年,AL的诊断和分型渐趋完善,先是从最初的形态诊断逐渐过渡到结合形态、细胞免疫表型和遗传特征的MIC(M)诊断分型体系。2001年,世界卫生组织(WHO)又借鉴淋巴瘤REAL的分型原则,综合现已认知的各种疾病要素来精确定义疾病,制定了包括急性白血病在内的造血与淋巴组织恶性肿瘤新的诊断分型标准。经过数年的实践,在新的临床和实验研究证据的基础上,2008年WHO对此又做了重新修订,使这一开放性的诊断分型系统更为科学、客观地反映了疾病的本质。然而,无论是FAB分类原则还是造血和淋巴组织WHO分类标准,形态学总是占有很重要的地位,许多疾病所表现的特征性形态特点甚至是诊断依据之一,体现了白血病形态学的重要性和意义,儿童白血病的分型体系也沿用上述模式。
FAB协作组在1976年最初的AL的诊断分类标准中,将原始细胞≥30%作为AL的诊断界限。按细胞形态和细胞化学染色分为急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)和急性髓系白血病(acute myeloid leukemia,AML),其后随着骨髓增生异常综合征(myelodysplastic syndrome,MDS)的提出,为区分AML和MDS,1985年FAB协作组又对AML的分类标准作了修订,即按骨髓全部有核细胞(all nucleate cell,ANC)计数原始细胞百分比和非红系有核细胞(Non-erythroid cell,NEC)计数原始细胞百分比,确定在原始及幼稚红细胞≥50%,NEC的原始细胞≥30%时,即使ANC的原始细胞<30%亦应诊断AML-M6,以便与MDS相鉴别。NEC计数是指不包括浆细胞、淋巴细胞、组织细胞、巨噬细胞及有核红细胞的骨髓有核细胞计数。急性髓系白血病的诊断模式见图5。当骨髓有核细胞中原、幼淋巴细胞≥30%,即可诊断为急性淋巴细胞白血病。
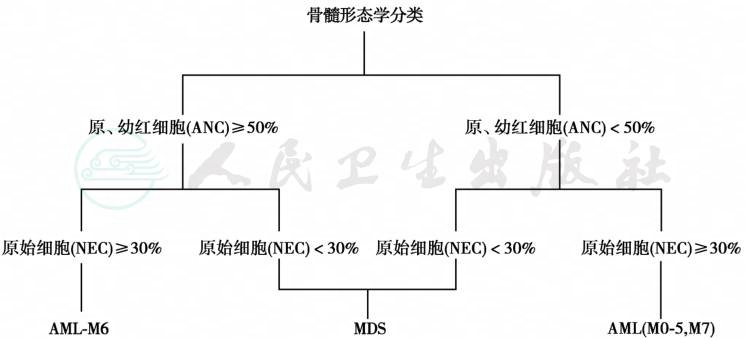
图5 急性髓系白血病的诊断模式
急性白血病的高度异质性客观上要求其诊断和分型时应综合考虑病因、发病机制、临床表现、细胞形态、免疫表型、遗传特征、治疗、预后等各种疾病要素。2001年发表的WHO诊断分型标准突出了细胞分子遗传学异常在疾病诊断分型中的作用,结合病史、形态、细胞化学和免疫表型来界定病种,并将AL的诊断标准重新做了调整。该标准确定外周血或骨髓中原始粒(或单核)细胞≥20%,即可诊断AML;若具有克隆性重现的细胞遗传学异常,即使原始细胞<20%,也应诊断AML;伴有多系病态造血的AML及治疗相关性AML和MDS,分别单独划分为独立亚类;诊断急性淋巴细胞白血病标准需满足骨髓中幼稚淋巴细胞>25%。2008年WHO再次修订将急性白血病分为AML及相关前体髓系肿瘤、前体淋巴肿瘤和系列未明的AL的三类,较前有了明显变化。
目前,ALL的诊断及疗效反应评价以WHO诊断急性淋巴细胞白血病(骨髓中原始幼稚淋巴细胞>25%)的条件为标准。
(一)儿童急性淋巴细胞白血病的形态学诊断
急性淋巴细胞白血病是单个淋巴前体细胞在某个发育阶段发生一次或者多次体细胞突变导致的恶性肿瘤,约占儿童急性白血病的75%~80%,是儿童时期常见的恶性疾病之一。随着科学技术手段的不断进步,儿童ALL在诊断分型上不断细化,其治疗渐趋分层化、个体化,临床疗效获得很大的提高,5年无事件生存率甚至可达到90%左右。
最初的FAB分型是依据细胞大小、核浆比例、核仁大小及数量、细胞质嗜碱程度等,辅以细胞化学染色将ALL分为L1、L2、L3三个亚型(表10),但除L3以外,这种分型不能说明白血病的系列归属和分化阶段,且与预后无关,故目前临床应用不大,ALL的细胞化学染色表现为POX、SB阴性,而过碘酸希夫反应大部分阳性,呈小珠状或团块状。
表10 急性淋巴细胞白血病各亚型(L1、L2、L3)细胞形态学特征

随着检测手段的迅速发展,人们对于白血病的生物学特点的认识在逐步加深,ALL诊断分型单纯依赖形态学远远无法解决其治疗上的要求,结合免疫分型、细胞遗传学、分子生物学、分子遗传学等特点的诊断标准,更具有客观性和准确性。1985年在比利时举行的第一届国际MIC(形态学、免疫学和细胞遗传学)组织分型会议上,制定了ALL的MIC分型标准,以及后期又进一步发展的MICM分型,为儿童ALL的预后判断、微小残留病检测及指导治疗提供了重要的依据。2000年WHO关于淋巴系统恶性肿瘤的分类有了较大变化,将ALL分为B淋巴母细胞白血病/淋巴瘤(B-ALL/LBL)和T淋巴母细胞白血病/淋巴瘤(T-ALL/LBL),而将ALL-L3命名为Burkitt淋巴瘤/白血病,归入成熟B细胞肿瘤。相对于FAB分型而言,WHO分型更加强调遗传学异常在疾病诊断中的价值,认为遗传学改变在预后因素中占有重要意义,因此,结合免疫学、遗传学等的分型系统更具科学性。
儿童ALL的细胞形态学特征如图6A,B,C,D所示。
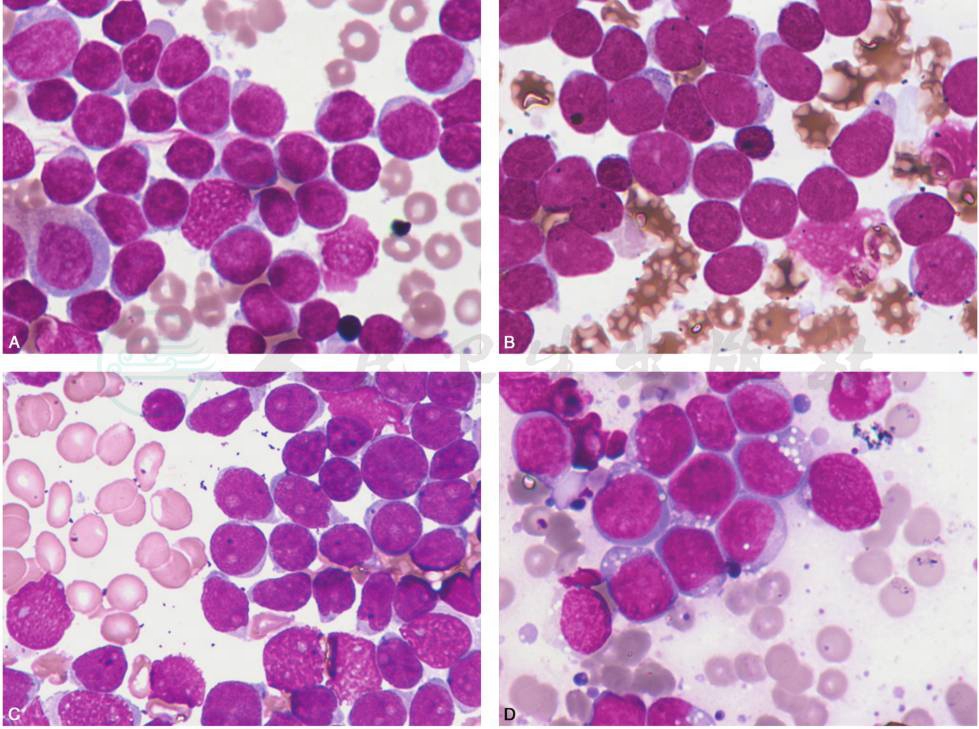
图6 急性淋巴细胞白血病
A.为ALL-L1,骨髓增生程度明显活跃或极度活跃,小原始淋巴细胞为主,胞核规则,偶有凹陷,核仁小或无,染色质均一,胞质量少,嗜碱性;B.为ALL-L2,骨髓增生程度明显活跃或极度活跃,原始淋巴细胞大小不一,胞核不规则,核仁清晰,核染色质细而分散或粗而浓集,结构较不一致,胞质量略多;C.形态学为ALL-L2,免疫表型为T细胞型,骨髓增生程度明显活跃或极度活跃,原始淋巴细胞大小不一,胞核不规则,核仁清晰,核染色质细而分散或粗而浓集,结构较不一致,胞质量略多;D.为ALL-L3,命名为Burkitt淋巴瘤/白血病,归入成熟B细胞肿瘤Burkitt淋巴瘤,多伴有MYC基因易位,原始淋巴细胞胞体较大,染色质细致,核仁明显,胞质量较多,泡沫状,深蓝色,空泡常明显,蜂窝状
(二)儿童急性髓系白血病形态学诊断
急性髓系白血病(acute myeloid leukemia,AML)是由外周血、骨髓或其他组织中髓系原始细胞克隆性增殖所致的疾病,它是一种在临床、形态学和遗传学方面存在异质性的一组疾病,可累及一系或全部髓系系别。在15岁以下儿童,AML占所有急性白血病的15%~20%,发病高峰期为出生后3~4年。
1.急性髓系白血病FAB分型标准(1985年修订及1991年增补)
(1)急性髓系白血病微分化型-M0
①骨髓中原始细胞≥90%(NEC),形态上呈原始细胞特征,胞质大多透亮或中度嗜碱,无嗜天青颗粒及Auer小体,核仁明显,类似ALL-L2。②组化:POX及SBB染色<3%。③免疫标志:髓系CD33及(或)CD13可阳性;淋系抗原阴性;可有 CD7、TdT阳性。④电镜MPO 阳性。⑤常伴有del(7q)、-7、del(5q)、-5染色体异常。
(2)急性粒细胞白血病未分化型-M1
骨髓原粒细胞(Ⅰ+Ⅱ型)(NEC)≥90%,早幼粒细胞很少,中幼粒细胞以下阶段不见或罕见,小于10%。组化:POX及SBB染色至少3%。
(3)急性粒细胞白血病部分分化型-M2
骨髓原粒细胞(Ⅰ+Ⅱ型)(NEC)占30%~90%,早幼粒细胞以下至中性分叶核粒细胞>10%,单核细胞<20%,原始细胞核染色质细腻,有1~2个核仁,胞质丰富,嗜碱性,有颗粒,部分可见颗粒聚集。
(4)急性早幼粒细胞白血病-M3
骨髓中以多颗粒的早幼粒细胞为主>30%。此类异常早幼粒细胞胞质中可见粗黑颗粒,常覆盖细胞核,核不规则,呈折叠或肾形,含束捆状Auer小体,MPO和SBB强阳性;但也有的异常早幼粒细胞胞质内以细颗粒为主,细胞呈双叶状或胞质呈肾型。
(5)急性粒单核细胞型白血病-M4
有下列多种情况:①骨髓中原始细胞(NEC)>30%,原粒细胞加早幼、中性中幼及其他中性粒细胞在30%~79%,不同成熟阶段的单核细胞>20%;②骨髓象如上述,外周血中单核细胞系(包括原始、幼稚及单核细胞)≥5×109/L;③外周血单核细胞系<5.0×109/L,而血清溶菌酶以及细胞化学支持单核细胞系的细胞有显著数量者;④骨髓象类似M2,而单核细胞系>20%,或血清溶菌酶超过正常(11.5±4)mg/L的3倍或尿溶菌酶超过正常(2.5mg/L)的3倍;⑤骨髓象类似M2,外周血单核细胞≥5×109/L时亦可划分为M4。
(6)急性粒单核细胞型白血病伴嗜酸细胞增多-M4Eo
除具有上述M4的各型特点外,骨髓中嗜酸性粒细胞(NEC)>5%,这些嗜酸性粒细胞较异常,除有典型的嗜酸颗粒外,还有大的嗜碱(不成熟)颗粒,还可有不分叶的核,细胞化学染色氯乙酸酯酶及PAS染色明显阳性。
(7)急性单核细胞白血病-M5
又分为两种亚型,①M5a(急性单核细胞白血病未分化型):骨髓原始单核细胞(NEC)≥80%;②M5b(急性单核细胞白血病分化型):骨髓原始单核细胞(NEC)<80%,其余为幼稚及成熟单核细胞等。
(8)红白血病-M6
骨髓(NEC)原始细胞(原粒细胞或原始单核细胞)≥30%,红细胞系≥50%。
(9)急性巨核细胞性白血病-M7
骨髓中原始+幼稚巨核细胞≥30%,如原始细胞呈未分化型,形态不能确定时,应做电镜血小板过氧化物酶检查,或用血小板膜糖蛋白单克隆抗体(CD41、CD61、CD42)以证明其为巨核细胞系。如骨髓干抽,有骨髓纤维化,则需骨髓活体组织检查,用免疫酶标技术证实有原巨核细胞增多。
注:国内将M2分为M2a和M2b,M2b形态学特点与t(8;21)M2一致,骨髓中原始及幼粒细胞增多,以异常的中性中幼粒细胞增生为主(>30%),具有明显核浆发育不平衡,胞质中多空泡,核凹陷处有团块状特异颗粒。
2.急性髓系白血病的细胞化学染色特点
急性髓系白血病的不同亚型其细胞化学染色特点不尽相同,原始细胞的POX、SBB、CE或AE染色阳性,单核细胞白血病的AE染色可被氟化钠抑制;POX和髓过氧化物酶(MPO)是鉴别AML和ALL的重要指标。原始细胞如POX或MPO阳性率≥3%可确定为AML,AML中POX和MPO的阳性率依次为M3>M2>M4>M5>M1;少数分化很差的髓系原始细胞POX和MPO染色可为阴性。SBB的意义与POX和MPO类似。CE是中性粒细胞标志酶,在M1、M2a和淋巴细胞一般阴性,但M3强阳性,通常将CE与POX/MPO和SBB联用鉴别AML和ALL。中性非特异性酯酶包括醋酸AS-D萘酚酯酶(NAS-DAE)染色和α染醋酸萘酚酯酶(α酸萘酚酯)染色。NAE主要分布在单核、淋巴和巨核细胞,粒细胞和有核红细胞为弱阳性或阴性。单核细胞NAE染色为弥散性阳性,且可被NaF抑制;淋巴细胞NAE为单个点状阳性颗粒,常位于细胞核旁;粒系AML细胞NAE也强阳性,在M3反应强度和积分高于M4和M5,但粒细胞NAE阳性反应不被NaF抑制。细胞内的氯乙酸AS-D萘酚酯酶(NAS-DCE)几乎仅出现在粒细胞,其特异性高,因此又称为特异性酯酶,在M3中表现为强阳性,而在原始及幼稚单核细胞则呈阴性。ANAE正常主要见于T细胞、单核细胞和巨核细胞,而在B细胞、粒细胞和有核红细胞含量较少,主要用于ALL与 AML鉴别和从ALL中区分出T-ALL。NBE是单核细胞标志酶,在单核细胞反应最强,淋巴细胞和巨核细胞仅为弱阳性或阴性,粒细胞为阴性;主要用于将M4、M5与M3区分开来。N-ALP在晚幼粒和成熟粒细胞含量最高,而原始粒细胞和其他血细胞为阴性。类白血病反应时ALP显著增高,而急性粒细胞白血病和CML时减低。ACP在AML中反应强度要高于ALL,以M4较强。在AML中ACP阳性物质为弥散状分布,而ALL为局灶分布。过碘酸-希夫(PAS)染色又称糖原染色,可显示细胞内糖原,在原始淋巴细胞多为粗颗粒或珠状阳性,原始粒细胞和单核细胞多为细颗粒弥散状阳性;红白血病时有核红细胞多呈阳性反应,有助于红白血病的诊断。各型急性髓系白血病细胞化学染色特点见表11。
表11 急性髓系白血病细胞化学染色特点
3.急性髓系白血病WHO分类标准
WHO分类的目标是将临床、形态学和细胞遗传学相结合,引入了对某些疾病的新的界定标准以及一些新的独立的疾病实体,在AML的诊断流程中,原有的形态学诊断仍然保留,但是在此基础上增加了重现性遗传学异常的疾病亚类,从而更能体现AML的疾病异质性,优化疾病分层,获得更有效的治疗。同时将NPM1与CEBPA突变等遗传学改变加入疾病亚类中,作为“暂定疾病实体”,表明还需要更多的研究和探索来证实这一分型的意义。表12为WHO AML及相关髓系肿瘤分类。
表12 2008年修订的WHO AML及相关髓系肿瘤分类

4.儿童急性髓系白血病的骨髓形态学特点
无论哪一种分型标准,其目的在于总结某一疾病的群体生物学特性,白血病的细胞形态学发展至今,每种亚型已经形成了一些各自的独有特征,通过细胞形态学可以实现快速、早期诊断,争取治疗时机,提高疾病的整体疗效,如APL。在此我们从WHO分类来逐一认识它们。
伴有重现性细胞遗传学异常的儿童急性髓系白血病的形态学特点:
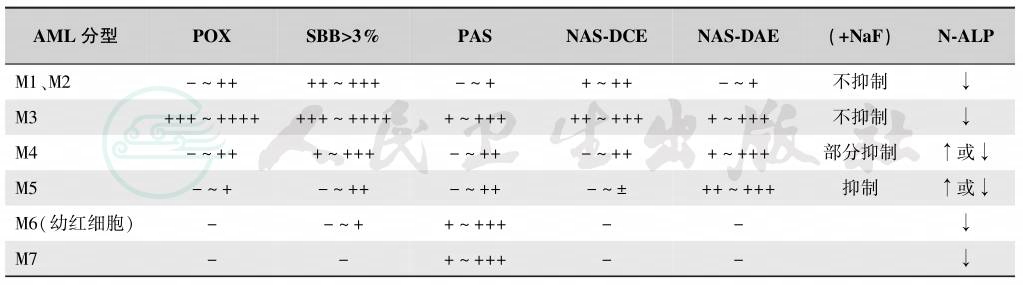
(1)AML 伴 t(8;21) (q22;q22),(AML1-ETO):是儿童急性髓系白血病常见的重现性遗传学异常之一。在FAB分型中,急性粒细胞白血病部分分化型-M2。国内又分为M2a和M2b,此亚型即为通常所称的M2b。常见的形态学表现为原始细胞胞体较大,胞质嗜碱,含有丰富的嗜天青颗粒,核周淡染或核凹陷;常见Auer小体,表现为单根细长而一端尖削的棒状,可见不同程度发育异常的早幼粒、中幼粒及成熟中性粒细胞,嗜酸细胞常增多,单核细胞很少或缺如,有核红细胞及巨核细胞形态正常(图7)。
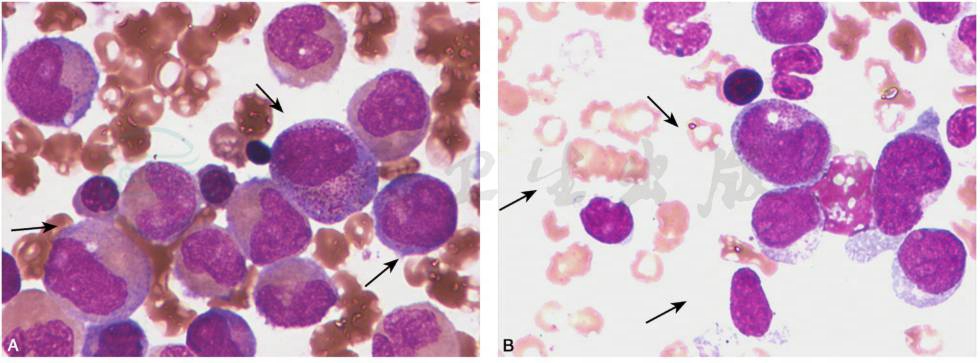
图7 AML伴t(8;21)(q22;q22),(AML1-ETO)
A.骨髓增生程度多为明显活跃或极度活跃,以异常中性中幼粒细胞增高为主,此类细胞胞体偏大,不规则,核浆发育不平衡,胞核有凹陷,染色质细致,可见核仁,核凹陷处颗粒丰富,Auer小体易见;成熟粒细胞亦可有不同程度的病态造血,胞质呈均匀粉红色;嗜酸性、嗜碱性粒细胞和肥大细胞可增多。B.骨髓增生程度多为明显活跃或极度活跃,原始及早幼粒细胞易见,异常中性中幼粒细胞胞体偏大,核浆发育不平衡,胞核有凹陷,核凹陷处颗粒丰富,可见空泡
(2) AML 伴 inv(16)(p13;q22)或 t(16;16)(p13;q11),(CBFβ/MYH11):在儿童髓系白血病中发生率亦较高,FAB分型中称为急性粒单核细胞型白血病伴嗜酸性粒细胞增多(M4Eo),因此形态学上具有急性粒单核细胞型白血病的表现,可见原始、幼稚单核细胞以及原粒细胞等,在此基础上骨髓中可见不同数量的各阶段嗜酸性粒细胞,嗜酸性粒细胞内颗粒较正常偏大,紫色,部分可密集分布,使细胞核形态模糊不清(图8)。
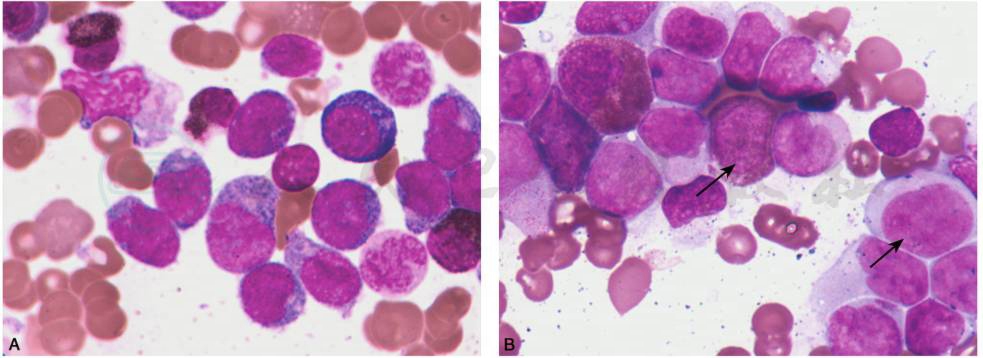
图8 AML伴inv(16)(p13;q22)或t(16;16)(p13;q11);CBFβ/MYH11
A.骨髓增生程度多为明显活跃或极度活跃,可见原始、幼稚单核细胞以及原粒细胞等,各阶段嗜酸细胞易见,嗜酸细胞内颗粒较正常偏大,紫色,部分可密集分布,使细胞核形态模糊不清。B.骨髓增生程度多为明显活跃或极度活跃,原始单核细胞胞体大,染色质细网状,核仁明显,胞质丰富,嗜碱性,可见空泡及嗜天青颗粒;幼稚单核细胞胞核形状多不规则,扭曲折叠。各阶段嗜酸细胞易见,嗜酸细胞内颗粒较正常偏大,紫色,部分可密集分布,使细胞核形态模糊不清
(3)AML 伴 t(15;17)(q22;q21),PML-RARα及其变异型:即FAB分型中的急性早幼粒细胞白血病(APL),异常早幼粒细胞胞核大小及形状多不规则,常为肾型或双叶,多颗粒型胞质内可见浓集甚至融合的大颗粒,有些则是粉尘样颗粒,其Auer小体呈束状、柴捆样杂乱分布;而细颗粒(或少颗粒)型APL胞质内颗粒明显少或无,胞核呈双叶。而变异型是指部分患者形态学特征类似APL,同时涉及RARα 变异易位(图9)。
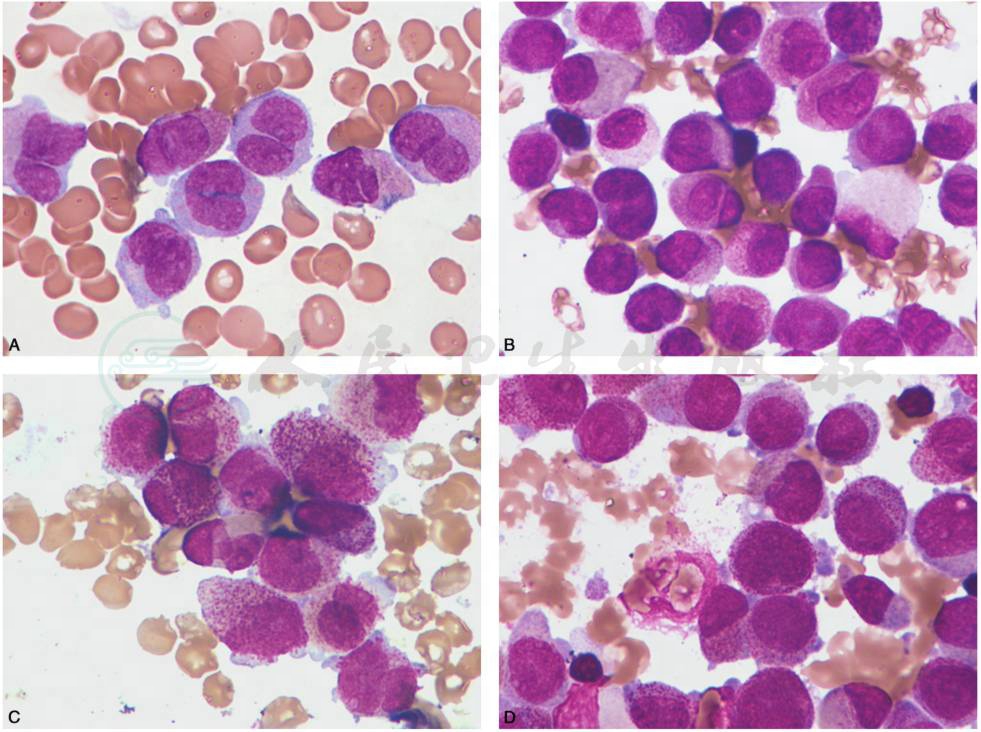
图9 AML伴t(15;17)(q22;q21),PML-RARα
A.骨髓增生程度多为明显活跃或极度活跃,异常早幼粒细胞胞体不规则,有伪足,染色质细致,胞核呈肾型或双叶状,胞质内以细颗粒为主,伴染色体t(15;17)易位,PML-RARα阳性,形态学诊断M3v。B.骨髓增生程度多为明显活跃或极度活跃,以多颗粒的异常早幼粒细胞为主>30%。胞体较小,大小一致,染色质细致均一,胞核呈双叶型,胞质内细小颗粒,呈粉尘状,或者颗粒明显少或无,形态学为细颗粒型。C.骨髓增生程度多为活跃及明显活跃,骨髓中以多颗粒的早幼粒细胞为主>30%。胞体大小不等,不规则,有伪足,染色质细致,核不规则,呈折叠或肾形,胞质粗黑颗粒,常覆盖细胞核,含束捆状Auer小体,形态学为粗颗粒型。D.骨髓增生程度多为活跃及明显活跃,骨髓中以多颗粒的早幼粒细胞为主>30%。胞体大小较均一,不规则,有伪足,染色质细致,胞质内颗粒增多,粉尘状,形态学为细颗粒型
(4) AML 伴 t(9;11)(p22;q23),AF9-MLL 及MLL变异易位的AML:此型儿童亦较为常见,约占儿童AML的9%~12%,急性单核细胞白血病和急性粒单核细胞型白血病与此细胞遗传学异常密切相关。其原始细胞多表现为原始单核细胞和幼稚单核细胞为主,原始单核细胞胞体大,染色质细网状,1个或多个核仁,胞质丰富,嗜碱性,可见伪足、空泡及嗜天青颗粒;幼稚单核细胞胞核形状多不规则,扭曲折叠(图10)。
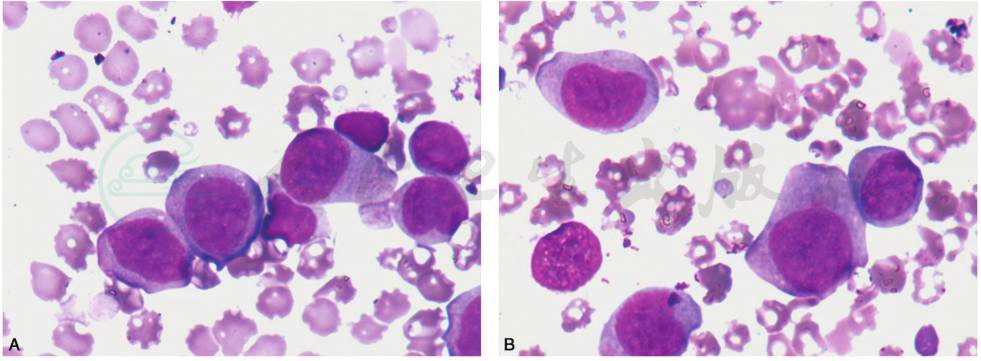
图10 AML伴t(9;11)(p22;q23),AF9-MLL及MLL变异易位的AML
A.伴有MLL变异易位,形态学为AML-M5,骨髓增生程度为活跃及明显活跃,原始及幼稚单核细胞为主,原始单核细胞胞体大,染色质细网状,胞质丰富,嗜碱性,可见伪足、空泡及嗜天青颗粒。B.伴有MLL变异易位,形态学为AMLM5,骨髓增生程度为活跃及明显活跃,原始及幼稚单核细胞为主,原始单核细胞胞体大,染色质细网状,胞质丰富,嗜碱性,可见伪足、空泡及嗜天青颗粒。幼稚单核细胞胞核形状多不规则,扭曲折叠
(5) AML 伴 t(6;9)(p23;q34),DEK-CAN:此类型在儿童AML中,非常少见,可能具有除了急性早幼粒细胞白血病和急性巨核细胞性白血病以外其他任何FAB亚型的形态学特征,以AML-M2a和M4最常见,此型中近半数的患者骨髓或外周血嗜碱颗粒增多,具有粒系和红系发育异常,巨核细胞发育异常少见(图11)。
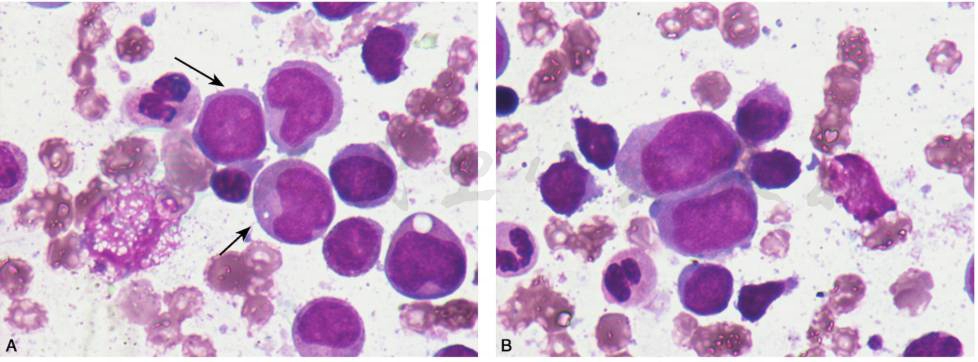
图11 AML伴t(6;9)(p23;q34),DEK-CAN
A.患者发病时白细胞高,形态学诊断为AML-M5,免疫分型表达CD13、CD33、CD123、CD38,部分表达 CD117、CD34、CD9、HLA-DR。融合基因:DEK-CAN阳性伴FLT/ITD阳性,染色体核型示:46,XY,t(6;9)(p23;q34)/46,XY。B.患者发病时白细胞高,形态学诊断为 AML-M5,免疫分型表达 CD13、CD33、CD123、CD38,部分表达 CD117、CD34、CD9、HLA-DR。 融合基因:DEK-CAN阳性伴FLT/ITD阳性,染色体核型示:46,XY,t(6;9)(p23;q34)/46,XY
(6)AML伴inv(3)(q21;q26.2)或t(16;16)(q21;q26.2),RPN1-EVI1:此亚型多见于成人。
(7)AML(原始巨核细胞)伴t(1;12)(p13;q13),RBM15-MKL:此亚型非常少见,占全部AML的不足1%,常见于3岁以下患者,原始细胞形态为FAB分型中的急性巨核细胞性白血病,胞体大到中等大小,核圆形,轻度不规则或有凹陷,染色质细网状,有核仁,常见小巨核细胞。
(8)伴NPM1突变,或伴CEBPA等基因突变的AML,在形态学上可以具有任何髓系白血病的特征,是预后较好的一种亚型。
不具有克隆性细胞遗传学异常儿童急性髓系白血病的形态学特点:
(1)AML-M0(急性髓系白血病微分化型):骨髓中原始细胞≥90%,原始细胞中等大小,染色质细致,有核仁,胞质大多透亮或中度嗜碱,无嗜天青颗粒及Auer小体,类似ALL-L2(图12)。
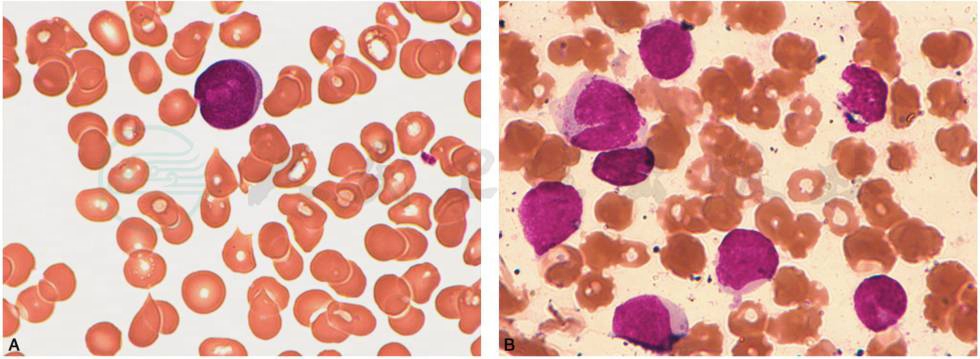
图12 急性髓细胞白血病微分化型(AML-M0)
A.骨髓增生程度为活跃及明显活跃,原始细胞中等大小,染色质细致,有核仁,胞质大多透亮或中度嗜碱,无嗜天青颗粒及Auer小体,类似原始淋巴细胞;B.骨髓增生程度为活跃及明显活跃,原始细胞中等大小,染色质细致,有核仁,胞质大多透亮或中度嗜碱,无嗜天青颗粒及Auer小体,类似原始淋巴细胞
(2)AML-M1(急性髓系白血病未分化型或不成熟型):骨髓原粒细胞≥90%,早幼粒细胞很少,中幼粒细胞以下阶段不见或罕见,<10%。部分原粒细胞有嗜天青颗粒或Auer小体(图13)。
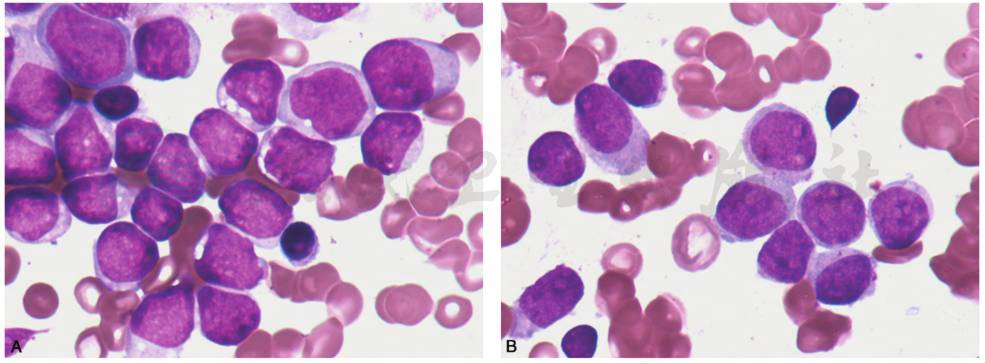
图13 急性髓系白血病未分化型或不成熟型(AML-M1)
A.骨髓增生程度明显活跃或极度活跃,以原粒细胞为主,胞体大小不一,核圆或椭圆形,也可不规则,染色质细,有核仁,胞质嗜碱,无颗粒。早幼粒细胞很少,中幼粒细胞以下阶段不见或罕见,部分原粒细胞有嗜天青颗粒或Auer小体。B.骨髓增生程度明显活跃或极度活跃,以原粒细胞为主,胞体大小不一,核圆或椭圆形,染色质细,有核仁,胞质嗜碱,无颗粒。早幼粒细胞很少,中幼粒细胞以下阶段不见或罕见
(3)AML-M2(急性髓系白血病部分分化型或成熟型):骨髓原粒细胞≥20%,早幼粒细胞以下至中性分叶核粒细胞>10%,单核细胞<20%,原始粒细胞核染色质细腻,有1~2个核仁,胞质丰富,嗜碱性,有颗粒,部分可见颗粒聚集,Auer小体常见(图14)。
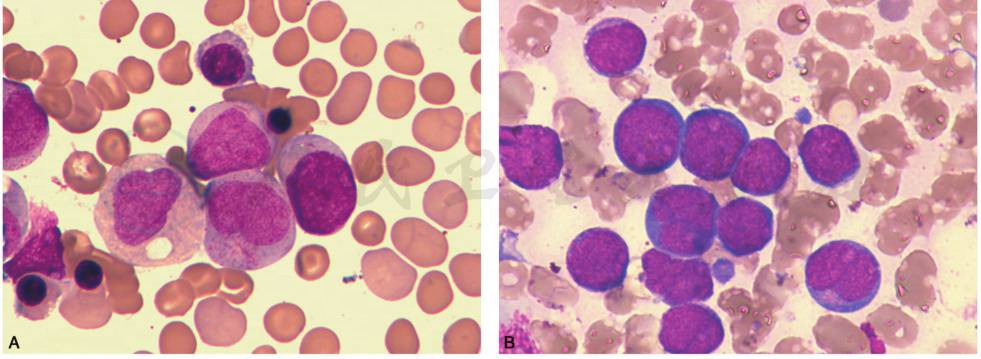
图14 AML-M2(急性髓系白血病部分分化型或成熟型)
A.骨髓增生程度明显活跃或极度活跃,原始粒细胞胞体大小不一,核染色质细腻,胞质丰富,嗜碱性,有粉红色颗粒,部分可见颗粒聚集,可见Auer小体;B.原始粒细胞胞体大小不一,核圆形或不规则,核染色质细腻,有1~2个核仁,胞质丰富,嗜碱性,有颗粒,部分可见颗粒聚集
(4)AML-M4(急性粒单核细胞型白血病):诊断及其亚型的分型标准类同FAB,形态上可见原粒细胞和原始幼稚单核细胞,原粒细胞中等大小,染色质细致,有核仁,胞质大多透亮或中度嗜碱;原始单核细胞胞体较大,胞质丰富嗜碱性,可有伪足或空泡,染色质细网状,有大而显著的核仁;幼稚单核细胞胞核常不规则,可扭曲折叠,颗粒明显,亦可有嗜天青颗粒及空泡(图15)。
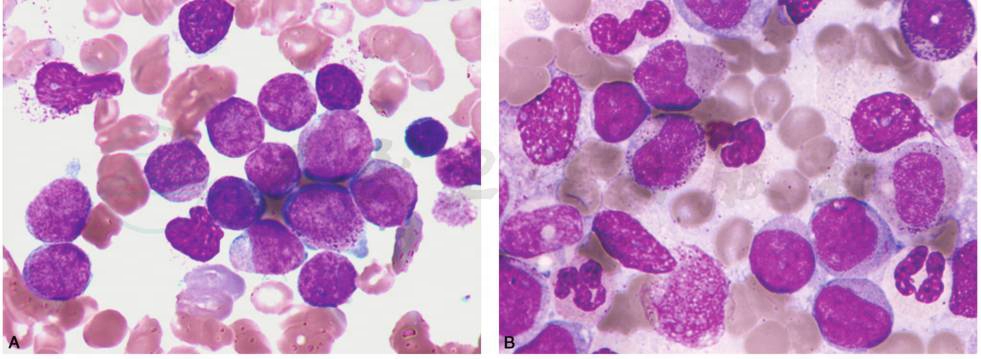
图15 AML-M4(急性粒单核细胞型白血病)
A.形态上可见原粒细胞和原始幼稚单核细胞,原粒细胞胞体相对较小,核圆形,染色质细致,有核仁,胞质量少,多透亮或中度嗜碱;原始单核细胞胞体较大,染色质细网状,有大而显著的核仁,胞质丰富嗜碱性,可有伪足或空泡。B.形态上可见原粒细胞和原始幼稚单核细胞,原粒细胞胞体相对较小,核圆形,染色质细致,有核仁,胞质量少,多透亮或中度嗜碱;原始单核细胞胞体较大,染色质细网状,有大而显著的核仁,胞质丰富嗜碱性,可有伪足或空泡
(5)AML-M5(急性单核细胞白血病):原始单核细胞胞体较大,胞质丰富嗜碱性,可有伪足或空泡,染色质细网状,有大而显著的核仁;幼稚单核细胞胞核常不规则,可扭曲折叠,颗粒明显,亦可有嗜天青颗粒及空泡(图16)。
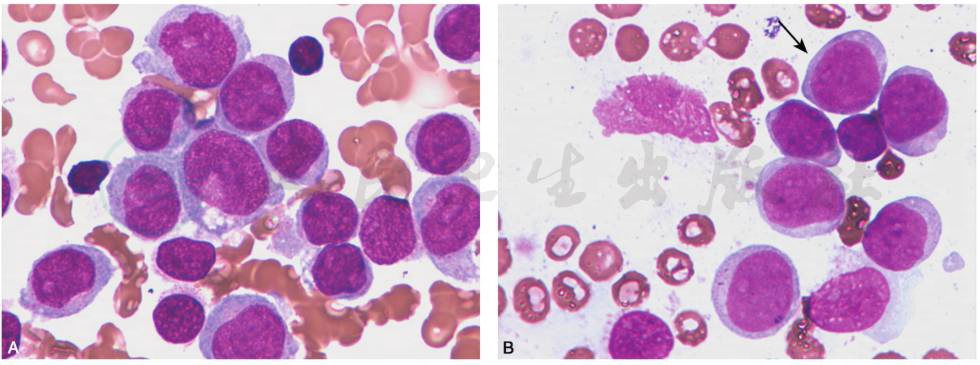
图16 AML-M5(急性单核细胞白血病)
A.骨髓以原始及幼稚单核细胞增多为主,原始单核细胞胞体较大,染色质细网状,有大而显著的核仁,胞质丰富嗜碱性,可有伪足或空泡;幼稚单核细胞胞核常不规则,可扭曲折叠,颗粒明显,亦可有嗜天青颗粒及空泡。B.骨髓以原始及幼稚单核细胞增多为主,原始单核细胞胞体较大,染色质细网状,有大而显著的核仁,胞质丰富嗜碱性,可有伪足或空泡;幼稚单核细胞胞核常不规则,可扭曲折叠,颗粒明显,亦可有嗜天青颗粒及空泡
(6)AML-M6(急性红白血病):根据有无显著髓系成分,可分为两种亚型:红白血病和纯红系白血病,红白血病是指骨髓原始细胞(原粒细胞或原始单核细胞)≥20%,红细胞系≥50%;纯红系白血病是指骨髓内以红系未成熟细胞为主≥80%,无明显髓系原始细胞成分。红系细胞形态上多表现为发育异常,巨幼样改变,可见双核或多核,染色质细致,1个或多个核仁,胞质嗜碱性,无颗粒,有空泡(图17)。
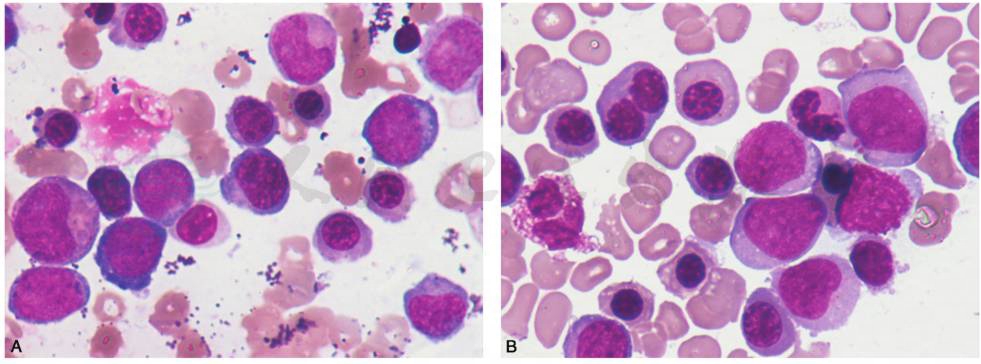
图17 AML-M6(急性红白血病)
A.骨髓增生程度活跃或明显活跃,红细胞系≥50%,红系细胞形态上多表现为发育异常,巨幼样改变,可见双核或多核,染色质细致,1个或多个核仁,胞质嗜碱性,无颗粒,有空泡。同时原始粒细胞或原始单核细胞易见。B.骨髓增生程度活跃或明显活跃,红细胞系≥50%,红系细胞形态上多表现为发育异常,巨幼样改变,可见双核或多核,染色质细致,1个或多个核仁,胞质嗜碱性,无颗粒,有空泡。同时原始粒细胞或原始单核细胞易见
(7)AML-M7(急性巨核细胞性白血病):骨髓中原始+幼稚巨核细胞≥20%,原始巨核细胞通常中等大小,胞核圆形,或轻度不规则、有切迹,染色质细网状,有核仁,胞质嗜碱性,常无颗粒,可有伪足,可见淋巴样小巨核细胞,或成簇存在的原始巨核细胞(图18)。
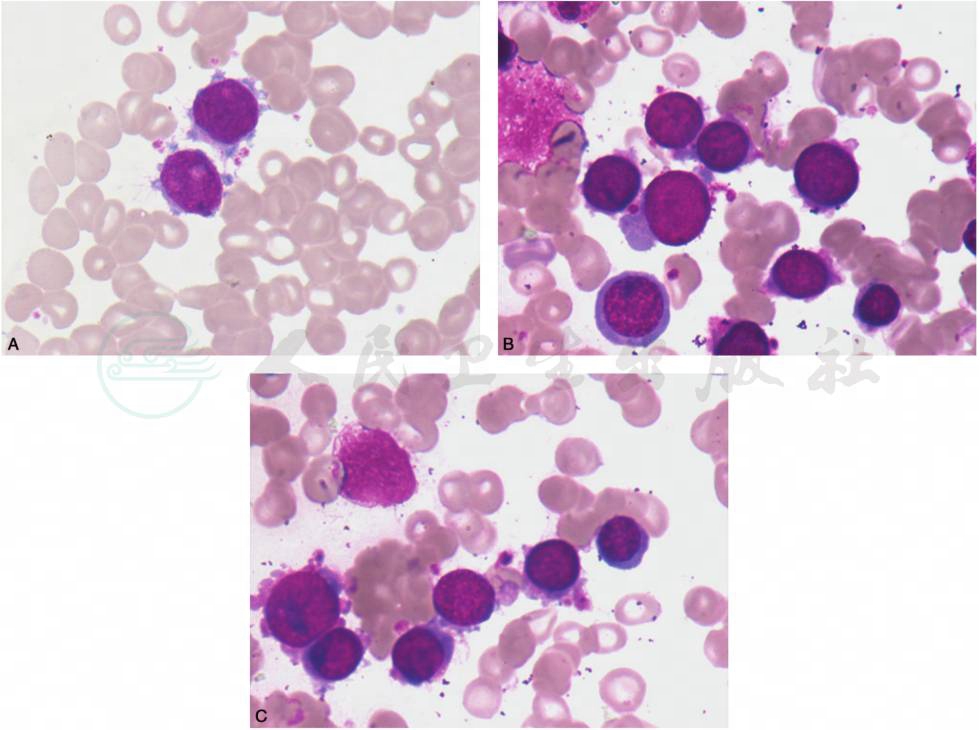
图18 AML-M7(急性巨核细胞性白血病)
A.骨髓增生程度活跃或明显活跃,巨核细胞增多,原始巨核细胞通常中等大小,胞核圆形,或轻度不规则、有切迹,染色质细网状,有核仁,胞质嗜碱性,常无颗粒,可有伪足;可见淋巴样小巨核细胞,或成簇存在的原始巨核细胞。B.骨髓增生程度活跃或明显活跃,巨核细胞增多,原始巨核细胞通常中等大小,胞核圆形,或轻度不规则、有切迹,染色质细网状,有核仁,胞质嗜碱性,常无颗粒,可有伪足;可见淋巴样小巨核细胞,或成簇存在的原始巨核细胞。C.骨髓增生程度活跃或明显活跃,巨核细胞增多,原始巨核细胞通常中等大小,胞核圆形,或轻度不规则、有切迹,染色质细网状,有核仁,胞质嗜碱性,常无颗粒,可有伪足;可见淋巴样小巨核细胞,或成簇存在的原始巨核细胞
(三)儿童双克隆和双表型白血病形态学诊断
WHO将急性未分化细胞白血病、双克隆和双表型白血病归入系列未明的急性白血病,双克隆和双表型白血病是指表达两类或两类以上造血系列抗原,也称混合表型急性白血病(mix phenotype acute leukemia,MPAL)。MPAL的原始细胞可以是一群(原始细胞同时表达多种不同造血系列的抗原),也可以是多群(原始细胞分属不同的造血系列)。
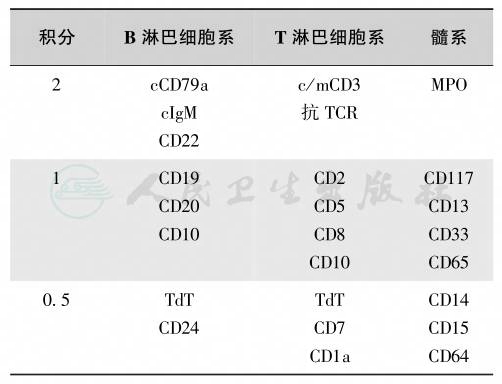
MPAL的诊断主要依赖于免疫分型,欧洲白血病免疫学分类提出了诊断急性双克隆和双表型白血病的EGIL积分系统,规定髓系积分>2分,淋系积分>2分才能确立诊断(表13)。
表13 欧洲组白血病免疫分类的标志积分系统(EGIL)
形态学上很多病例呈现二形性原始细胞组群,一种可类似原始淋巴细胞,另一种可表现原始粒细胞或单核细胞的特征,但有些病例的原始细胞无不同的形态学特征,常常在髓系表达的基础上同时具有淋系标志。
混合表型急性白血病伴 t(9;22)(q34;q11),BCR-ABL1:是混合表型急性白血病中最常见的重现性遗传学异常,非常罕见,约占急性白血病的不足1%,可发生于儿童和成人(图19)。
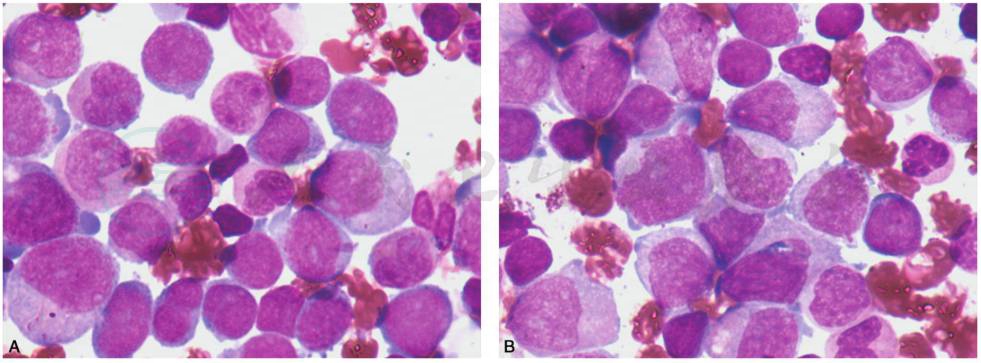
图19 混合表型急性白血病伴t(9;22)(q34;q11),BCR-ABL1
A.此例患者骨髓涂片可见原始单核细胞及少量原始淋巴细胞,细胞化学染色:可见16%原始及幼稚单核细胞,13%少量原始及幼稚淋巴细胞,免疫分型示:可见两群异常细胞,表达 CD34、CD117、CD38、CD33、CD13、CD123、HLA-DR,部分表达CD64、CD19、CD36,弱表达MPO,占14.8%,为异常髓系原始细胞表型;另一群细胞表达CD34、CD123、CD10、CD19、CD9、cCD79a、CD58,部分表达 TdT,弱表达 CD13、CD22,为 commonB 表型。 融合基因 BCR-ABL1 阳性。 B.混合表型急性白血病伴 t(9;22)(q34;q11),BCR-ABL1
混合表型急性白血病,B/髓系,非特指型:如图20所示。
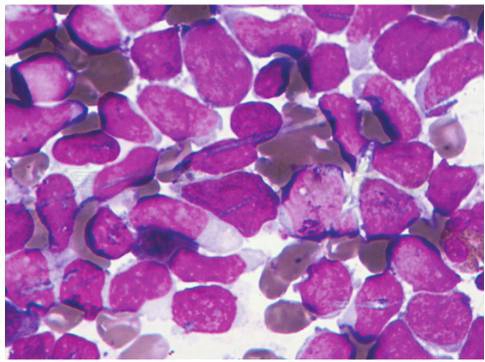
图20 混合表型急性白血病,B/髓系,非特指型
免疫分型提示:异常细胞表达 CD34、CD117、CD7、HLA-DR、CD38、CD13、CD11b、CD2、cCD3、cTdT,部分表 达 CD15、 CD5-、 CD16-、 CD4-、 CD8-、 CD1a-、mCD3-、CD33-、CD64-、MPO-,考虑 MPAL(M-T),细胞化学染色提示:原始及幼稚淋巴细胞比例增高,可见少量原始及幼稚单核细胞
(四)儿童慢性髓细胞性白血病的形态学诊断
儿童慢性髓细胞白血病是一种骨髓增殖性肿瘤,起源于多能造血干细胞,超过95%的患者造血细胞中存在9号和22号染色体相互易位,即费城染色体(Ph染色体),基于此分子病因学的发现,使其目前成为靶向治疗的成功典范。
大多数患者在慢性期确诊,外周血白细胞升高,可见各阶段成熟粒细胞,以中幼粒及杆状核粒细胞为主,无明显发育异常,原始细胞通常小于2%,嗜酸性粒细胞及嗜碱性粒细胞易见。骨髓增生明显或极度活跃,各阶段粒细胞增生,嗜酸细胞增多,原始细胞通常小于5%,当原始细胞≥10%时则提示疾病进展,红系增生减低,巨核细胞通常正常或增生明显(图21)。
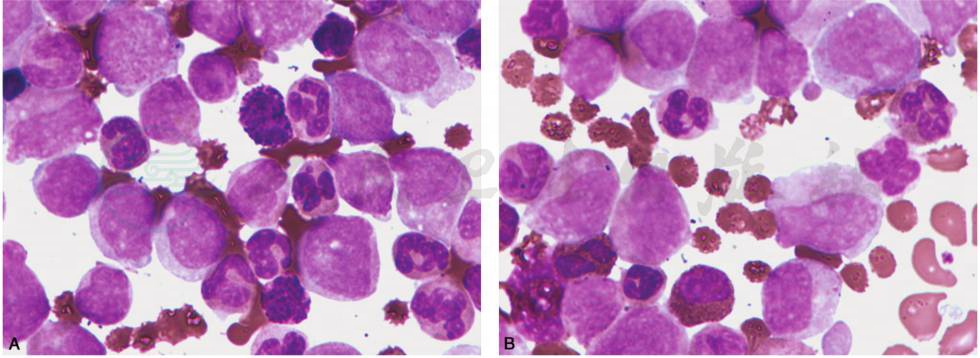
图21 儿童慢性髓细胞性白血病
A.骨髓增生明显或极度活跃,各阶段粒细胞增生,嗜酸细胞增多,原始细胞通常小于5%;B.骨髓增生明显或极度活跃,各阶段粒细胞增生,嗜酸、嗜碱细胞增多,原始细胞通常小于5%
(五)儿童骨髓增生异常综合征的形态学诊断
儿童骨髓增生异常综合征(myelodysplastic syndrome,MDS)是一组克隆性造血干细胞疾病,其特征是一系或多系血细胞减少、无效造血、一系或多系髓系细胞发育异常和发生急性髓系白血病的危险增高。儿童骨髓增生异常综合征相对较少见,在年龄小于14岁的患儿中MDS的比例少于所有血液系统肿瘤的5%。
MDS的形态学分类主要是根据外周血和骨髓中原始细胞百分率,发育异常的细胞类型和程度,环形铁粒幼细胞的多少,为确定原始细胞的百分比,建议在骨髓涂片或骨髓活检印片所有有核细胞中分类500个,外周血片需分类200个白细胞。判定红系和粒系发育异常所需百分率为发育异常细胞占该系细胞≥10%,巨核细胞系发育异常的定义是在涂片或切片中至少计数30个巨核细胞,而发育异常的巨核细胞≥10%。
2003年,Hasle等参照成人MDS的WHO诊断分型标准提出了一个儿童MDS的WHO分型标准,并提出了儿童MDS的最低诊断标准,认为至少符合以下四项中的任何两项方可诊断为MDS:①持续性不能解释的血细胞减少(中性粒细胞减少、血小板减少或贫血);②至少二系有发育异常的形态学特征;③造血细胞存在获得性克隆性细胞遗传学异常;④原始细胞增高(≥5%)(表2-1-6)。2008年WHO又提出儿童MDS中的暂定类型:儿童难治性血细胞减少(refractory cytopenia of childhood,RCC),是指持续血细胞减少,骨髓内可见一系或多系发育异常的形态学表现,外周血原始细胞<2%,骨髓原始细胞<5%,大部分RCC患者骨髓增生程度表现为减低或重度减低,应与先天性或获得性骨髓衰竭性疾病相鉴别(表14)。
表14 儿童骨髓增生异常和骨髓增殖性疾病的WHO诊断分类

发育异常的形态学特征:①异常红细胞生成:外周血中大红细胞增多,红细胞大小不均,可见巨大红细胞、异形红细胞、点彩红细胞,可出现有核红细胞。骨髓中幼稚红细胞常见的发育异常形态改变有核出芽、核间桥、核碎裂核、多核、核过分叶、核的幼巨红细胞样改变、环状铁粒幼红细胞、空泡、PAS染色阳性。②异常粒细胞生成:外周血中中性粒细胞颗粒减少或缺如,胞质持续嗜碱,假Pelger-Huët异常。骨髓中出现原粒细胞,幼粒细胞核浆发育不平衡,胞体小或异常增大、颗粒减少或无颗粒、假Chediak-Higashi颗粒、核分叶减少(假Pelger-Huët异常)、Auer小体等。③异常巨核细胞生成:外周血中可见巨大血小板,骨髓中出现小巨核细胞,包括淋巴样小巨核细胞、小圆核小巨核细胞,同时可有核低分叶、多核等(图22)。
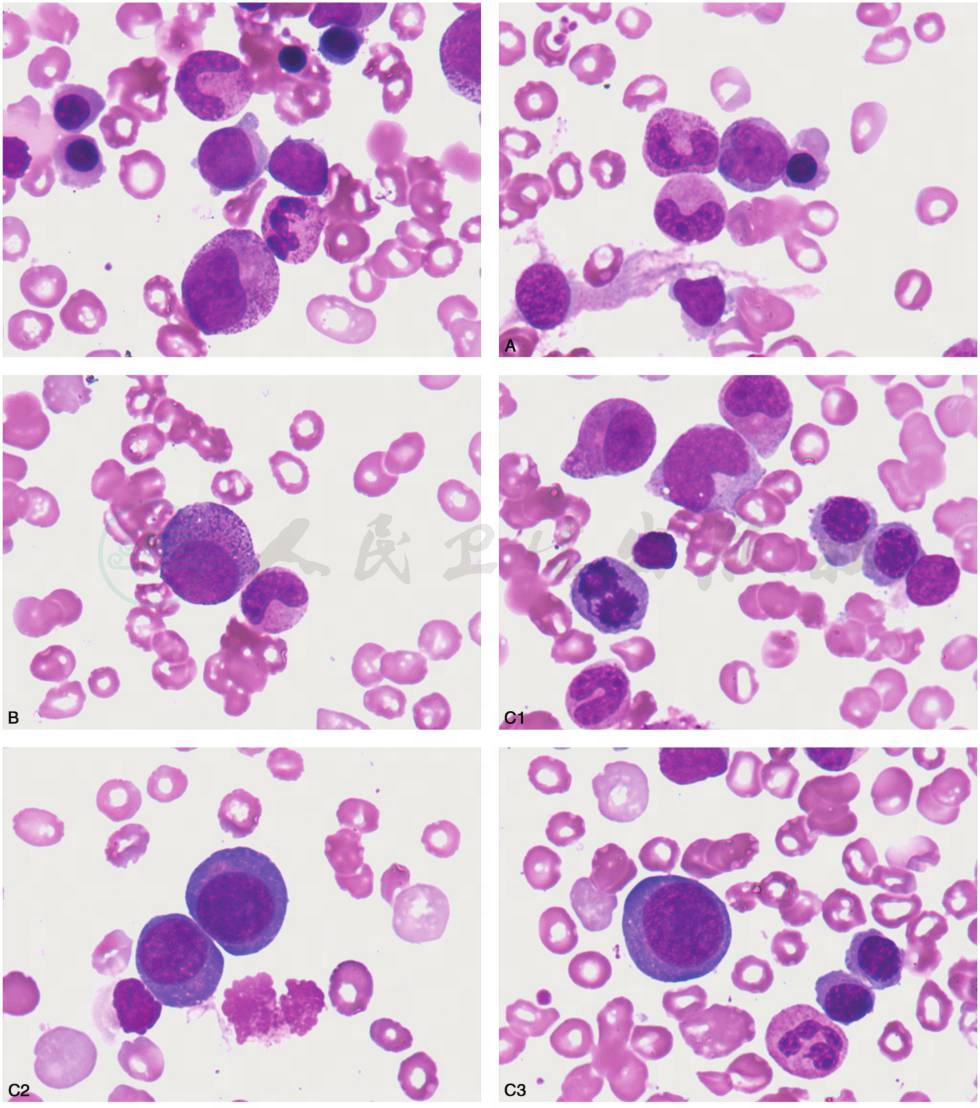
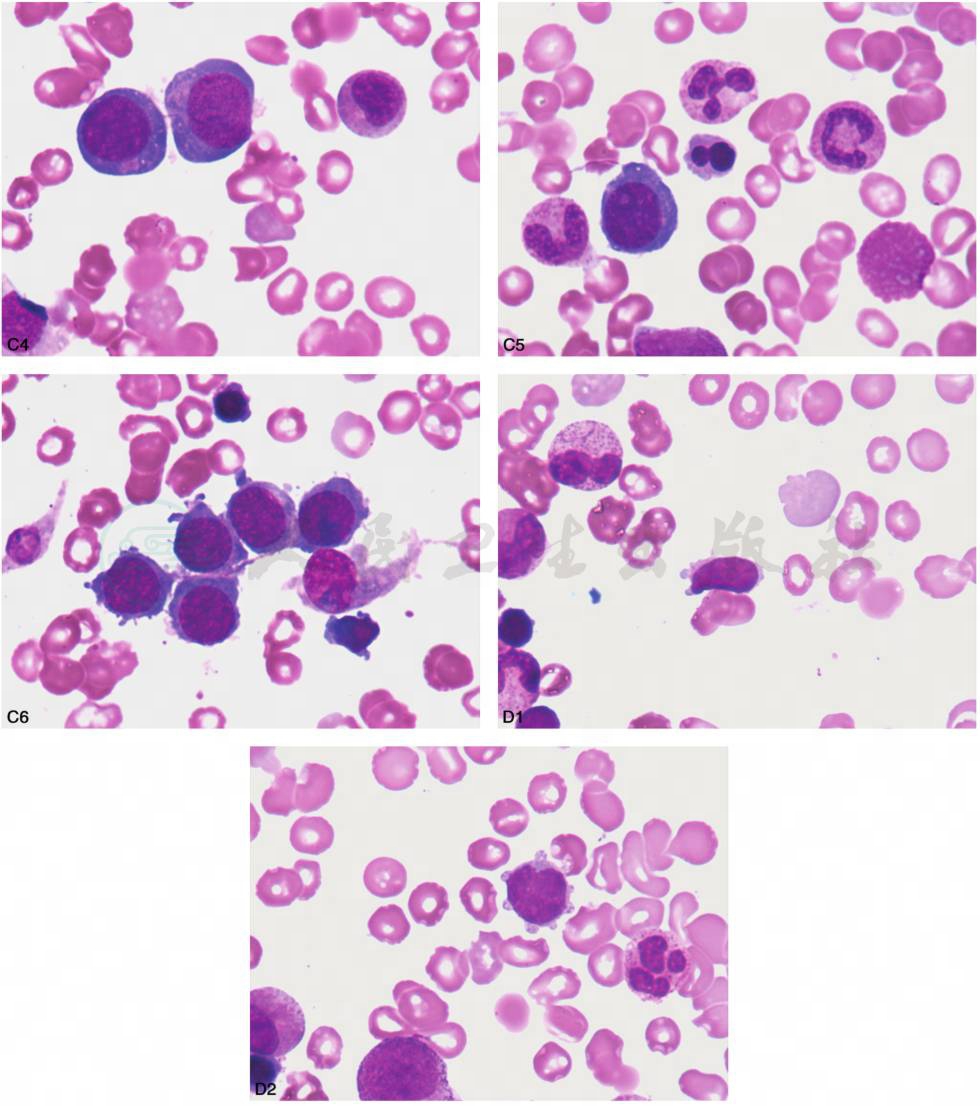
A~B.粒系发育异常:幼粒细胞核浆发育不平衡,胞体小或异常增大、颗粒减少或无颗粒。C1~C6.红系发育异常:C1:核碎裂核、多核、核过分叶;C2:幼巨红细胞样改变;C3:核间桥、核的幼巨红细胞样改变;C4:核浆发育不平衡,胞间桥;C5~C6:红系发育异常。D1~D2.巨核细胞系发育异常:淋巴样小巨核细胞
图22 儿童骨髓增生异常综合征
(六)幼年型粒单核细胞性白血病形态学诊断
幼年型粒单核细胞性白血病(juvenile myelomonocytic leukemia,JMML)是一种儿童克隆性造血干细胞疾病,主要发生于4岁以下的幼儿,男性较多。皮肤损害,特别是面部皮疹是常见而重要的体征之一。多数患儿脾脏肿大,部分患儿肝脏和淋巴结肿大;外周血中白细胞及单核细胞增多,贫血,血小板减少;血液中胎儿血红蛋白(HbF)持续性明显升高,其特征主要为粒系和单核系增殖,外周血和骨髓中原始、幼稚单核细胞<20%,常有红系和巨核细胞异常。目前WHO分类将其归于儿童MDS/MPN,通常会有特征性的累及RAS/MAPK通路基因的突变。
JMML的形态学特征主要为:外周血在诊断中具有重要地位,多表现白细胞增多,中位数为(25~30)×109/L,可见不成熟细胞,如早幼粒细胞、中幼粒细胞和单核细胞,原始细胞(包括幼稚单核细胞)易见,但小于20%,伴血小板减少及贫血,少数病例嗜酸性粒细胞和嗜碱性粒细胞增多,常见有核红细胞。骨髓改变本身不具有诊断意义,骨髓中单核细胞常不如外周血明显,通常占骨髓细胞的5%~10%,原始细胞(包括幼稚单核细胞)占骨髓细胞比例小于20%,无Auer小体。部分病例可见粒系发育异常,包括假Pelger-Huët异常、中性粒细胞颗粒减少等(图23)。
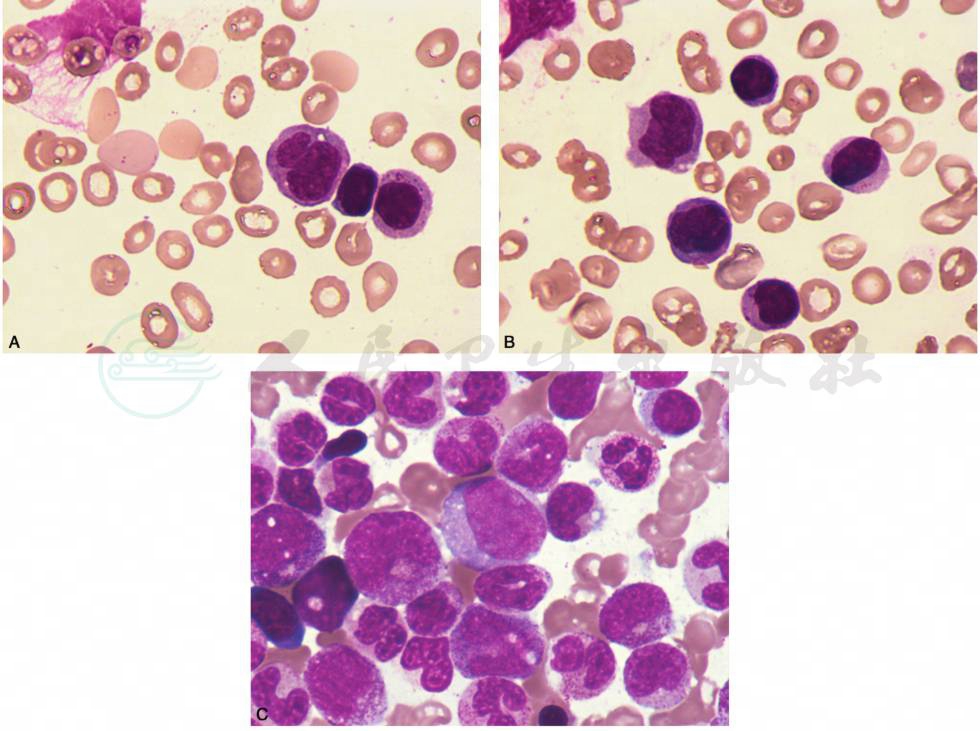
图23 幼年型粒单核细胞性白血病
A.外周血可见不成熟细胞,如早幼粒细胞、中幼粒细胞和单核细胞,幼稚单核细胞)易见;B.外周血可见不成熟细胞,如早幼粒细胞、中幼粒细胞和单核细胞,幼稚单核细胞)易见;C.骨髓增生多为活跃以上,可见粒系发育异常,单核细胞升高不明显













