英文名称 :Duchenne muscular dystrophy
进行性肌营养不良是一组原发于肌内组织的遗传变性病,其共同特征是缓慢起病,进行性加重的肌肉萎缩与无力;主要累及肢体近端肌肉,少数为远端起病;腱反射消失,肌肉假性肥大。电生理、组织学和分子生物学研究都表明本病原发于肌肉。
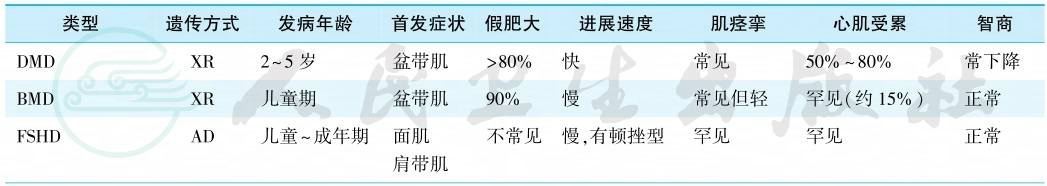
从临床来看,至少有9种类型:①Duchenne型肌营养不良(Duchenne muscular dystrophy,DMD);②Becker型肌营养不良(Becker muscula dystrophy,BMD);③面肩肱型肌营养不良(facioscapulo-humeral muscular dystrophy,FSHD),又称Landouzy-Dejerine型肌营养不良;④肢带型肌营养不良(limb-girdle muscular dystrophy,LGMD);⑤Emery-Dreifuss肌营养不良(Emery-Dreifuss muscular dystrophy,EDMD);⑥先天性肌营养不良;(congenital muscular dystrophy,CMD);⑦眼咽型肌营养不良(oculopharyngeal muscular dystrophy);⑧远端型肌营养不良(distal muscular dystrophy);⑨强直性肌营养不良(myotonic muscular dystrophy)。其临床特点见表1。
表1 各型肌营养不良的临床特点
续表
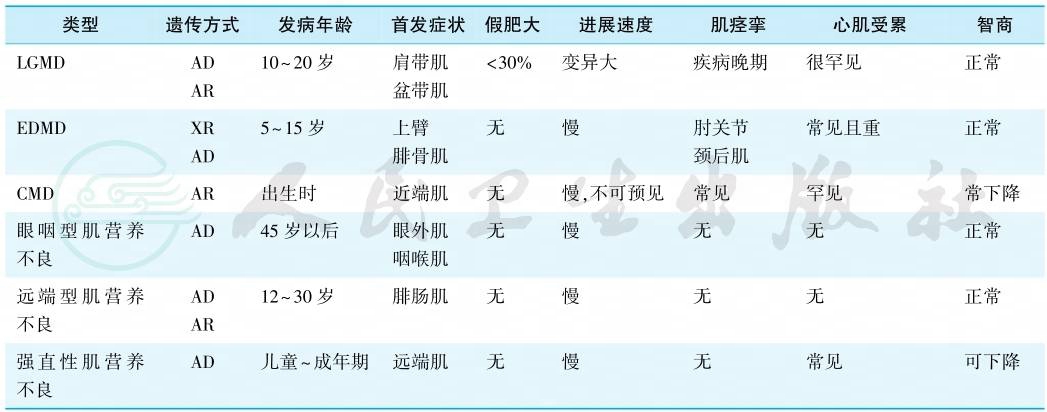
注:XR,X连锁隐性遗传;AD;常染色体显性遗传;AR,常染色体隐性遗传;DMD,Duchenne型肌营养不良;BMD,Becker型肌营养不良;FSHD,面肩肱型肌营养不良;LGMD,肢带型肌营养不良;EDMD,Emery-Dreifuss肌营养不良;CMD,先天性肌营养不良。
Duchenne型肌营养不良(Duchenne muscular dystrophy,DMD)和Becker型肌营养不良(Becker muscular dystrophy,BMD)均是肌肉假肥大性的肌营养不良,均为X连锁隐性遗传。DMD由法国医生Duchenne于1868年首先进行系统、详细地描述,Gowers于1879年更精确地描述了本病,并用连续图片的方式直观地介绍DMD患儿奇特的从平卧起立的方式。DMD的发病率为3/10万活产男婴,是一种预后不良的常见的原发性肌肉疾病。Becker和Walton分别于1953年和1955年注意到存在一种X连锁肌营养不良,其发病年龄比DMD更晚,进展速度更慢。为此Becker提出存在一种良性X连锁遗传的DMD变异型,即BMD。
1.分子发病机制
Duchenne型和Becker型肌营养不良的病因是抗肌萎缩蛋白(dystrophin)基因缺陷所致。DMD基因定位于X染色体,Xp21区域的DMD基因缺陷,其机制是其蛋白产物缺失所引起的一系列病理生理变化。
2.细胞膜缺陷学说
1959年,日本学者Ebshi首次检测DMD患者血清肌酸磷酸激酶(CK),发现70%的患者血清中CK水平异常升高,且溶血也不影响CK的含量,因为红细胞中不含CK,而CK是骨骼肌中最丰富的可溶性酶之一,故认为CK来自于骨骼肌细胞。此后,许多学者的研究表明,CK在DMD患者血清中显著增高。虽然CK增加是非特异性的,但极度升高却是DMD所特有,其CK值可达正常人的50~100倍,临床上除急性心肌梗死和广泛肌组织外伤外,没有其他疾病有如此高的CK值。除了CK外,血清丙酮酸激酶(PE)、血清肌红蛋白(Mb)、血清乳酸脱氢酶(LDH)、醛缩酶(ALD)、谷草转氨酶(GOT)、腺苷酸激酶、葡萄糖磷酸变位酶等也升高。因此,多数学者提出“细胞膜缺陷学说”来解释DMD疾病的发生。他们认为DMD是由于遗传性肌细胞的某些膜结构蛋白缺陷,致使骨骼肌细胞膜的结构与功能发生改变,肌细胞内容物外漏,从而影响细胞内正常代谢过程。骨骼肌的生化和组织化学研究发现,DMD肌内钙的含量比正常肌组织增加了3倍,组织化学分析DMD的肌肉内钙阳性纤维比正常人多20倍。有学者报告病变肌组织中肌质网横管有异常,导致与钙结合能力下降,细胞内游离钙升高。这可能是由于质膜结构异常,细胞外液大量钙离子内流,肌质网及线粒体钙超载,同时激活钙依赖的中性蛋白酶,使肌纤维Z线被消化,肌溶灶形成,细胞代谢紊乱,因而发生肌肉萎缩、抗张、激活阳离子通道。
现今已在膜上找到了DMD细胞缺陷的分子生物学证据,即抗肌萎缩蛋白缺失或缺失热区疏水肽段的缺失,使维持和稳定细胞骨架蛋白空间最主要的疏水作用力丧失,抗肌萎缩蛋白的构象发生改变,导致它不能与抗肌萎缩蛋白相关糖蛋白以及肌动蛋白结合,破坏肌膜结构的完整性,从而引起局灶性富含钙离子的细胞外液成分顺着膜缺陷内流入肌纤维,最终可能出现下列情况:①线粒体钙超载,导致ATP合成减少;②激活中性蛋白酶,后者能消化肌纤维以及细胞骨架蛋白;③增加前列腺素E2介导的蛋白降解;④激活膜固的磷脂酶,使膜磷脂降解。这些情况都会加剧膜缺陷,从而形成恶性循环,最终使肌细胞变性、坏死。最后引起肌无力和萎缩。
基本病理改变是肌纤维膜缺失,这也是最早出现的病理改变,之后由于肌膜缺陷导致细胞外的Ca2+内流,激活内源性蛋白酶,引起肌纤维Z线溶解,这可能是肌肉分解的第1步。随后,肌细胞数目减少。肌纤维大小不均,肌核肿胀,数目增多,这是对肌纤维损伤的再生反应。数年后这一反应更剧烈,肌纤维增大、分叉、透明样变或萎缩。随着疾病的进一步发展,胶原和脂肪细胞在肌纤维间聚积,这是导致肌肉性肥大的部分原因。
1.肉眼所见
受累的骨骼肌色泽较正常的苍白,质软而脆。脑组织可以是正常的或表现出不同的皮质发育异常,诸如巨脑回、异位以及皮质结构紊乱。
2.光镜所见
①肌纤维坏死:可单一也可成簇存在,每簇有2~15条肌纤维。②再生出现于邻近坏死纤维残余物原本被非坏死纤维占据的区域,与坏死纤维束的纤维数目一样多或更多。③肌内膜纤维化,肌纤维分支或分裂,各型肌纤维的分布改变,肌纤维大小的变异增大(粗细不均)等。尚有炎性细胞浸润于血管周围、肌束膜和肌内膜
3.电镜所见
①早期及基本的病理改变是肌浆膜缺陷,病灶周边常见细胞内囊泡。②更晚期病灶:呈圆顶状或三角形,底朝外尖指向纤维中心。在这些病灶内有扩张的肌质网囊泡、位置异常的肌小管、肿胀或变性的线粒体和小糖原湖。肌原纤维变疏,肌丝稀少或被邻近的收缩带牵扯甚至扯断。将近50%的终板连接襞存在局灶变性。
4.冷冻切片
冷冻切片的免疫细胞化学研究显示,绝大部分肌纤维都存在肉膜抗肌萎缩蛋白表达明显减少或消失。
5.免疫印迹
利用抗肌萎缩蛋白抗体,对肌肉组织匀浆进行免疫印迹研究,可揭示出肌肉中抗肌萎缩蛋白缺乏的程度、残余抗肌萎缩蛋白及其降解产物的大小以及识别保留或丧失了抗肌萎缩蛋白的区域。
1.血清学检查
(1)血清酶活性异常:
肌营养不良的早期阶段伴有明显的肌酶从肌细胞漏入循环中,正常状态下存在于肌肉中的可溶性酶在血清中的水平均升高,包括肌酸激酶(CK)、乳酸脱氢酶(LDH)、谷丙转氨酶(GPT)、谷草转氨酶(GOT)、丙酮酸激酶(PK)、二磷酸果糖醛缩酶、磷酸葡萄糖异构酶、碳酸酐酶Ⅲ、烯醇酶等。在这些酶当中,以CK的MM型同工酶最为敏感和特异。
(2)其他血清学异常:
肌红蛋白血症在DMD和BMD患者最常见。DMD的血清血红素结合蛋白也可增高,该蛋白与肌红蛋白相结合,其在血清中的增高可能是继发于肌红蛋白血症。
在DMD患者血清中可检测到针对细胞核、平滑肌和骨骼肌抗原的抗体,检测率分别为47%、65%和27%,说明肌纤维的变性触发了继发性的免疫过程。
2.脑脊液检查
各种肌营养不良患者的脑脊液蛋白均增高。DMD和先天性肌营养不良患者脑脊液中的前白蛋白增高,γ-球蛋白下降,且DMD患者的智商与脑脊液γ-球蛋白水平呈正相关。
3.尿液检查
尿中肌酸排泄量下降,而肌酸酐排泄量上升。DMD患者尿中肌酸酐、牛磺酸、3-甲基组氨酸、二甲基精氨酸、多胺(腐胺、亚精胺和精胺)以及肌肽排泄量增高。
4.心电图
特征性的改变包括V1导联高大的R波(R/S>1)和左心前区及肢体导联深Q波(>3mm)。还可有心律和传导的异常。5岁后DMD患者的平均脉搏为100次/min,而同龄对照仅77次/min。DMD患者的心律失常包括窦性心动过速、窦性心律不齐、房性期前收缩、房性异位节律以及室性期前收缩复合波。心电图检查对散发的男性患者和罕见的女性患者有助诊作用,V1和V2导联中R-S总数和R/S比值有助于检测血清CK水平正常的携带者。超声心动图检查可反映出左室的大小和功能。
5.二维超声心动图
表现为心室壁后基底部运动减少,心室内径明显比正常小。这可能与机体发育不良和活动少或由于心肌纤维化引起的心室顺应性降低有关。收缩期射血前期与左室射血时间之比增大。大约20%患者左室射血分数轻微下降。心内最大收缩和舒张速率分别反映心室收缩和舒张速率。DMD患者的收缩速率没有明显改变,但90%患者舒张速率异常低。
6.基因检测
多重连接探针扩增技术(multiplex ligation dependent probe amplification,MLPA)可检测DMD基因79个外显子的缺失或重复;DNA测序可明确DMD基因的点突变和微小突变。当明确先证者的突变类型后,可应用PCR法对家系其他成员进行已知突变位点的检测。我国DMD患者基因缺失突变占60%,重复突变占10%,点突变占20%,微小突变占10%。反转录PCR法对有异常转录子的cDNA进行全长PCR扩增,可检测相应的基因突变的存在和类型。
7.肌肉活检
选择适当的肌肉进行活检,其病理改变通常已足够用于诊断肌营养不良(详见病理部分)。偶尔由于炎性成分的存在会造成肌营养不良和肌炎鉴别的困难。一般来说肌炎发病更快,更可能伴有受累肌肉的疼痛和压痛,而全身受累的情况更少见。
8.肌电图
肌病的肌电图特点是平均时限缩短,运动单位动作电位幅度降低。以2Hz反复刺激并不减少对诱发复合肌肉动作电位的反应。到了疾病晚期,可被诱发的运动单位数目减少,肌肉中越来越多的部分变成电静息,越来越多的运动单位电位呈多相电位。单纤肌电图提示DMD患者的纤维密度(即在随机插入的微电极能记录到其电位的同一运动单位中肌纤维的平均数目)增大。
9.视网膜电图(ERG)
正常人在感光细胞和色素上皮组织交界处产生一约为60mV的稳定直流电位,称为视网膜静止电位。DMD和BMD患者的ERG改变主要表现如下:①暗适应b波波幅降低、潜伏期延长,b/a波波幅比≤1;②亮适应b波波幅正常或轻度降低;③暗适应ERG振荡电位迟;④亮适应ERG振荡电位第二小波消失或衰竭;⑤30Hz闪光反应锯齿状波波幅降低、波形异常,上升支陡峭而下降支相对较为平坦;⑥a波大多为正常,仅有少数表现为a波幅增大。
10.CT检查
骨骼肌CT扫描可显示肌肉的选择性受累、肌肉萎缩和肌肉的假性肥大,肌肉萎缩在CT上仅表现为密度减低,体积缩小不明显。肌肉的假性肥大在CT检查表现为体积增大但肌肉的密度随着病变的加重却逐渐减低。而肌肉的真性肥大表现为肌肉体积增大,密度正常。
11.MRI检查
MRI很容易检出受损害的肌肉,确定病变程度和范围,特别是对于临床上肌萎缩不明显,皮下脂肪较多的患者。其图像与CT有共同点,但清晰度优于CT,所观察的病变范围也大于CT。在T1加权像上肌肉有轻重不等的信号增强,T2加权像可见信号增高更明显。肌肉假性肥大在MRI上除上述表现外还表现为肌肉体积增大。
1.一般处理
(1)避免患者长期卧床不从事活动。
(2)鼓励患者尽可能地保持质量较高的生活。这有助于防止因不从事活动而使病情迅速恶化,以及保持患者健康的心理状态。
(3)饮食中应有较多的动物蛋白质,较少的碳水化合物和脂肪以避免肥胖。因为肥胖会进一步降低患者的肺活量和行动能力,并使搬运患者更困难。
(4)应适当锻炼,只要患者能步行就尽量鼓励患者多活动。游泳对于他们来说是一项有益的运动。
(5)对患儿的教育不能停止,应教会他们做一些力所能及的工作。
2.对症治疗
主要是针对并发症的治疗:
(1)呼吸系统并发症:
由于呼吸肌无力、血氧不足及阻塞性通气障碍,患儿可出现呼吸功能恶化和通气不足,临床表现为晨昏、食欲减退、恶心、疲乏、注意力不集中及发育障碍,此时即使一般的感染也容易因咳嗽无力诱发呼吸衰竭。近年来家庭无创呼吸机的应用在缓解患者通气不足的症状和延长生存期方面非常有用,它既可以纠正通气不足又可以改善患者的症状,如果在需要时加用咳嗽辅助装置患者可以平均活到25岁甚至40多岁。
肺活量可以预测患者的高碳酸血症和生存期限,因此定期监测患者的夜间通气及肺活量有助于预防呼吸衰竭的发生。对肺活量低于50%的患者应该及时应用无创呼吸机。对于夜间有高碳酸血症而白天正常的患者缓慢启用无创呼吸机是一种有效的方法,可以避免患者因为一般的肺部感染出现不可控制的呼吸衰竭。
所有DMD患者最终都会出现呼吸衰竭,其他类型的肌营养不良患者的呼吸衰竭可缓慢出现,只在出现睡眠窒息,或由于二氧化碳潴留导致晨起头痛,或由于呼吸肌过度疲劳导致体重下降时才明显。因此,对于反复出现氧饱和度不足的患者,夜间辅助通气有助于改善患者白天的肌力。早期可应用负压护胸甲设备以周期性地扩张胸壁,或给予经鼻正压通气;晚期可采用通过气管造口的正压通气。
(2)心脏并发症:
心力衰竭是DMD患者死亡的第二常见原因。在DMD患者的心脏损害中,扩张型心肌病和心律失常最常见。扩张型心肌病主要是左室扩大,6岁的DMD患儿左室扩大占25%,10岁患儿左室扩大占59%,而成年DMD患者,几乎都有心肌受累。扩张型心肌病可引起心力衰竭,进而导致死亡。既往认为大约20%的患者死于心力衰竭,但近年来由于无创呼吸机的应用使这一比例大大增加,因此对于心脏病变的治疗显得尤为迫切。对于治疗心肌病的最佳时间目前尚无统一的意见。Duboc等人报道早期应用培哚普利可以延缓左心室功能下降的起始时间和进展,并且与降低死亡率相关。血管紧张素转化酶抑制剂(ACEI)在治疗扩张型心肌病时引起的副作用(如咳嗽、血管性水肿)较多,但研究发现血管紧张素受体Ⅱ阻滞剂(如氯沙坦)对扩张型心肌病的治疗似乎与ACEI疗效相同,且副作用明显减少。
虽然有心脏病专家认为没有必要在出现心力衰竭之前就进行治疗,但是目前越来越多的研究表明早期治疗效果优于晚期治疗。多数研究表明,ACEI、β受体阻滞剂和利尿剂应早期使用,即使是在心功能正常或接近正常的时候。很多研究支持对扩张型心肌病的患者应用β受体阻滞剂,其作用不仅可以抗心律失常,还可以提高射血分数和促进心室重构。此外,对于DMD伴心力衰竭患者,应用利尿剂、地高辛等可以控制患者的症状,提高生存率。
窦性心动过速在DMD患者中最常见,这可能是对缺氧和心力衰竭的反应。危及生命的心律失常是室性心室颤动,此时心脏射血基本停止,因此预防和及时处理室性心律失常很重要。
3.药物治疗
药物治疗是通过药物作用于病理生理的特定环节,如减轻炎症、促进肌肉前体细胞的增殖和分化、保持钙的平衡等方式来减轻DMD临床症状,目前使用的这些药物本身并不能纠正DMD基因缺陷。虽然药物治疗无法根治疾病,但能延缓病程、提高生活质量,所以仍然是临床上DMD治疗的主要手段。常用的药物主要有:
(1)糖皮质激素:
截至目前糖皮质激素仍然是治疗DMD的最常用的药物,随机对照试验已经证实糖皮质激素可以稳定肌肉功能6个月~2年。糖皮质激素最常用的方法是0.75mg/(kg·d)。非对照研究发现长期每天服用糖皮质激素(泼尼松)可以延缓患者独立行走的时间,保持呼吸功能,减少脊柱侧凸和心肌病的发生率。但是长期应用糖皮质激素的副作用不可忽视,首先是肥胖,但可以通过节食缓解这一问题。椎骨骨折也是很严重的副作用,可发生于1/3长期服用激素的患者。间断疗法可以减轻这一副作用,6个月的随机对照试验表明每个月前10天服用泼尼松0.75mg/(kg·d),后20天停用泼尼松,下一个月再序贯使用,可以延缓病情的恶化和减轻泼尼松的副作用。
目前国际上对泼尼松的应用已经达成一致意见,认为除非有糖皮质激素的禁忌证,否则泼尼松应该优先用于4~6岁可以行走的患儿及大部分年龄稍大的患者。对于长期应用来讲,0.75mg/(kg·d)对大部分患者不能耐受,因此要根据患者的情况做适当的调整,并且要提醒患者及时补充钙片和维生素D。糖皮质激素治疗DMD的确切治疗机制不清,可能与激素可以促进合成代谢、减轻炎症反应、抑制细胞毒性作用、刺激成肌细胞和增强肌力、提高钙平衡等有关。
(2)沙丁胺醇(salbutamol):
是一种非甾体β2受体激动剂,可以促进肌肉蛋白的合成代谢,减少蛋白的分解,促进肌卫星细胞的增殖。在多项双盲对照试验中,服用沙丁胺醇的DMD/BMD患者较安慰剂组膝关节屈伸力量及徒手肌力明显改善、肌肉体积增大,皮下脂肪减少。但是长期疗效有待于进一步观察研究。
(3)其他药物:
艾地苯醌、三磷酸腺苷(ATP)、肌苷、维生素E、灵芝胶囊、蜂花粉、胞磷胆碱钠以及改善肌肉微循环的中成药如通塞脉片、黄芪颗粒、通络活血丸、血府逐瘀胶囊等对肌肉有一定的营养作用。
4.康复治疗
早期进行适当阻力运动训练可以使DMD患者的肌力增强,但耐力训练并不能使心肺功能改善。每天被动伸展上下肢关节20~30次,辅以夹板固定可使挛缩减轻。坚持行走并保持直立位可延缓脊柱侧凸。预防性措施比促进恢复更有效。当患者丧失行走能力后,挛缩和脊柱侧凸迅速发展,这时可使轮椅轻度后倾或使用脊柱支架使脊柱下段轻度前凸以延缓脊柱侧凸的发生。
(1)物理疗法:
目的在于改善肌肉组织的微循环,加强和锻炼肌肉,促进代偿性肥大,转化和改善挛缩的肌腱组织,超短波、红外线、电刺激、超声波等方法可供选择。
(2)心理康复:
由于DMD患者迄今无满意治疗方法,患儿常陷入自暴自弃的心理环境中,情绪极不稳定,因此要做好耐心细致的思想教育工作,使患者从悲观情绪中解脱出来,坚持个体化治疗,提高对生活的信心。
5.家庭护理
国内大部分患者居家接受各种治疗,因此家庭护理十分重要。疾病早期应帮助、引导患者进行一定的运动锻炼,早期进行关节的屈伸运动,防止关节畸形和肌腱挛缩,坚持进行热水浴、按摩,改善肌肉的血液循环。在患者丧失步行能力后,进行各种日常生活的护理,坚持对肌肉的被动运动和各种康复治疗。疾病晚期应帮助患者翻身、排痰、改变体位,顺应患者心愿,获得最佳的效果。
晚期主要表现为心肺功能不全。可供选择的具体措施:①正压呼吸;②塑料筒式通气;③胸腹式护甲通气器;④间歇性腹部加压呼吸器;⑤气管内插管机械呼吸。
6.基因治疗
(1)DMD基因缺失突变的治疗(外显子跳跃法):
外显子跳跃治疗是采用反义寡核苷酸(antisense oligoribonucleotides,AONs)人为地干扰前体mRNA上有点突变的外显子,或有缺失、重复突变的前或后引起移码突变型外显子的剪接位点,从而恢复mRNA的阅读框并编码截短的、有功能的抗肌萎缩蛋白,将Duchenne表型变为Becker表型。虽然,DMD基因突变本身并无改变,但其mRNA不再含有被跳过的突变外显子信息,而使相邻的外显子拼接在一起形成完整的阅读框。
目前Eteplirsen仍在继续进行Ⅲ期临床试验,同时尚有针对其他外显子跳跃的药物在进行研发及临床试验。
(2)DMD基因无义突变的治疗(PTC124法):
PTC124是分子量284Da的1,2,4-𫫇二唑,能够跳过基因的无义突变位点提高mRNA的转录,生成几乎完整的抗肌萎缩蛋白,从而达到治疗目的。可能对5%~15%由于dystrophin基因无义突变导致发病的DMD患者有效。研发的药是ataluren。
(3)腺相关病毒载体介导的小基因治疗:
是一种替代基因治疗,可用于各种基因缺陷的DMD患儿。腺相关病毒(AAV)血清型9携带长度为6.3kb的DMD基因cDNA片段,可以在DMD患儿骨骼肌和心肌表达缩短的、有一定功能的抗肌萎缩蛋白,在动物实验成功后,已进入Ⅱ期临床研究。
预后与疾病类型(如DMD的病情较重)、遗传方式(常染色体隐性遗传病情较重)、基因突变类型(如DMD基因的移码突变,破坏了阅读框架,不能编码抗肌萎缩蛋白,故症状较重)、起病年龄(起病早者,症状较重)等有关。
由于目前尚无有效的治疗方法,预防至关重要,检出携带者、进行产前诊断、遗传咨询是重要的措施。首先,应确定先证者(患儿)的基因型,然后确定其母亲是否为携带者。当携带者怀孕以后应确定是男胎还是女胎,对男胎进行产前基因诊断,若是病胎则终止妊娠,防止患儿出生。













