英文名称 :bone neoplasms
骨肿瘤是发生在骨骼系统的肿瘤,分为原发性和继发性两种。原发性骨肿瘤的发生率约为2~3/10万人,占全部肿瘤的2%左右,其中又分为良性和恶性。继发性骨肿瘤是身体其他组织或器官的肿瘤转移到骨骼,属于恶性。骨肿瘤的发病情况男性比女性稍多,原发性骨肿瘤中良性比恶性多见。
骨与软骨恶性肿瘤的病因目前不是很清楚,但是这些肿瘤的不同的发病方式提示可能有不同的病因。骨肿瘤登记为在不同的国家或种族间进行骨肿瘤之间差异的比较提供了可能。通过全世界的各地区肿瘤治疗中心和肿瘤登记中心,已经发现了骨肿瘤发病的地区差异性。Larsson报道城市中骨肉瘤的发病率比农村高,Song发现在中国骨巨细胞瘤的发病率比西方国家高。SEER 1973~1987年收集的资料,证实了早先关于尤文肉瘤在黑种人群中发病率相当低的结论。SEER最近提供的资料表明脊索瘤在黑种人群中亦非常少见。但是我们对于骨肿瘤流行病学和发病机制的研究只是处于刚刚起步的阶段。因此,不同研究组织的资源共享对于这一相对比较冷僻的学科的进步至关重要。尽管实验室及病理学研究越来越倾向于病毒引起恶性骨肿瘤的假说,但是现在一定量的电离辐射是唯一已知的可能会引起人类骨肿瘤的因素。也可能是由于电离辐射可能会激活潜在的肿瘤病毒的原因。当有放射线损伤和慢性炎症存在时,尽管有其他骨恶性病的罕见原因及其他的暴露因素和条件(如铬、镍、钴、铝、钛,甲基异丁烯酸盐和聚乙烯)也被怀疑,但仍不能肯定地证实。近来,一些关于与金属植入和关节修复相关的骨肉瘤的病例的报道引起了关注。然而,关于病因的流行病学证据仍是有限或不能肯定。在未来,关于金属或是其他异物植入体内整形病人的分子生物学的研究可能为骨潜在恶性病变的发病机制提供线索。
准确的骨肿瘤的发病率非常难以统计,因为大部分的统计学资料是根据死亡病例得到的,并不能够完全地代表全部肿瘤。来源于骨与软骨的恶性肿瘤约占全身恶性肿瘤的0.5%~1%。NCI的一项统计中,1983~1985年的1 010 600例肿瘤病例中,有2100例(男性1200例,女性900例)新发骨肿瘤病例。不同种族人群的不同的骨肿瘤发病率受多种因素影响,这包括不具代表性的病例,还有诊断标准的不同等。但是通过比较不同国家的资料,包括英国、荷兰、美国和日本,发现各国的骨肿瘤的发病率还是非常相似的。
大体上,骨肉瘤的发病率只占所有肿瘤发病率的0.2%。比较骨肉瘤发病率与密切相关软组织肉瘤组的发病率可以看出,骨肿瘤发病率大约只占相对软组织肿瘤发病率的1/10。在南美和欧洲,男性骨肉瘤的发病率大约为每年0.8个新发病例/100 000人。在癌症组织学分类统计数据显示骨肉瘤在恶性骨肿瘤中发病率最高,约占35%,占25%的软骨肉瘤紧随其后,尤文肉瘤只占16%。近些年,由于对以往诊断类别区分率的显著下降,纤维肉瘤的诊断已经大大地被恶性纤维组织细胞瘤替代。
肿瘤发生的生物学核心定理是:肿瘤是由遗传调控机制消失的单克隆细胞增殖形成。肿瘤形成是一个复杂、多步骤的过程,是正常组织从正常的表型逐渐转变为不正常增殖细胞集落的过程。由于基因组的不稳定性,这一过程可使良性疾病状态失控而进展成为退分化、侵袭性和永生性的表型。就是这种不稳定性使细胞进展至突发恶变,DNA的调控以及相应的DNA的完整性最终遭到破坏,使得肿瘤产生。
因此,如果要想理解骨肿瘤的发生,就必须对细胞周期有基本的了解。细胞周期就是一个特定的细胞将它的遗传信息复制,并分别传至两个子细胞中的过程。这一过程由细胞蛋白质的复杂组合所协调,并被分成4个阶段:G1期(间期1)、S期(DNA合成期)、G2期(间期2)、M期(有丝分裂期)。DNA合成发生在S期,染色体分离、细胞分裂发生在M期。细胞生长大部分发生在G1期。成熟的间质组织正常情况下处于一个休眠、非增殖的阶段,即G0期。各种影响细胞从G0期进入G1期的因素都是肿瘤性疾病的标记。
大量的调控蛋白和调控点具备控制这一过程的功能,这些调控点监测和纠正遗传序列。这些蛋白质被编码为两种基本基因类型:癌基因和抑癌基因。癌基因编码许多生长因子,促进细胞进展通过G1期,产生有丝分裂的信号。抑癌基因(如野生型TP53),表现为抑制细胞周期。与其他抑癌基因不同,TP53将细胞周期停止在G1/S交界期,作为终止增殖的最后步骤。其他抑癌基因则在更早的阶段使复制停止。分子的复杂排列具备诱导或抑制功能。对细胞周期素和依赖细胞周期素激酶的研究正在进行,以期阐明它们在调节细胞周期中的作用。
当这一过程协调不正常时,某一细胞就获得了有限的甚至永生性增殖的潜能。随着基因突变的累积,一个正常细胞由癌前病变状态向癌症发展。基因突变过程中,抑癌基因失去功能是其中关键的一步,它的发生包括了一系列异常:缺失、易位、扩增、杂合性丧失、点突变、微卫星改变及端粒结合。源于连续有丝分裂而致发生基因组不稳定的数量决定了子细胞去分化至恶性表型的程度。由于调控点和调控机制修复基因编码持续失败,基因突变接连发生。
影响这些机制的因素包括遗传基因疾病(如视网膜母细胞瘤)或环境因素。众所周知,致癌病毒、射线、化学致癌物能够影响这些过程,并最终损害基因组的稳定性。
肿瘤产生的过程可以停止在“良性”状态,但随着越来越多的基因组不稳定的出现,可以进展至恶性状态,例如由软骨细胞起源的肿瘤有可能发展为骨软骨瘤或软骨肉瘤,而且软骨肉瘤能够进一步去分化为恶性程度更高的肿瘤,以至于表型几乎不能反映出其软骨细胞的起源。需要强调的是,并不是所有的良性肿瘤都有恶变的危险,骨软骨瘤外科治疗的指征绝不是仅仅因为担心骨软骨瘤有可能恶变为软骨肉瘤而将其切除。
尽管目前正在对多种分子标记物进行研究,但对基因组不稳定的细节以及随后肿瘤发生过程的了解还很匮乏。肿瘤生成过程的启动及其发展是基因表达和失调控的一个复杂的多步骤过程。肿瘤的产生不是通过单一途径,而是大量的基因靶位在不同的顺序中发生变化,这些变化的共同结果为细胞增殖,即肿瘤形成。
根据2020年《软组织和骨肿瘤WHO分类》(第5版),不同组织起源的骨肿瘤依据其生物学行为分为良性、中间型(交界性)和恶性肿瘤三类,但部分骨肿瘤的类属关系较2013年版有较大的改动,具体分类汇总如下,供参考。本文只选择其中较常见的几种肿瘤进行阐述。
2020年《软组织和骨肿瘤WHO分类》(第5版)(骨肿瘤部分)
骨肉瘤多发生于20岁以下的病人,80%发生于长骨末端。在这个年龄阶段,一小部分病例也发生在包括其他骨骼,如颅骨、脊柱和盆骨上。好发在四肢骨的骨肉瘤发病率有随着年龄增长而下降的趋势。在50岁以上的病人中,末端骨骨肉瘤只占病例数的50%。在这个年龄组,颅骨和骨盆骨肉瘤发病率各占了20%。50岁以上的病人末端骨骨肉瘤发病率大约只占年轻病人组的1/3。
软骨肉瘤发病率随着年龄增长而递增,可到75岁。相同年龄阶段的发病率也因性别和种族的不同而不同。50%以上的软骨肉瘤发生在长骨末端。骨盆和肋骨为其次好发的部位。肋骨和胸骨为恶性软骨肿瘤高发的部位。
尤文肉瘤的流行病学特征与骨肉瘤相似,但是骨肉瘤好发于骨骼未发育成熟病人的长骨的干骺端,而尤文肉瘤好发于骨干。同骨肉瘤的第一个年龄发病率高峰一样,尤文肉瘤也好发于10~20岁阶段。虽然在20岁后发病率迅速下降,但仍可见于各个年龄阶段。不同于骨肉瘤,尤文肉瘤多见于白种人群。
病理检查包括大体病理、HE染色检查、免疫组织化学、细胞遗传学、流式细胞仪及电镜检查等。
许多肿瘤都有相当典型的大体病理,如骨软骨瘤、骨样骨瘤、软骨母细胞瘤等。某些瘤样病变也有典型的大体病理特点,如骨纤维结构不良、骨囊肿、动脉瘤样骨囊肿等。大体病理也可以提供病变的特点,对肿瘤的侵袭性提供必要的根据,如肿瘤浸润范围、是否破坏皮质骨、是否突破骨膜和侵犯软组织。
显微镜下HE染色的诊断是综合诊断,首先应在整体下观察,只有当整体结构关系搞清楚后,再仔细观察局部(图1)。当有一个特异的病理形态而不能确诊时,应进一步研究X线片、临床和实验室检查结果,再进行补充切片和染色,正确的诊断与初次的镜下印象经常不同。
部分检查如免疫组织化学、细胞遗传学、流式细胞仪及电镜检查,需要特殊标本,因此进行活检的骨科医生在处理标本前应咨询病理科医生。另外,许多检查需要新鲜标本(无甲醛固定)。应养成对临床怀疑病例进行标本细菌培养(有氧及厌氧)、真菌及抗酸细菌培养的良好习惯。
分子学诊断将为肉瘤诊断带来革命性的变化。特异性分子改变可在不同的肿瘤中发现。另外,治疗恶性肿瘤特异分子缺陷亦在设计当中。如胃肠道间质肿瘤(gastrointestinal stromal tumor,GIST)是发生于胃肠道、大网膜及肠系膜的恶性间质肿瘤,其表现出c-kit突变的过表达。KIT基因编码为酪氨酸激酶受体,其调控生长因子被称为干细胞因子或肥大细胞生长因子。采用直接阻抗c-kit治疗难治性恶性肿瘤已显现出早期明显作用。同样的方法正开始应用于其他的肉瘤治疗中。
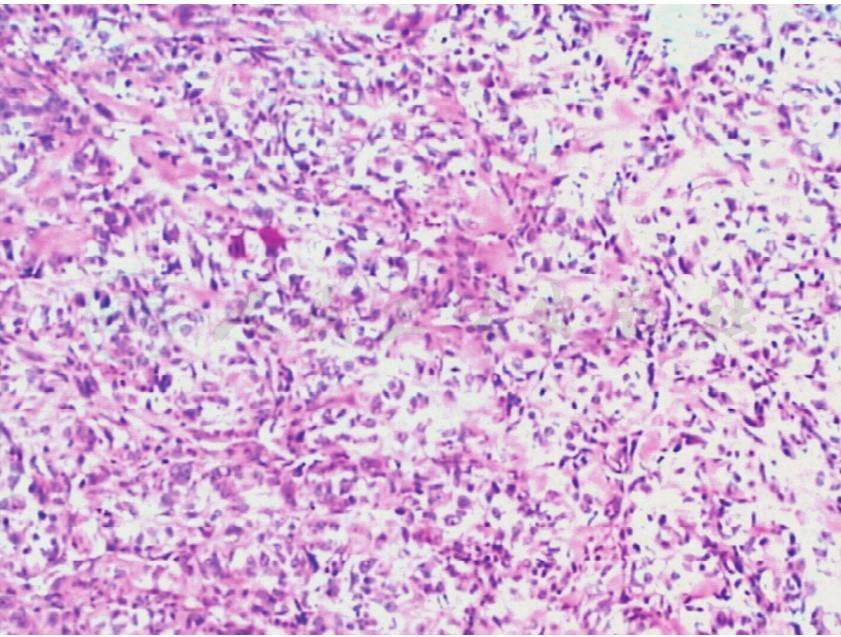
图1 骨肉瘤标本的HE染色图像
1.实验室检查
实验室检查是骨肿瘤检查的辅助方法。对于大多数骨肿瘤而言,常规检查都是正常的;但对于某些特殊肿瘤,实验室检查有诊断意义。如对于浆细胞骨髓瘤,患者血沉快、异常免疫球蛋白升高、A/G降低或倒置、尿本周蛋白阳性等;神经母细胞的转移出现儿茶酚胺的代谢异常;甲状旁腺功能亢进性骨病出现高钙血症、血清磷降低、血清碱性磷酸酶升高、甲状旁腺激素升高、尿钙增多、尿磷增多等。血清碱性磷酸酶及乳酸脱氢酶水平在骨肉瘤及Ewing肉瘤诊断及判断预后中有重要意义。
2.X线片
X线片是诊断骨肿瘤的首选影像学检查方法。优质的X线片可清晰地显示骨的细微结构,发现大多数的骨质异常,并结合临床表现,对大多数骨肿瘤做出定位定性诊断;X线片还可以观察肿瘤周围软组织内的肿瘤骨、钙化及其与病变骨的关系等。X线片之所以广泛应用的骨肿瘤的影像诊断中,是因为它能发现肿瘤、确定肿瘤部位、显示骨质破坏、病灶边缘、骨膜反应、肿瘤骨及软组织变化等多发面的影像征象从而可对骨肿瘤进行研究。
3.CT
随着影像设备的发展,CT逐渐成为骨、软组织肿瘤的重要检查方法。CT的密度分辨率较高,能清晰显示横断解剖结构,可以提供更多的诊断信息,CT还能够显示肿瘤内部的钙化,尤其是环形、半环形钙化的检出对于软骨来源肿瘤的诊断有确诊意义。骨盆、脊柱、髋关节、肩关节等部位由于肠气、粪便的重叠或由于骨骼结构的重叠、较厚的骨皮质的掩盖,X线片难以显示较小的病变,CT扫描就可以较好地显示骨肿瘤的范围、大小及其与邻近组织的关系,可以发现细小的变化如细微的钙化或骨化、病理骨折及骨质破坏等。
4.MRI
骨及软组织肿瘤的正确诊断和分期有助于术前辅助化疗、介入治疗和外科治疗方案的制订,正确的治疗方案不但提高了患者的生存率,而且改善了他们的生活质量。MRI可以准确显示肿瘤的范围,是肿瘤局部分期的最可靠的方法,也是除了X线检查以外骨骼系统最重要的影像学检查方法。MRI具有软组织分辨率高,多方位、多层次观察病变的优点,冠状位、矢状位、轴位MR成像较CT能提供更好的多角度空间信息,可以判断肿瘤大小形态和边缘、骨髓内外浸润、软组织、筋膜、血管、神经有无受侵,提高了影像对骨肿瘤分级的准确性。MRI对骨髓病变亦敏感,能发现早期骨髓内病变。MRI缺点在于难以显示细微钙化,对骨软组织肿瘤缺乏组织特异性,肿瘤的定性较困难。
5.血管造影(digital subtraction angiography,DSA)
血管造影是一种创伤性的检查方法。随着CTA和MRA技术的不断发展,DSA已很少用于骨软组织肿瘤的诊断。仅当怀疑血管畸形或血管性肿瘤复发时,才行血管造影。DSA可显示骨软组织肿瘤的肿瘤血管以及对邻近大血管浸润压迫。可通过观察肿瘤大小的变化和血供情况来监测肿瘤血管内化疗的效果。
6.核素扫描
核素扫描敏感性高,对于肿瘤髓腔侵犯较X线片敏感。核素骨扫描有很高的敏感性且能够覆盖全身,有利于发现病变。核素扫描的缺点是易出现假阳性,因为骨与软组织的任何病理变化都可能增加血流量或使骨代谢加快,包括肿瘤引起的充血和水肿也可以使同位素浓聚。
骨骼系统肿瘤可以破坏骨质,造成病变部位肿胀、疼痛、畸形、功能障碍,甚至威胁生命,因此骨肿瘤治疗的原则是保护患者生命的基础上解除患者局部症状,恢复运动功能。
良性肿瘤主要引起患者局部骨强度下降、肿块、畸形等,这主要需要局部手术治疗;恶性肿瘤除造成患者局部症状外,还可以转移、威胁患者生命,因此在进行局部手术治疗的同时还需要辅助化疗、放疗、免疫治疗等方法。













