(一)儿童霍奇金病
1832年,霍奇金(Hodgkin)首先对本病在解剖学水平进行描述,因此而命名为霍奇金病(Hodgkin disease,HD),当时认为它是一种脾脏和淋巴结异常性疾病。直至19世纪50年代以后,由于显微镜技术的发展才对本病有了更进一步的了解,镜下观察到巨大畸形的细胞作为霍奇金病的诊断依据。Sternberg和Reed分别在1898年和1902年对霍奇金病的组织病理学变化作了全面的定义和说明。Reed对本病中的巨型多核细胞作了仔细的描述,并否认了这些细胞来自变异型结核的观点,以后这些畸形巨型细胞被命名为Reed‐Sternberg细胞(R‐S细胞)。霍奇金病的浸润细胞有多样性,多数为形态正常的反应性细胞,其中的R‐S细胞由相对成熟的淋巴细胞恶性转化而来。
(二)儿童非霍奇金淋巴瘤
儿童非霍奇金淋巴瘤(non‐Hodgkin lymphomas,NHL)是源于免疫系统器官和细胞的一系列疾病的总称,包括所有未归类于霍奇金病的恶性淋巴瘤。由于儿童非霍奇金淋巴瘤涉及游走于全身各处的淋巴细胞,其在发病部位和蔓延速度上类似于儿童白血病,倾向于归类为全身性疾病。儿童NHL的现代治疗策略与儿童急性淋巴细胞性白血病(acute lym‐phoblastic leukemia,ALL)的治疗极其类似。此外,免疫系统细胞具多样性,细胞分化为不同功能的多种细胞,以履行各种机体防御的职责。细胞恶变可发生在这些功能截然不同的细胞及其前体细胞之中,因此,儿童NHL的形态学特征、免疫学特征及临床表现均呈现出多样化。
组织病理学、免疫学、细胞学及分子生物学的发展已极大地推动了我们对NHL生物学的理解,对正常及恶性淋巴细胞行为学和分子学基础研究的进步也使这些疾病得到了更合理的划分。这些发展直接源于对正常免疫系统生物学及其构成的理解。同时对恶性淋巴瘤的研究也充分增进了我们对正常淋巴细胞发育的认识。
儿童NHL治疗的进展是过去20年中最为成功疾病之一。超过75%的患儿现在可经现代疗法治愈,而近期研究正着重于治疗减量,以减少治疗的近期和远期的并发症。值得注意的是,疗效的明显进步并非源自新型有效药物的开发,而是基于对NHL生物学、免疫学及分子生物学更深刻认知的、更合理的分类系统和相适应的治疗方案的进步和支持治疗的进展。
儿童霍奇金病
病变组织中常有正常淋巴细胞、浆细胞、嗜酸粒细胞、组织细胞反应性浸润,伴有细胞形态异常的R‐S细胞。R‐S细胞大而畸形,直径≥15~45μm,有丰富的胞质,多核或多叶核,核膜染色深,有细致的染色质网,在核仁周围形成淡染的圈影、核仁大而明显。未见到R‐S细胞时很难诊断本病,但在其他一些疾病中如传染性单核细胞增多症、非霍奇金淋巴瘤及其他非淋巴系恶性肿瘤中也可见到类似细胞。
1966年提出RYE分类系统,将HD分为4个组织学亚型。1994年Real及2001、2008年WHO又分别在此基础进行了修订,三个分型间的关系及免疫标记特征(表1)。目前国内外均采用WHO 2008分型标准。
表1 HD分型标准变迁及WHO‐2008分型标准

(一)儿童霍奇金病
根据我国上海市肿瘤登记系统,1986~1992年间,0~14岁组儿童HD的年发病率为2.39/百万,男女比为2.3∶1。流行病学调查提示疱疹病毒6、巨细胞包涵体病毒、EB病毒感染可能与发病有关。
(二)儿童非霍奇金淋巴瘤
儿童淋巴瘤的发病率依年龄不同,在世界不同地区也有显著差异。在美国和发达国家,恶性淋巴瘤(包括NHL及霍奇金病)是继白血病和脑肿瘤之后第三个常见的儿童恶性肿瘤,在小于20岁的少儿中占儿童恶性肿瘤的15%。10岁以下的儿童中NHL比霍奇金病更为常见,但霍奇金病的相对发病率在大于10岁的儿童中迅速上升。15~19岁之间的儿童霍奇金病发病率几乎是NHL的两倍。所有年龄组内男性均占主导地位,但在小于15岁的儿童组内尤其显著,约有四分之三的病例发生于男性。NHL发病率因年龄有显著差异;5岁以内儿童NHL并不常见,仅占所有肿瘤的3%,NHL的发病率在整个人生中持续上升,在10岁以上的儿童肿瘤中占8%~9%。此外,特定组织学亚型发病率与年龄有关,如Burkitt及Burkitt样淋巴瘤在5~15岁儿童中多见,而淋巴母细胞性淋巴瘤(lymphoblastic lymphoma,LL)的发病率则在各年龄组中比较恒定。弥漫性大B细胞淋巴瘤(diffuse large B‐cell lymphoma,DLBCL)是一种好发于大龄青少年的疾病,其发病率在整个童年期稳步上升,并在15~19岁年龄组内作为主导地位的组织学亚型达到高峰。不同亚型NHL的发病率和相对频率在世界各个地区也有很大差异。2002~2005年上海市肿瘤登记系统统计结果表明上海市0~14岁组儿童淋巴瘤年发病率为9.9/100万,在儿童肿瘤中占第三位,仅次于白血病和颅内肿瘤,其中近80%为NHL。
儿童非霍奇金淋巴瘤
NHL为一组复杂疾病,无论从细胞形态学、临床表现、免疫表型,还是最近的细胞遗传学/分子生物学均有差异较大的变异。因此历史上各个分类系统里使用的术语复杂而多变,如不同系统中相似的术语常用来指定不同的对象,同时不同系统中不同的术语也用来指定形态学及临床上相似的对象。自从对正常免疫系统有了更深的认识,免疫诊断技术也应用于NHL的诊断,NHL是淋巴细胞在分化成熟过程中某个时期细胞恶变的结果。大约40%~50%儿童NHL都起自T细胞系;同等比例的病例则来自表达表面免疫球蛋白的B细胞肿瘤。仅有不到10%的儿童NHL为缺乏表面免疫球蛋白的早前B细胞肿瘤。值得注意的是,儿童NHL免疫表型特征与在儿童ALL有明显不同,后者约85%病例为早前B细胞免疫表型,15%源自T细胞,而仅有不到2%的病例是表达表面免疫球蛋白的成熟B细胞表型。NHL的现代分类方案包含了淋巴细胞性白血病,从而确认了NHL与ALL之间的紧密关系,并认识到从骨髓浸润的程度区别ALL和NHL并不合理。纵观所有淋巴系肿瘤,似乎早期B系来源淋巴肿瘤常起源于骨髓,临床上表现为ALL;而T细胞及成熟B细胞肿瘤分别源于胸腺和肠道淋巴组织的生发中心,较前者更可能起源于髓外部位,临床上则表现为NHL为多。大细胞淋巴瘤从形态学和免疫学上均表现有异质性。约1/3的儿童大细胞淋巴瘤为B细胞肿瘤;1/3为T细胞来源,且通常表达胸腺后“激活”T细胞的抗原谱;另30%则来自不确定的谱系(非T、非B)。极少数病例来自组织细胞/巨噬细胞系,此类可被称为“真性组织细胞淋巴瘤”(表2)。
表2 儿童NHL组织病理学、免疫表型、临床特征、细胞遗传学及分子学特征之间的关系
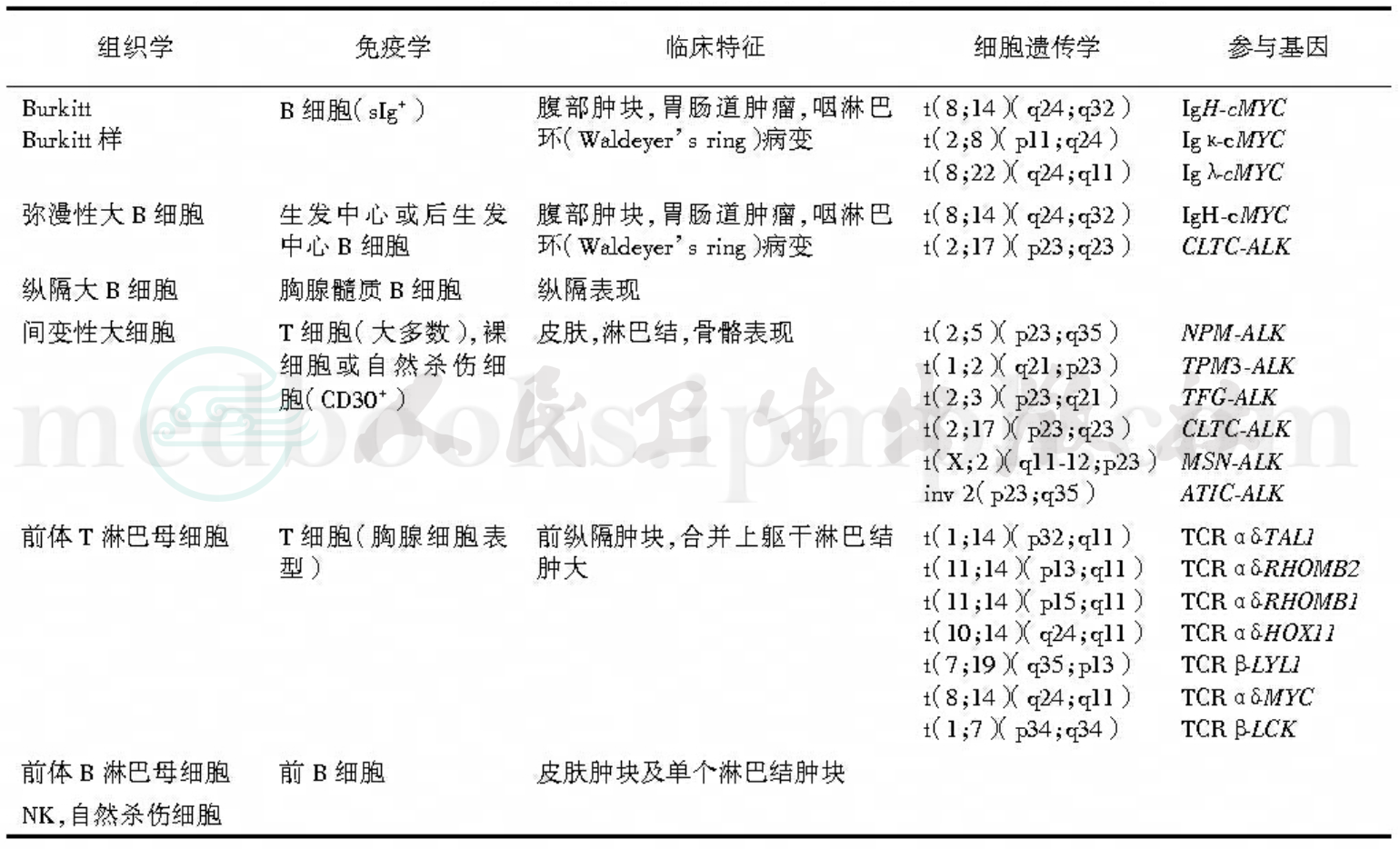
以欧洲/美国主导的REAL淋巴肿瘤分类法(REAL classi‐fication)将免疫学、分子遗传学及标准形态学结合,并由此形成了WHO造血系统及淋巴肿瘤分类法的基石。由此而来的WHO分类法将源自前体(淋巴母)淋巴细胞到成熟淋巴细胞各阶段起源淋巴系肿瘤ALL和NHL均包括在内,基于免疫表型谱(B细胞或T细胞/自然杀伤细胞肿瘤)进一步分类。这一分类系统体现了淋巴细胞在不同成熟阶段恶变所形成的NHL和ALL自特定的临床、形态学、免疫学、遗传学特征。
根据WHO 2008分类标准,儿童NHL主要有四个重要类型:成熟B细胞肿瘤(包括Burkitt淋巴瘤/成熟B细胞性白血病、未能进一步分类的B细胞淋巴瘤、弥漫大B细胞淋巴瘤及纵隔大B细胞淋巴瘤亚型),成熟(或周围)T细胞及自然杀伤细胞肿瘤(包括ALCL、CD30+、T细胞及裸细胞型),前B细胞肿瘤(包括前体B淋巴母细胞白血病/淋巴瘤),以及前T细胞肿瘤(包括前体T淋巴母细胞白血病/淋巴瘤)。
1.Burkitt淋巴瘤
Burkitt淋巴瘤在显微镜下肿瘤细胞弥漫性浸润,细胞小,含圆或卵圆形细胞核、1~3个强嗜碱性核仁,以及常含有脂泡的嗜碱性胞质。增殖抗原Ki‐67高表达。零散的残余正常巨噬细胞散布于恶性细胞之间,呈现特征性的“星空”貌。从免疫学上来说,Burkitt淋巴瘤及其变异型是生发中心B细胞肿瘤,细胞膜表达κ或λ轻链相关的表面免疫球蛋白(常为IgM),并可表达B系相关抗原CD19、CD20、CD22、CD79a及CD10,但常不表达末端脱氧核苷酸转移酶(TdT),是否表达TdT有助于鉴别Burkitt淋巴瘤与LL。
1%~2%ALL患者有Burkitt淋巴瘤的形态学及免疫学特征(即FAB形态学分类中的L3型),常伴有腹部或其余部位的包块性疾病,可以将之视为极晚期Burkitt淋巴瘤,对这类患儿应采用晚期Burkitt淋巴瘤的治疗方案。绝大多数Burkitt淋巴瘤存在非随机染色体易位[t(8;14)(q24;q32)],结果是8号染色体上的MYC原癌基因与位于14号染色体的免疫球蛋白重链基因融合。另两种变异易位可在15%的Burkitt淋巴瘤病例中观察到,包括t(2;8)(p‐11.1;q24.1)及t(8;22)(q24.1;q11.2)。
2.间变性大细胞淋巴瘤
间变性大细胞淋巴瘤(ALCL)是儿童大细胞淋巴瘤中最常见的亚型,绝大多数归于成熟T细胞和自然杀伤细胞肿瘤。ALCL约占儿童NHL的8%~12%,或儿童大细胞淋巴瘤的30%~40%。组织学常表现为凝聚性的、奇形怪状的、含丰富胞质的多型性大细胞,包含形状怪异的马蹄形细胞核,有多个或单个明显核仁。免疫学和分子学研究表明,大部分ALCL表达T细胞抗原。该类肿瘤细胞也表达上皮细胞膜抗原(epithelial membrane antigen,EMA)和CD30(Ki‐1)抗原ALCL常存在特征性非随机染色体[t(2;5)(p23;q35)]平衡易位,染色体5q35位上的核磷蛋白基因NPM,与染色体2p23位上的间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK),一种酪氨酸激酶基因融合。
3.淋巴母细胞白血病/淋巴瘤
WHO将前驱T或B淋巴母细胞型白血病/淋巴瘤归为同一类,前驱T细胞起源者以淋巴瘤为多见,而前驱B细胞起源者以白血病多见。同一系列(T或B)的白血病或淋巴瘤在病理/细胞形态学、免疫学、生物遗传学均无法鉴别白血病还是淋巴瘤,但临床上前者骨髓原发,而后者骨髓外局部原发。T系相关抗原表达通常包括UCHL1(CD45RO)、CD1、CD2、CD3、CD4、CD5、CD7、CD8、CD56;B系表达CD19、CD20、CD22、CD79a及CD10,类似B系白血病,不表达细胞膜表达κ或λ轻链相关的表面免疫球蛋白(常为IgM)。前驱T和B淋巴细胞均表达TdT。
(一)儿童霍奇金病
1.血液学检查
血常规检查常无特异性异常,偶可见到嗜酸粒细胞或单核细胞增多。血沉可增快。
2.淋巴结活检
病理组织形态检查是确诊的必需手段。
3.影像学检查
可选择性作胸部X线平片、腹部B超、胸部CT、腹部CT,以确定病变的范围。由于67镓对淋巴组织亲和力高,可作67镓扫描作为补充检查确定肿瘤浸润范围。
4.骨髓活检
HD可发生灶性骨髓转移,因此骨髓活检比骨髓涂片容易发现肿瘤细胞,在治疗前应常规作骨髓活检。
(二)儿童非霍奇金淋巴瘤
1.影像学检查
全身的影像学检查以评估疾病浸润范围,见分期检查。
2.实验室检查
实验室检查:①血清乳酸脱氢酶(LDH)水平与肿瘤成正相关,并和预后相关,因此在治疗前应进行评估;②高肿瘤负荷者可发生心、肝、肾等重要脏器的浸润而致功能不全,治疗前因仔细评估;③高负荷NHL在治疗前、初始治疗的一周内易发生肿瘤细胞溶解综合征,因此在这段时间内应定时进行肾功能、血电解质的监测;④进行增强CT检查前应先核实肾功能情况,有肿瘤细胞溶解综合征或肾功能不良时应避免增强CT,因造影剂可能加重肾功能不全;⑤外周血常规检查如存在贫血、血小板减少常提示为晚期或有骨髓浸润;⑥骨髓涂片可除外骨髓浸润;⑦浆膜腔液体沉渣涂片检查结合免疫表型检查有助于诊断、鉴别诊断和肿瘤浸润状态的评估。
3.疾病分期检查及分期标准
在治疗前必须先明确分期,常规分期检查包括以下项目:全身体格检查,眼底检查,骨髓活检及涂片,胸腹盆腔影像学检查(以增强CT检查为主),脑脊液离心甩片找肿瘤细胞,疑有中枢浸润时增强头颅MRI或CT以除外颅内转移,疑有骨骼浸润时全身骨扫描。通过以上检查确定肿瘤浸润范围并据此作出临床分期。常用分期标准为St﹒Jude分期系统,标准(表3)。
表3 St.Jude非霍奇金淋巴瘤分期系统
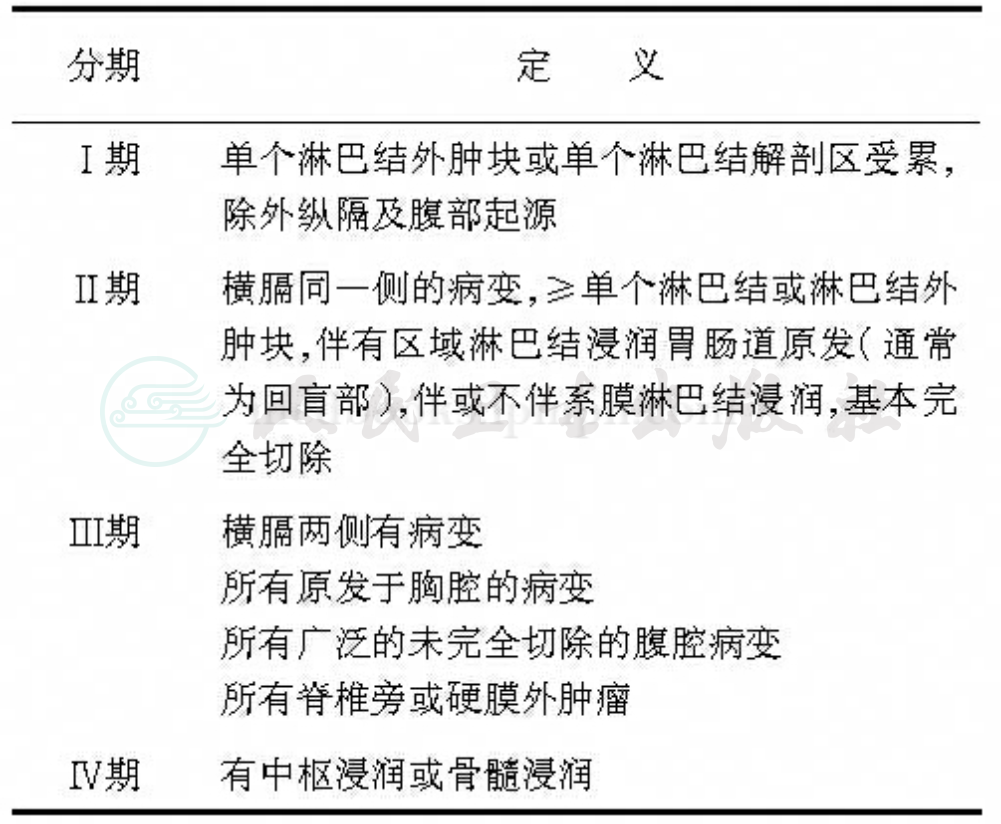
注:中枢神经系统浸润定义:1.CSF WBC≥5个/μl,并CSF标本离心发现淋巴瘤细胞;或2.有明确中枢神经系统受累症状和/或体怔,如脑神经瘫痪,并不能用其他原因解释;或3.脊髓浸润;或4.孤立性脑内肿瘤性病变。骨髓受累定义:1.骨髓穿刺涂片见≥5%但<25%的幼稚淋巴细胞;2.或骨髓活检发现局灶性浸润。
(一)儿童霍奇金病
主要的治疗手段为化疗和放疗。
1.放疗
HD对放疗敏感,20世纪70年代以前,无论年龄、分型和分期的差别均采用放疗。70年代以后才有专门以儿童为对象的治疗方案。目前对生长期儿童主要采用联合化疗加肿瘤浸润野低剂量放疗,有试图进一步减少或删除放疗的倾向。对已完全发育的青少年局限性病变采用肿瘤扩大野高剂量放疗。常用的放疗野有以下几个:
1.Waldeyer野
用于Waldeyer或耳前淋巴结病变。上颈部病变并以放疗为单一治疗手段时应同时作Waldeyer野预防性放疗。
2.横膈上斗篷样野
包括颌下、颏下、颈部、锁骨上下、腋下、纵隔和肺门淋巴结。
3.横膈下野
包括脾和主动脉旁淋巴结。
4.倒“Y”野
包括髂总、髂外、腹股沟淋巴结。
2.化疗
经典联合化疗方案MOPP对成人与儿童的晚期HD有50%的治愈率。ABVD方案仍可使50%的MOPP耐药者获得缓解。MOPP与ABVD联合时耐药者减少。化疗剂量宜大,但过长的维持治疗并不延长缓解期,根据不同分期以4~6个疗程为宜。常用的MOPP、COPP、COPP/ABV方案(表5)。
表5 HD化疗方案
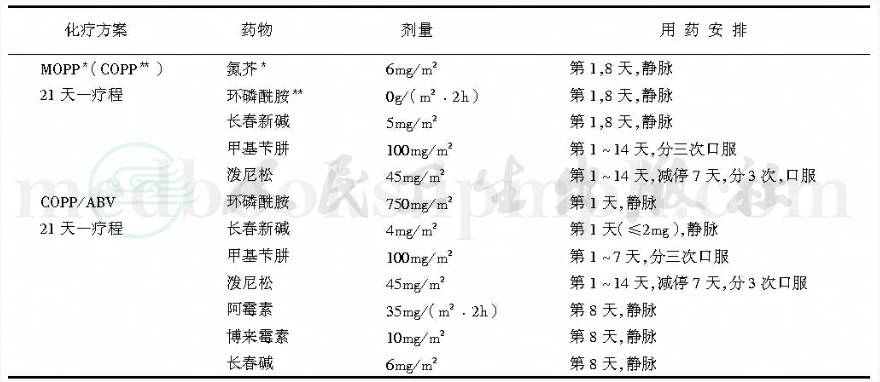
注:*MOPP中M为氮芥 ;**COPP中C为环磷酰胺。
(二)儿童非霍奇金淋巴瘤
1.整体治疗原则及目标
治疗的目标是使疾病获得完全缓解并长期无病生存,同时获得正常的远期生命质量。治疗原则上以化疗为主,根据不同分期、形态分型或/及免疫分型采用不同药物联合和强度的治疗方案。除中枢浸润、脊髓肿瘤压迫症、化疗后局部残留病灶、姑息性治疗等特殊情况外,常规治疗不推荐放疗。手术主要用于下列情况:①手术活检,尽量争取获得组织标本以明确诊断及分型,如肿块较小并为局限性病变,可将肿块完全切除。估计肿块不能完全切除时应仅做小切口活检术,不推荐肿瘤部分或大部分切除术;②急腹症:出现如肠套叠、完全性肠梗阻、肠穿孔、严重的胃肠道出血等外科急腹症时考虑急诊手术;③二次活检及手术:化疗3个疗程后有稳定残留病灶时,应考虑再次活检(手术),为进一步治疗提供依据。
2.急诊处理
儿童NHL临床进展较快,应将之视作急诊,尽快完成各项检查明确诊断。如为巨大纵隔肿块伴有气道及上腔静脉压迫症状,无外周淋巴结肿大,细胞学检查(如骨髓及胸腹腔积液)也不能诊断时,可选择性采取肿块粗针穿刺活检、纵隔镜活检或胸骨旁切口活检。如此时有危及生命的现象,全身麻醉过于危险,临床及影像学检查符合NHL,为抢救生命可给予紧急低剂量化疗,12~24小时后多数病人的压迫症状就可能得到缓解,病情稍稳定后再行活检(24~48小时内),但此时由于受化疗影响组织细胞学判断可能出现困难,因此应尽量避免先治疗后活检。治疗时间越长病理诊断越困难,因此即使先治疗缓解危及生命的状况,也应积极准备在治疗48小时内进行活检手术。有胸膜腔积液或心包积液时可引流改善症状。对已明确诊断的肿瘤负荷较大的患儿,应尽早采用3~7天低强度化疗(如糖皮质激素和长春新碱),同时给予水化2000~3000ml/m2、5%碳酸氢钠5ml/kg碱化尿液、别嘌呤醇10mg/kg抑制过多的尿酸形成,维持水电解质酸碱平衡,避免肿瘤细胞溶解过快造成的肿瘤细胞溶解综合征。刚开始治疗时,输入液体多时可致原有的胸腹腔积液增多,必要时可留置引流。
3.支持治疗
(1)治疗期及治疗结束后1月TMP‐SMZ 50mg/(kg·d)分两次口服,每周用三天,大剂量MTX前24小时至MTX血浓度降至<0.1μmol/L期间停用。以预防肺孢子虫感染。
(2)当外周血白细胞<1000/cm3或粒细胞绝对计数<500/cm3时应用C‐CSF或GM‐CSF 5μg/(kg·d)至外周血白细胞>2000/cm3。
(3)血小板减少并有活动性出血或血小板<20×109/L输注血小板。
4.各亚型NHL的方案选择
根据病理形态学分型及/或免疫分型,分别采用成熟B细胞型NHL(非淋巴母细胞型)或淋巴母细胞型NHL(免疫表型为前驱T或前驱B)治疗方案,根据分期及分组化疗强度不同。成熟B细胞性NHL(代表性疾病为伯基特淋巴瘤)的化疗方案原则是短程、强烈,以烷化剂和抗代谢性药物(主要是甲氨蝶呤和阿糖胞苷)为主,化疗强度根据临床分组或分期而定。而对前驱T或B淋巴细胞型NHL(形态为淋巴母细胞型)的化疗方案原则与急性淋巴细胞白血病(ALL)一致。具体方案见后供参考。













