急性髓细胞白血病(acute myeloid leukemia,AML)占儿童急性白血病的20%左右,全球每年新发儿童和青少年(0~21岁)AML约10 000人。儿童AML可发生于任何年龄,男女之间无差异。AML在1岁以内出现第一个发病高峰,然后逐渐下降,4岁后处于平台期,发病率约为5~7/100万,到青少年期以后AML发病率又开始上升。既往AML的治愈率约为40%,远不及儿童ALL,近年来采用强化疗、短疗程的方案,儿童AML的治愈率可达65%以上。
白血病的分型是指导临床选用治疗方案和提示预后的基础。目前采用MICM即形态学(morphology)、免疫学(immunology)、细胞遗传学(cytogenetics)和分子生物学(molecular biology)分型。随着人类基因组计划的完成和基因研究的不断进展,基因学分型将是白血病新的分型方向。
1.形态学分型
也称FAB分型,1976年法、美、英(French-American-British,FAB)三国的血细胞形态学专家讨论制订了白血病的形态学分型,将AML分成M1~M7共7个亚型,后来又增加了“M0”型。
(1)急性髓系白血病微分化型(M0):
极少见。骨髓中幼稚细胞占30%以上,形态学和细胞化学染色不能证明髓系来源,但免疫方法或电镜能检出髓系表达标志。该型的其他特点有表达T细胞相关抗原CD7及具有AML1基因的突变。
(2)急性髓系白血病未成熟型(M1):
骨髓中髓系幼稚细胞占90%以上,细胞大,核圆、规则,核仁1个或数个,胞浆少,可有Auer小体,MPO(±),无颗粒。
(3)急性髓系白血病部分分化型(M2):
骨髓中髓系幼稚细胞占30%以上,细胞很大,核肾形,核仁1个或数个,胞浆量不等,有细小颗粒及Auer小体。
(4)急性早幼粒细胞白血病(M3):
细胞很大,核肾形,核仁1个或数个,胞浆量不等,可有Auer小体,胞浆含粗大颗粒是其特征。
(5)急性粒单细胞白血病(M4):
可以说是M2+ M5,粒单幼稚细胞各占20%以上。骨髓中嗜酸细胞增多时称为M4Eo。
(6)急性单核细胞白血病(M5):
骨髓原始中幼稚单核细胞增多。细胞大,核不规则,锯齿状,核仁少见,轻度嗜碱,含天蓝色颗粒。
(7)红白血病(M6):
骨髓中有核红细胞占50%以上,以原始及早幼红为主,髓系幼稚细胞占30%以上,粒细胞中可见Auer小体。
(8)急性巨核细胞白血病(M7):
骨髓中原始巨核细胞占50%以上,形态学很难独立诊断,常需用免疫学等方法协助鉴别。
以上FAB分型只是根据白血病的形态学,但后来随着对AML研究的不断深入,发现了AML一些特异的遗传学和分子学标志。WHO于1997年、2001年和2008年三次修订AML的分型标准,不仅将诊断AML的幼稚细胞百分率降到20%,而且指出即使幼稚细胞未达诊断标准,但如果具有特异的遗传学和分子学标志,也应诊断为AML。
2.免疫学分型
根据血细胞在发育不同阶段表达不同的抗原,用相应抗体进行检测的一种方法。特别是20世纪80年代后采用流式细胞术结合单克隆抗体的方法检测白血病细胞的抗原表达,能精确区分不同系列的白血病,并发现了急性混合细胞白血病(acutemixed leukemia),即白血病祖细胞中同时表达髓系和淋系相关抗原标志。2008年WHO在血液肿瘤分类标准中将此类白血病统一命名为混合表型急性白血病(mixed phenotype acute leukemia,MPAL)。
CD13、CD33、CD117是髓系最常见的表达标志,在90%以上AML患者的幼稚细胞上表达。AML的免疫分型标志有:M0具有 CD34、TdT、CD7阳性; M1~M5表达CD13、CD33、CD14(多见于M5)、CD15 (M4型100%表达)、HLA-DR、MPO等髓系标志的一种或多种,但M3常出现CD34、HLA-DR阴性;M6具有血型糖蛋白A或膜收缩蛋白阳性;M7表达CD41、CD42b、CD61。
3.细胞遗传学和分子生物学分型
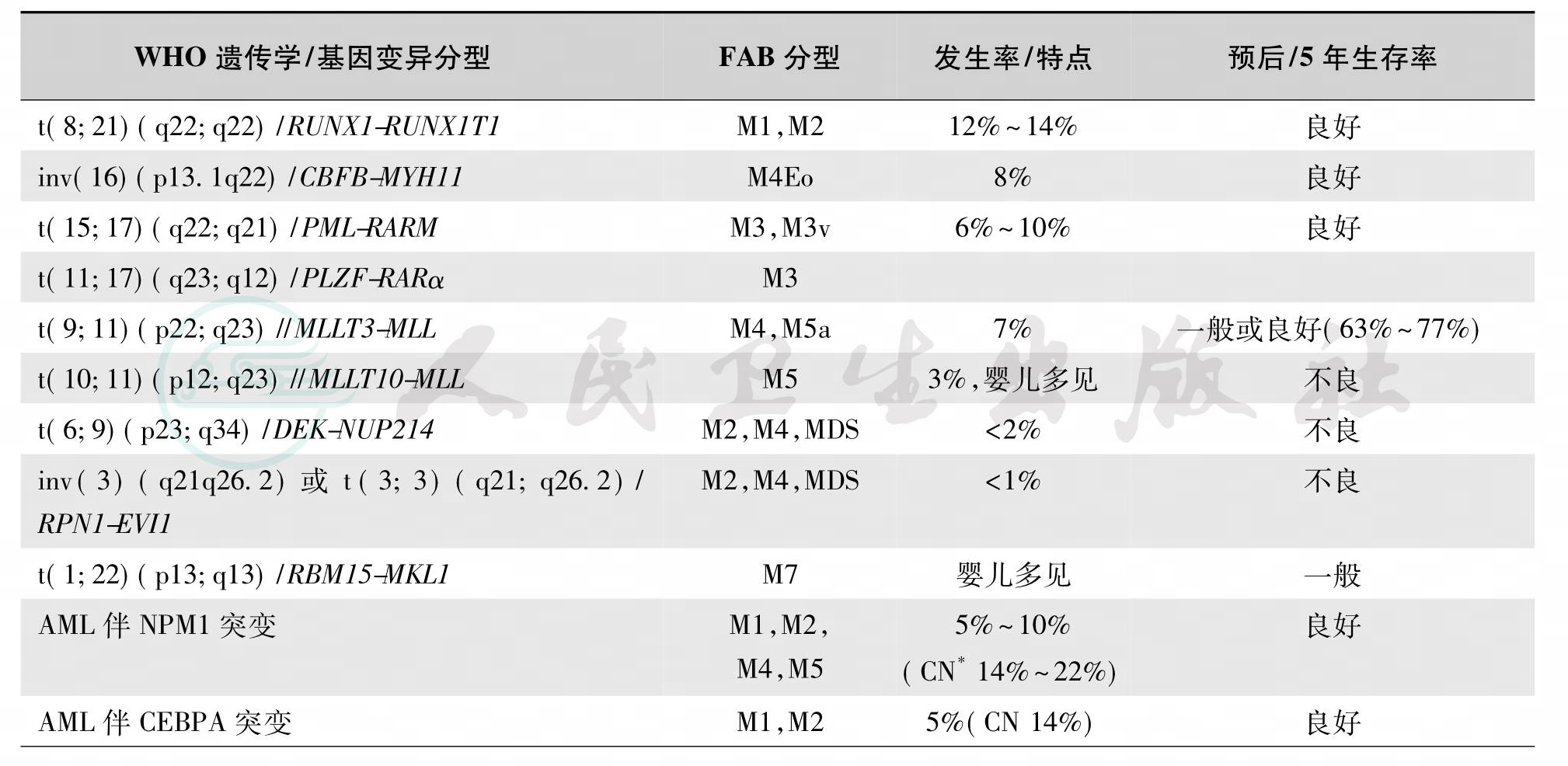
在儿童AML中,可检出70%以上的染色体/基因异常。2001年WHO发表了AML的遗传学分型,其后在2008年又进一步修订,确立了AML遗传学及分子学特点(表35-13)。从此对AML的诊断不再机械地定义于幼稚细胞必须达到20%以上,而是更重视特异的遗传学异常,即如果有特异的AML遗传学变异,不管幼稚细胞比例多少,都应诊断为AML7。
儿童AML常见染色体/基因变异与FAB分型具有一定的相关性,其发生率及与预后情况见表35-13。
表35-13 儿童AM L常见染色体/基因变异的发生率及与预后关系
续表

注:良好、一般及不良定义:5年生存率>70%为良好,50%~70%为一般,<23%为不良。*CN:细胞遗传学正常
1.血液检查
多数患儿的血常规检查有贫血和血小板减少。白细胞数量可高可低或正常,约20%的患儿白细胞数超过100×109/L,但中性粒细胞多降低。外周血涂片需仔细观察,有些会出现Auer小体,更提示为AML。所有AML患儿均需行凝血功能检查,如果APL患儿出现DIC表现,还需行D-二聚体检查。AML患儿还需常规行尿酸检查,以监测肿瘤溶解综合征的发生。化疗及输血前的其他常规检查还有肝炎病毒A、B、C,HIV,EBV及VZV等。
2.骨髓检查
AML的确诊必须行骨髓穿刺检查,并进行MICM分型。
3.脑脊液检查
中枢神经系统白血病占白血病的5%,在起病时可无任何症状,常见于高白细胞、年龄小、单核细胞性及MLL基因重排的白血病。腰椎穿刺抽取脑脊液后行离心甩片法检测,如果腰穿无损伤,WBC>5×106/L并见有幼稚细胞,便可诊断为中枢神经系统白血病。当患儿伴有高白细胞血症或为APL时,应避免行腰椎穿刺,以免将白血病细胞带入中枢神经系统。对这类患儿可先行化疗及输注血小板等,使其白细胞下降及DIC纠正后再进行腰椎穿刺术。
4.影像学检查
所有患儿都应行胸片检查。由于白血病患儿的化疗用药具有心脏毒性,因此ECG和超声心动图也是必须做的基本检查。根据患儿情况,选择性进行头颅CT或MRI检查。
治疗
WHO新的分类方案(2008版)对髓系肿瘤和急性白血病提出了遗传学变异的分型,强调新诊断的AML需完善遗传学检查后方可开始化疗。由于现代化疗方案的进步,目前AML完全缓解率已达85%以上,总体生存率已达70%以上,其中APL的生存率已达90%以上,这些成绩的获得依赖于高强度的化疗及有力的支持治疗,使致死性的并发症得到有效控制。目前HSCT已很少用于初次缓解的AML患儿。
1.治疗原则
对AML患儿应实施强化疗以获得早期缓解和长期生存。应根据初诊时的复发危险度评估给予分层强化疗:当患儿具有良好预后因素时,应避免超强度化疗;反之,当患儿具有不良预后因素时,应给予高强度化疗。遗传学异常和早期治疗反应是评估预后的两个重要方面。根据下列指标将AML的预后分成三组:
(1)预后良好组:
CBF AML-t(8;21)和 inv (16)、t(15;17)、t(1;11)、NPM1突变伴核型正常、GATA1。
(2)预后不良组:
-7、-5或del(5q)、t(4;11)、t(6;11)、t(10;11)、t(6;9)、t(7;12)、inv(3)或t(3; 3)、复杂核型(3条以上的染色体变异)、WT1突变/ FLT3-ITD。
(3)预后一般组:
无预后良好、也无预后不良的因素,包括正常核型的AML。
诱导治疗后第15或30天将对早期治疗反应进行评估,如果15天幼稚细胞<15%或30天幼稚细胞<5%则认为反应良好。当患儿早期获得缓解并具有良好核型或基因型,便可进行低危方案的治疗;反之,如果患儿早期不缓解或具有不良核型或基因型,则应采用高危方案治疗;其他患儿则采用中危方案治疗。一旦患儿确诊为AML,应立即开始治疗。诱导治疗1~2个疗程后,患儿应获得完全缓解,即骨髓幼稚细胞<5%,未见Auer小体,未见髓外疾病,中性粒细胞绝对数>1.0×109/L,血小板计数>80×109/L,并且不用输注红细胞。有些患儿外周血细胞虽然没有完全恢复,但其他条件符合,也可开始下一疗程化疗,即巩固治疗。巩固治疗一般为2~5个疗程。目前大多数研究组认为,如果已给予高强度诱导和巩固治疗,则不推荐维持治疗。中枢神经系统白血病预防治疗是必须的,常规采用鞘内注射化疗药物。强化疗过程中,积极的支持治疗非常重要,这将有效提高AML患儿的生存率。
2.化学治疗(除外APL)
(1)诱导治疗:
蒽环类药物和阿糖胞苷是最常用于诱导治疗的两类细胞毒性药物。最常用的蒽环类药物有三种,即柔红霉素、去甲氧柔红霉素和米托蒽醌。去甲氧柔红霉素在用药2~4周内清除幼稚细胞较快,但对总体生存率无明显影响。诱导期蒽环类药物一般用3天,柔红霉素剂量为50~60mg/(m2· d),去甲氧柔红霉素剂量为10~12mg/(m2·d),米托蒽醌剂量为10~12mg/(m2·d)。相关研究表明,这三种蒽环类药物没有疗效差异。阿糖胞苷一般用7~10天,剂量为100~200mg/m2,每天1次或2次静脉点滴。上述组合被称为“3+7”或“3+10”诱导方案。诱导期不推荐使用大剂量阿糖胞苷,因为不仅对缓解无助,而且增加毒副作用。有些方案在诱导期加用依托泊苷(VP16)或硫鸟嘌呤,如英国MRC临床试验方案采用ADE三药诱导治疗,除了蒽环类药物和阿糖胞苷外,还有依托泊苷,剂量为 100mg/ (m2·d)×5天。欧洲斯堪的纳维亚NOPHO协作组采用AIET四药诱导治疗,依托泊苷剂量为100mg/ (m2·d)×4天,硫鸟嘌呤剂量为100mg/m2,q12h×4天。虽然各国诱导方案不尽相同,但儿童AML初次缓解率均能达到85%以上。多数研究组重复一次诱导治疗,当患儿骨髓恢复后即开始第二轮诱导治疗,一般在初次诱导治疗后第4周左右。如果初次诱导治疗后骨髓缓解不理想如15天幼稚细胞>15%,也可提前进行第二轮诱导治疗。
近来我国成人AML多中心协作组采用基于高三尖杉酯碱的诱导方案治疗AML,取得了显著进步,并成为具有中国特色的AML化疗方案。
(2)缓解后巩固治疗:
对维持AML的缓解非常必要。巩固治疗一般为2~4个疗程,化疗药物与诱导期不尽相同。大剂量阿糖胞苷(HiDAC)有助于增加AML尤其是CBF-AML的疗效,用法可为阶梯式递增,从1g/m2增加至3g/m2,也可采用标准剂量3g/ m2。具体用法各国不尽相同,英国MRC方案的Hi-DAC用法为3g/m2,q12h,d1、d3、d5,总计6次,每次静脉点滴时间需大于4小时。而NOPHO方案的Hi-DAC用法为1~3g/m2,q12h,d1~d3,总计6次,每次静脉点滴时间需大于2小时。有些协作组方案除了HiDAC,还加用依托泊苷或米托蒽醌联合用药(HAE、MidAC)。巩固治疗期加用其他药物如安吖啶、氯脱氧腺苷的疗效仍不肯定。有研究组随机给予吉妥珠单抗奥唑米星(GO)(注:一种抗体导向肿瘤药,由重组人源化CD33单抗与细胞毒抗肿瘤抗生素刺孢霉素结合而成),但使用后未发现生存率明显增加。目前尚无证据表明巩固治疗需要多少疗程合适。关于AML的维持治疗,共识认为如果已在诱导和巩固期进行了强化疗,就没有必要进行维持治疗。总体来说,AML诱导和巩固治疗最少不应少于4个疗程。
3.中枢神经系统治疗
约有5%~10%的AML患儿初诊时即有中枢神经系统(CNS)受累。对所有AML患儿,均需进行CNS预防治疗,否则CNS复发很高。鞘注化疗药是常规治疗方法,可行单剂阿糖胞苷或单剂甲氨蝶呤鞘注,也可行三联鞘注,即阿糖胞苷+甲氨蝶呤+类固醇激素。对于CNS的预防治疗,是采用单联还是三联鞘注目前没有一致共识,但如果初诊时已有CNS受累,则推荐使用三联鞘注。对已有CNS白血病的患儿,予每周两次鞘注直至脑脊液幼稚细胞消失。AML患儿的鞘注总次数没有统一规定,许多中心在每个疗程治疗期间至少给予一次鞘注,因此鞘注总次数在4~10次之间。如果患儿已接受大剂量阿糖胞苷和鞘注化疗,则毋需进行颅脑放疗。
4.髓细胞肉瘤治疗
髓细胞肉瘤或粒细胞肉瘤是髓外白血病的表现形式,占AML的2%~4%。髓细胞肉瘤可为首发表现,可以单发、也可同时伴有骨髓浸润。此时即使骨髓幼稚细胞<20%,也应诊断为AML而不是 MDS。眶部绿色瘤多见于 AML t(8; 21)。皮肤(皮肤白血病)、淋巴结、骨或软组织均可受累。髓细胞肉瘤的患儿即使骨髓幼稚细胞<5%,也应同样进行高强度的AML方案化疗。经过系统化疗后,多数肿瘤反应良好并消失,不需局部放疗。但如果治疗后肿瘤仍不消退,可采用局部放疗。由于对这种罕见情况很难开展临床研究,目前仍不确定放疗是否获益。
5.造血干细胞移植
随着强化疗的实施,AML的疗效已相当甚至高于自体造血干细胞移植,因此现在自体造血干细胞移植已不再是治疗AML的指征。异基因造血干细胞移植曾一度被认为是治疗AML的最佳选择,后来随着大规模临床研究的开展,发现对于低危险组、且获得首次缓解的AML患儿,采用化疗而不行移植也能获得相似的疗效。对中危和高危组AML,采用化疗还是移植仍有争论。异基因造血干细胞移植复发率可能较低,但却存在早期或晚期的移植相关并发症。早期并发症与供者类型、HLA相合程度及患者移植前状况有关。无关供者移植后出现急性或慢性移植物抗宿主病和感染的几率较高。许多中心已不采用全身放疗的预处理方案,这样可以减少远期的并发症如生长迟缓和内分泌疾患。马利兰和环磷酰胺是目前AML移植的常用预处理方案。第二肿瘤是长期生存患儿的另一种远期并发症。当AML患儿选择移植治疗时,一般在巩固治疗第1~2疗程后进行,这样的缓解状态使移植效果更好。
6.靶向治疗
是未来治疗放向。吉妥单抗GO是一种由人源化抗CD33单克隆抗体与卡奇霉素(calicheamicin)组成的缀合药物,该药靶点为AML患者中检测到的CD33阳性白血病细胞。英、美、法等临床试验发现,在GO联用诱导治疗的情况下,患者的诱导缓解率及长期缓解率虽然没有明显增加,但GO治疗组患者在无复发生存期及整体生存期方面明显延长。但是,不良遗传型患者未能从GO中取得临床获益。
英国儿童MRC AM L-15方案
1.诱导治疗
(1)ADE(10+3+5):
Ara-C 100mg/m2,q12h×10天;DNR 50mg/m2,d1、d3、d5;VP16 100mg/m2,qd× 5天。
(2)ADE(8+3+5):
Ara-C 100mg/m2,q12h×8天;其余同上。
2.巩固治疗
该方案比较了2个疗程与3个疗程的巩固治疗情况,没有发现疗效区别,因此只介绍2个疗程的巩固治疗方案。AML-15方案在巩固治疗中,随机分为2组:
(1)随机组1:
该组病例先用一疗程MACE,再用一疗程MidAC。
MACE:安吖啶 100mg/m2,qd×5天;Ara-C 200mg/m2,qd×5天;VP16 100mg/m2,qd×5天。
MidAC:米托蒽醌10mg/m2,qd×5天;Ara-C 1g/ m2,q12h×3天。
(2)随机组2:
该组病例采用大剂量阿糖胞苷3g/m2,共2个疗程。每疗程q12h,d1、d3、d5。但其后总结认为与随机组1相比,无明显差异。













