英文名称 :tetrahydrobiopterin deficiency
四氢生物蝶呤缺乏症(tetrahydrobiopterin deficiency,BH4D)是一种特殊类型的高苯丙氨酸血症(hyperphenylalaninemia,HPA),为常染色体隐性遗传病。由于苯丙氨酸(phenylalanine,Phe)、酪氨酸、色氨酸羟化酶及一氧化氮合成酶的辅酶四氢生物蝶呤(tetrahydrobiopterin,BH4)缺乏所致。各国BH4D在HPA中所占比例不同:白种人1%~2%;东南亚地区中,日本约占4%,韩国占10%,泰国占17%,菲律宾占23%,马来西亚较高占64%。中国台湾省、沙特阿拉伯发病率也较高。至今我国大陆累积诊断BH4D 300余例,南方发病率高于北方,北方BH4D在HPA中占6%~7%,中部约占14%,南部较高约29%。
BH4D是由于BH4合成或代谢途径(图1)中5种酶的先天性缺陷所致。根据2012年BIODEF数据统计,已注册670余例BH4缺乏症,较常见的为6-丙酮酰四氢蝶呤合成酶(6-pyruvoyl tetrahydropterin synthase,PTPS)缺乏(占56%,其中1/5为轻型),其次为二氢蝶啶还原酶(dihydropteridine reductase,DHPR)缺乏(占34%),鸟苷三磷酸环水解酶Ⅰ(guanosine triphosphate cyclohydrolaseⅠ,GTPCH)缺乏(4.9%),墨蝶呤还原酶(SR)缺乏症及蝶呤-4a-二甲醇胺脱水酶(pterin 4a-carbinolamine dehydrogenase,PCD)缺乏(3.7%)少见。上述任何一种酶缺乏均可导致BH4合成障碍,不仅影响了苯丙氨酸羟化酶(phenylalanine hydroxylase,PAH)活性,导致血Phe浓度不同程度增高,而且由于降低了酪氨酸、色氨酸羟化酶活性,使神经递质前质左旋多巴(L-DOPA)和5-羟色氨酸(5-hydroxytryptophan,5-HTP)生成减少,影响了脑内神经递质(多巴胺、5-羟色胺)的合成,未治疗患儿其神经系统损害症状比PKU更严重,预后更差。本节阐述的GTPCH缺乏是指常染色体隐性遗传者,而不包括常染色体显性遗传的、GTPCH缺乏(即多巴反应性肌张力低下症)。
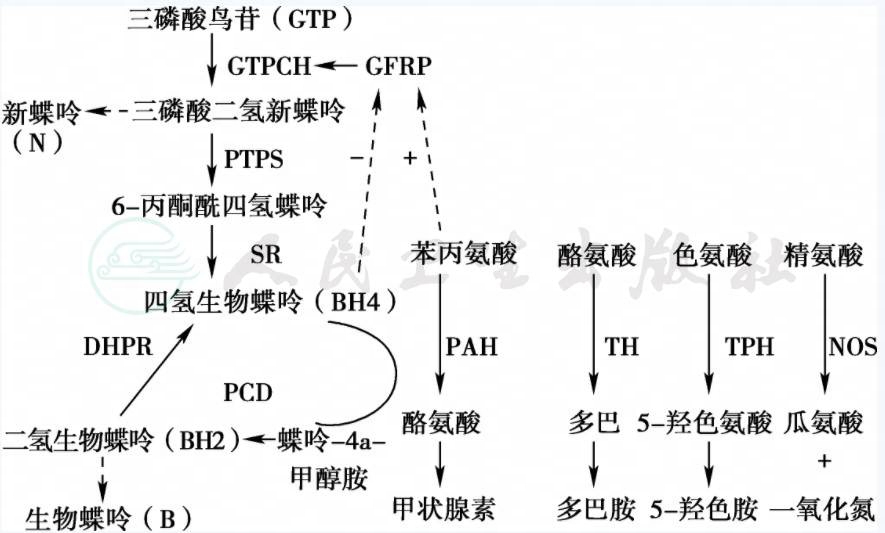
图1 四氢生物蝶呤合成代谢示意图
GFRP:GTP环化水解酶Ⅰ反馈调节蛋白;GTPCH:鸟苷三磷酸环水解酶Ⅰ;PTPS:6-丙酮酰四氢蝶呤合成酶;SR:墨蝶呤还原酶;PCD:蝶呤-4a-甲醇胺脱水酶;DHPR:二氢蝶啶还原酶;PAH:苯丙氨酸羟化酶;TH:酪氨酸羟化酶;TPH:色氨酸羟化酶;NOS:一氧化氮合成酶
四氢生物蝶呤缺乏症属于常染色体隐性遗传病。1987年Dahl等从鼠肝和人肝中分离出DHPR,克隆人DHPR的cDNA编码蛋白,编码区为244个氨基酸,DHPR基因QDPR位于4p15.3,含7个外显子;1991年,Hartakeyama等克隆了鼠肝GTPCH基因GCH1,cDNA编码序列全长为222个氨基酸,基因位于14q22.1~q22.2,含6个外显子;1992年,Thony等从成人肝细胞克隆了PTPS的基因PTS cDNA,PTPS的cDNA编码序列全长为500多个核苷酸,人类 PTS基因位于11q22.3,全长2kb,6个外显子;另从鼠肝和人肝中分离出PCD酶基因PCBD,编码103个氨基酸,基因位于10q22;SR酶基因SPR位于2p14-p12,含3个外显子。
根据最新BIOMBD数据库显示,220余种基因突变与BH4缺乏症有关,其中已知114种GCH1基因突变(占51%),94%基因突变与DRD(不伴HPA)有关,极少数突变导致常染色体隐性遗传的GTPCH缺乏;52种PTS突变(占24%)、35种QDPR基因突变(占16%)、13种SPR基因突变及9种PCBD基因突变。东亚地区已发现43种PTS基因突变类型(21种新基因突变),c.155A→G(p.N52S)、c.259C→T(p.P87S)、c. 272A→G(p.K91R)、c.286G→A(p.D96N) 和c.84-291A→G是东亚患者常见突变;中国大陆143例BH4D患者的基因突变类型分析结果发现32种PTS基因突变,其中c.155A→G、c.259C→T、c.286G→A和c.IVS1-291A→G为热点突变(占76.9%),c.259C→T在中国南北方多见,c.155A→G则多见于南方患者;c.155A→G、c.259C→T、c.286G→A可导致严重型PTPS缺乏有关,c.166G→A(V56M)及c.IVS1-291A→G可能与轻型PTPS缺乏症有关。至今中国已发现14例DHPR缺乏症,已发现10种QDPR基因突变。
1.新生儿疾病筛查
出生3天采集干滤纸血片进行血Phe浓度测定,对所有高苯丙氨酸血症患儿进行尿蝶呤谱分析及血DHPR活性测定进行BH4缺乏症鉴别,对BH4缺乏症进行早期治疗,可避免神经系统损害和智能障碍发生。BH4缺乏症患儿血Phe增高程度变异大,可轻度增高,或显著增高类似经典型PKU。
2.尿蝶呤谱分析
对BH4合成酶缺乏(PTPS及GTPCH缺乏症)诊断较可靠。新鲜尿液收集后马上加入抗坏血酸(每毫升尿液加10~20mg抗坏血酸),避光下混合均匀后-70℃保存或浸透5cm×5cm大小专用滤纸片上,避光晾干后邮寄检测。实验室采用HPLC进行尿新蝶呤(neopterin,N),生物蝶呤(biopterin,B)定量分析,从而得出两者之比例和生物蝶呤百分率[B/(B+N)×100%]。
PTPS缺乏时,尿新蝶呤(N)明显增加,生物蝶呤(B)明显降低,B%<10%(多数<5%);对于尿新蝶呤明显增高,尿生物蝶呤正常或略低,B%介于5%~10%,诊断需谨慎,可结合BH4负荷试验协助诊断。还原酶DHPR缺乏时,尿新蝶呤可正常或稍高,生物蝶呤明显增加,B%增高,但部分DHPR缺乏患儿尿蝶呤谱可正常;GTPCH缺乏者,尿新蝶呤、生物蝶呤均极低,B%正常;蝶呤-4α-二甲醇胺脱水酶(pterin-4α-carbinolamine dehydratase,PCD)缺乏者在生物蝶呤峰后出现7-生物蝶呤波峰(需要有特异内标);墨蝶呤还原酶缺乏症尿蝶呤谱可正常。
3.二氢蝶啶还原酶分析
红细胞二氢蝶啶还原酶活性测定是DHPR缺乏症的确诊方法。由于常规尿蝶呤谱分析和BH4负荷试验并不能完全对DHPR缺乏症进行鉴别,需要通过红细胞DHPR活性测定以确诊。分析采用用双光束分光光度计,测定外周血干血滤纸片中的DHPR活性。
4.BH4负荷试验
BH4负荷试验是一种快速而可靠的BH4缺乏症辅助诊断试验,也是鉴别BH4反应性PKU/HPA的有效方法。采用人工合成BH4药物(二盐酸沙丙蝶呤,Kuvan)(每片100mg)进行BH4负荷试验。试验前先留尿做尿蝶呤谱分析,血Phe>600µmol/L(新生儿>400µmol/L),可在喂奶前30分钟给予口服BH4片(20mg/kg),BH4服用前及服用后2、4、6、8、24小时分别取血做Phe、Try测定,服后4~8小时留尿做尿蝶呤谱分析。Phe(100mg/kg)+BH4联合负荷试验不推荐,可能导致假阳性判断。PTPS缺乏者,当给予BH4后,因其苯丙氨酸羟化酶活性恢复,血Phe浓度多在服用BH4后4~6小时下降80%~90%或降至正常;DHPR缺乏者血Phe下降缓慢,类似部分BH4反应型PKU/HPA。
5.头颅影像学检查
BH4缺乏症MRI检查,T1加权成像可发现在豆状核对称性钙化灶、脑沟脑回深,皮质下囊性变,T2加权成像显示脱髓鞘病变导致的脑室周围脑白质高信号改变。另外还可显示脑发育不良、脑萎缩等病变。
一经诊断为BH4缺乏症,应立即给予BH4和神经递质前质L‐DOPA,5‐羟色氨酸(5‐HTP)联合治疗,单独一种药物治疗疗效差。每日口服BH42‐10mg/kg以控制血Phe浓度达正常水平,如无BH4药物,只能给低Phe饮食治疗,将血Phe浓度控制在理想范围,同时给予L‐DOPA和5‐HTP治疗。因DHPR缺乏者体内往往存在变异酶,其与BH4发生竞争作用而降低BH4作用,故DHPR缺乏患者所需BH4量更大些,若按2~10mg/(kg·d)的量服用BH4不能将血Phe浓度控制在正常水平时,可加大剂量至10‐20mg/(kg·d),必要时还可考虑同时合用低Phe饮食治疗。
给予L‐DOPA 5~15mg/kg·d和5‐HTP 3~13mg/kg·d以改善神经系统症状,L‐DOPA和5‐HTP药物开始治疗剂量从1mg/(kg·d),每周逐渐增加1mg/kg,至治疗剂量,并将一天DOPA,5‐HTP的总量分3~4次。DHPR缺乏者,除了上述3种药物外,还需给予叶酸(5~15mg/d)以补充由于生物蝶呤的堆积对叶酸代谢的干扰而使叶酸水平下降。BH4D患儿在用L‐DOPA治疗中往往会出现On‐Off现象,即间歇性出现精神萎靡不振、软弱无力、嗜睡等,可在1天中出现几次,持续数天或长达几周。患儿这种精神运动状态改变与较短的L‐DOPA半衰期有关,必要时,将1天药物总剂量分为6~8次服用可减少On‐Off现象。根据临床症状,有条件可根据脑脊液神经递质代谢产物水平来调节药物剂量。
1.新生儿筛查
出生3天采集干滤纸血片进行血Phe浓度测定以筛查HPA,对所有HPA者进行尿蝶呤谱分析及血DHPR活性测定进行BH4缺乏症鉴别,以早期治疗,避免神经系统损害和智力障碍发生。然而也有患者尽管新生儿期早期治疗仍有严重神经系统损害,一项对BH4D患者长期随访结果显示26例PTPS缺乏者早(出生2个月内)、晚治疗后其智力发育延迟比例分别占35%与44%,10例DHPR缺乏症者早、晚治疗其智力发育延迟比例占50%与100%。
2.产前诊断
对先症者通过基因突变分析明确诊断者,于18~20周采集羊水进行基因分析进行产前诊断,阻止患者出生。













