血栓性疾病(thrombo-embolics,TEs)是指一组血栓形成和血栓栓塞两种病理过程所引起的疾病,已经被视为影响人们健康的主要疾病。儿童期凝血是一个贯穿新生儿期直至整个儿童期的、动态的、发展的系统,整个儿童期凝血系统呈现低凝血、低纤维蛋白溶解状态,其优点是减少了血栓发生的风险,但也促进了DIC的发生、加重了血栓并发症的出现。
易栓症(thrombophilia)是指存在抗凝蛋白、凝血因子、纤溶蛋白等遗传性或获得性缺陷,或者存在获得性危险因素而具有高血栓栓塞倾向。发生血栓的易栓症一般分为遗传性易栓症(inherited thrombophilia)和获得性易栓症(acquired thrombophilia)两类(表1)。常见的遗传性易栓症有蛋白C缺陷症、蛋白S缺陷症、抗凝血酶缺陷症、因子V Leiden和凝血酶原G20210A突变等,是基因缺陷导致相应的蛋白数量减少和/或质量异常所致,可通过基因分析和/或蛋白活性水平测定发现。获得性易栓症有些是容易引发血栓的疾病,如抗磷脂综合征、肿瘤,还有一些则是易发生血栓的危险状态,如长时间制动、创伤、手术等。
1.遗传性易栓症
(1)遗传性天然抗凝蛋白缺陷症(hereditary anticoagulant protein deficiency)
主要包括抗凝血酶(AT)、蛋白 C(PC)和蛋白S(PS)的缺陷。首例遗传性AT缺陷症、PC缺陷症和PS缺陷症分别报道于1965年、1981年和1984年。这些天然抗凝蛋白缺陷的杂合子发生血栓的危险性比正常人高约10倍,其中以AT缺陷症的危险性最高。抗凝蛋白缺陷症的纯合子极为罕见,患者往往于出生后发生暴发性紫癜(fulminant purpura),不久死于血栓形成。
表1 易栓症的分类

(2)遗传性凝血因子缺陷症(hereditary coagulation factor deficiency)
常见的有活化蛋白C抵抗(activated protein C resistance,APC-R)和凝血酶 原 G20210A。APC-R主要是由于FⅤ基因的突变,生成凝血活性正常而对活化的蛋白C(activated protein C,APC)的降解作用不敏感的变异型FⅤ。变异型FⅤ不易被APC降解,故血浆中FⅤa水平升高,导致血栓危险性升高。最常见的APC-R基因缺陷为FⅤ Leiden,占所有APC-R的90%。FⅤ Leiden最初报道于1994年,是 FⅤ基因第1691位的点突变(G→A),导致FⅤ蛋白分子第506位的精氨酸被谷氨酰胺取代,表现出APC-R。其杂合子者静脉血栓的危险性升高3~8倍,纯合子者升高50~80倍。FⅤLeiden是高加索人群中最常见的遗传性易栓缺陷,人群总检出率高达5%,个别欧洲地区的检出率可达15%,纯合子的检出率竟然达1/5 000,在静脉血栓患者中的检出率平均为20%。相比之下,截至目前,FⅤLeiden在中国(汉族人群)、日本、韩国、泰国等亚洲国家的检出率几乎为零。凝血酶原 G20210A(FⅡG20210A)是凝血酶原第20210位的核苷酸发生突变(G→A),生成异常凝血酶原,1996年由荷兰的 Poort等首先报道。与FⅤ Leiden相同,FⅡG20210A突变在高加索人群中相当常见,检出率达2%~6%,而在亚洲各国人群中,除个别报道外,检出率几乎为零。FⅡG20210A携带者血栓危险性升高约3倍,在西方静脉血栓患者中,检出率约为6%。具有高血栓倾向的遗传性凝血因子缺陷症还有异常纤维蛋白原血症。异常纤维蛋白原形成的纤维蛋白虽然与tPA的结合正常,但纤维蛋白介导的纤溶酶原活化存在异常,故引起高血栓倾向。
(3)遗传性纤溶蛋白缺陷症(hereditary fibrinolytic deficiency)
主要涉及纤溶酶原(plasminogen)、组织型纤溶酶原激活物(yissue plasminogen activator,tPA)和纤溶酶原激活物抑制物(plasminogen activator inhibitor,PAI)。纤溶酶原或tPA的缺陷可降低纤维蛋白溶解,致高血栓倾向。在有静脉血栓栓塞的患者中纤溶酶原缺陷的检出率达0.38%,几乎与抗凝血酶缺陷的检出率(0.47%)相当。
2.获得性血栓危险因素
(1)恶性肿瘤
恶性肿瘤患者静脉血栓形成的发生率高达3%~18%。瑞典曾有一项研究显示,19%的静脉血栓患者在诊断的同时发现有恶性肿瘤,另有5%的患者在静脉血栓事件后1年内发现恶性肿瘤。有些成人患者可于肿瘤确诊前数年反复发生静脉血栓或血栓性静脉炎。在各种恶性肿瘤中,以腺癌更易引发血栓。恶性肿瘤引起静脉血栓的机制有多方面,包括肿瘤组织释放组织凝血活酶样物质、肿瘤机械性阻塞静脉、患病后活动减少、手术、放化疗等。
(2)抗磷脂抗体
抗磷脂抗体(antiphospholipid antibody,APA)主要包括狼疮型抗凝物、抗心磷脂抗体和β2GP1。由抗磷脂抗体引起的一组相关的临床综合征称为抗磷脂综合征(antiphospholipid syndrome,APS),是较常见的获得性易栓症。抗磷脂抗体可出现于系统性红斑狼疮等免疫系统疾病(系统性红斑狼疮患者抗磷脂抗体阳性率约为50%),也可独立存在。抗磷脂抗体患者血栓形成的发生率约为30%~40%。血栓既可发生于动脉也可发生于静脉,但以静脉为主,占70%左右。抗磷脂抗体阳性患者发生静脉血栓的危险性比正常人高约10倍。在一些抗磷脂抗体阳性患者的血清中发现了针对PC、PS或凝血酶调节蛋白等抗凝蛋白的抗体;抗磷脂抗体还通过影响血小板活性、凝血或抗凝机制和血管内皮功能而诱发血栓形成。
(3)骨髓增殖性肿瘤(myeloproliferative neoplasm,MPN)
MPN中真性红细胞增多症和原发性血小板增多症常伴有动静脉血栓性疾病的发生:PV和ET初诊时主要血栓事件的发病率分别约34%~39%和10%~29%,而随访期则分别为8%~19%和8%~31%。无论是PV还是ET,动脉血栓事件的发病率都要高于静脉血栓事件(70%vs.30%)。MPN患者的静脉血栓事件常发生于少见部位,特别是腹腔内静脉血栓形成,且常常可以成为MPN患者的首发表现。成人中约半数的巴德-吉亚利综合征和 1/3的门静脉血栓患者合并有MPN。
(4)阵发性睡眠性血红蛋白尿症(paroxysmal nocturnal hemoglobinuria,PNH)
PNH显著增加患者静脉血栓疾病的发生率,而静脉血栓栓塞症是导致PNH死亡最为常见的原因。据报道,29%~44%的PNH患者在疾病过程中至少合并有1次血栓栓塞事件。少见部位静脉血栓形成常见于PHN患者,例如肝静脉血栓(巴德-吉亚利综合征)、颅内静脉窦血栓以及门静脉和下腔静脉血栓等。其中,巴德-吉亚利综合征为PNH患者最为常见的血栓部位。PNH导致易栓状态的机制较为复杂,血小板活化、补体介导的溶血、一氧化氮耗竭、纤溶系统受抑以及炎症介质均可能参与其中。
(5)肾病综合征(nephrotic syndrome,NS)
膜性肾病和微小病变是肾病综合征并发高凝状态最常见的病理类型。高凝状态与多种因素导致的凝血、抗凝和纤溶功能失衡有关。凝血功能亢进的表现以纤维蛋白原升高最为常见和明显,因子Ⅴ和Ⅷ的水平也有不同程度的升高,常超过200%;长期应用肾上腺皮质激素和高脂血症可促进因子Ⅷ的活化;患者活动期血和尿中D-二聚体(D-Dimer)含量明显升高,体内补体系统活性增强;抗凝活性常常降低,如血浆中AT水平降低、游离型PS缺乏;NS时常有血小板数量增高、黏附与聚集功能增强、纤溶活性多减低。NS患者血栓栓塞的发生率从6%~44%不等,静脉血栓较动脉血栓常见。
1.VTE的治疗
VTE的治疗包括抗凝治疗、溶栓治疗、血栓去除术、静脉滤器等,其中抗凝为主要的治疗方法。
VTE急性期治疗的主要目的是控制DVT进展、防止发生PE和纠正血流动力学异常,主要采用抗凝治疗。有急性静脉性坏疽和大块PE伴血流动力学异常(血压下降)和低氧血症的患者可予溶栓治疗。有些情况下可考虑手术取栓。如果急性DVT有抗凝、溶栓的禁忌,可酌情安置下腔静脉滤网,防止致死性PE的发生。急性期后的治疗则以防止DVT和PE复发和避免并发症为主,应坚持按预期抗凝强度和疗程进行抗凝治疗。
(1)抗凝治疗:
目前抗凝治疗一般分为初始抗凝治疗、长疗程抗凝治疗和延续抗凝治疗3个阶段(图1)。
所有接受初始抗凝治疗的急性VTE患者均建议接受长疗程抗凝。虽然长疗程抗凝可以继续使用肝素类药物,但肝素类药物需注射给药,长期使用不方便,故除了肿瘤为VTE触发因素外,推荐使用口服抗凝药。目前最常用的口服抗凝药仍是华法林。由于口服华法林起效慢,且给药后PC和PS水平的降低先于凝血因子水平的降低,造成给药初期一过性高凝状态,可出现血栓栓塞加重的现象,尤其是PC和PS缺陷症的患者,故华法林需要与UFH或LMWH重叠使用至少5日或待PT的国际正常化比值(international normalization ratio,INR)≥2.0后再停用肝素类药物。华法林的抗凝强度一般以INR维持在2.0~3.0为宜。抗凝3个月后进入延续抗凝治疗阶段,主要目的是预防VTE再发,抗凝期限不定,需定期再评估停止抗凝后的血栓复发危险性和继续抗凝的出血危险性,决定抗凝的期限。
停止抗凝后血栓复发的危险性主要取决于血栓急性期抗凝疗程是否充分和患者自身的VTE复发危险因素。经综合分析血栓复发的危险性,若存在下述情况,如无禁忌证,应接受延续抗凝治疗:①存在一种以上易栓因素;②遗传性抗凝蛋白缺陷;③获得性易栓症持续存在(如肿瘤、抗磷脂综合征);④少见部位的血栓形成;⑤复发性血栓形成;⑥超声检查发现DVT持久残留;⑦D-二聚体水平持久升高;⑧并发PE相关慢性肺动脉高压。之后需定期(如每半年或1年)再评估血栓复发的危险性,决定是否终止抗凝。
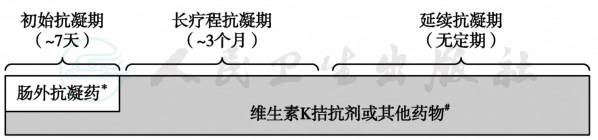
图1 VTE抗凝治疗分期
(2)VTE急性期的其他抗血栓治疗
1)溶栓治疗
下肢急性近端DVT不主张常规行全身溶栓治疗或导管引导下溶栓治疗。但如果认为患者将来发生下肢血栓后综合征的风险极高,溶栓治疗有望避免其发生,且没有溶栓禁忌,可以考虑给予导管下溶栓治疗。若没有导管下溶栓的经验和条件,也可以行全身溶栓治疗。急性PE不主张常规溶栓治疗。但若伴有低血压,且无出血高风险,建议尽早给予全身溶栓治疗。即使没有低血压,但临床上判断其将来发生肺动脉高压的可能性较大,也可考虑溶栓治疗。
2)血栓去除术
下肢急性近端DVT不主张常规采用手术取栓,儿科较少开展。
3)下腔静脉滤器
下肢急性DVT或急性PE均不主张常规安置下腔静脉滤器。但患者若有抗凝禁忌,可以考虑安放临时滤器,待出血风险消除后,取出滤器,给予常规抗凝。儿科较少开展。
4)弹力袜
下肢急性症状性DVT应坚持穿戴弹力袜,推荐至少穿戴2年,以预防血栓后综合征(postthrombotic syndrome,PTS)。
2.特殊情况下的抗凝治疗
(1)抗凝蛋白缺陷症
肝素通过增强抗凝血酶的活性起抗凝作用。有些抗凝血酶(antithrombin,AT)缺陷症的患者对肝素耐药,需大剂量使用。国内无AT制剂上市,遇肝素耐药时,可输注新鲜冰冻血浆,补充AT。遗传性PC或PS缺陷症的患者,口服抗凝药需在完全肝素化下开始,华法林应以相对低剂量开始,逐渐加量。
(2)恶性肿瘤
一旦出现VTE,治疗往往较困难。一般不主张溶栓,因为有促进肿瘤转移的潜在可能。抗凝治疗的出血并发症高于非肿瘤患者,而且VTE复发率也较高。与华法林相比,LMWH的优点为无需实验室监测,出血的危险性低,血栓复发率低。临床试验表明,肿瘤患者发生VTE后长疗程抗凝的血栓复发率低于短疗程抗凝。目前提倡:只要肿瘤未控制或已转移,应持续给予抗凝治疗。病情稳定的肿瘤患者,至少抗凝6个月或直到化疗或激素替代疗法结束。
(3)抗磷脂综合征
无症状的单纯抗磷脂抗体阳性患者一般无需特殊治疗,可观察或给予小剂量阿司匹林。当接受较大手术时,应预防性给予肝素抗凝。继发于SLE等自身免疫性疾病的抗磷脂抗体阳性患者采用激素等免疫抑制剂治疗,常可使抗体减少或消失,是否预防性抗凝治疗尚无定论。抗磷脂综合征患者一旦发生血栓栓塞并发症,停止抗凝治疗后血栓复发率高,一般主张应长期口服抗凝,如为动脉血栓,还应加用血小板聚集抑制剂。口服华法林时,狼疮型抗凝物的存在可能会给INR值的调整带来困难,应该密切注意出血并发症或血栓复发。













