2002年,在美国肾脏病基金会(NKF)组织撰写KDOQI中首次正式提出了慢性肾脏病(Chronic Kidney Disease,CKD)的定义及分期。 2012 年改善全球肾脏病预后组织(Kidney Disease:Improving Global Outcomes,KDIGO)在《CKD评估和治疗临床实践指南》中对其进行了修订。根据KDIGO标准,满足以下标准之一即可诊断为儿科CKD:
GFR<60ml/(min·1.73m2)持续 3 个月以上并对健康有影响,无论是否存在其他CKD的指标。
GFR>60ml/(min·1.73m2)且伴有结构性损伤的证据或功能异常的其他指标,包括蛋白尿、白蛋白尿、肾小管疾病或者组织学检查发现的或通过影像学检查结果推断的病理学异常。
慢性肾脏病的分期:
G1:GFR 正常[≥90ml/(min·1.73m2)]
G2:GFR 为[60~89ml/(min·1.73m2)]
G3a:GFR 为[45~59ml/(min·1.73m2)]
G3b:GFR 为[30~44ml/(min·1.73m2)]
G4:GFR 为[15~29ml/(min·1.73m2)]
G5:GFR<15ml/(min·1.73m2)(肾衰竭)
说明:上述分类系统不适用于2岁以下儿童,因为他们的GFR通常低于年龄较大的患者,可根据血清肌酐计算的eGFR与标准的适龄值进行比较,以检测CKD婴儿和幼儿的肾损伤。
慢性肾衰竭(chronic renal failure,CRF)是由于慢性持久性肾受损、肾单位受到破坏、功能减退致使肾脏排泄调节功能和内分泌代谢功能严重受损而造成含氮代谢废物在体内潴留、水与电解质、酸碱平衡紊乱出现一系列综合征。
随着对儿童肾小球疾病防治水平的提高、诊断手段的不断完善以及对儿童先天性泌尿系统畸形的重视,目前由获得性肾小球疾病引起的慢性肾功能不全逐渐减少,而先天性肾脏和尿路畸形(CAKUT)、遗传性肾脏疾病、反流性肾病等逐渐成为引起的慢性肾衰的主要原因。
无论肾损害的原发病因如何,一旦肾功能损害达到危险水平时则难于避免进展到终末期肾衰。肾功能进行性恶化的确切机制不详,但与多种因素有关。包括肾小球高滤过使残存肾小球硬化;肾小球基膜通透性改变、持续的蛋白尿及高血压、脂质代谢紊乱、系膜细胞增殖、基质增多、肾小管间质损伤、RAS系统的作用及饮食因素等。
肾小球硬化、肾小球毛细血管血流动力学改变,特别是高灌注、高压力、高过滤的损伤是造成最终肾小球破坏的常见过程。任何原因引起的肾单位丢失可引起剩余肾单位的功能及结构改变,如肥大、肾小球血流量增加。增加的血流量增加肾单位内肾小球的过滤,此种存活肾小球的高过滤虽可以保持肾功能但同时也可损害这些肾小球。损害的机制包括增高的静水压力直接作用于毛细血管的完整性,导致蛋白质通过毛细血管增多或兼有两者。最终引起肾小球系膜及上皮细胞的改变,发生肾小球硬化。当硬化进展时,剩余的肾单位排泄负担增加,形成肾小球血流量增多和高过滤的恶性循环。
肾间质纤维化(renal interstitial fibrosis,RIF)是各种原因引起的慢性肾脏病进展为终末期肾衰的共同途径。特征是正常肾小管和肾间质结构被大量聚集的细胞外基质(extracellular matrix,ECM)所替代,其程度与肾功能的相关性比肾小球硬化与肾功能的相关性更为密切,RIF的发生机制及防治研究目前被认为是延缓和防治CKD进展的关键。肾间质纤维化形成的分子机制主要分4个阶段:第一阶段是炎症损伤诱发细胞的活化和受损。第二阶段是促纤维化因子的释放。包括细胞因子、生长因子、血管活性因子和趋化黏附因子等。第三阶段是基质蛋白在肾间质沉积导致纤维化的形成。第四阶段是肾脏结构和功能受损,主要是ECM在肾脏的沉积所致。此阶段肾小管周围毛细血管堵塞、有效肾单位大量减少、肾小球滤过率也进一步降低。
肾素-血管紧张素(RAS)系统可通过多种机制引起或加重肾脏病的进展。AngⅡ是RAS系统最主要的效应分子,目前研究认为除传统RAS系统外,在其他许多器官包括肾脏、心脏、血管、脑、脂肪组织、胰腺、眼底、睾丸等亦产生局部组织RAS系统,其调节机制与传统RAS也不完全一致。AngⅡ不仅通过改变肾小球血流动力学促进肾小球硬化,还可促进系膜细胞、内皮细胞和肾小管上皮细胞增生、生长因子表达及细胞外基质积聚等。贫血、高脂血症、慢性炎症、蛋白尿、高尿酸及半胱氨酸血症等均是肾功能恶化进展的危险因素。贫血是CRF进展的一个独立的危险因素,贫血时低氧血症,刺激肾小管产生转化生长因子B(TGF-B)或内皮素而合成细胞外基质,由于氧消耗增加促进CKD进展。血脂异常可致肾小球毛细血管内皮细胞、系膜细胞、足突受累,系膜细胞增生、系膜基质沉着;细胞因子、生长因子增加,氧化应激也增高;血脂异常与肾功损伤程度常是平行的。CKD时氧化应激增高,是由于ROS(reactive oxygen species)与抗氧化物质水平失调,可使肾功能恶化;细胞外基质与成纤维细胞增生,促进了CKD发展。贫血、高脂血症、慢性炎症可进一步促进氧化应激。持续蛋白尿或高血压可直接损害肾小球毛细血管壁,导致肾小球硬化及高过滤损伤。
慢性肾衰时的主要病理生理变化可概括见表1。
表1 慢性肾衰的主要病理生理改变
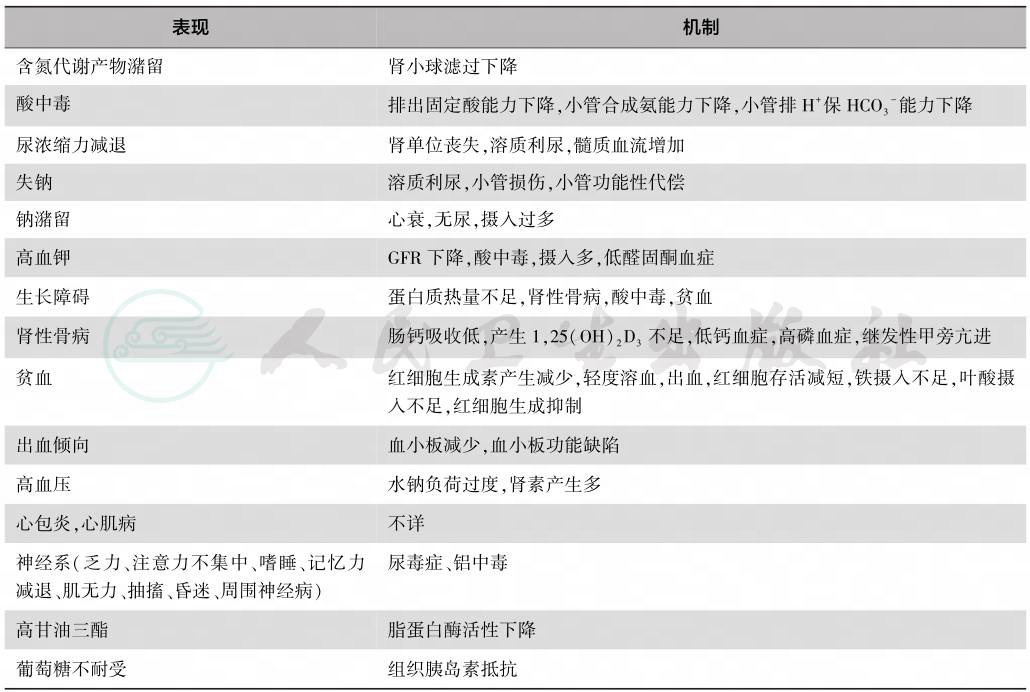
结合上述病理生理变化仅就小儿时期临床表现的某些特点叙述如下:
由于肾脏有相当的代偿能力,故早期除致慢性肾衰的原发病的表现外,慢性肾衰本身症状不明显,且多为非特异表现,如乏力、食欲缺乏、生长迟滞等。随病情进展至氮质血症或尿毒症时则出现多系统表现。消化系统表现为恶心、呕吐;血液系统有贫血、出血倾向;循环系统有高血压、心功能不全、心律失常、心包炎;神经系统则淡漠、周围神经病征;水电解质及酸碱平衡方面有:水钠调节差(一方面易水钠潴留、水肿,另一方面又可发生钠不足),血钾可正常但晚期尿少则血钾增高,多有高磷、低血钙、代谢性酸中毒。
与成人期慢性肾衰相比较,小儿时期患儿生长发育的停滞突出;肾性骨病时易发生骨骼变形、骨痛及骨骺脱位;心血管方面小儿常有心衰、心包炎;神经系统则周缘神经改变比成人少,但常有中枢神经系统改变,特别是婴幼儿期起病者可有惊厥、脑萎缩、智力落后等改变。还可有青春期发育延迟。
CKD防治的总目标为:减慢肾脏损害的进展速度,预防心血管并发症的发生,预防其他并发症的发生,如肾性骨病、贫血,最终提高生存率和生活质量(表2)。
表2 慢性肾脏病的分期和治疗计划

1.饮食、营养
此为非透析治疗中的重要组成部分,尤其对生长发育的小儿更为重要。恰当的饮食不仅能维持小儿的生长发育,并有助于减轻氮质血症症状和延缓病情进展,因可减轻残存肾小球的高滤过和肾小管的高代谢状态从而延缓肾小球硬化过程。蛋白质一般以0.8~1.5g/418kJ(即0.8~1.5g/100cal)计,并选用优质蛋白(如蛋、牛奶、鱼、肉、禽等,因牛奶中含磷高,故可采用低磷奶粉)。余热量不足部分给予碳水化合物及脂肪补充。2009年美国肾脏病杂志发表了慢性肾脏病患儿营养临床实践指南,指南建议:CKD3期患儿,维持膳食蛋白摄入量(dietary protein intakes,DPI)于100%~140%膳食营养摄入参考(dietary reference intake,DRI);CKD4~5 期患儿,维持 DPI于 100%~120%DRI;CKD5D 期,维持 DPI为 100%DRI,再加上透析中丢失的蛋白质及氨基酸量(表3)。但上述数据还需结合我国儿童营养状况做进一步研究。
表3 CKD 3~5期及5D期患儿蛋白质摄入量[DRI,g/(kg·d)]

在无水肿及高血压者一般不严格限钠,但一般小儿每天不超过2g氯化钠。并注意补充水溶性维生素如B1、B2、B6、C等。如肾功能进一步恶化或摄入困难可给予必需氨基酸或α-酮酸制剂,可提供营养并有助于利用体内尿素氮转为氨基酸,从而降低尿素氮水平。控制高脂血症,对伴有高脂血症者应给予低脂饮食(低脂、低胆固醇及高多聚不饱和脂肪酸)。
2.水、电解质、酸碱失衡的治疗
水、钠已如上述。对有高血钾者应限含钾丰富的食品摄入(如橘子、香蕉、干果、巧克力、蘑菇等);对含钾盐或影响钾代谢之药物(如青霉素钾盐、醛固酮拮抗剂)应用时慎重,不输注库存血,当血钾>5.8mmol/L时应给予药物治疗(见急性肾衰竭)。本症多有代谢性酸中毒,当其有临床症状(如呼吸深快等)、血HCO3-<15mmol/L时,可给予碳酸氢钠2~3mmol/kg纠正。纠正酸中毒过程中注意可能因游离钙下降而诱发手足搐搦,当患儿有高血压、水肿、尿少时尤应慎重。
3.慢性肾衰竭合并症的预防及处理
(1)矿物质与骨异常(mineral and bone disorder,MBD)
根据2017年KDIGO慢性肾脏病矿物质与骨异常(CKD-MBD)诊疗指南,对于CKD儿童患者,建议从G2期开始监测血钙、磷、PTH和碱性磷酸酶活性。对于G3a~G5D期CKD患儿,建议将血钙维持在年龄相对应的正常值,并根据血钙水平合理选择降磷治疗。对于儿童CKD患者,可应用骨化三醇和维生素D类似物使血钙维持在与年龄相对应的范围内。
我国2019年慢性肾脏病矿物质与骨异常(CKDMBD)诊治指南推荐,在管理血清钙、磷同时,应重视对继发性甲状旁腺功能亢进(SHPT)的控制。
(2)贫血
除注意营养、补充叶酸及铁剂(口服或静脉)外,还可根据情况应用促红细胞生成素(如rHuEPO等)。对于未接受透析的年纪较大的儿童,rHuEPO的初始剂量为每周80~120U/kg,分2~3次给药。5岁以下儿童或频繁接受透析的儿童需要接受更高剂量。对于接受红细胞生成刺激剂(erythropoiesis stimulating agent,ESA)的CKD儿童,根据指南推荐及专家共识意见,在临床实践中采用的血红蛋白目标值为11~12g/dl。
(3)控制高血压
推荐所有CKD儿童都严格控制血压,因为积极控制血压会延缓CKD进展。高血压治疗应包括规定目标血压水平、非药物疗法和降压治疗。根据现有证据,优选的抗高血压药物是作用于肾素-血管紧张素系统的药物(ACEI或ARB),其还可有效减少蛋白尿,因此会减缓CKD进展。注意如果GFR<60ml/(min·1.73m2),则应谨慎使用 ACEI和 ARB。
(4)身材矮小
2017年KDIGO慢性肾脏病矿物质与骨异常(CKD-MBD)诊疗指南推荐,对于儿童和青少年G2~G5 DCKD患者,若存在身高缺陷,必要时可应用重组人生长激素治疗。根据2019年欧洲儿科肾脏病协会透析和移植工作组制定的CKD儿童应用生长激素治疗的临床实践指南,CKD3~5期或正在透析的身材矮小的患儿可酌情考虑应用生长激素。
(5)其他
病程中之感染、心功能不全、心包炎等均影响预后,需给予相应治疗。在选用药物时应注意根据肾功情况对某些药物剂量或给药频度进行调整。
4.关于ACEI及ARB类药物在慢性肾衰患儿中的应用
此类药物对阻断RAS作用的认识早已从通过单一降低血压提高到通过其他许多机制改善肾脏血流动力学,减少蛋白尿,干预肾小球硬化及肾小管间质纤维化等。目前主张慢性肾脏病患儿无论处于哪一期均应使用RAS阻断剂。研究表明ACEI的肾保护作用与基础肾功能无关,对血肌酐>265.2mol/L的CKD患儿,需在医师严密观察下应用RAS阻断剂。
5.透析和肾移植
对于CKDⅣ期患儿,应行肾脏替代治疗前准备,Ⅴ期患儿应开始肾脏替代治疗。













