英文名称 :Glycogen storage syndrome liver type
糖原累积病(glycogen storage disease,GSD)是一组由于先天性酶缺陷所导致的糖代谢障碍,主要侵犯肝脏和横纹肌的遗传性疾病。根据欧洲资料,其发病率约为1/2万~1/2.5万,已证实糖原合成和分解代谢中所必需的各种酶至少有8种,由于这些酶缺陷所造成的临床疾病有12型,其中Ⅰ、Ⅲ、Ⅳ、Ⅵ、Ⅸ型以肝脏病变为主,Ⅰ、Ⅲ和Ⅳ型的肝脏损害最为严重;Ⅱ、Ⅴ、Ⅶ型则以肌肉组织受损为主。各型特征见表1,除部分Ⅵ型为X连锁隐性遗传外,其余都是常染色隐性遗传病。

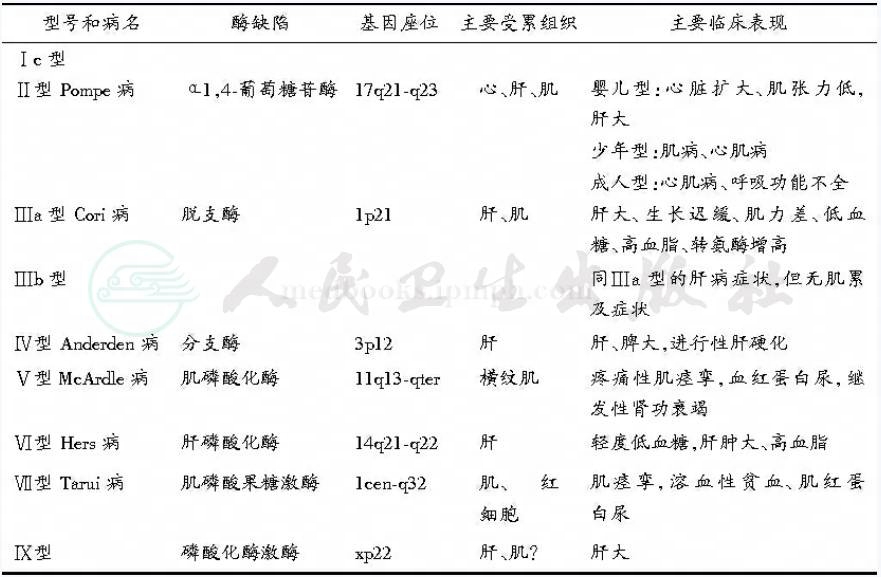
表1各型糖原累积病的分型、酶缺陷及临床表现
1.糖原累积病Ⅰ型(GSD‐Ⅰ Von Gierke病)
葡萄糖‐6‐磷酸酶是所有参与糖代谢途径中惟一存在于细胞内质网腔内的酶,其编码基因(G6PT)暂定位于第17号染色体;葡萄糖‐6‐磷酸酶系统由以下成分组成:①分子量为36.5kDa的多肽,是酶的活性单位;②分子量为21kDa的具有保护酶活性的稳定蛋白,SP;③使6‐磷酸葡萄糖进入内质网腔的转运蛋白,T1;④使磷酸盐通过内质网膜的转运蛋白,T2β;⑤使葡萄糖释出内质网的转运蛋白,GLUT7。由遗传导致的上述系统任一组分的缺陷可使酶系统活力受损、造成Ⅰ型糖原累积病,依次定名为Ⅰa、ⅠaSP、Ⅰb、Ⅰc和Ⅰd型。本节叙述其中常见的Ⅰa型。其发病率约为1/20万。
在正常人体中,由糖原分解或糖原异生过程所产生的6‐磷酸葡萄糖都必须经葡萄糖‐6‐磷酸酶系统水解以获得所需的葡萄糖,该酶系统可提供肝糖原分解所得的90%葡萄糖,在维持血糖稳定方面起主导作用。当酶缺乏时,糖代谢即发生紊乱,机体仅能获得由脱支酶分解糖原1,6糖苷键所产生的少量葡萄糖分子(约8%),必然造成严重空腹低血糖。正常人在血糖过低时,其胰高糖素分泌随即增高,以促进肝糖原分解和葡萄糖异生过程,生成葡萄糖使血糖保持稳定。Ⅰ型GSD患儿因葡萄糖‐6‐磷酸酶系统的缺陷,6‐磷酸葡萄糖不能进一步分解成葡萄糖。因此由低血糖刺激分泌的胰高糖素不仅不能提高血糖浓度,还可使大量糖原分解所产生的部分6‐磷酸葡萄糖进入糖酵解途径。同时,由于6‐磷酸葡萄糖的累积,大部分1‐磷酸葡萄糖又重新再合成糖原。而低血糖又不断导致组织蛋白分解,向肝脏输送葡萄糖异生原料。这些异常代谢加速了肝糖原的合成。糖代谢异常同时还造成脂肪代谢紊乱,亢进的葡萄糖异生和糖酵解过程不仅使血中丙酮酸和乳酸含量增高导致酸中毒,还产生了大量乙酰辅酶A,为脂肪酸和胆固醇的合成提供了原料,同时还产生了合成脂肪酸和胆固醇所需的还原型辅酶Ⅰ(烟酰胺腺嘌呤二核苷酸,NADH)和还原型辅酶Ⅱ(烟酰胺腺嘌呤二核苷酸磷酸,NADPH);此外,低血糖还使胰岛素水平降低,促进外周脂肪组织分解,使游离脂肪酸水平增高;这些代谢改变最终造成了三酸甘油酯和胆固醇等脂质合成旺盛,临床表现为高脂血症和肝脂肪变性。
Ⅰ型GSD常伴有高尿酸血症,这是由于患儿嘌呤合成代谢亢进所致。6‐磷酸葡萄糖的累积促进了戊糖旁路代谢,生成过量的5‐磷酸核糖,进而合成磷酸核糖焦磷酸,再在谷氨酰胺磷酸核糖焦磷酸氨基转移酶作用下转化为1‐氨基‐5‐磷酸核糖苷,从而促进嘌呤代谢并使其终末代谢产物尿酸增加。
2.糖原累积病Ⅲ型(GSD‐Ⅲ)
由于脱支酶(debrancher)缺乏所致。脱支酶具有两种酶催化活力,即淀粉‐1,6‐葡糖苷酶(amylo‐1,6‐glucosidase)和低聚‐(1,4→1,4)‐葡聚糖转移酶(oligo‐1,4‐glucantransfer‐ase),其编码基因位于1p21。当糖原外层葡萄糖直链在分支点前仅存4个葡萄糖残基时,低聚‐(1,4→1,4)‐葡聚糖转移酶将其中三个残基转移至其他直链,以保证磷酸化酶的作用继续进行;与此同时,淀粉‐1,6‐葡糖苷酶可解除分支点上以a‐1,6‐键连接的葡萄糖分子。脱支酶缺乏时,糖原分解不能正常进行,致使1,6糖苷键点数量增多和糖原分子结构异常。根据酶缺陷和累及组织器官的不同情况,本病又分为数个亚型,患儿肝脏和肌肉中酶活力均缺损者属Ⅲa型,最为多见;仅肝脏中酶活力缺陷者属Ⅲb型,约占15%。
3.糖原累积病Ⅳ型(GSD‐Ⅳ,Anderson病)
本型是由于分支酶(brancher)缺陷所致,较为罕见,迄今仅约40余例见诸文献报道。分支酶的编码基因(GBE1)位于3p12,根据现有资料分析,本病为常染色体隐性遗传病,但因患儿绝大多数为男性,故性连锁遗传的可能性尚不能除外。
分支酶又称为a‐1,4‐葡聚糖、a‐1,4‐葡聚糖‐6‐葡糖基转移酶(a‐1,4‐glucan,a‐1,4‐glucan‐6‐glycosyl transferase),是糖原合成途径中必需的酶。缺乏此酶使糖原合成时形成的直链增长,分支点锐减,糖原分子结构近似植物的支链淀粉而难溶于水。这种结构异常的糖原分子导致了肝脏的进行性严重损害,其机制尚不清楚。约半数患儿可同时有心肌、骨骼肌、中枢神经系统等损害,少数患者以肌肉、神经系统病变为主。因此,推测分支酶可能有两种从属于不同器官的同工酶,不同患者的临床表现取决于其酶缺陷的种类。这样也就解释了为什么这种结构异常的糖原分子中仍然有少量分支点(1,6糖苷键)存在。
1.糖原累积病Ⅰ型(GSD‐Ⅰ Von Gierke病)
肝细胞染色较浅,浆膜明显,因胞浆内充满糖原而肿胀,且含有中等或大的脂肪滴,其细胞核亦因富含糖原而特别增大。细胞核内糖原累积、肝脂肪变性明显但无纤维化改变是本型的突出病理变化,有别于其他各型糖原累积病。
2.糖原累积病Ⅲ型(GSD‐Ⅲ)
本型的肝组织病理变化与GSD‐Ⅰ者类似,肝糖原含量可高达17%;本型甚少脂肪变性,但纤维化明显,可资鉴别。肌组织受损者常见糖原累积于肌原纤维之间及肌纤维膜下等部位。
3.糖原累积病Ⅳ型(GSD‐Ⅳ,Anderson病)
肝脏呈结节性硬化,肝细胞排列不规则,纤维组织增生。肝细胞浆内有无色或染色较浅的包涵体沉积,其边缘与胞浆分界明显,包涵体内呈玻璃样或网状结构,细胞核常偏于一旁。电镜检查和组织化学染色可显示异常结构的糖原。
1.糖原累积病Ⅰ型(GSD‐Ⅰ Von Gierke病)
空腹血生化检测可显示程度不等的低血糖和乳酸血症,重症低血糖常伴有低磷血症。血清丙酮酸、三磷酸甘油酯、磷脂、胆固醇和尿酸等均增高。血小板膜释放ADP能力减低,因此其粘附率和聚集功能低下。多数患儿肝功能正常。X线检查可见骨质疏松和肾脏肿大。CT扫描可能发现少数病程较长患儿肝脏有单个或多个腺瘤并发。
2.糖原累积病Ⅲ型(GSD‐Ⅲ)
患儿血清转氨酶明显增高,血脂增高程度不一,与其低血糖发作是否严重有关。血清乳酸和尿酸一般正常。
半乳糖和果糖耐量试验正常。由于患儿的葡萄糖异生机制正常,故给予蛋白质或氨基酸可使血糖上升。在餐后1~3小时进行胰高糖素或肾上腺素试验亦可使患儿血糖上升,但如在饥饿14小时后进行试验则无效应。说明糖原水解过程进行至分支点处即被阻断。上述功能试验可用作辅助诊断,确诊仍需依据肝脏和肌肉中脱支酶活力测定,部分患儿外周红细胞中亦可能呈现糖原累积和酶缺陷。
3.糖原累积病Ⅳ型(GSD‐Ⅳ,Anderson病)
本病常无低血糖表现,口服葡萄糖和果糖耐量试验亦正常。胰高糖素或肾上腺素试验可使血糖轻度上升(0.8~1.3mmol/L),峰值常在30分钟时再现。血清胆固醇轻度增高,血清转氨酶和碱性磷酸酶活力显著增高。血清蛋白质和血氨等常随肝功能恶化而异常。酶活性检测可采用肝脏、肌肉组织或红、白细胞进行。
1.糖原累积病Ⅰ型(GSD‐Ⅰ Von Gierke病)
治疗原则为预防惊厥,防止神经系统后遗症的发生。
(1)急性发作期可静脉输注25%葡萄糖0.5~1.0g/kg,症状控制后可代之以10%~15%葡萄糖,根据血糖浓度,调整减慢速度,使血糖维持在2.22~6.66mmol/L(40~120mg/dl)为宜。
(2)预防感染。
(3)日间少量多次进食,夜间应用鼻饲管持续点滴高碳水化合物液。通常以维持血糖在4~5mmol/L为宜。这种治疗方法不仅可消除临床症状。并且还使患儿获得正常的生长发育。为避免长期鼻饲的困难,现已改用每4~6小时口服生玉米淀粉(2g/kg)的替代方法。
(4)为预防高尿酸血症及痛风,可口服别嘌呤醇100mg/次,每日2~3次,若肾功良好,可服用丙磺舒以利尿酸排出,最初可服0.25g,1日2次,渐增到2g/日。
2.糖原累积病Ⅲ型(GSD‐Ⅲ)
本病的最佳饮食治疗方案仍在探索中。可以在日间给予高蛋白饮食,夜间予以鼻饲高蛋白液体;也可采用与治疗GSD‐Ⅰ相似的高淀粉饮食。经恰当的饮食治疗后,患儿血糖可以保持正常,转氨酶值下降,生长情况改善。
3.糖原累积病Ⅳ型(GSD‐Ⅳ,Anderson病)
迄今为止,除一般支持治疗外,尚无有效治疗方法。已证实高蛋白、高脂肪、低碳水化合物饮食、胰高糖素和α‐葡糖苷酶等对本病无效。对病损仅限于肝脏者,可考虑肝移植术。













