腹泻病(diarrheal diseases)是一组多病原多因素引起的消化道疾病,为世界性公共卫生问题。WHO把腹泻病的控制列为全球性战略。1978年起WHO在全世界推行腹泻病控制规划及ORS口服液体疗法,取得了巨大成效,使第三世界5岁以下儿童因急性腹泻病死亡数从1979年的450万下降到2002年的160万。但腹泻病对发展中国家儿童的影响仍然是严重的。2017年WHO资料,它是造成5岁以下儿童死亡的第二大原因,每年造成约52.5万名儿童死亡。
腹泻病在我国儿童中属第二位常见多发病(仅次于呼吸道感染)。在新中国成立之前,腹泻病曾夺去无数儿童性命。新中国成立后,由于营养和医疗卫生条件的改善,我国儿童腹泻的死亡率已显著下降至1%以下(约0.51‰),但发病率仍然较高。儿童患腹泻严重危害生长发育,所以腹泻病被卫生部列为我国儿科重点防治和研究的“四病”之一。
近10多年来,我国对腹泻病的研究与控制已取得重大进展,包括:①进行了大面积的流行病学调查,基本查清了我国儿童腹泻病的发病规律;②通过全年大样本的监测,基本查清了我国儿童腹泻病的主要病原;③已研究出儿童腹泻病的危险因素通过控制危险因素总结出一些有效的预防方法;④制定了全国统一的《中国腹泻病诊断治疗方案》;⑤国家卫生健康委及多数省市有了腹泻病控制规划(control of diarrheal diseases,CDD);⑥为了落实CDD曾进行过层层培训。在20世纪50和60年代,我国曾发生过较大规模的致病性大肠埃希菌肠炎(病死率高达18%)和细菌性痢疾(中毒型痢疾病死率22.3%)的流行。70年代以后,前者已基本被控制,也罕见引起死亡;中毒型痢疾病例临床也已很少见,病死率已降至1%以下。1973年Bishop证实秋冬季腹泻的病原是轮状病毒以来,我国也于1978年在秋季腹泻的粪便中检测到该病毒。80年代中期,我国得到世界卫生组织和联合国儿童基金会的支持,在全国范围内开展了腹泻病学、病原学、预防、医院内交叉感染、米汤加盐口服补液盐及厌氧菌与儿童腹泻发病机制及治疗作用等课题的研究,取得了一系列具有代表性的科研成果。
引起小儿腹泻病的病因分为:①感染性:如病毒、细菌、真菌和寄生虫等感染;②非感染性:包括饮食性、过敏性、先天酶缺陷及气候等因素引起的腹泻。
1.感染因素
肠道内感染:可由病毒、细菌、真菌、寄生虫引起,以前两者多见,尤其是病毒。
(1)病毒感染
寒冷季节的婴幼儿腹泻80%由病毒感染引起。20世纪70年代国外证明病毒性肠炎主要病原为轮状病毒(rotavirus),其次有星状(astrovirus)和杯状病毒(calicivirus)、肠道病毒,包括柯萨奇病毒(coxsackis virus)、埃可病毒(echo virus)和肠道腺病毒(enteric adenovirus)、诺沃克病毒(Nor walk virus,现又称Norovirus)和冠状病毒(coronavirus)等。
(2)细菌感染(本文中不包括法定传染病)
1)致腹泻大肠杆菌:根据引起腹泻的大肠杆菌不同致病性和发病机制,已知菌株可分为5大组。①致病性大肠杆菌(enteropathogenic E﹒coli,EPEC)为最早发现的致腹泻大肠杆菌。EPEC侵入肠道后,粘附在肠粘膜上皮细胞,引起肠粘膜微绒毛破坏,皱襞萎缩变平,粘膜充血、水肿而致腹泻,可累及全肠道。②产毒性大肠杆菌(enterotoxigenic E.coli,ETEC)可粘附在小肠上皮刷状缘,在细胞外繁殖,产生不耐热肠毒素(labile toxin,LT)和耐热肠毒素(sta ble toxin,ST)而引起腹泻。③侵袭性大肠杆菌(enteroinvasive E﹒coli,EIEC)可直接侵入小肠粘膜引起炎症反应,也可粘附和侵入结肠粘膜,导致肠上皮细胞炎症和坏死,引起痢疾样腹泻。该菌与志贺菌相似,两者O抗原有交叉反应。④出血性大肠杆菌(enterohemorrhagic E.coli,EGEC)粘附于结肠产生与志贺杆菌相似的肠毒素(vero毒素),引起肠粘膜坏死和肠液分泌,致出血性肠炎。⑤粘附‐集聚性大肠杆菌(enteroadherent‐aggregative E.coli,EAEC)以集聚方式粘附于下段小肠和结肠粘膜致病,不产生肠毒素,亦不引起组织损伤。
2)空肠弯曲菌(campylobacter jejuni):与肠炎有关的弯曲菌有空肠型、结肠型和胎儿型3种,95%~99%弯曲菌肠炎是由胎儿弯曲菌空肠亚种(简称空肠弯曲菌)所引起。致病菌直接侵入空肠、回肠和结肠粘膜,引起侵袭性腹泻。某些菌株亦能产生肠毒素。
3)耶尔森菌(Yersinia):除侵袭小肠、结肠粘膜外,还可产生肠毒素,引起侵袭性和分泌性腹泻。
4)其他:沙门菌(sal monella)(主要为鼠伤寒和其他非伤寒、副伤寒沙门菌)、嗜水气单胞菌(aeromonas hydrophila)、难辨梭状芽孢杆菌(clostridium difficile)、金黄色葡萄球菌(staphylococcal aureus)、绿脓杆菌(bacillus pyoeyaneus)、变形杆菌(bacillus proteus)等均可引起腹泻。
(3)真菌
致腹泻的真菌有念珠菌、曲菌、毛霉菌,小儿以白色念珠菌(candida albicans)多见。
(4)寄生虫
常见为蓝氏贾第鞭毛虫、阿米巴原虫和隐孢子虫等。
肠道外感染:有时亦可产生腹泻症状,如患中耳炎、上呼吸道感染、肺炎、泌尿系感染、皮肤感染或急性传染病时,可由于发热、感染原释放的毒素、抗生素治疗、直肠局部激惹(膀胱感染)作用而并发腹泻。有时病原体(主要是病毒)可同时感染肠道。
滥用抗生素引起的腹泻:除了一些抗生素可降低碳水化合物的转运和乳糖酶水平之外,肠道外感染时长期、大量地使用广谱抗生素可引起肠道菌群紊乱,肠道正常菌群减少,耐药性金黄色葡萄球菌、变形杆菌、绿脓杆菌、难辨梭状芽孢杆菌或白色念珠菌等可大量繁殖,引起药物较难控制的肠炎,有学者称之为抗生素相关性腹泻(antibiotic‐associated diarrhea,AAD)。
2.非感染因素
(1)饮食因素:①喂养不当可引起腹泻,多为人工喂养儿,原因为:喂养不定时,饮食量不当,突然改变食物品种,或过早喂给大量淀粉或脂肪类食品;果汁,特别是含高果糖或山梨醇的果汁,可产生高渗性腹泻;肠道刺激物(调料、富含纤维素的食物)也可引起腹泻。②过敏性腹泻,如对牛奶或大豆(豆浆)过敏而引起腹泻。③原发性或继发性双糖酶(主要为乳糖酶)缺乏或活性降低,肠道对糖的消化吸收不良而引起腹泻。
(2)气候因素:气候突然变化、腹部受凉使肠蠕动增加;天气过热消化液分泌减少或由于口渴饮奶过多等都可能诱发消化功能紊乱致腹泻。
1986年和1988年七省一市对5岁以下急性腹泻患儿逐月监测2959例的粪便标本作了细菌、病毒与原虫等病原流行病学调查,结果如表1。七省示范县农村小儿急性腹泻病原依次顺序为:①致泻性大肠埃希菌;②轮状病毒;③志贺菌;④空肠弯曲菌。北京市腹泻病原依次为:①轮状病毒;②致泻性大肠埃希菌;③志贺菌;④沙门菌。上海市腹泻病原监测有所不同:1981-1984年小儿腹泻病原菌中志贺菌占首位,空肠弯曲菌第二位。1985年以后空肠弯曲菌跃居首位,志贺菌居第二位。2009-2018年贵阳市感染性腹泻病原中病毒性腹泻居首位,其次为沙门菌感染。以上差异与经济、文化、卫生条件及地区特殊性有关。2014-2015年全国其他感染性腹泻监测显示病毒感染>90%,以轮状病毒为主,其次为诺如病毒。
耐药性监测:据七省一市细菌耐药性监测,总的显示四环素耐药率达71.1%~83.6%,磺胺54.4%~74.8%,氯霉素 33.9%~35.8%,呋喃唑酮53.6%~100%,氨苄西林49.1%~97.1%。以下抗生素保持较低耐药率:庆大霉素29.2%~32.9%,多黏菌素E 20.0%,阿米卡星12.7%~5.2%,卡那霉素21.2%~33.6%,新霉素耐药率已降至12.0%~17.9%。喹诺酮类药物对肠道病原菌有较好的效果。据北京原302医院耐药试验结果显示对痢疾杆菌的耐药率为:吡哌酸5.7%~3.9%,诺氟沙星4.1%,依诺沙星0.9%~0.7%,环丙沙星为0%。近年来喹诺酮类药耐药率有上升趋势。第3代头孢菌素中的头孢噻肟及头孢他啶对鼠伤寒沙门菌有较好的效果。
表1 1986年和1988年七省一市逐月监测小儿急性腹泻2959例主要病原
喹诺酮类药物对小儿骨骼发育障碍的问题多年来是国内外学者争议的问题。美国学者从动物实验中发现喹诺酮类药物可影响小动物骨骼发育;而英国学者在小婴儿中应用萘啶酸(第一代喹诺酮类药)并未发现有骨骼障碍。认为婴儿不同于动物有种族差异。为此,《中华儿科杂志》于1996年邀请国内有关专家就喹诺酮类药对小儿毒副作用问题专门进行了一次笔谈。专家们一致认为我国小儿中应用喹诺类药已多年,有的进行了多年毒副作用监测包括骨骼X片、钙、磷及碱性磷酸酶的监测均未发现有异常。近年来国外文献也有许多报道认为喹诺酮类药在小儿中可以应用,对小儿是安全的。但要注意选择好适应证。剂量不宜太大,疗程不要太长,并继续监视其远期毒副作用。
在中国有两组大范围的流行病学调查资料:①1985-1986年由首都儿科研究所牵头在广东、福建、云南、四川、湖北、陕西、山西七省妇幼卫生示范县及北京市,对5岁以下小儿10 287人进行了流行病学调查。按当时WHO规定的诊断标准,除粪便性质异常外,患儿每天大便次数≥4次,采用每月3天调查法,全年调查119 088人次。查明7省示范县农村5岁以下小儿急性腹泻平均每人年发病次数为(2.01±0.03)次,年死亡率为0.51‰;北京市平均每人年发病次数为(0.45±0.03)次,北京监测儿童中没有死亡。监测结果显示小儿腹泻发病率农村高于城市;北京市郊区每人每年1.01次,高于城区每人每年0.27次;散居儿童每人每年0.50次,高于集体儿童每人每年0.08次。以1岁以内发病构成比(占38.65%)最高,其次是1~2岁组(占32.29%)。2岁以内发病占70.94%。②1988年卫生部防疫司组织20省市入户调查,当时WHO的诊断标准有了改变,除粪便性质异常外,大便次数≥3次即可诊断,标准放宽。采用8月调查一天回顾半月,所得结果推算全年的方法。20省市共调查126 956人,其中5岁以下小儿10 987人,调查结果:20省市总发病率为每人每年0.7次(包括成人和小儿),当时全国总人口为11亿,依次推算全国每年发生腹泻病为7.7亿人次,其中5岁以下小儿发病率为每人每年1.9次(城市农村混合计算),当时测算5岁以下小儿占人口总数的8.65%,约0.95亿,依此推算全国每年5岁以下小儿腹泻病为1.80亿人次,可见腹泻病危害面之大。
据1986年7月-1987年6月我国七省一市(福建、广东、云南、四川、湖北、陕西、山西及北京)儿童腹泻病调查结果每年有两个发病高峰,一是发生在6、7、8月,称夏季腹泻主要病原是致泻性大肠埃希菌与痢疾杆菌;另一高峰发生在10、11、12月,称秋季腹泻,主要病原是轮状病毒。
危险因素研究:对腹泻有关的31种发病因素逐个进行调查,然后与患儿发病因素作队列分析,使用SAS软件包,在VAX750型电子计算机上运算处理,先用Mantal-Haenzen分层分析方法进行单因素分析,然后采用加权的非条件的Logistic回归模型进行多元分析,得出共有的联合危险因素是:①1岁以内小婴儿;②小儿照看人卫生差;③小儿饭前不用肥皂洗手;④既往经常患腹泻病;⑤饮用水不洁;⑥禽畜放养。可作为预防措施的依据。
小儿感染性腹泻病传染性强,经常在医院内发生交叉感染。引起医院内感染性腹泻的病原菌主要是沙门菌属、志贺菌属、大肠埃希菌、耶尔森菌、空肠弯曲菌、亲水单胞菌等,其中鼠伤寒沙门菌是引起婴幼儿肠炎的重要病原菌。常见的病毒有轮状病毒和腺病毒,其中轮状病毒占70%~80%。
首都儿科研究所联合北京市4个城区医院及1个郊区县医院作了交叉感染的监测。分4个季度对工作人员、患儿、陪住家长作了粪便带菌调查,以及上述人员的双手、外环境及医疗用具等作了大肠埃希菌污染的调查。全年检测工作人员粪便标本262份,未发现致病菌。本次排除了工作人员带菌传播的可能。病房非腹泻患儿全年带菌率为3.03%,其中春季发现1例鼠伤寒菌,冬季1例鼠伤寒,1例婴儿沙门菌;住院非腹泻患儿轮状病毒全年携带率为11.7%,其中秋冬季15.8%,夏季12.2%,提示处理好非腹泻患儿粪便防止污染环境也很重要。采集标本检测大肠埃希菌与腹泻病原菌作为粪便污染指标,结果显示陪住家长双手污染率为42.9%,卫生员为33.3%,护士为16.6%,医生为11.5%,显示双手污染传播腹泻病的可能性大。这次监测显示儿科病房环境物品污染严重。总污染率为22.6%,其中一所郊区县医院总污染率高达46.3%。污染较严重的有水池(38.5%),空气(38.5%),蟑螂(35.7%)。空气标本中检出一株沙门菌,蟑螂检出2株志贺菌,1株副伤寒乙。这些监测结果提示儿科病房消毒急需改进。本次监测一年中发现6起交叉感染,其中2起为鼠伤寒沙门菌,2起为婴儿沙门菌,1起为轮状病毒,1起为致泻性大肠埃希菌。以鼠伤寒沙门菌与婴儿沙门菌最为严重,最多一起前后传染了44人。在发生交叉感染时复查病房环境与物品污染率显著升高达31.3%~75.2%,经严格消毒后病房污染率下降到10%以下,交叉感染得以控制。不同消毒方法效果比较显示:过氧乙酸烟熏消毒效果最好,其次是洗消净或84液(含氯制剂)表面消毒再加紫外线照射,单纯表面消毒效果较差。本次监测提示患儿未早诊断、未早隔离,病房消毒不严格,工作人员双手及环境物品污染是造成院内交叉感染的主要环节。依据上述监测资料提出以下控制对策:①儿科病房应设有环境物品污染监测制度,至少每季度检测一次;②腹泻患儿入院应快速诊断、明确病原早期隔离;③儿科病房工作人员应有良好卫生习惯,每次检查完患儿一定要用肥皂洗手,进隔离室应穿隔离衣、鞋,患儿尿布被服不能丢弃在地面,医疗用具用后均需消毒;④儿科病房要有严格消毒制度,每天用洗消净或84液作表面消毒并配合紫外线照射。各病室每月至少一次用过氧乙酸烟熏彻底消毒。
近年来的研究,发现人的健康有赖于两个生态环境的维护:一为宏观生态(即空气、阳光、森林、河流等),另一个为微生态,是由体内共生菌群组成,它们的构成比大致为:双歧杆菌占95%,乳酸杆菌占1%,其他厌氧菌占3%,需氧菌(大肠埃希菌、肠球菌、葡萄球菌等)所占比例不足1%。为探讨腹泻病与微生态的关系,作者采用八种选择性培养基,应用形态学、常规生化反应、色谱分析、细菌分子生物学技术,对33名腹泻患儿的粪便中需氧菌大肠埃希菌、肠球菌、葡萄球菌及厌氧菌群中的双歧杆菌、拟杆菌、真杆菌、乳酸杆菌和难辨梭状芽孢杆菌等8类细菌进行了分离、培养、计数和鉴定。并与30名同龄健康儿童作对照。结果(表2)显示健康儿童粪便标本需氧菌与厌氧菌之比为2.65×107∶1.04×1010(≈1∶1000);而腹泻患儿需氧菌与厌氧菌之比为2.14×107∶4.05×107(≈1∶1)。两者差别非常显著,P<0.001,也就是说腹泻时肠道厌氧菌减少了约1000倍。这标志着肠内微生态系统严重失去平衡。肠道失去了厌氧菌的屏障与保护作用,从而有利于外来病原的侵袭与定植,促进腹泻病的发生。滥用抗生素则会加重菌群紊乱及微生态失衡。本研究结果提示肠道厌氧菌群减少、微生态失衡,在腹泻发病机制中起重要作用。也为微生态制剂在腹泻病的预防和治疗中提供了理论依据。
表2 正常儿童与腹泻儿童粪便中8类细菌数量比较(Log10n/g)
注:表中数值为对数平均值±标准差;括号中数字为检出阳性率。
世界卫生组织(WHO)推荐口服葡萄糖电解质液(WHO-ORS)是20世纪70年代医学史上一个重大贡献。已在世界各国推广应用,挽救了许多急性腹泻脱水患儿的生命,成功率达95%以上。但在我国有些偏僻农村买不到也不能自己配制WHO-ORS。七省一市腹泻科研协作组于1986-1987年采用米汤或米粉研制口服补液盐(Rice-ORS)取得成功。
1.米粉口服补液盐(Rice-ORS)
以大米粉代替WHO-ORS中口服葡萄糖(即大米粉50g加水到1200ml煮沸15分钟,冷却后加入NaCl 3.5g、KCl 1.5g、NaHCO3 2.5g,混匀而成1000ml)。与WHO-ORS作比较。治疗2岁以下急性腹泻脱水患儿100例(轻度65例、中度30例、重度5例)。随机分成Rice-ORS组71例,WHOORS组29例。结果:Rice-ORS成功率94%,WHO-ORS成功率90%。脱水纠正时间、止泻时间两组均无显著差异,P>0.05。纠正脱水后体重净增数Rice-ORS组平均为0.24±0.25kg,WHO-ORS为 0.14±0.11kg,前者优于后者,P<0.01。Rice-ORS味道好,患儿更乐于接受。说明Rice-ORS可以替代WHO-ORS。
2.米汤加盐口服补液
配制方法是,米汤500ml(约5%浓度)+食盐1.75g(半啤酒瓶铁盖)。预防脱水为40ml/kg,治疗轻、中度脱水剂量为60~80ml/kg,总量在4~6小时内分次服完,并继续饮食。用上述米汤加盐溶液用于预防脱水254例,成功率为91.3%,发生脱水22例(8.7%);另选对照组急性腹泻139例,不用米汤加盐溶液预防结果发生脱水25例(20%),两组比较有显著性差异,P<0.01。应用米汤加盐溶液治疗轻、中度脱水146例,成功率为97.4%;对照组应用WHO-ORS(剂量同上)治疗中度脱水228例,成功率为96.4%,两组比较无显著性差异,P>0.05。表明米汤加盐溶液可用于预防和治疗脱水,且具有家长能自己配制及应用的优点。
导致腹泻的机制有:肠腔内存在大量不能吸收的具有渗透活性的物质——“渗透性”腹泻;肠腔内电解质分泌过多—— “分泌性”腹泻;炎症所致的液体大量渗出——“渗出性”腹泻;肠道蠕动功能异常——“肠道功能异常性”腹泻等。但在临床上不少腹泻并非由某种单一机制引起,而是在多种机制共同作用下发生的。
(一)感染性腹泻
病原微生物多随污染的食物或饮水进入消化道,亦可通过污染的日用品、手、玩具或带菌者传播。病原微生物能否引起肠道感染,决定于宿主防御功能的强弱、感染病原微生物的量的大小及毒力。
1.病毒性肠炎
各种病毒侵入肠道后,在小肠绒毛顶端的柱状上皮细胞上复制,使细胞发生空泡变性和坏死,其微绒毛肿胀,排列紊乱和变短,受累的肠黏膜上皮细胞脱落,遗留不规则的裸露病变,致使小肠黏膜吸收水分和电解质的能力受损,肠液在肠腔内大量积聚而引起腹泻。同时,发生病变的肠黏膜细胞分泌双糖酶不足且活性降低,使食物中糖类消化不全而积滞在肠腔内,并被细菌分解成小分子的短链有机酸,使肠液的渗透压增高。微绒毛破坏亦造成载体减少,上皮细胞钠转运功能障碍,水和电解质进一步丧失(图1)。新近的研究表明:轮状病毒的非结构蛋白4(NSP4)亦与发病机制关系密切。NSP4是具有多种功能的液体分泌诱导剂,可以通过以下方式发挥作用:作用于固有层细胞,激活Cl-分泌和水的外流;改变上皮细胞的完整性,从而影响细胞膜的通透性;本身可能形成一个通道或是激活一种潜在的Ca2+激活通道,导致分泌增加;通过旁分泌效应作用于未感染的细胞,扩大了被感染的黏膜上皮细胞的感染效应;直接作用于肠道神经系统(ENS),产生类似于霍乱毒素引起的腹泻。
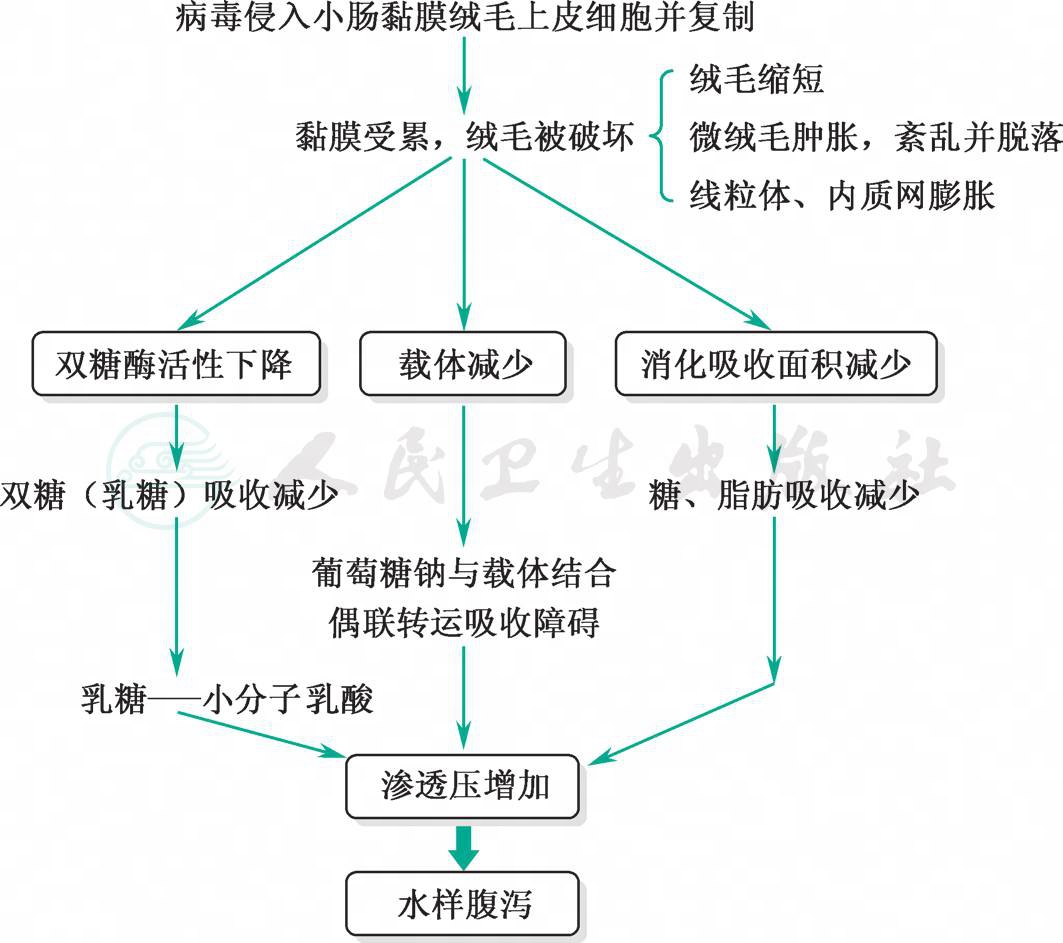
图1 病毒性肠炎发病机制
2.细菌性肠炎
肠道感染的病原菌不同,发病机制亦不同。
(1)肠毒素性肠炎
各种产生肠毒素的细菌可引起分泌性腹泻,如霍乱弧菌、肠产毒性大肠埃希菌等,如图2所示。病原体侵入肠道后,一般仅在肠腔内繁殖,黏附在肠上皮细胞刷状缘,不侵入肠黏膜。细菌在肠腔释放2种肠毒素,即不耐热肠毒素(LT)和耐热肠毒素(ST):LT与小肠上皮细胞膜上的受体结合后激活腺苷酸环化酶,致使三磷酸腺苷(ATP)转变为环磷酸腺苷(cAMP),cAMP增多后即抑制小肠绒毛上皮细胞吸收Na+、Cl-和水,并促进肠腺分泌Cl-;ST则通过激活鸟苷酸环化酶,使三磷酸鸟苷(GTP)转变为环磷酸鸟苷(cGMP),cGMP增多后亦使肠上皮细胞减少Na+和水的吸收、促进Cl-分泌。两者均使小肠液总量增多,超过结肠的吸收限度而发生腹泻,排出大量水样便,导致患者脱水和电解质紊乱。

图2 肠毒素引起的肠炎发病机制——以肠产毒性大肠埃希菌为例
(2)侵袭性肠炎
各种侵袭性细菌感染可引起渗出性腹泻,如志贺菌属、沙门菌属、肠侵袭性大肠埃希菌、空肠弯曲菌、耶尔森菌和金黄色葡萄球菌等均可直接侵袭小肠或结肠肠壁,使黏膜充血、水肿,炎症细胞浸润引起渗出和溃疡等病变。此时可排出含有大量白细胞和红细胞的菌痢样粪便,并出现全身中毒症状。结肠由于炎症病变而不能充分吸收来自小肠的液体,并且某些致病菌还会产生肠毒素,故亦可发生水样腹泻。
(二)非感染性腹泻
非感染性腹泻主要是由饮食不当引起,如图3所示。当进食过量或食物成分不恰当时,消化过程发生障碍,食物不能被充分消化和吸收而积滞在小肠上部,使肠腔内酸度降低,有利于肠道下部的细菌上移和繁殖;食物发酵和腐败,分解产生的短链有机酸使肠腔内渗透压增高,腐败性毒性产物刺激肠壁使肠蠕动增加导致腹泻,进而发生脱水和电解质紊乱。
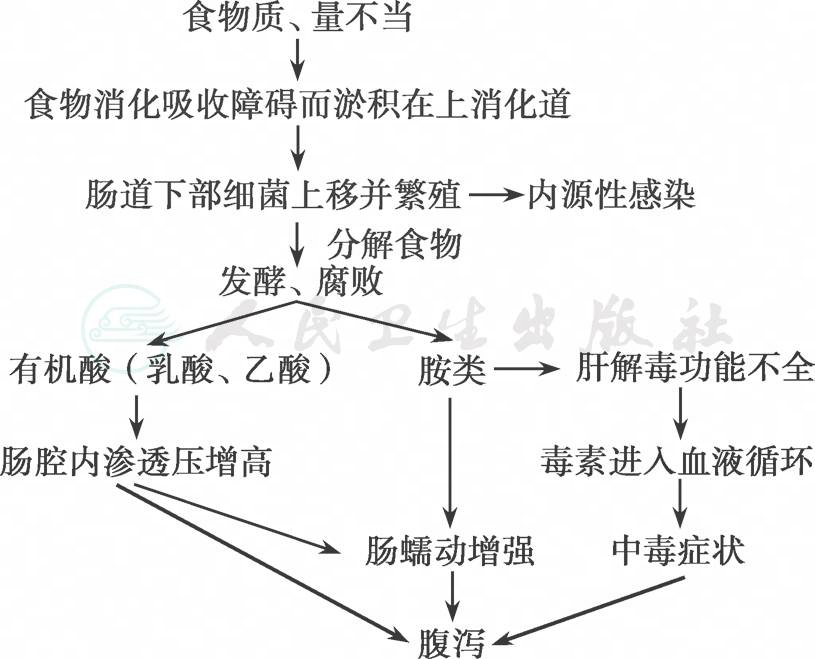
图3 食饵性腹泻发生机制
治疗原则为:调整饮食;预防和纠正脱水;合理用药;加强护理;预防并发症。不同时期的腹泻病治疗各有侧重:急性腹泻多注意维持水、电解质平衡及抗感染;迁延及慢性腹泻则应注意肠道菌群失调及饮食疗法。
(一)急性腹泻的治疗
1.饮食疗法
腹泻时进食和吸收减少,而肠黏膜损伤的恢复、发热时代谢旺盛、侵袭性肠炎丢失蛋白等因素使得营养需要量增加。限制饮食过严或禁食过久常造成营养不良,并发酸中毒,以致病情迁延不愈,影响生长发育。故应强调继续饮食,满足生理需要,补充疾病消耗,以缩短腹泻后的康复时间;应根据疾病的特殊病理生理状况、个体消化吸收功能和平时的饮食习惯进行合理调整。有严重呕吐者可暂时禁食4~6小时(不禁水),待好转后继续喂食,由少到多,由稀到稠。病毒性肠炎多有继发性双糖酶(主要是乳糖酶)缺乏,对疑似病例可暂停乳类喂养,改为豆类、淀粉类代乳品,或去乳糖配方奶粉以减轻腹泻,缩短病程。腹泻停止后逐渐恢复营养丰富的饮食,并每日加餐1次,共2周。
2.纠正水、电解质紊乱及酸碱失衡
重度脱水时静脉补液见图4。
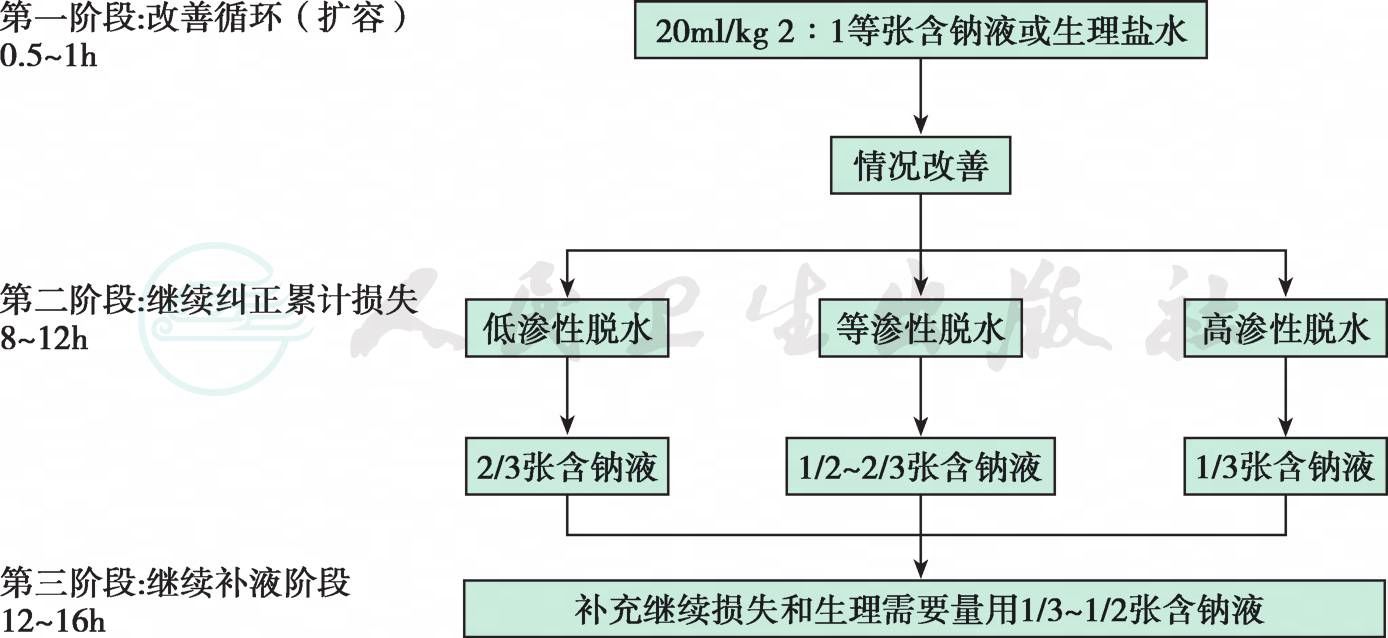
图4 重度脱水时静脉补液
3.补钙、补镁治疗
(1)补钙
补液过程中如出现惊厥、手足抽搐,可用10%葡萄糖酸钙5~10ml,用等量葡萄糖液稀释后静脉滴注。心力衰竭患者慎用洋地黄制剂。
(2)补镁
在补钙后手足抽搐不见好转反而加重时要考虑低镁血症,可测定血镁浓度。同时用25%硫酸镁,每次0.2~0.4ml/kg,深部肌内注射,每日两三次,症状消失后停用。
4.药物治疗
(1)控制感染
①水样便腹泻(在排除霍乱后,约占70%)多为病毒及非侵袭性细菌所致,一般不用抗生素。如伴有明显中毒症状不能用脱水解释者,尤其是对重症患者、新生儿、小婴儿和衰弱患者(免疫功能低下),应选用抗生素治疗。②黏液、脓血便患者(约占30%)多为侵袭性细菌感染,应根据临床特点,针对病原经验性选用抗菌药物,再根据大便细菌培养和药敏试验结果进行调整。对于大肠埃希菌、空肠弯曲菌、耶尔森菌、鼠伤寒沙门菌所致感染,常选用抗革兰氏阴性杆菌的抗生素以及大环内酯类抗生素。金黄色葡萄球菌肠炎、假膜性小肠结肠炎、真菌性肠炎者应立即停用原使用的抗生素,根据症状可选用苯唑西林、万古霉素、利福昔明、甲硝唑或抗真菌药物治疗。③寄生虫引起的腹泻。健康儿童不需要进行抗寄生虫治疗。但是,症状严重者可酌情考虑。严重蓝氏贾地鞭毛虫病例可以用甲硝唑、硝唑尼特、阿苯达唑或者磺甲尼立达唑治疗;隐孢子虫病主要发生在免疫低下儿童中,用硝唑尼特治疗;阿米巴性结肠炎患者应该用甲硝唑治疗。
(2)肠道微生态疗法
有助于恢复肠道正常菌群的生态平衡,抑制病原菌定植和侵袭,控制腹泻。常用布拉酵母菌、鼠李糖乳杆菌、双歧杆菌、嗜酸乳杆菌、需氧芽孢杆菌、蜡样芽孢杆菌制剂。益生元是一类消化性食物,在胃、小肠内不被消化吸收,到达结肠后被双歧杆菌发酵分解利用,能促进双歧杆菌的增长并激发其活性。常用的益生元有寡果糖,亦称双歧因子。
(3)肠黏膜保护剂
能吸附病原体和毒素,维持肠细胞的吸收和分泌功能,与肠道黏液糖蛋白相互作用可增强其屏障功能,阻止病原微生物的攻击,如蒙脱石散。
(4)抗分泌治疗
脑啡肽酶抑制剂消旋卡多曲可以通过加强内源性脑啡肽来抑制肠道水、电解质的分泌,治疗分泌性腹泻。
(5)避免用止泻剂
如洛哌丁醇,因为它抑制胃肠动力的作用,增加细菌繁殖和毒素的吸收,对于感染性腹泻有时是很危险的。昂丹司琼是有效并且毒性低的止吐药物。在持续的呕吐可能妨碍口服补液的进行时,可以给予一次舌下含服昂丹司琼口腔溶解片:4~11岁剂量4mg/次,>11岁剂量8mg(通常0.2mg/kg)。但大部分患者并不需要止吐治疗。
(6)补锌治疗
在锌缺乏高发地区和营养不良患者中,补锌治疗可缩短6月龄~5岁患者的腹泻持续时间和严重程度,增强免疫功能,能潜在阻止部分腹泻病的复发,能改善食欲,促进生长发育。除了能有效缩短病程和降低发病率,补锌及应用口服补液盐增多,还同时减少了抗菌药物的应用;世界卫生组织/联合国儿童基金会建议,对于急性腹泻患者,应每日给予元素锌20mg(>6个月),6个月以下婴儿每日10mg,疗程10~14天。元素锌20mg相当于硫酸锌100mg,葡萄糖酸锌140mg。
(7)密切观察病情
如果患者在治疗3天内临床症状不见好转或出现下列任何一种症状,即应该去医院就诊:①腹泻次数和量增加;②频繁呕吐;③明显口渴;④不能正常饮食;⑤发热;⑥大便带血。
(二)迁延性和慢性腹泻治疗
因迁延性和慢性腹泻常伴有营养不良和其他并发症,病情较为复杂,必须采取综合治疗措施。积极寻找引起病程迁延的原因,针对病因进行治疗(图5),切忌滥用抗生素,避免发生顽固的肠道菌群失调。预防和治疗脱水,纠正电解质及酸碱平衡紊乱。此类患者多有营养障碍,继续喂养对促进疾病恢复,如肠黏膜损伤的修复、胰腺功能的恢复、微绒毛上皮细胞双糖酶的产生等是必要的治疗措施。
(1)调整饮食:应继续母乳喂养。人工喂养儿应调整饮食,保证足够热卡。
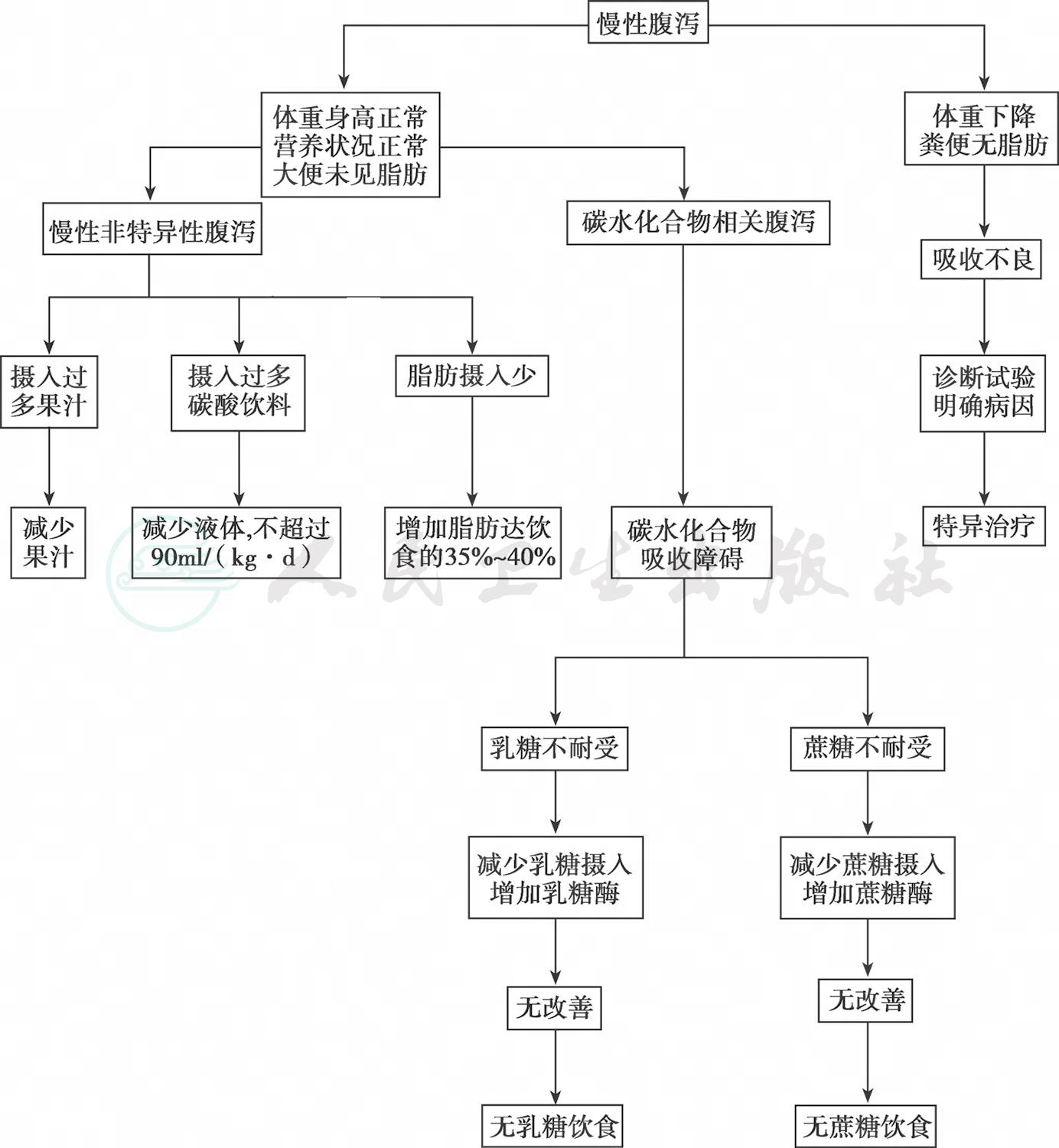
图5 慢性腹泻一般治疗方法
(2)双糖不耐受患者由于有不同程度的原发性或继发性双糖酶缺乏,食用含双糖(包括蔗糖、乳糖、麦芽糖)的饮食可使腹泻加重,其中以乳糖不耐受最多见,所以治疗宜采用去双糖饮食,如采用豆浆或去乳糖配方奶粉。
(3)过敏性腹泻的治疗:如果在应用无双糖饮食后腹泻仍不改善,应考虑食物过敏(如对牛奶或大豆蛋白过敏)的可能性,应回避过敏食物或采用水解蛋白配方饮食。
(4)要素饮食:是肠黏膜受损伤患者最理想的食物,系由氨基酸、葡萄糖、中链甘油三酯、多种维生素和微量元素组合而成。应用时的浓度和量视患者的临床状态而定。
(5)静脉营养:少数患者不能耐受口服营养物质,可采用静脉高营养。推荐方案为:脂肪乳剂每日2~3g/kg,复方氨基酸每日2~3g/kg,葡萄糖每日12~15g/kg,电解质及多种微量元素适量,液体每日120~150ml/kg,热卡每日50~90cal/kg。好转后改为口服。
(6)药物治疗:抗生素仅用于分离出特异病原的感染患者,并根据药物敏感试验选用。补充微量元素和维生素:如锌,铁,烟酸,维生素A、B12、B1、C和叶酸等,有助于肠黏膜的修复。应用微生态调节剂和肠黏膜保护剂。
(7)中医辨证论治有良好疗效,并可配合中药、推拿、捏脊、针灸和磁疗等。
临床营养包括肠内和肠外营养。肠内营养通过鼻胃管或胃造瘘管给予,因原发性肠道疾病或极度衰竭而不能经口喂养的患者亦可应用。持续肠内营养可延长营养物质在仍有吸收功能肠道的通过时间,因此,持续肠内营养对一些吸收功能不良的患者很有效,例如短肠综合征。
在特定条件下(如自身免疫性肠病),应考虑使用免疫抑制剂,甚至生物制剂。对于神经内分泌肿瘤、微绒毛包涵体病引起的腹泻以及肠毒素引起的严重腹泻,可考虑给予生长抑素类似物奥曲肽。
三级预防是我国疾病控制中心推行的策略。即一级预防是针对病因:在疾病发生之前采取措施控制病因,预防疾病的发生;二级预防是针对患者:早发现,早诊断,早治疗,对于传染病来讲,做到三早,一方面对群体有利于控制和消除传染源,另一方面对于患者个体可防止病情的发展;三级预防是针对治疗:使患者尽可能完善地康复,尽力减少并发症、后遗症或伤残。
针对联合危险因素,制定综合预防措施,进行预试验。综合预防措施包括如下内容:①加强2岁以内婴幼儿的卫生管理,提倡母乳喂养,科学护理,做好奶瓶与餐具消毒;②讲究个人卫生,照看人和小儿饭前便后要用肥皂洗手;③改善饮水卫生,改造水源(使用机井水或自来水),防止水源受污染,不喝生水;④加强粪便管理,不随地大小便,改造不卫生厕所,婴儿推广坐盆,禽畜圈养防止粪便污染环境,不用生粪浇菜;⑤加强饮食卫生,不吃变质食物,生吃瓜果要洗净;⑥灭蝇、灭蛆、食物存放要加罩,防止昆虫污染。建立有效的腹泻病管理制度,利用多种形式加强卫生宣传,健全并加强了防治腹泻三级(县、乡、乡村医生)管理组织,保证宣传与预防措施的落实。在七省示范县干预试验2年,结果使小儿腹泻发病率下降了51.74%,年死亡率下降了66%。













