SP-C的功能是建立在基于其特殊的结构和疏水性,但插入磷脂膜时,SP-C可干扰脂质的包装,促进脂质在膜内的运动。SP-C的生物生理特性取决于其膜整个的版图的螺旋的结构,胜于其氨基酸顺序。前驱蛋白在成熟的SP-C的介导下形成非共价的聚体。BRICHOS区域在SP-C蛋白前体复杂的翻译过程中起着重要作用:①辅助蛋白质进入分泌途径;②协助细胞内蛋白酶解系统的独特性转化;③避免蛋白质在细胞内淀粉样沉积。BRICHOS区域基因突变的SP-C前体蛋白(proSP-C)的错误折叠、转运和合成异常,导致一系列毒性作用,如诱导内质网应激作用、细胞毒性、细胞凋亡蛋白酶3和4诱导的细胞凋亡。这些因素可使肺泡Ⅱ型上皮细胞的细胞质的如内质网、高尔体的聚集,导致细胞压力反应的激活,随后的Ⅱ型上皮细胞损伤和凋亡,肺泡Ⅱ型上皮细胞是肺泡修复的祖细胞,其肺泡Ⅱ型上皮细胞的凋亡,其细胞池的耗尽,导致肺纤维化。如基因突变发生在邻近SFTPC的 BRICHOS结构域部位,含SP-C突变体的多囊小泡或被转运至细胞膜进而融合、释放出的SP-C突变体会抑制细胞膜的再吸收循环功能或经高尔基体转运至细胞内包涵体后被逐渐降解,这种突变SP-C的合成仅轻度减少,肺组织损伤相对较轻。
在成人的一项100例的特发性肺纤维化的病例中,只有1例为SP-C基因173T的突变,说明在老年患者的发生率低。然而在一项639例的足月婴儿的原因不明的急性和慢性的肺疾病中,大约一半的基因突变为新生的突变,另一半为遗传其父母一方。
组织学上表现多为NSIP、DIP、特发性肺纤维化、PAP以及CPI。婴儿可表现为慢性婴儿肺炎的特点,如伴有Ⅱ型上皮细胞增生的弥漫性肺泡损伤、含胆固醇结晶的肺泡蛋白沉积、泡沫巨噬细胞、间质淋巴细胞炎症,肺泡壁肌化等。年长儿童主要表现为非特异间质性肺炎或普通间质性肺炎。在成人多诊断为特发性肺纤维化。与SP-B基因突变相比,这些病理表现并非SP-C基因突变特异的类型。肺泡Ⅱ型上皮细胞的超微结构的检查偶尔会发现排列紊乱的板层小体和聚集的电子致密核心的小囊泡一起出现。
表面活性蛋白C(SP-C)是由8号染色体上的SFTPC基因编码的。该基因包含6个外显子,这个大约3.5kb的基因编码一个0.9kB的转录本,然后转录为191或197的氨基酸前蛋白。SP-C的前多肽经过一系列的蛋白水解切割产生35氨基酸的疏水的成熟的SP-C蛋白。超过50个显性表达的SFTPC基因突变可引起从新生儿到成年人的急性和慢性的肺疾病。SFTPC突变为具有不同外显率的常染色体显性遗传。大约55%的突变的病例为自发的突变和散发的病例。其余的为遗传性的。这些突变可发生于整个基因的任何部位,包括错义、片段移位、插入、缺失和拼接位点的突变。最常见的突变为位于C.218T>C,导致密码子73(I73T)的苏氨酸代替异亮氨酸。这个突变与25%的SP-C基因突变的疾病相关。p.I73T的突变在散发病例和遗传的病例均有发现。还有ISV4+1G>C的突变,BRICHOS显性基因突变,如 c.298 G>A(G100S)、A116D、L110R、C189Y(c.566G>A)、L194P(c.581 T>C)、c.325-1G>A、c.424delC、V39A(c.116T>C)、Q145H(c.435 G>C)和 L188P(c.563 T>C)等。其中 V39A 位于成熟的SP-C,其余均为BRICHOS区域的突变。研究还证实了Q145H(c.435 G>C)引起的蛋白质改变并不是氨基酸的取代,而是随后的外显子4的剪接缺陷。
肺部高分辨CT可见磨玻璃影和肺外周的囊泡影(图1)。影像的加重表现为磨玻璃影到纤维化特征出现和囊泡形成。
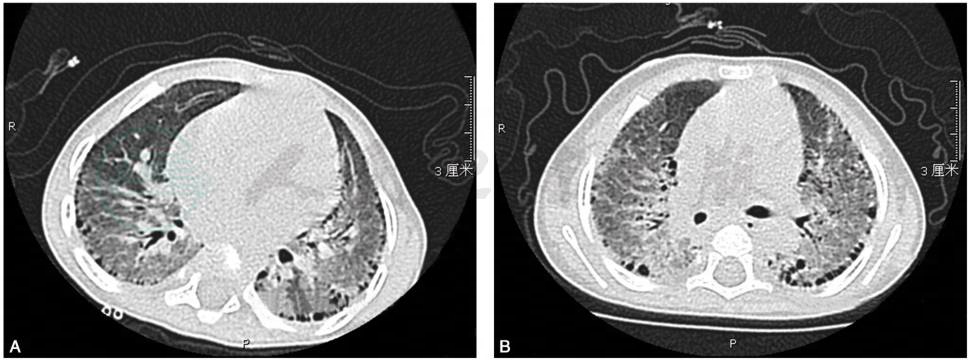
图1 SP-C基因突变相关肺疾病
男,8个月,咳嗽、呼吸困难住院,肺CT示弥漫性磨玻璃影胸膜下囊泡影(A,B),基因检测为SP-C的IVS4,+1G>C突变。
一些病例可自行改善,一些病例用激素治疗后改善,也有用羟氯喹治疗病情改善的报道。另一些需要肺移植。













