英文名称 :invasive fungal infections
中文别名 :侵袭性真菌病
深部真菌病(deep mycosis)系指致病性真菌(pathogenic fungi)侵入人体表层以下的组织,包括皮肤、黏膜、肌肉及内脏所致的各种感染,亦称全身的真菌病(systemic mycosis)或深部真菌感染(deep fungus infection),其感染可局限于某一脏器组织,亦可播散全身。仅有皮肤及附件感染者,称为浅表真菌病(superficial mycosis)。致病性真菌亦可导致真菌过敏(变态反应)及真菌中毒症(毒性反应)。
一、病原真菌分类
大多数已知的病原真菌属于真菌界中囊菌纲(Ascomycetes,如酵母菌)、半知菌纲(Deuteromycetes,如青霉菌、曲霉及假丝酵母菌)及接合菌纲(Zygomtcetes,如毛真菌及根真菌)。早期的真菌分类主要是基于表型特征,目前从核酸水平对真菌进行了更科学的分类,例如已将放线菌划归细菌门,卡氏肺孢子菌划归为真菌门。
(一)按形态分类
真菌按其细胞的基本形态可分为酵母(yeast)、真菌(mould)及蕈菌三类。酵母及真菌是临床上导致深部真菌感染的主要病原体。它们由细胞组成体细胞。真菌的体细胞沿长轴方向延伸呈圆筒状,且边延长边分支形成菌丝,称为丝状真菌(filament fungi)。这两类细胞还通过形成新的、游离的、可重新发育成新个体细胞的孢子(spore),完成菌体的保存和繁殖。此外,部分真菌的形态可随培养条件而变化,在感染组织内寄生和在37℃高营养培养基上呈酵母相,在体外腐生及30℃培养时呈菌丝相,这种菌称为双向真菌(dimorphic fungi)。如球孢子菌、副球孢子菌、皮炎牙生菌、孢子菌及马内菲青真菌等,隐球菌则属于真正的酵母菌型增殖。
(二)按真菌来源分类
临床上常根据不同的来源将真菌分为内源性及外源性两大类。前者存在于健康人的皮肤、口腔及黏膜等处,为内源性的条件致病菌。后者大多数存在于自然界,人体因接触而受染。
二、真菌的结构特征
真菌属于真核细胞,有核膜和核仁,在细胞质内有内质网、高尔基体、线粒体及核糖体等细胞器,在真菌胞核的染色体中DNA具有与组蛋白结合的特点。
三、真菌的生物学特点
真菌培养最常用的培养基为沙保(Sabouraud)培养基。最适宜的培养温度为35~37℃,培养时间为24~72小时。真菌对干燥、紫外线及一般的化学消毒剂的抵抗力较强,对常用抗生素亦不敏感,但对温度较敏感,一般在60℃30分钟,或用石炭酸可将其杀灭。
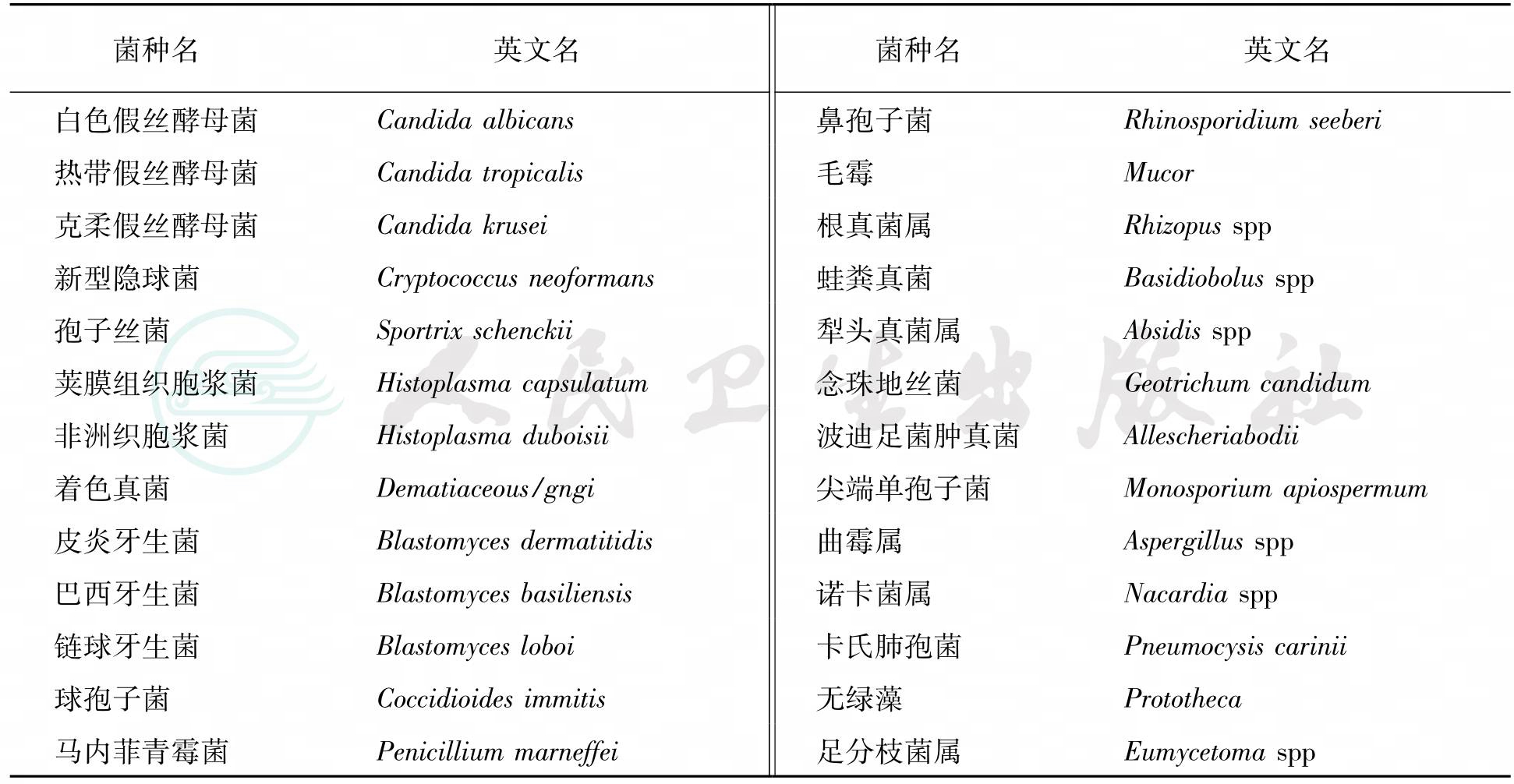
四、常见的致病性真菌
真菌普遍存在自然界,约有150万种,大多数真菌对人类有益,仅200余种对人类有致病性,其中21属48种能引起深部真菌病。常见的致病性真菌病见表1。
表1 临床常见致病性真菌种类
深部真菌感染病情较重,治疗棘手,常危及生命。一旦出现深部真菌感染,应积极采取有效措施。深部真菌感染治疗的关键是对患者进行早期诊断、早期进行经验性治疗。
一、治疗策略
深部真菌感染患者的治疗策略根据不同情况可分为预防性治疗、先发治疗、经验治疗和目标治疗。表21-1-2总结了近年国际上对于侵袭性真菌感染的治疗建议。
(一)预防性治疗
即对尚未发生真菌感染的高危患者给予抗真菌药,可减少侵袭性真菌感染并减少抗真菌药的全身应用,降低与真菌感染相关的病死率和某些中性粒细胞缺乏及器官移植患者的总病死率。目前认为预防性治疗适应证为:①急性白血病诱导期采用细胞毒药物者;②同种异体造血干细胞移植受者及自身骨髓移植患者;③应用增强免疫抑制剂者;④AIDS患者;⑤肝移植受者术后早期。
(二)经验治疗
中性粒细胞减少症发热患者经恰当抗菌药物治疗4~6日后仍持续发热,原因不明者可予以经验性抗真菌治疗。
(三)先发治疗
先发治疗系对高危患者已有真菌感染迹象但尚无临床表现的患者进行抗真菌治疗。现已确认对移植物受者应监测CMV抗原、CMV培养及基因检测,如确证患者存在CMV脱壳时,在出现临床症状前开始抗病毒治疗,可提高治愈率。因此提示对高危患者采取先发抗真菌治疗可能是有益的。
(四)目标治疗
对已明确病原真菌的深部真菌感染患者,针对病原真菌进行治疗。
二、抗真菌药物
目前应用于抗真菌药物主要分为以下三大类。
(一)作用于真菌细胞膜的药物
1.多烯类抗真菌药
其通过与真菌细胞膜上的麦角甾醇结合,使膜分解或增加膜通透性、导致细胞内容物外溢而死亡。两性霉素B(amphotericin B,AmB)来源于结节状链丝菌,抗菌谱广,对多种致病性酵母、隐球菌及真菌等均有良好的抑制作用,广泛应用于假丝酵母菌病、隐球菌病、组织胞浆菌病、曲霉病、球孢子菌病、副球孢子菌病及马内菲青霉病等,是治疗深部真菌感染良好的药物,但其急性输入性毒性(寒战、发热及头痛)和明显的不良反应(恶心、呕吐、低钾血症、血栓静脉炎及溶血)以及剂量限制性肾毒性等制约了临床应用。针对AmB的肾脏毒性,已有3种含脂类的AmB制剂上市:①AmB胶质分散体(amphotericin B colloidal dispesion,ABCD)是AmB的异构体,它与AmB的分子量相同,且有同样的胆固醇硫酸基。但它的药代学和药效学与AmB不同,ABCD进入体内后主要通过肝脏代谢,从而降低了肾毒性。且血浆浓度低,分布容积大,半衰期延长。ABCD对哺乳动物细胞的细胞壁的亲和力要低于真菌的细胞壁,亦使不良反应减小。对于那些因使用AmB致肾功能损害的患者,ABCD可替代AmB行序贯及长期治疗;②两性霉素B脂质体(amphotericin B liposome,AmBisome)是AmB被整合成单室脂质体的产物。当AmBisome和真菌细胞或者利什曼原虫接触,脂质降解,AmB被释放并优先与真菌的细胞膜的麦角固醇结合,从而导致真菌及利什曼原虫崩解。同传统的AmB相比,它的肾毒性和致其他严重不良反应要明显偏低,致死率要低于AmB约28%;③两性霉素B脂质复合物(amphoterin B lipid complex,ABLC)是AmB即由磷酸卵磷脂及磷脂酰甘油构成的双层膜性物质聚合而成。根据ABLC的药代动力学特性,它的血浆廓清率高,外周组织分布浓度高,致使血浆中的游离药物浓度降低,这使得同AmB相比不良反应大大降低。因此,ABLC的剂量可比AmB的常规剂量大。对于那些AmB治疗失败或者不能耐受AmB的患者ABLC仍然有效。AmB耐药主要是由于ERG2或ERG3基因的缺失导致麦角甾醇含量的降低。唑类抗真菌药能抑制麦角甾醇的生物合成,导致细胞膜中缺乏AmB结合位点,使真菌对AmB产生耐药性。两性霉素B的主要临床给药方法如下:
(1)静脉点滴法:
稀释液用5%葡萄糖液或右旋糖酐溶液,稀释浓度为0.1mg/ml以下。首剂每日1mg,以后每日或隔日给药一次,每次递增5~10mg,直至 50mg,总量不超过每日1.5mg/kg。输注速度宜慢,每次要求在3~6小时内滴完。
(2)鞘内及脑室内注射:
开始用药为每日0.1mg,吸入脑脊液3~5ml稀释,与地塞米松2~4mg混合后缓慢注入,以后隔日或3日给药一次,共10次,每次增加0.25~0.5mg,最大剂量不超过每日0.5mg,总剂量10~20mg。小脑延髓池内注射,开始剂量为0.25mg,以后逐渐增大至每日0.5mg。注入前药物必须以脑脊液稀释2~8倍,每周注射2次。
(3)气管内注射:
首剂量为每日1mg,以后从每日5mg开始,逐渐增加至每日10~20mg,隔日气管内滴注一次。药物用灭菌蒸馏水稀释。
(4)胸腔内注射:
药物剂量从每日1mg开始,逐渐增量至5~20mg,每周1~3次,每次均应先抽胸腔积液后作胸腔内注射。
(5)皮内注射:
用2%普鲁卡因溶液2ml加药物0.5~2mg,做病灶或皮下注射,每次药物总量不超过50mg,每隔10~30日注射一次。
(6)膀胱内注射:
将药物15~20mg溶解于100ml注射用的蒸馏水中,每日1~2次膀胱内注射。
2.吡咯类(或称唑类、三唑类)抗真菌药
吡咯包括咪康唑(miconazole,MCZ)、氟康唑(fluconazole,FLCZ)、伊曲康唑(itraconazole,ITCZ)、伏立康唑(voriconazole,VRCZ)、泊沙康唑(posaconazole)等,为目前临床应用最广的抗真菌药。FLCZ通过干扰真菌的细胞色素P-450合成,从而干扰真菌细胞膜麦角固醇的合成,生物利用度极好,抗菌谱广,为治疗白色假丝酵母菌的首选药物,但对光滑假丝酵母菌效果较差,克柔假丝酵母菌几乎是完全耐药,对曲霉无效。近年来耐FLCZ的白色假丝酵母菌亦有逐年增高趋势,加大FLCZ用量对某些病例仍然有效。ITCZ作用机制同FLCZ,但ITCZ优先与角蛋白组织(如指甲、头发和皮肤)结合,所以在治疗浅表、皮下真菌感染方面有良好的疗效。ITCZ对非白色假丝酵母菌和曲霉属的真菌有广谱抗菌活性,不仅具有抗真菌的活性且具有免疫调节功能,它能够协助巨噬细胞杀死皮炎芽生菌,对中性粒细胞减少的患者亦可有效预防及治疗全身真菌感染。但口服吸收差,限制了对深部真菌感染的治疗。VRCZ是新的三唑类广谱抗真菌药,其作用机制是抑制真菌细胞膜中的羊毛甾醇14α-去甲基酶,从而影响麦角固醇的合成,导致细胞死亡。VRCZ对酵母菌和真菌效果好,临床用于治疗侵袭性曲霉、波伊德假霉样真菌、足放线病菌及镰刀菌属感染。对耐FLCZ的白色假丝酵母菌和近平滑假丝酵母菌以及对FLCZ先天耐药的克柔假丝酵母菌,耐AmB的曲霉、隐球菌等VRCZ亦有良好疗效。泊沙康唑是一种新型的三唑类抗真菌药,是ITCZ的结构类似物,能较好透过脑脊液屏障,在脑中具有较高的生物利用度。对曲霉、荚膜组织胞浆菌、假丝酵母菌、新型隐球菌等多种真菌具有较好活性。泊沙康唑对AmB耐受菌株的活性优于ITCZ,即使对那些曾经有过接受其他抗真菌药物治疗失败的难治性病例同样安全有效。此外,泊沙康唑的耐药比其他三唑类药物要少,这是因为泊沙康唑对细胞色素类的突变不敏感,而细胞色素类的突变阻碍了其他三唑类抗真菌药物与真菌的结合才产生耐药。唑类药物发生耐药机制主要有:①唑类药物的靶酶14-α-去甲基化酶(14DM)发生改变,包括基因突变导致靶酶与药物的亲和力降低,以及靶酶的过度表达;②耐药菌细胞膜上外排泵基因的过度表达。主动外排系统包括两大类:一类是ATP结合盒转运子家族(ATP binding cassette ABC)如假丝酵母菌耐药基因(Candida drug resistance,CDR);另一类是主要易化超家族(major facilitator superfacilitater,MFS)如假丝酵母菌多药耐药基因(C.albicans multidrug resistance,CaMDR1)及flu1(fluconazole resistance)基因;③真菌细胞膜对抗真菌药的通透性下降;④生物被膜的形成,使真菌对多种唑类药物呈现高度耐药性,敏感性下降几十倍甚至几百倍。
3.丙烯胺类抗真菌药
通过抑制角鲨烯环氧化酶,干扰真菌甾醇的生物合成,导致细胞内角鲨烯的堆积,使真菌的脂质代谢发生紊乱而起到抗真菌作用。代表药物有布替萘芬及特比萘芬,临床多用于浅部真菌感染。目前对丙烯胺类药物耐药性的报道较少,但临床已经出现了对特比萘芬耐药的毛孢子菌属(Trichophyton rubrum)。对这些耐药株的角鲨烯环氧化酶编码基因进行序列分析,结果显示每株都包含1个氨基酸突变1.393F。部分对氟康唑耐药的光滑假丝酵母菌表现出对特比萘芬的交叉耐药。而且CDR基因的产物与特比萘芬之间存在着交互作用。推测其耐药机制可能与CDR1介导的外流有关。
(二)作用于真菌细胞壁的药物
棘白菌素类,通过抑制真菌细胞β-葡聚糖合成酶的活性而抑制细胞壁1,3-β-D-葡聚糖合成,致使细胞破坏,细胞内容物渗漏,发挥抗真菌作用,已上市的品种有卡泊芬净(caspofungin)、米卡芬净(micafungin)及阿尼芬净(anidulafungin)。卡泊芬净具有广谱抗真菌活性,对耐FLCZ的假丝酵母菌、曲霉及孢子菌等真菌均有较好的活性及耐受性,不良反应小。主要是通过肝脏代谢,故没有肾毒性,对有肾脏功能不全的患者无需调整剂量。卡泊芬净治疗侵袭性假丝酵母菌感染时疗效与AmB相同,且可用于对其他抗真菌药物无效病例的治疗。卡泊芬净较常见的不良反应有寒战、发热、静脉炎、恶心、呕吐、皮疹、肝功能异常及血细胞减低等。静脉滴注时勿用葡萄糖稀释,血液透析不能清除该药。米卡芬净及阿尼芬净的活性谱与卡泊芬净相似,分布在肺组织中的药物浓度最高,其次为肝、脾、肾。米卡芬净在脑组织浓度极低或不可测,而阿尼芬净在脑组织中浓度相对较高。
(三)抑制真菌核酸生物合成的药物
代表药物为氟胞嘧啶(flucytosine,5-FC),很少单独应用,主要与其他药物合用治疗深部真菌感染。氟胞嘧啶通过真菌细胞的酶系统进入细胞内,转换为氟脲嘧啶(5-fluorouracil,5-FU),替代尿嘧啶进入真菌的脱氧核糖核酸中,阻断核酸的合成。氟胞嘧啶为抑菌剂,高浓度时有杀菌作用。氟胞嘧啶对隐球菌属、假丝酵母菌属及球拟酵母菌等具有较高的抗菌活性,对着色真菌、少数曲霉有一定抗菌活性,对其他真菌抗菌作用均差。真菌对本品易产生耐药。本品口服吸收迅速而完全,可经透析排出体外。不良反应有恶心、呕吐等消化道症状,肝脏血清转氨酶升高,偶发肝坏死,可使白细胞或血小板减少,偶发全血细胞减少、骨髓抑制和再生障碍性贫血。单独应用5-FC抗真菌治疗时有10%~15%的真菌可产生耐药性。
预防深部真菌感染,关键在于临床合理使用抗菌药物,保护皮肤,各种黏膜屏障的完整性,增强患者的免疫功能,注意医院环境的消毒灭菌工作。在血液病患者、肿瘤患者及器官移植等特定情况下,适当使用酮康唑或氟康唑等抗真菌药物预防病原真菌进一步侵入组织器官亦非常重要。













