英文名称 :bacterial meningitis
我国儿科医生常常将细菌性脑膜炎(bacterial meningitis,BM)机械的分为脑膜炎球菌引起的流行性脑脊髓膜炎(流脑)和其他细菌引起的化脓性脑膜炎,前者属于传染病范畴。应该与国外统称细菌性脑膜炎一致,也都可称为化脓性脑膜炎。在美国,它们都称为“应上报感染性疾病(notifiable infectious diseases)”。 细菌性脑膜炎的主要致病菌除脑膜炎球菌外,还有肺炎链球菌和b型流感嗜血杆菌。许多细菌都能引起脑膜炎。
急性细菌性脑膜炎是常见的严重的中枢神经系统感染性疾病。2016全球疾病、伤害和危险因素负担研究(Global Burden of Diseases,Injuries,and Risk Factors,2016 study)显示,全球脑膜炎新发病例数从1990年的2 500 000上升至2016年的2 820 000。不同地区国家细菌性脑膜炎的发病率各不相同,2016年发病率最高为南苏丹(207.4/100 000),最低为澳大利亚(0.5/100 000)。撒哈拉以南的非洲脑膜炎带(从塞内加尔延伸到南苏丹和埃塞俄比亚)的脑膜炎疾病负担仍较重。随着疫苗的应用及有效抗感染及综合治疗方案的推广,脑膜炎病死率下降明显,1990年至2016年下降了21.0%。全球不同年龄段儿童的脑膜炎相关死亡率下降程度不同,对于5岁以上儿童,全球死亡人数仅减少了2.7%,从1990年的165 900减少到2013年的161 500;<5岁年龄组,减少43%,其中1~59个月年龄组,减少54%。
细菌性脑膜炎在小儿,尤其是婴幼儿中较常见。自使用抗生素以来其病死率已由50%~90%降至10%以下,但因致残率高,神经系统后遗症(neurological sequelae)发生率占存活儿的1/3,因此仍是小儿严重感染性疾病之一。其死亡率在发展中国家为4%~15%,居世界感染性疾病死亡病例的前10位。虽然细菌性脑膜炎在诊断和治疗方面已有了较大的进步,但细菌性脑膜炎在治疗过程中可能出现多种神经系统和全身系统并发症,其发生率可能因年龄和致病菌而异,既往文献报道,多达50%的幸存者可能出现神经系统并发症,基于18篇儿童细菌性脑膜炎并发症病例系列,包括硬脑膜下积液17%~40.3%,癫痫4%~47%,脑积水 2.5%~31%,听力损害1.56%~12%,颅内出血0.3%~28%,脑室炎0.3%~9%,脑神经麻痹1%~6%,脑梗死1%~14%,硬脑膜下积脓0.3%~2.6%,抗利尿激素分泌不良0.4%~2%,硬脑膜下血肿约1%,脑脓肿0.5%~0.3%,视力损害或丧失0.6%。全身系统并发症包括感染性休克0.3%~4%,DIC 2%,消化道出血0.7%、关节炎0.3%等。另有细菌性脑膜炎合并脑静脉血栓病例报告7例,烟雾病2例,血管炎3例,无法统计其发生率。2020版《尼尔森儿科学》指出细菌性脑膜炎可在急性期出现的并发症包括硬脑膜下积液(10%~30%)、癫痫、脑神经麻痹、脑卒中、静脉窦血栓形成、脑疝、抗利尿激素分泌不良综合征。血栓、贫血、DIC、休克也可在脑膜炎治疗过程中发生。我国2000-2003年与国际疫苗研究所合作,在广西进行的流行病学调查,首次揭示我国5岁以下儿童病原确诊的细菌性脑膜炎年均发病率为12.28/10万,病死率为18.42%,并发症率13.16%,调查同时发现,各级医疗机构都存在抗生素不合理应用现象,在一定程度上掩盖了我国细菌性脑膜炎的真实发病情况。2006-2009我国CDC进行四省市调查,证实5岁以下儿童细菌性脑膜炎的发病率(6.95~22.30)例/100 000;目前化脓性脑膜炎总体预后不容乐观,存活者中常发生各种后遗症如精神发育迟滞、运动障碍、视力损害及感应神经性耳聋、脑积水和癫痫等,并且随着年龄的增长,许多的患儿会出现学习和行为方面的问题,给患儿家庭及社会带来沉重的负担。
文献报道,2个月以上儿童细菌性脑膜炎主要致病菌是肺炎链球菌、流感嗜血杆菌和脑膜炎球菌,我国这三种病原菌的培养阳性率在6.3%~35.8%不等,采用针对细菌荚膜多糖抗原进行检测的阳性率最高报道是50.7%,同时有38%~50%以上病例病原不明。在具体病原体分布上,不同地区存在着差异,但5岁以下流感嗜血杆菌性脑膜炎的发病率最高报道仅为10.4/10万,世界卫生组织免疫、疫苗和生物学专家战略性建设委员会认为,目前亚洲流感嗜血杆菌性脑膜炎等发病率要低于其他国家和地区,很大程度上是因为现行的方法学对真实的发病情况做出了过低的估计。首都医科大学附属北京儿童医院自20世纪90年代末期开始把乳胶凝集试验(latex agglutination test,LAT)作为细菌性脑膜炎常规检测项目,抗原阳性率不足10%。研究证实,抗生素应用不仅影响脑脊液细菌培养结果,对抗原检测同样有很大程度的影响。大量不明原因的细菌性脑膜炎中不少是由这三种病原菌所引起的。不同年代各种细菌在病因学上所占地位不同,也存在明显的地理差异。在我国,脑膜炎球菌、肺炎链球菌及流感嗜血杆菌引起的化脓性脑膜炎占小儿化脓性脑膜炎总数2/3以上。不同年龄小儿感染的致病菌也有很大差异。新生儿容易发生肠道革兰氏阴性杆菌脑膜炎,其中大肠埃希菌占第一位,其次为B族链球菌、金黄色葡萄球菌、铜绿假单胞菌等。此外,单核李斯特菌、拟多形杆菌引起新生儿脑膜炎的报道亦不罕见,这些可能与产妇阴道菌群及母、婴免疫状态有关。例如产妇在分娩过程中,易感胎儿可因宫内或产道中细菌感染而引起化脓性脑膜炎,亦可由于分娩时吸入患败血症母亲的羊水引起。金葡菌脑膜炎可因创伤、手术、先天畸形而并发,治疗颇为困难。近年有报告两种或多种细菌混合感染,多为继发性,原发者很少见。
早期和轻型病例,炎性渗出物多在大脑顶部表面。以后逐渐蔓延,使全部大脑表面、基底部、脊髓被一层脓液覆盖。脑膜炎球菌感染时,渗出物显著地覆盖于顶、枕叶和小脑。肺炎链球菌感染时,稠厚的脓性纤维素分泌物主要局限于大脑表面,特别是额叶,基底部受侵犯较轻。链球菌感染与肺炎链球菌感染相似,但分泌物所含纤维素较少,因此渗出物较稀薄。蛛网膜下腔充满浆液脓性分泌物,脑桥前面、第四脑室底及脑桥与小脑之间尤甚。脑膜表面的血管极度充血,常有血管炎,包括血管与血窦的血栓形成,血管壁坏死、破裂与出血。
感染延及脑室内膜则形成脑室膜炎。在软脑膜下及脑室周围的脑实质亦可有细胞浸润、出血、坏死和变性即发生脑膜脑炎(meningoencephalitis)。稠厚的脓块或粘连可闭塞马氏孔、路氏孔及大脑导水管,造成梗阻性脑积水(obstructive hydrocephalus)。大脑表面蛛网膜因炎症发生粘连、萎缩而影响脑脊液吸收时,则可形成交通性脑积水(communicating hydrocephalus)。 感染波及周围脑神经,或因颅内压力增高使脑神经受压、坏死,则可引起相应的脑神经功能改变。如失明、面瘫、耳聋。经脑膜间的桥静脉发生栓塞性静脉炎,可导致硬膜下积液或积脓。少量积液多可自行吸收,大量积液经多次穿刺仍未吸收者,可有纤维素性包膜形成,而使附近脑组织受压萎缩。
此外,肝、肾组织可见中毒性病变。
细菌抵达脑膜可通过多种途径,如外伤或手术直接接种,淋巴或血流播散等。通常脑膜炎是由菌血症发展而来。细菌多由上呼吸道侵入,先在鼻咽部隐匿、繁殖,继而进入血流,直接抵达营养中枢神经系统的血管,或在该处形成局部血栓,并释放出细菌栓子到血液循环中。由于小儿防御、免疫功能均较成人弱,病原菌容易通过血脑屏障到达脑膜引起化脓性脑膜炎。婴幼儿的皮肤、黏膜、胃肠道以及新生儿的脐部也常是感染侵入门户。鼻旁窦炎、中耳炎、乳突炎既可作为病灶窝藏细菌,也可因病变扩展直接波及脑膜,如耳源性脑膜炎(otogenic meningitis)即常为慢性乳突炎所致。化脓性脑膜炎也可是颅骨外伤、骨折的并发症,特别是那些涉及鼻旁窦的骨折更可形成颅内与外界的直接通道,成为细菌侵入门户。此外,脑膜炎亦可见于有皮肤窦道或脑脊髓膜膨出患儿,此时颅内与外界相通,细菌可经此直接进入蛛网膜下腔。细菌是否入侵中枢神经系统与机体免疫功能状态和细菌数量、毒力有关。细菌进入脑脊液后,由于脑脊液缺乏补体,Ig含量少,吞噬细胞活性不足,因而迅速繁殖,并释放出致炎因子,如革兰氏阳性细菌细胞壁的多肽糖和磷壁酸质,革兰氏阴性菌的内毒素脂多糖。这些物质作为抗原刺激宿主中枢神经系统的单核细胞、内皮细胞、神经星状细胞和小胶质细胞等产生细胞因子:肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素(IL)、干扰素(TFN)、前列腺素(PG3)和血小板激活因子(PAF)等。其中TNF和IL-1是介导脑膜炎症反应最主要的两种细胞因子。它们可以活化脓性脑膜炎血管内皮细胞上的白细胞黏附受体,促使白细胞黏附于血管壁,释放蛋白溶解酶,破坏内皮细胞的联结,导致血脑屏障渗透性增加,使白细胞和血浆蛋白大量进入脑脊液中。细胞因子及白细胞相互作用引起蛛网膜下腔炎症反应,形成脑水肿、颅内压增高、脑缺血、脑梗死,最终造成脑损伤。
1.血象
白细胞总数及中性粒细胞明显增加。贫血常见于流感杆菌脑膜炎。部分病例,特别是重症或新生儿化脓性脑膜炎,可见白细胞总数减少或三系抑制。血C反应蛋白常增高,血前降钙素增高。
2.血培养
早期、未用抗生素治疗者可得阳性结果。能帮助确定病原菌。
3.咽培养
分离出致病菌有参考价值。皮肤脓疱疮等局部分泌物培养对病原菌诊断有参考价值。
4.瘀点涂片
流脑患儿皮肤瘀点涂片查见细菌阳性率可达50%以上。
5.脑脊液常规、涂片、培养
脑脊液可见典型化脓性改变。其外观混浊或稀米汤样,压力增高(当脓液黏稠、流出困难时,无法测量压力)。镜检白细胞甚多,可达每升数百至数万,其中以多核白细胞为主。典型改变为外观混浊,压力增高,白细胞总数明显增高,可(500~1 000)×106/L以上,以中性粒细胞为主,糖含量显著降低,蛋白明显增高,氯化物正常。脑脊液沉渣涂片找菌和脑脊液细菌培养是明确致病原的重要方法。特异性细菌荚膜多糖抗原测定有助于病原发现。糖定量常<2mmol/L。糖定量不但可协助鉴别细菌或病毒感染,还能反映治疗效果。蛋白定性试验多为强阳性,定量可在1g/L以上。将脑脊液离心沉淀,作涂片染色,常能查见病原菌,可作为早期选用抗生素治疗的依据。脑脊液涂片应多做几张备用;不宜用火焰固定,以免细菌凝固破坏。涂片检查用革兰氏染色,必要时加用亚甲蓝染色协助观察细菌形态。脑脊液涂片检查能较快获得结果,找到细菌的阳性率也高于细菌培养。但细菌培养可避免染色误差,且能作药敏试验。有时脑脊液虽较清亮,仍能培养出细菌。为提高培养阳性率应注意下列几点:在使用抗生素前采集脑脊液标本;标本必须收集在无菌玻璃管或小瓶内,并在保温条件下迅速送检,床边培养可提高阳性率;最好同时接种2个巧克力琼脂斜面培养基,分别在有氧及无氧条件下进行培养;经过治疗者,培养基内应加对氨苯甲酸与青霉素酶,以提高阳性率。若患儿需要转院,除详细介绍检查结果外,最好附一张细菌涂片或治疗前的脑脊液,以便收治医院复查。
6.特异性细菌抗原测定
利用免疫学技术检查患儿脑脊液、血、尿中细菌抗原为快速确定病原菌的特异方法。特别是脑脊液抗原检测最重要,其敏感性及特异性均较高。当脑脊液中细菌不多或被破坏时,脑脊液培养可呈阴性,但致病菌存在可溶性的荚膜多糖抗原。因此,用已知抗体(诊断血清)测定脑脊液中的细菌抗原,可提供快速诊断。检测特异性抗原的方法很多,包括对流免疫电泳、放射免疫、荧光抗体及酶联免疫吸附4项。目前应用较多的是流感杆菌、肺炎球菌和脑膜炎球菌多糖抗原的检测。
7.分子生物学方法
分子检测方法包括靶向试验、多重试验及宏基因组二代测序(next-generation sequencing,NGS)。用以二代测序为基础的宏基因组测序技术对临床样品中的全部微生物DNA进行测序分析,具有无偏倚的优点,可检测出一些采用传统病原学方法无法发现的微生物,或用来探究某种已知微生物的未知致病能力或做毒力判断。以NGS为基础的宏基因组测序在不明原因中枢神经系统感染患者的病原体检测中优势明显,不仅可发现感染中枢神经系统的传统病原体,同时有助于新型病原体的检出。对于疑似中枢神经系统感染患者,这项新技术可对多种临床样本进行检测,目前,NGS不但可以对患者脑脊液标本进行检测,还可以对患者脊髓、脑膜活组织标本、脑活组织标本进行检测,有高通量、高灵敏度等特点,在微生物检测方面具有显著的优势。宏基因组测序依靠其技术的无偏倚性,可以识别临床样品中的所有病原,但仪器和生物信息分析人员都无法完全依靠各种计算手段或流程判定检测出的病原是否与疾病相关。对正常状态下无菌部位的样本(如血液、脑脊液样本)的结果解读要比包括多种微生物的样本(比如呼吸道样本、粪便等)容易得多,但有时情况也是复杂的,如在标本取材与实验室检测过程中标本可能被污染和/或混入微生物基因序列是难以避免的,污染标本的测序结果可能作为背景“噪声”,加大了对致病菌判断的难度,这对判断条件致病菌更加困难。因此,二代测序结果需要结合临床实际综合判读。
8.脑脊液中某些成分的检查
(1)肿瘤坏死因子(tumor necrosis factor,TNF)
TNF为一种多功能生物因子。在实验性化脓性脑膜炎动物和化脓性脑膜炎患儿的脑脊液中发现TNF阳性,且出现较早,而病毒性脑膜炎患儿脑脊液中未测到该因子。说明脑脊液中TNF测定对化脓性脑膜炎早期诊断有帮助。脑脊液和血清TNF的检测尚有助预后判断,血清TNF增高,提示预后不良。
(2)磷酸己异构酶(phosphate isomerase,PHI)
为糖分解代谢酶之一。在化脓性脑膜炎患儿脑脊液中活性明显升高,正常人最高值为6U/L。化脓性脑膜炎时脑脊液白细胞吞噬能力加强,糖酵解加速,PHI活性增加。
(3)干扰素(IFN)
在病毒感染时,血清和脑脊液中IFN有较特异性的增高。有助于某些病毒性脑膜炎与化脓性脑膜炎鉴别。
(4)脑脊液免疫球蛋白
正常脑脊液中免疫球蛋白量很低,IgM缺乏。化脓性脑膜炎患儿IgM明显增高,若大于30mg/L,基本可排除病毒感染。但某些肺炎链球菌脑膜炎IgM增高不明显,相反有些腮腺炎脑炎IgM反可增高。
(5)脑脊液乳酸脱氢酶(lactic dehydrogenase,LDH)及其同工酶
正常脑脊液 LDH平均值:新生儿53.1U;乳儿32.6U;幼儿29.2U;学龄儿童28.8U。LDH同工酶正常值:新生儿LDH1 27%,LDH2 35%,LDH3 34%,LDH4 3%,LDH5 1%。出生1个月后LDH1 37%,LDH2 32%,LDH3 28%,LDH4 2%,LDH5 1%。化脓性脑膜炎患儿LDH值明显升高,同工酶中LDH4及LDH5亦明显上升。在病毒脑炎LDH值正常或有轻微改变,LDH1、LDH2略有升高,LDH4、LDH5正常。 LDH 值的改变可能与粒细胞有关,能反映脑膜炎的轻重。
(6)乳酸(lactic acid)
正常脑脊液乳酸平均值为159mg/L,细菌性脑膜炎都超过200mg/L,而无菌性脑膜炎都高于250mg/L。将脑脊液中乳酸值>350mg/L定为细菌性脑膜炎诊断标准,无假阳性与假阴性。乳酸不高常可排除化脓性脑膜炎。脑外伤、脑出血和其他脑缺氧致颅内压升高时,脑脊液中乳酸也可增高。
9.CT及磁共振(MRI)
有助于化脓性脑膜炎合并颅内有局限性脓肿、硬膜下积液或脑积水等并发症的诊断与监测。
大量研究表明,早期进行准确的病原学诊断,尽早给予合理治疗后,其死亡率和神经系统后遗症率显著降低。疑似细菌性脑膜炎患者应尽快取血和脑脊液作细菌培养,并开始经验性抗菌药物治疗,开始给药时间不得超过1小时。细菌性脑膜炎抗菌药物应用的原则为属于杀菌剂、可透过血脑屏障、足量、联合用药。近年来病原体的耐药问题日益严重,治疗方案的选择应基于致病原的药敏试验结果。而当药敏试验不能进行或结果待定时,应根据当地病原的耐药情况决定用药。2004年美国感染病学会及2016年欧洲临床微生物和感染病学会的细菌性脑膜炎指南中均指出对于年龄大于1个月的确诊或可疑化脓性脑膜炎患儿推荐使用万古霉素联合头孢曲松或头孢噻肟。我国一项关于肺炎链球菌耐药情况的分析中已出现了对万古霉素的耐药,耐药率为3.09%,头孢曲松为10.9%。国外研究表明利福平不仅具有抗杆菌作用,同时还具有人类糖皮质激素受体的配体和激活剂作用。有研究在肺炎链球菌脑膜炎治疗中尽管27.03%患儿使用四代头孢类抗生素,8.78%患儿使用万古霉素,31.76%患儿使用夫西地酸,21.62%患儿使用利福平,患儿预后不良者依旧高达20.27%,目前抗生素的选择面临严峻的挑战。相关文献报道,尽管抗生素和支持治疗手段发展,存活率极大提高,但永久性后遗症并未显著下降,有待基础与临床进一步就发病机制、新的抗微生物制剂等不断深入研究。可能最好的选择是相关疫苗的预防应用研究和评价。
1.抗菌治疗
治疗化脓性脑膜炎的关键是及时合理应用抗菌药物,而选择抗生素的关键是明确病原菌并根据药物敏感试验决定。
(1)病原菌尚未明确之前可根据不同年龄、季节结合临床分析何种致病菌可能性大,选择1~2种有效抗生素。在流脑流行季节、年长儿童一般应先考虑系脑膜炎球菌所致,若有瘀点、瘀斑则更可疑。可先用青霉素、氨苄西林、磺胺治疗。大于1月龄儿童的化脓性脑膜炎,在病原菌未确定时的经验性治疗,应选用三代头孢菌素(头孢曲松或头孢噻肟)联合万古霉素。具体治疗选药见表1。
表1 化脑治疗方案
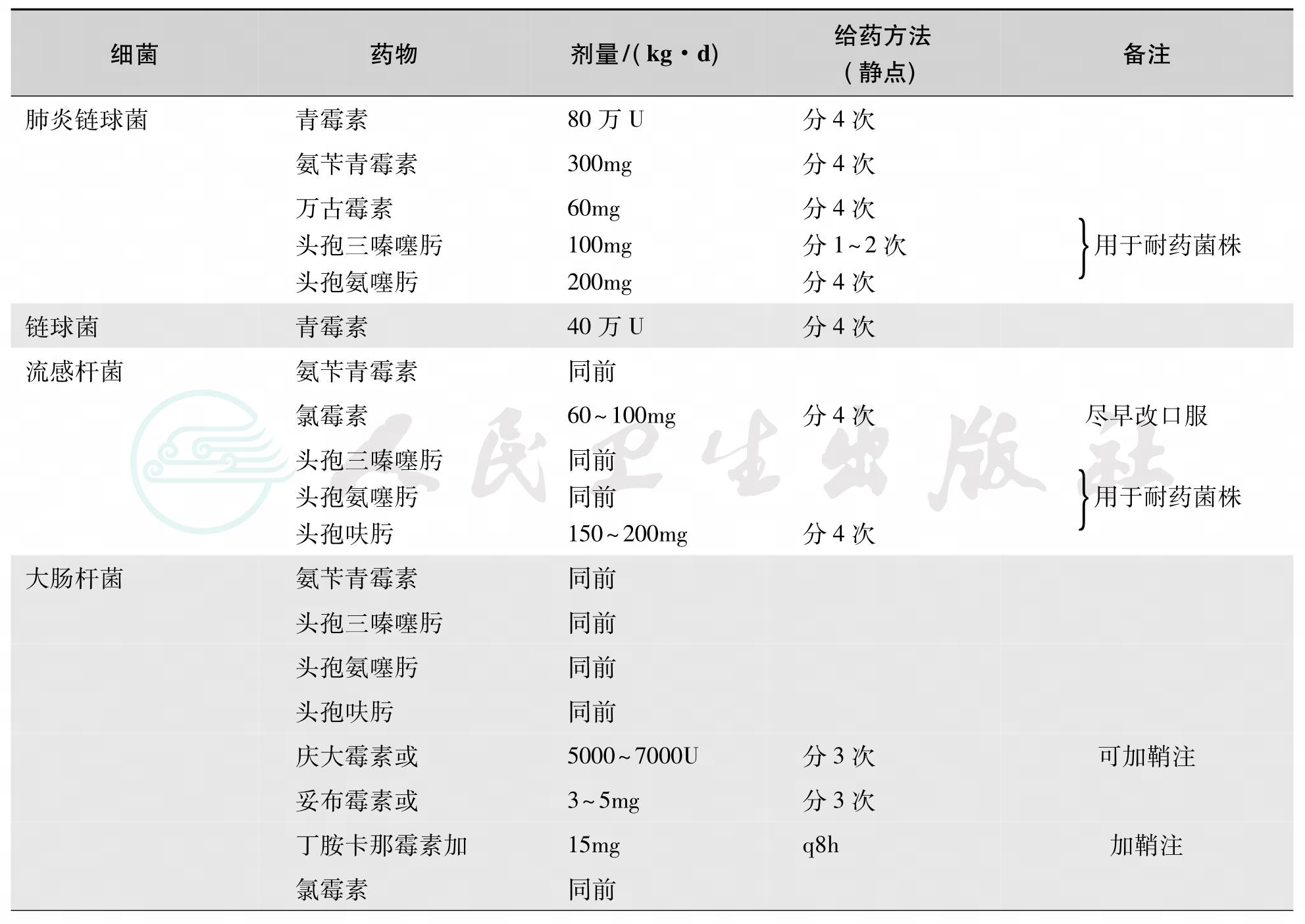
续表
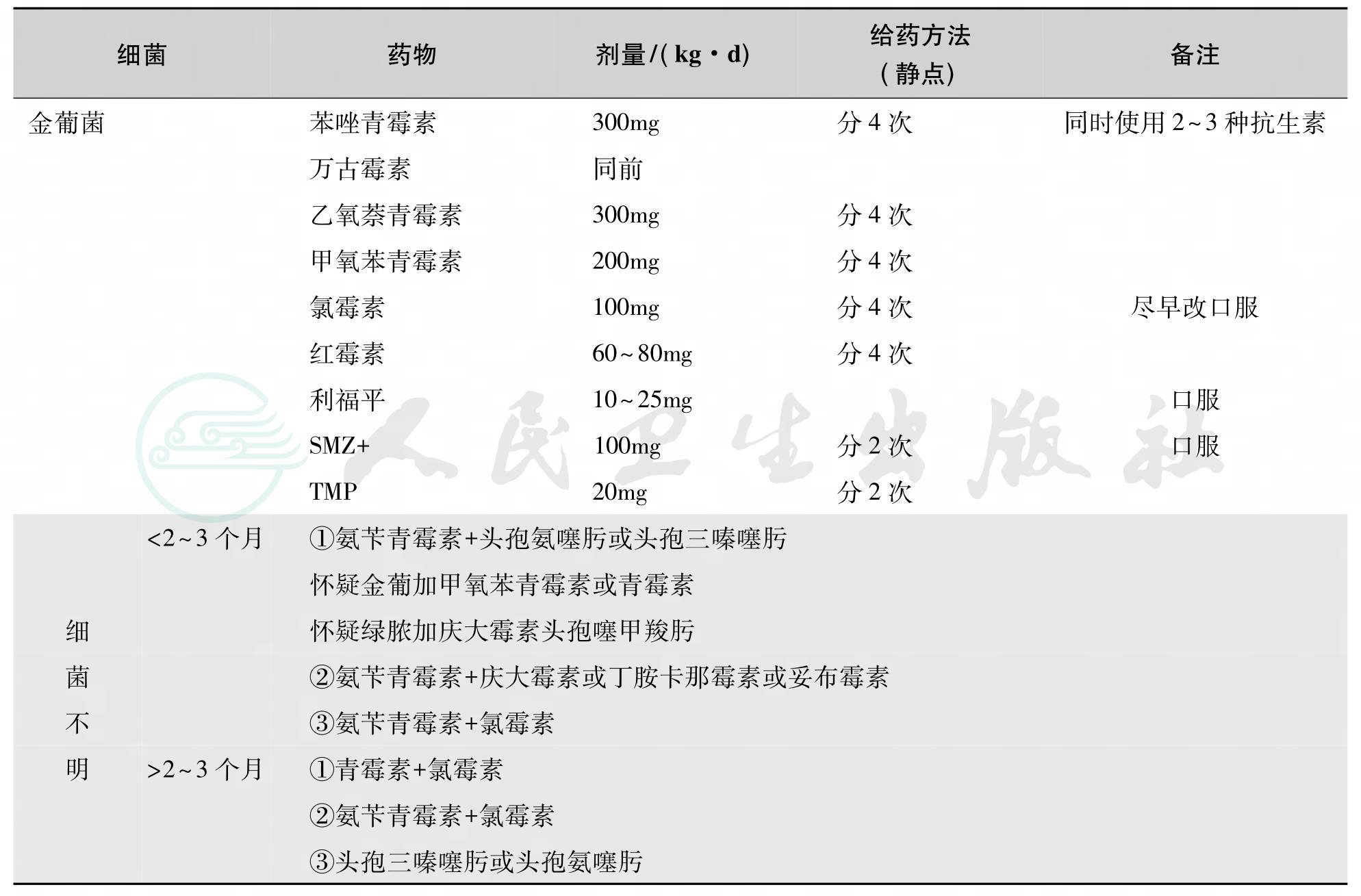
(2)脑脊液缺乏有效防御系统,不能对细菌进行有效的调理和吞噬,因而宜用杀菌性抗生素,不用抑菌药。且脑脊液抗生素浓度应达有效杀菌浓度。一般认为达到最小杀菌浓度(minimal bactericidal concentration,MBC)10倍以上,或最小抑菌浓度(MIC)10~20倍,才能迅速杀死脑脊液中的细菌。因此要选择易于透过血脑屏障的抗生素。凡脂溶性大、离子化程度小,血浆蛋白结合率低和分子量小的药物较易透过血脑屏障如氯霉素、磺胺嘧啶。青霉素G不易透过血脑屏障,但能较好地通过发炎的脑膜。第三代头孢菌素如头孢曲松钠、头孢噻甲羧肟、头孢噻肟均较易透过血脑屏障。抗生素使用的剂量要足够,至完成全部疗程均不减量。
(3)抗生素给药的方法也很重要,将抗生素每日总量分3~4次静脉给药,每次量可在1~2小时左右滴注完毕,使药物浓度在血循环中形成几次高峰值,以利于进入脑脊液,但大剂量青霉素(每日总量1 000万U)静脉高浓度滴入,可致抽搐,此为青霉素的神经毒性反应,又称青霉素脑病(penicillin encephalopathy)。 青霉素在脑脊液中浓度>8~10U/ml,即可出现毒性反应,有文献认为可能与青霉素盐中的阳离子浓度有关。此外与制剂纯度、个体差异也有关系。青霉素90%由肾脏排出,小婴儿特别是新生儿对青霉素的排泄为年长儿及成人的20%,因而半衰期延长,因此需注意调整输液速度。
(4)疗程及停药指征:近年短程疗法多有报道,主张流感杆菌脑膜炎7日疗法;肺炎球菌性脑膜炎疗程10日;早期及无合并症的化脓性脑膜炎疗程可适当缩短。鉴于化脓性脑膜炎是一种严重的中枢神经系统感染,其疗程应视病菌种类、病情轻重、有无合并症及治疗反应而不同。一般对金葡菌、耐药的肺炎链球菌及肠道革兰氏阴性杆菌所致脑膜炎疗程宜3周以上。流感杆菌脑膜炎、肺炎球菌性脑膜炎疗程一般10~14日,流脑为7日。停药指征:完成疗程时症状消失、退热一周以上,脑脊液细胞数少于20×106/L,且均为单核细胞,蛋白及糖量恢复正常。病原学检查阴性。一般完全达到这些标准,少需8~10天,多则1个月以上,平均2~3周左右。
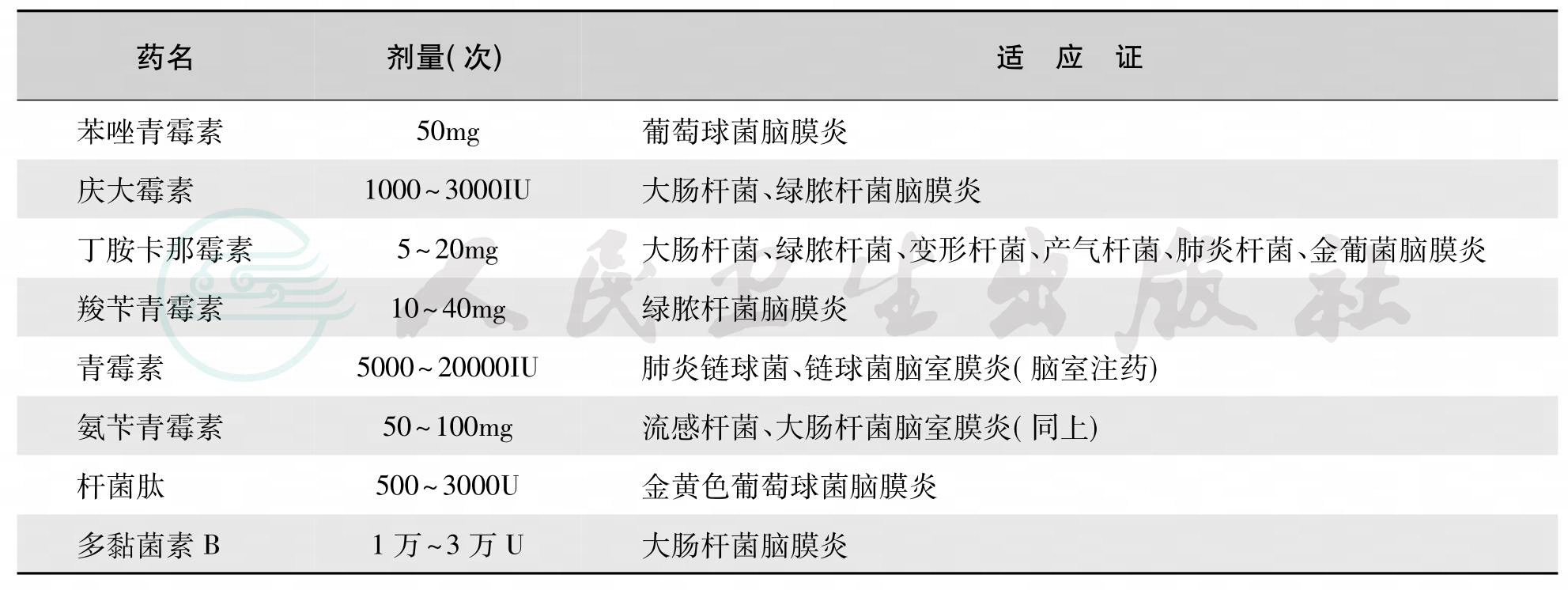
(5) 鞘内注射(intrathecal injection):如果选用的药物能很好地通过血脑屏障,原则上不需鞘内注射,以免出现不良反应及增加患儿痛苦。庆大霉素、阿米卡星等药不易到达脑脊液,可采用鞘内或脑室注射给药。对延误诊治的婴儿晚期化脓性脑膜炎,脑脊液外观有脓块形成,或细菌对抗生素耐药,加用鞘内注射抗生素可提高治愈率。给药剂量参考表2。根据抗生素在脑脊液中存留时间,每日或隔日注射一次,一般连用3~5次,直至脑脊液转为清晰,细胞数明显下降,细菌消失。对葡萄球菌或少见细菌所致化脓性脑膜炎,若治疗3日后脑脊液仍有细菌存在,或鞘注3~5次后脑脊液仍呈明显炎症改变时,可延长鞘内注射时间,甚至连续用7~10次。进行鞘内注射时,药物必须稀释至一定浓度,可用抽出之脑脊液或生理盐水稀释,需注意注入液量应略少于放出之脑脊液量。注射速度应缓慢,注射后若有惊厥发作,需仔细分析病情,如确系鞘注反应则应停止鞘注。
表2 鞘内注射药物剂量参考表
(6)脑室内注药(intraventricular injection):由于存在血脑屏障及脑脊液系单向循环,对并发脑室膜炎患儿采用静脉及鞘内注射,药物很难进入脑室,脑脊液中抗生素浓度亦不易达到最小抑菌浓度的50倍,故近年有人主张脑室注药以提高疗效。对颅内压明显增高及脑积水患儿,采用侧脑室穿刺注药,同时还可行控制性脑脊液引流减压。国外研究显示万古霉素或脑室内给药治疗颅内感染具有较好的疗效,且无明显毒性。所用药物与全身所用抗生素一致,剂量同鞘内注射。对大肠杆菌或金黄色葡萄球菌脑膜炎,甚至有主张用脑室内注药取代鞘内注药,不论其是否合并脑室膜炎。
2.抗炎药物
当细菌被杀死或溶解后,释放出内毒素、肽聚糖等炎症因子,导致脑膜炎症一过性加重,易形成脑脊液循环通路的部分或完全梗阻及听力损伤等后遗症,而肾上腺皮质激素(adrenocortical hormone)可以抑制TNF-α和IL-1L的合成及降低其活性,从而减轻脑水肿,降低颅内压,增加脑血流和改善脑代谢,在抗生素治疗开始前或同时给予地塞米松对b型流感嗜血杆菌性脑膜炎有肯定疗效,对小儿肺炎链球菌脑膜炎可能有效。糖皮质激素可降低患儿的听力损伤和神经系统后遗症,但不能降低整体病死率。一项美国、欧洲指南推荐年龄>6周的BM患儿使用地塞米松,在应用抗生素前15~30分钟或同时给予疗效更好,每日剂量0.6mg/kg,分4 次静脉注射,连用4日。
3.对症处理
某些症状或并发症能直接危及患儿生命,应及时处理。
(1)控制惊厥
频繁惊厥必须控制,以免发生脑缺氧及呼吸衰竭。上海交通大学医学院附属新华医院总结96例化脓性脑膜炎患儿,有惊厥症状者占37.6%。惊厥发生的原因很多,如水、电解质紊乱(低钙、低钠),过度换气,发热,硬脑膜下积液,颅内压增高,脑血管病变,大脑周围炎症刺激作用,青霉素的毒性作用等。其中最常见的原因是颅内压增高和低钙。除用脱水药降低颅内压,常规补钙外,对症治疗采用安定、水合氯醛、副醛、苯巴比妥等药物抗惊厥,亦很必要。考虑有脑实质受损而致癫痫发作者,应按癫痫治疗。同时可给予维生素 C、B1、B6,谷氨酸钠、γ-氨酪酸、ATP 脑活素等药物保护脑细胞,促进其功能恢复。
(2)减低颅内压
参阅有关“颅内高压症”治疗。
(3)抢救休克及 DIC
参阅有关“感染性休克”。
(4)矫正脑性低钠血症
确诊后用3%盐水6ml/kg缓慢滴注,可提高血钠5mmol/L,若仍不能纠正,可再给3~6ml/kg。同时应限制入量,每日 800~900ml/m2,给液成分与一般维持液相同。由于大量应用钠盐,必然增加钾和钙离子的丢失,需注意补充。
(5)治疗硬脑膜下积液
目前尚无统一方法。有人认为积液可自行消失,不必穿刺放液。但大量液体积聚可使颅内压增高,除引起症状外,还可压迫损伤脑组织,影响远期预后;且积液发生与感染有关,有时液体本身即为脓性,若不穿刺引流,很难自行吸收。穿刺放液简便易行,只要注意操作规程并无危险。积液的细菌学检查亦有助于病原学诊断。穿刺放液应根据以下情况处理:①CT或颅骨透照试验阳性者,可行穿刺以确定积液性质。首次穿刺液应检查常规生化、细菌涂片,并作细菌培养。②积液量不多,非脓性,蛋白含量不高,临床无颅内压增高表现,治疗经过顺利者,不再穿刺,定期透照复查,部分患儿在数月内自行吸收好转。③硬脑膜下积液有明显炎性改变时,可诊断为硬膜下积脓。积液量较多,同时有颅内压增高症状;蛋白含量高,色发黄,硬膜下积脓时均应穿刺放液。开始每日或隔日穿刺1次。放液量,每次各侧以少于30ml为宜,两侧总量一般不超过60ml。也有主张放至液体不再流出为止,但均应待其自然流出,不能抽吸。1~2周后酌情延长穿刺间隔时间,减少穿刺次数,直至症状消失,积液性质好转或液量明显减少。由于反复硬膜下穿刺容易造成局部损伤、出血,引起硬膜下积血等并发症,故目前多采用神经外科手术行硬膜下积液钻孔引流,术中可应用生理盐水反复冲洗,术后留置引流管,待引流充分、引流液减少,可拔出引流管(一般引流持续1周左右)。④有硬膜下积脓时,亦可进行局部冲洗,并注入适当抗生素(剂量参考鞘内注射药量)及地塞米松每次1mg。
4.其他
病室应空气流通,温度适宜。对急性期患儿需严密守护观察,定期测呼吸、脉搏、血压,观察尿量、呼吸状况、瞳孔变化,以便及早发现休克与脑疝。化脓性脑膜炎患儿急性期入量应控制在1 000~1 200ml/(m2·d),即正常生理需要量的75%。既要保证患儿入量,又要避免输液量过多加重脑水肿。合并脱水者,应按损失量补充,否则影响脑灌注。监测血、尿、渗透压可早期发现ADH分泌异常。此外,加强支持疗法,输血、血浆,治疗贫血、中耳炎等亦很重要。定期查血、尿,防止药物毒性反应,有助指导治疗。恢复期注意神经肌肉功能锻炼及检查听力,尽力减少后遗症都是治疗中不可缺少的环节。目前,已有噬菌体和抗菌肽等非传统抗菌药物治疗多重耐药菌脑膜炎成功的报道,但还需开展广泛的临床研究明确不同细菌性脑膜炎治疗中的作用,并解决大规模生产中的技术问题。
化脓性脑膜炎尤其是肺炎链球菌脑膜炎,大多是由上呼吸道感染发展而来,因此对婴儿呼吸道感染必须重视,平时即应建立良好的生活制度,注意保暖,多见阳光,多呼吸新鲜空气,进行必要的户外活动,以增强身体抵抗力,并少与患呼吸道感染的患者接触,以尽量防止发生呼吸道感染。这点对于减少肺炎链球菌脑膜炎的复发极为重要。新生儿脑膜炎的预防则与围产期保健有关,应彻底治疗产妇感染。新生儿如果暴露在严重污染环境中,则应使用抗生素预防。流脑已有特异疫苗,流感杆菌疫苗已开始在国内应用。肺炎链球菌型别太多,疫苗制备与应用见各论,流脑与流感杆菌脑膜炎的密切接触者可预防用药。













