腹泻是世界各地婴幼儿最常见的疾病之一。在发展中国家,腹泻病显得尤其重要,因为它常常是婴幼儿死亡的主要原因。在发现轮状病毒之前,人们已经认识到急性腹泻有一个“非细菌性的”病原,但是用细胞培养去分离这种假设“病毒”的努力一直未获成功,直至1973年Bishop等首先报告,从患急性腹泻而住院治疗的儿童十二指肠黏膜上皮细胞中发现了病毒颗粒,因这些病毒颗粒形似车轮,而将其命名为轮状病毒(rotavirus,rota来源于拉丁文,意为车轮)。从此之后,人们发现轮状病毒是全世界婴幼儿重症腹泻最重要的病原,估计每年有百万名儿童死于轮状病毒腹泻[1]。在我国,每年秋冬季节均有一个婴幼儿腹泻的发病高峰(因此曾称其为“秋季腹泻”),病原学研究证实,这些病例40%~60%是由轮状病毒引起的[2]。
1.轮状病毒的一般特征
轮状病毒是呼肠孤病毒科(family Reoviridae)轮状病毒属(genus Rotavirus)的成员,不同种属来源的轮状病毒有共同的形态学与生物化学特征[1],最显著的特征为:原先用负染电镜技术发现成熟病毒颗粒的直径约为70~75nm,后来用不经染色的冷冻电镜技术发现成熟病毒颗粒的直径约为100nm(算上棘突)。由三层二十面体蛋白衣壳组成,最里层的核壳包着病毒的基因。光滑的外壳表面有60个穗状突起。病毒毒粒含有依赖RNA的RNA多聚酶及一些能够产生帽状RNA转录子的酶;病毒基因组含11个分节段的双链RNA片段(dsRNA)。病毒在被感染的细胞质内复制,蛋白酶处理可以促进试管内的病毒培养,这是因为蛋白酶将病毒外壳的穗状突起多肽裂解而增强了病毒的感染性。病毒有一个形态发生学旁路,即病毒向内质网出芽时形成一过性的有包膜的颗粒,而成熟的病毒颗粒无包膜,通过细胞裂解而从感染的细胞中释放。
根据血清学反应的不同将轮状病毒分为不同的组(serogroups,根据病毒的VP6蛋白),每个组内又可分为不同的血清型(serotypes,由VP4和VP7的抗原表位决定的)。至今为止已分为7个轮状病毒组(A组~G组),其中A、B、C三组轮状病毒既感染人类也感染动物,而D、E、F、G组迄今为止只在动物中发现。在同一组中的轮状病毒,可发生基因重配。
A组轮状病毒在世界各地引起婴幼儿和新生动物的重症腹泻这一点已得到肯定,B组轮状病毒曾在中国引起成人腹泻的大流行,在一些国家(主要为东南亚)B组轮状病毒也引起成人腹泻的散发,而C组轮状病毒则引起散发的腹泻,但在日本,有关C组轮状病毒引起小学内腹泻暴发流行的报告。同一组内,根据病毒在中和试验中反应性的不同,又将病毒分为不同的血清型,决定这种反应性的是病毒的两个外壳蛋白VP7和VP4,它们是两个相互独立的具有抗原活性的结构蛋白,分别决定了病毒的血清型别(在下文中详述)。本文所叙述的是与婴幼儿腹泻有关的A组轮状病毒。
2.生物学性状
(1)病毒毒粒:
轮状病毒毒粒有着独特的形态,在电子显微镜下,可见到三种类型的病毒颗粒(图1)。①完整的病毒毒粒直径约为75nm,具有辐条状结构及一个非常清晰的平滑周边,酷似车轮。由于采用了低温电镜技术(electron cryomicroscopy),发现完整病毒颗粒具有三层(three layers),完整病毒的结构蛋白VP1、VP2、VP3、VP4、VP6、VP7 完全,具感染性;②没有外壳的双层颗粒外缘粗糙,内壳的三体亚单位在表面突起,不含VP4和VP7,不具感染性;③单层核颗粒较少见,常缺乏基因组RNA,并且聚集在一起,这类颗粒不具感染性。
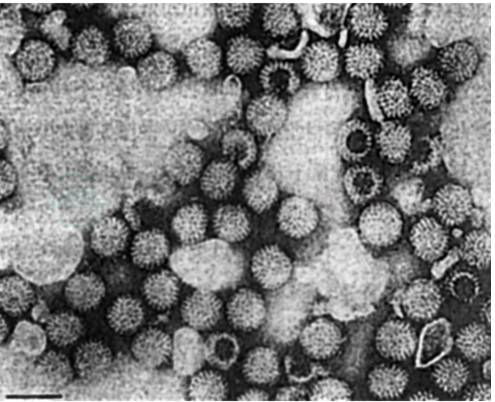
图1 人类轮状病毒电镜图
胃肠炎患儿粪便悬液磷酸盐孵育后制成的负染电镜标本。图中直线为100nm[1]。
(2)理化特性:
不同的轮状病毒颗粒具有不同的生物物理和生物学特征,病毒的感染性依赖于病毒衣壳外层的存在,用钙螯合剂(如EDTA或EGTA)处理将外壳去除,病毒的感染性随之消失。用离液剂如硫氰酸钠或高浓度的氯化钙可以将双层颗粒变为单层核心颗粒。
三层或双层的颗粒可以通过氯化铯或蔗糖梯度离心而分开。三层的颗粒在氯化铯中的密度为1.36g/cm3,在蔗糖中的沉降系数为520~530S,而双层的颗粒分别为1.38/cm3和380~400S。单层的核心颗粒在氯化铯中的密度为1.44g/cm3,沉降系数为280S,这三种颗粒也可用葡聚糖凝胶分开。用氟利昂提取或暴露于乙醚、氯仿或脱氧胆酸盐不能破坏轮状病毒的感染性及病毒颗粒的完整性,这说明成熟的病毒颗粒没有包膜。氯仿处理略微减少病毒的感染性,但是破坏病毒的血凝素活性。0.1%十二烷基硫酸钠(SDS)破坏病毒的感染性,但是暴露于非离子型去污剂可以增强感染性。轮状病毒的感染性相对稳定。在pH值3~9的范围内感染性稳定;对温度也较稳定,当用1.5mm CaCl2作为稳定剂时,含病毒的人粪便标本可以在4℃甚至20℃维持其感染性数月;但反复冻融会破坏感染性和血凝素活性。
病毒的感染性可以被消毒剂灭活,如酚、甲醛、氯和β丙内酯。95%的乙醇可能是最有效的消毒剂,因为它可以去除病毒的外壳。
(3)病毒培养:
目前已有一些细胞系被成功地运用于轮状病毒的培养,如原代非洲绿猴肾细胞、传代非洲绿猴肾细胞(MA104),而对于粪便标本中轮状病毒的初次分离,一般先在原代细胞上传几代适应后再传至MA104细胞大量增殖。用胰酶预处理标本(10μg/ml)并在培养基中加入胰酶(0.5~1.0μg/ml)有利于病毒的生长。
可运用细胞培养系统检测病人血清中的特异性抗体(中和抗体),或用已知型别的免疫血清进行中和试验,方法为空斑减少中和试验来鉴定分离到的病毒。
(4)病毒的基因组结构及基因编码分配:
病毒的基因组含11个节段的dsRNA,在病毒的核心衣壳内(图2)。去蛋白化的轮状病毒dsRNA无感染性。目前已经知道一些病毒株11个基因片段的完整的核苷酸序列和每一个基因片段的共同的一般特征。
迄今为止,轮状病毒是已知仅有的哺乳类动物和鸟类含11个dsRNA片段的致病因子。其基因大小为0.6~3.3kb。根据分子量的大小(从大至小)将基因片段在聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)中泳动顺序排为基因1~11而形成其独特的电泳图形:4个高分子量的dsRNA节段(基因1~4);5个中等大小的节段(基因5~9),其中7~9往往在一起形成一个特征性的三体(因此又有人将其分为4∶2∶3∶2);2个小片段(基因10~11)。如果在电泳中见到的11个节段的dsRNA不是以这样典型的方式排列,那么很可能是鸟类的A组轮状病毒、非A组轮状病毒或发生了个别基因重新排列(rearrangement)的A组轮状病毒。这种对具有特征性的电泳图形的分析是一种相对简便、快速和常见的轮状病毒的检测方法,常被应用于监测病毒暴发流行和传播途径的分子流行病学研究。但是由于电泳图形会受不同因素的影响(基因漂移、变异或基因重排),因此电泳图形不能作为判断病毒毒株分类的唯一标准。不同毒株间相对应的基因片段常常在电泳中显示出不同的迁移率。有一些A组轮状病毒株的第11基因泳动得较慢,在PAGE上显示其位置在第9和第10基因之间,这样的图形称为短型,这些毒株往往属血清型2型,第Ⅰ亚组(代表株为DS-1)。而长型毒株往往属Ⅱ亚组,血清型可是1、3、4或9。但电泳图形不是唯一区分轮状病毒型别的标准,研究证明,一些电泳图形一致的毒株可以分属不同的血清型别,而同一型别的毒株又可显示不同的电泳图形。
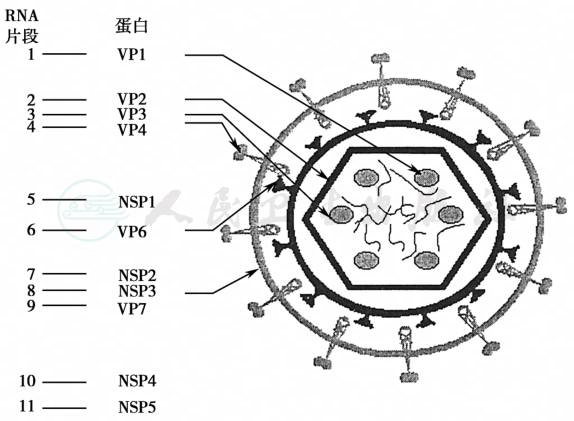
图2 轮状病毒结构示意图
(左)轮状病毒核酸(以A∶Si∶SA11株为例)经聚丙烯酰胺凝胶电泳,显示共有11个基因片段编码相应的蛋白;(右)完整的轮状病毒颗粒结构示意图,表明了不同蛋白的位置。
轮状病毒基因组的11个基因片段分别编码六个结构蛋白和五或六个非结构蛋白。结构蛋白是指组成病毒毒粒的蛋白:基因1、2和3分别编码组成核心的病毒蛋白(virus protein,VP)VP1、VP2和 VP3,基因 6编码主要内壳蛋白VP6,基因4和9分别编码外壳结构蛋白VP4和VP7。五/六个非结构蛋白是指存在于感染病毒的细胞中、但不存在于成熟病毒毒粒中的蛋白。它们是由基因节段5、7、8、10和11所编码,曾根据它们的分子量而命名,如 NS53、NS35、NS34、NS28 和 NS26,目前将这些非结构蛋白命名为 NSP1(相当于 NS53)、NSP2(NS35)、NSP3(NS34)、NSP4(NS28)和 NSP5(NS26)。VP4可以被蛋白水解酶-胰酶特异性地裂解,形成裂解产物VP5∗和VP8∗,蛋白水解VP4可以增强病毒穿入细胞的能力从而增强病毒的感染性。
(5)轮状病毒蛋白及病毒抗原成分
1)血清型与亚组的名称:
轮状病毒的抗原成分较复杂,因此当提到轮状病毒的抗原性时,必须考虑到三个重要的抗原特异性:组(group)、亚组(subgroups)和血清型(serotypes)。组抗原是指在同一个组内不同毒株共同具有的抗原,至今已发现A~G组。在诊断性实验中所测到的决定性的组抗原是VP6,因为VP6占了病毒毒粒的51%;VP6也决定了亚组特异性,亚组特异性是一个重要的流行病学标志,因为大部分轮状病毒株不是属于亚组Ⅰ(常为短型),就是属亚组Ⅱ(常为长型)。组和亚组抗原与中和性无关。属同组或同亚组的毒株用动物的高价免疫血清进行中和试验,又可发现存在不同的血清型。中和试验所检测的抗体是分别针对VP4和VP7这两个外壳蛋白的。因此,从这种意义上说,当对轮状病毒的抗原成分进行命名时,必须考虑到四种抗原特异性:组、亚组(由VP6决定)、VP7血清型(也即G血清型,因为 VP7是一个糖蛋白,glycoprotein)和VP4血清型(也称为P血清型,因为VP4是对蛋白酶敏感,protease sensitive的蛋白)。上述对组和亚组的区分仅适用于A组轮状病毒并且仅为一般原则,因为随着对轮状病毒研究的不断深入,又发现了一些例外的毒株,如一些新发现的毒株既不属于Ⅰ也不属于Ⅱ亚组,或一些毒株兼有Ⅰ和Ⅱ亚组的特性。
2)VP6:
VP6位于病毒的内壳,是第6基因片段(对A组轮状病毒而言)的产物,分子量为44kD,占病毒颗粒的51%。VP6是大多数检测方法所测到的抗原,已经确定了VP6上数个抗原表位,但这些抗原表位不参与病毒的中和作用。VP6含有一个共同的(交叉反应性的)表位,称作组抗原,VP6还含有亚组特异性抗原表位。这种亚组特异性可用作流行病学研究的工具,因为可据此亚组特异性来区别毒株。
3)VP7:
VP7由病毒基因组的第7、第8或第 9基因编码(依不同的毒株而异),其分子量为34kD,是一个外壳糖蛋白,组成病毒颗粒光滑的外表,占毒粒蛋白的30%,仅次于VP6。VP7是高价免疫血清能检测到的主要的中和抗原,依此而决定病毒的血清型。至今根据VP7中和抗原与高价免疫血清反应的差异已至少发现27个 VP7 血清型(G1~G27)。 其中 G1~G4,G8、9、10、12既感染人类也感染动物,其他型别只感染动物。世界各地(包括我国)最常见的感染婴幼儿的轮状病毒为G1~G4型,近年来,在一些地区G9型逐渐上升为优势型别。这些血清型的VP7基因序列均已被测定,比较分析根据这些核苷酸序列而推断的氨基酸序列表明属同一血清型的不同毒株氨基酸的同源性很高(91%~100%),而不同型的毒株之间同源性则低得多(往往低于85%),因此用中和试验和核苷酸序列测定方法来确定轮状病毒血清型的相关性很好。根据对VP7的氨基酸序列的比较发现,在VP7上有9个可变区,这些区域中,同一型别毒株之间高度保守,而不同毒株间则高度变异,根据这一特点建立了一些检测轮状病毒株G血清型的方法,如直接测定这些高可变区的序列,利用高可变区的序列设计引物进行RT-PCR,根据PCR产物的不同而判定毒株的G型别,或用核酸杂交来确定。检测轮状病毒分离株的G血清型,是轮状病毒分子流行病学研究的一个重要组成部分。
4)VP4:
VP4由病毒基因组的第4基因编码,是个非糖基化蛋白,分子量88kD,占病毒蛋白的1.5%。虽然VP4是病毒外壳一个小小的组成部分,但是经遗传学和免疫学分析发现它有着许多重要的作用:如VP4是许多病毒株的血凝素,使病毒能凝集人的O型血球;是使病毒吸附至细胞的蛋白,蛋白水解酶可将VP4裂解成VP5∗(分子量60kD)和VP8∗(分子量28kD),并使病毒的感染性增强,这种裂解作用增强了病毒穿入细胞的能力;VP4限制了一些轮状病毒在组织细胞中的生长,它还是决定病毒毒力的一个蛋白;VP4能诱导中和抗体的产生,这种中和抗体在试管内中和病毒,在动物体内可产生被动保护作用,这种被动保护还可以在不同型之间起交叉保护作用,研究还证明无论对动物还是对儿童,VP4都有很好的免疫原性。
由于VP4能诱导产生中和抗体,而且这种中和抗体与VP7诱导的中和抗体无关,又建立了VP4的血清分型系统(P血清型)。不同G血清型的毒株可属于同一P血清型,而一些相同G血清型的毒株可属于不同的P血清型。虽然尚未对所有毒株的VP4进行抗原性测定,但是运用RNA-RNA杂交和序列测定的方法对一些人轮状病毒株进行分析已发现至少有9个不同的VP4基因组(alleles)。由于缺乏对大量毒株的VP4进行中和抗原测定的试剂,又建立了运用核酸杂交和序列测定来分型的方法(基因型),这些方法与中和试验方法高度相关。目前已约定将中和试验分型法定为P血清型而将杂交和测序分型方法定为基因型(genotype),而基因型可作为P血清型的替代方法。
一项汇集了发达国家和发展中国家的流行病学资料表明轮状病毒是全世界两岁以下婴幼儿严重腹泻的第一位的病原[1]。在发达国家中虽然轮状病毒腹泻发病常见,但是病死率很低。如美国,1~4岁年龄组每年轮状病毒严重腹泻的人数超过百万,但死亡人数不超过150例。但是在发展中国家,轮状病毒通常是婴幼儿致命性腹泻的首要病因。每年5岁以下婴幼儿轮状病毒腹泻的病例有1.25亿,1 800万以上是严重腹泻。另据统计,每年有87万1~4岁婴幼儿死于轮状病毒腹泻。
轮状病毒主要引起2岁以下婴幼儿腹泻,也有轮状病毒引起成人感染的报告,受感染者可以是婴幼儿患者的父母或密切接触者。但因成人有抗体,可能是亚临床感染,或症状较轻。但有报告在老年病房或养老院发生的老年人感染是严重的,甚至是致死性的。
一般认为,轮状病毒经粪-口途径传播,口服含轮状病毒的粪便提取物可使志愿者腹泻。但是始终有人猜测轮状病毒是否也能经呼吸道传播,经观察:①不管卫生状况如何,所有人均在生后不久很快获得轮状病毒的抗体;②有一些大规模的暴发流行找不到粪-口途径传播的证据,③相当一部分患者出现腹泻症状前有呼吸道症状。有一些零星的关于在呼吸道检测出轮状病毒的报告,但大部分研究者仍认为经呼吸道感染不是常见的传播途径。
婴幼儿通过与患儿接触,或是通过与亚临床感染的亲属接触而感染。在腹泻发生前及腹泻症状消失后都可检测到粪便排出轮状病毒。轮状病毒在环境中不易自行失活,因此较易传播。人和动物的轮状病毒在环境中均较稳定,如牛轮状病毒株(存在于粪便中)在室温中保持7个月仍维持其感染性。轮状病毒可以造成医院内感染。
轮状病毒性腹泻有明显的季节性,一般发生在较寒冷的季节,每年的10月至次年的2月是轮状病毒腹泻的高发季节,7~10月份很少能检测到轮状病毒。
一般认为人轮状病毒感染限于小肠,但近年曾有引起全身播散的个例报告。患儿小肠绒毛变短、萎缩,黏膜固有层单核细胞浸润,内质网池的膨胀,线粒体肿胀,微绒毛稀少,不规则,可见到裸露的微绒毛。在扩大的内质网池和柱状上皮细胞的溶酶体内可见到病毒颗粒,在杯状细胞和黏膜固有层的吞噬细胞中也可见到病毒颗粒。有时在扩张的内质网池中可见到管状组织。还可见到D-木糖吸收受损,胃蠕动功能不正常,表现为液体食物排空变慢。腹泻的发病机制尚不十分清楚,一般认为与小肠消化吸收功能障碍,分泌增加有关,另外,小肠黏膜双糖酶降低可引起渗透性腹泻;近年的研究表明和病毒的非结构蛋白NSP4所编码的肠毒素样作用有关,还有研究者认为和肠道神经系统(the enteric nervous system)的激活有关。
本病无特异治疗方法。因是自限性疾病,主要采用纠正水与电解质紊乱及对症治疗。轻者可采用口服补液盐(ORS)纠正或预防脱水,重症则需静脉输液。
在世界各地的流行病学研究和对于病人的研究均已证明轮状病毒的感染极需有效的预防措施,而疫苗预防重症轮状病毒感染已经取得共识。我国兰州生物制品研究所已研制成功口服单价轮状病毒活疫苗,研究结果表明安全性良好,有效保护率在70%以上。国外已有单价或多价的轮状病毒疫苗上市。轮状病毒疫苗研制的目标是预防2岁以下婴儿患严重的轮状病毒胃肠炎,因为这一年龄段的小儿所患的轮状病毒感染是最严重的,甚至可危及生命。将疫苗的目标定为预防重症感染而不是再感染是比较现实的,因为轮状病毒型别繁多,即使是自然感染后,也不能对今后的再次感染产生完全的保护作用。
[1]ESTES MK,GREENBERG HB.Rotaviruses.In:Fields Virology.Vol.2,6th ed.Philadelphia: Lippincott Williams& Wilkins Publishers,2013,1347-1401.
[2]袁丽娟,钱渊,刘军,等.北京等我国四个地区婴幼儿腹泻轮状病毒 VP4及 VP7型别的研究.病毒学报,1994,10(2):137-144.
[3]PANG XL,SMIEJA M.Gastroenteritis Viruses//PR Murray.Manual of Clinical Microbiology.Vol.2,12th ed.Washington,DC:ASM press,2019:1656-1673.













