1956年Morris等从实验室流行的类似感冒的黑猩猩鼻洗液标本中分离出一种病毒,当时称为“猩猩感冒因子”。不久Chanock等从患呼吸道感染(肺炎和哮吼)的婴儿呼吸道标本中分离到了同样的病毒,因为这种病毒可使培养细胞产生独特的细胞融合,故命名为呼吸道合胞病毒(respiratory syncytial virus,RSV)。此后,世界各地的研究证明RSV是全世界婴幼儿下呼吸道感染最重要的病毒病原,无论在发达国家还是发展中国家,凡有病原学研究的地方,都发现RSV是婴幼儿下呼吸道感染的最重要病原。而且与其他的呼吸道病毒病原不同,RSV表现为特殊的感染和疾病的形式,尤其在小婴儿组该病毒引起的危及生命的严重下呼吸道感染的致病机制始终是困扰病毒学家和流行病学家的谜。
1.一般特征
RSV属副黏病毒科,肺病毒属。具有副黏病毒科的特征:①病毒基因组为不分节段的负链单链RNA;②病毒蛋白附着于病毒核酸上,形成核衣壳;③在病毒颗粒内具有病毒编码的、同核衣壳连接的多聚酶。④以病毒RNA为模板,主要转录生成非重叠的病毒亚基因组mRNA;⑤病毒的复制主要在被感染宿主的细胞浆;⑥核衣壳以出芽的方式通过宿主细胞的浆膜,从而形成具有脂质膜的子代病毒,其脂质膜上有病毒编码的跨膜蛋白。
2.生物学性状
(1)病毒颗粒
RSV毒粒由包裹在脂蛋白包膜的核衣壳组成。组织培养中的RSV经负染后在电镜下观察,可见毒粒的形态和大小不规则,既有直径为80~350nm的球形颗粒,又有直径为60~100nm、长达10μm的丝状体。尽管形态、大小差异大,但每个病毒颗粒只含一个有功能的基因RNA,是含有脂蛋白包膜的中等大小(120~200nm)的病毒。
RSV的核衣壳与其他的副黏液类病毒相似,呈螺旋对称,只是直径不同。包膜为双层脂质,来自感染细胞的细胞浆并含有病毒基因编码的跨膜表面糖蛋白。这种糖蛋白突起在毒粒表面,使病毒能够吸附和穿入被感染细胞。与其他的副黏液病毒不同,RSV毒粒不含血凝素和神经氨酸酶。
(2)理化特性
对热不稳定,毒粒在无蛋白的溶液中,4℃或室温放置2~4小时其感染力可以丢失90%~99%,在-15~-25℃数天即灭活;冰冻融化也易灭活。在酸性或碱性溶液中均易被破坏,在中性溶液中较稳定。对乙醚敏感。
(3)病毒培养
RSV可在Hep-2、HeLa等传代细胞系增殖,也可在原代猴肾、人胚肾细胞培养中增殖。细胞病变的特点是形成融合细胞及胞质中的嗜酸性包涵体(图1)。在Hep-2细胞培养中还可形成空斑(也称为蚀斑)。RSV不能在鸡胚中增殖。
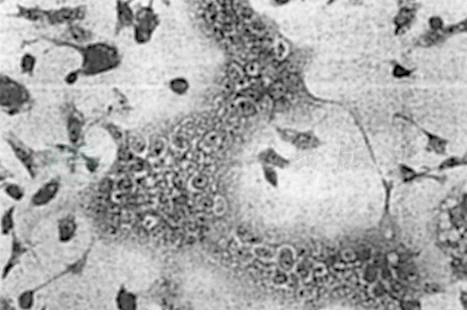
图1 RSV感染Hep-2细胞后病变照片
出现典型的细胞融合病变及胞质中的嗜酸性包涵体。此图由王之梁教授提供
(4)病毒的基因组结构及基因编码分配
RSV(以原型株A2株为例)的基因组是由15 222个核苷酸组成的不分节段的负链单链RNA,转录成10个主要的亚基因组mRNA,分别编码10个相应的蛋白。其中3个为穿膜表面蛋白F、G和SH;2个非糖基化的病毒颗粒的基质蛋白M和M2;3个同病毒RNA相结合并组成核衣壳的蛋白N、P和L;另外还有2个是主要存在于被感染细胞的非结构蛋白NS1和NS2。基因的顺序为3'-NS1-NS2-N-P-M-SH-G-F-M2-L-5'。
(5)病毒蛋白及病毒的抗原成分
1)RSV亚型
以前曾认为RSV只有一个型,后来利用单克隆抗体技术证明RSV存在A、B两个亚型。A和B亚型间的抗原相关性为25%,其中F蛋白的抗原相关性为50%,而G蛋白的抗原相关性只有1%~7%。对多年来保存的RSV毒株的抗原性分析表明:RSV A、B亚型在30余年来一直稳定地存在,绝大多数年份A、B亚型共同流行,但以A亚型为主。近年来应用分子生物学技术,对于亚型的分型可利用基因序列的差异来决定。
2)病毒蛋白及抗原成分
RSV基因组编码的10个病毒蛋白中与病毒抗原型别有关的主要是毒粒表面的糖蛋白F和G蛋白。
F蛋白:是典型的副黏病毒科融合性糖蛋白,用抗F蛋白的单克隆抗体可以抑制组织培养中融合病变的形成。F蛋白在毒粒表面呈脊突样,是跨膜的表面糖蛋白,是RSV刺激机体产生保护性中和抗体的最重要的病毒抗原之一。
G蛋白:在毒粒表面呈脊突样,是病毒吸附于宿主细胞表面的病毒蛋白,与其他副黏液类病毒不同的是RSV的G蛋白没有血凝素或神经氨酸酶活性,是一个非常独特的蛋白。没有糖基化的G蛋白分子量为32.5kD,而经氮或氧连接糖基化后的G蛋白为90kD,说明成熟的G蛋白是一个高度糖基化的蛋白。
和F蛋白一样,G蛋白是RSV刺激机体产生保护性中和抗体的最重要的病毒抗原之一。与F蛋白不同的是G蛋白是已知RSV蛋白中变异最明显的蛋白,RSV A、B亚型抗原性的不同主要表现在G蛋白上,不同亚型的G蛋白刺激产生的中和抗体缺乏交叉保护作用。虽然F和G蛋白都是刺激机体产生中和抗体最重要的病毒抗原,但F蛋白在对机体的保护性方面有比G蛋白更重要的作用,表现为:①F蛋白在RSV不同亚型和不同毒株之间相对保守(不同亚型间F蛋白的氨基酸同源性为90%左右);②分别给动物输注抗F或抗G蛋白的单克隆抗体,抗F蛋白抗体可以使上、下呼吸道都得到几乎完全的保护,而抗G蛋白的单克隆抗体只能保护下呼吸道感染;③用表达RSV F或G蛋白的重组痘苗病毒免疫动物,F蛋白诱发的中和抗体滴度是G蛋白的6倍。
SH蛋白是一个只有64个氨基酸组成的位于毒粒包膜上的小蛋白,除了与F和G联合表达时SH蛋白具有增加F蛋白的融合细胞的功能外,SH蛋白本身的功能不详,可能同病毒的吸附、穿入及维持毒粒的形态有关。
与其他的非节段性负链RNA病毒一样,RSV有三个与核衣壳结合的蛋白,N、P和L。N是与RNA结合的主要核衣壳蛋白;P是磷蛋白;L是最大的蛋白,可能是转录酶的亚单位。M和M2蛋白是非糖基化的基质蛋白。
NS1和NS2是非结构蛋白,其功能不详。但作为非结构蛋白,可能与RNA合成的调控和毒粒的形成有关。
除了L蛋白以外,对RSV所有的结构蛋白的免疫原性和保护作用逐一作过研究。在这些蛋白中,只有F和G蛋白能刺激机体产生中和抗体,F蛋白比G蛋白更有效。在许多不同的动物实验中都证实对F或G糖蛋白的免疫反应能够抵御RSV的感染。因此认为这两个糖蛋白是RSV的主要保护性抗原。此外,用基因工程表达的产物证明,M蛋白和N蛋白也有一定的保护作用,但是通过细胞免疫,并且很短暂。
1.RSV的初次感染
大量的研究证明,RSV是人出生后早期严重(甚至致命的)下呼吸道感染的最主要的病原。在一项有1179名新生儿参加的前瞻性研究中,143人(12.1%)在1岁前发生了RSV引起的下呼吸道感染,这些婴儿中有5人还发生了再次感染;在这143名初次感染的婴儿中,有123名(86%)是毛细支气管炎。血清流行病学研究还证明,2岁以下的婴幼儿有48%有血清RSV中和抗体,到3岁时抗体阳性率达到77%。血清学监测表明,血清抗体阴性(从未受过感染)的儿童受感染的危险性是很高的。集体住宿的人群(如:幼儿园、住宿学校、老人院)的感染率或再次感染率也很高。再次感染几乎也都是有症状的。
2.RSV在不同临床综合征中的作用
目前已经比较清楚,RSV是婴儿期毛细支气管炎和幼儿期肺炎的主要病因。5岁以下的儿童患伴有喘息症状的呼吸道感染,不管其严重程度如何,最常见的病原是RSV。
3.RSV在院内感染中的作用
RSV是造成院内交叉感染的主要病原。对早产儿、先天性心肺疾病的患儿、免疫功能不全的患者(包括婴儿、儿童和成人)和骨髓移植者尤其有害。而医院内的工作人员(包括医生和护士)不管是否有呼吸道症状,在这些院内感染中起了传播病毒的作用。
4.RSV的流行规律
RSV的流行十分有规律,每年在城市引起相当规模的流行。在温带地区,RSV在晚秋、冬季和春季流行,夏季一般少有RSV的感染。RSV感染在我国具有显著的特征:在我国的南方RSV流行高峰主要在炎热的夏秋季,而在我国北方则发生在寒冷的冬春季。此外,RSV感染在我国不但有散发流行,而且每隔几年还引起农村地区大规模的暴发流行,在我国南北方农村均有报道。在我国,婴幼儿的RSV感染以A亚型和B亚型交替流行,以A亚型更为常见。和流感病毒一样,RSV也是人群呼吸道感染死亡率增加的主要病原。
5.免疫系统对RSV感染的保护作用
RSV感染的恢复及获得对RSV感染的保护,很大程度依靠免疫系统,包括特异性的局部分泌性抗体、血清抗体、细胞免疫;小婴儿则主要靠血清中的母传抗体。如果因为先天缺陷、艾滋病或使用免疫抑制剂等原因使免疫系统受损,患儿RSV感染往往不能终止,长时间持续排毒。
RSV感染刺激产生血清和局部分泌性抗体,即使在小婴儿也不例外。但是和大年龄组比较,1至8月龄的婴儿感染后抗体水平仅为大龄儿童的15%到25%。这可能是因为小婴儿的免疫系统尚不成熟,或者被动获得的血清中的母传抗体的免疫抑制作用,或者两者兼有。
但从RSV感染的流行病学资料来看,免疫系统的保护作用是不完全的。表现为:①血清中有中等水平的抗RSV母传抗体的小婴儿仍可发生RSV感染;②所有年龄组的RSV的再次感染都很常见,有些小婴儿初次感染恢复后仅数周又发生RSV再次感染。
对呼吸道病毒再次感染的保护作用来自于局部分泌性抗体和黏膜免疫系统的其他功能。小婴儿感染RSV后产生的分泌性抗体在试管内往往不能中和病毒,这可能是婴幼儿初次感染RSV后所获得的自然免疫不完全的原因。随着年龄的增长和RSV重复感染次数的增多,对RSV的免疫力逐渐增强。对成人志愿者的研究发现,对实验性感染的免疫力与鼻部中和性IgA的相关性要大于血清中和抗体。但是,分泌性IgA仅提供部分保护,因为尽管这些志愿者有着高浓度的IgA抗体,仍可以再次被感染并出现症状。
随着对于RSV感染的流行病学、动物实验和抗体预防法研究的日益深入,血清抗体对于RSV感染的保护作用的证据逐渐显现出来。如母传抗体的水平与婴儿抵御严重感染的能力有关;另外,RSV感染的严重程度与婴儿血清中母传抗体的水平和急性期抗体的水平呈负相关。目前认为,对于上呼吸道的RSV感染,局部的分泌性IgA起了主要的作用,而对于抵御严重的下呼吸道感染,血清中和性抗体起主要作用。
细胞免疫在RSV感染中也起了重要的作用。对于RSV感染小鼠的研究显示,CTLs(细胞毒性T细胞)和抗体在清除病毒方面起了同样重要的作用。RSV从感染小鼠肺中的清除与病毒特异性CTLs的出现有关。在RSV感染的成年鼠中,CD8+和CD4+在降低病毒滴度和感染的恢复中起了重要的作用。
RSV感染引起呼吸道疾病的潜伏期为4~5天。疾病初期病毒在鼻咽部复制,通常在小婴儿每毫升鼻分泌物中病毒滴度可达104~106TCID50。对因RSV下呼吸道感染而住院的小婴儿的观察揭示,开始时,大部分婴儿的鼻咽分泌物内的病毒滴度可达103.5~105TCID50,然后在住院期间逐日下降。有的小婴儿可持续排毒长达3周。排毒持续时间与疾病严重程度成正比,而排毒的滴度与年龄成反比。病毒可能是通过呼吸道上皮细胞间的传播由上呼吸道播散至下呼吸道,也就是说,病毒可以不通过细胞外的液体而通过细胞至细胞直接传播。虽然没有关于RSV病毒血症的报道,但曾有报道在患病婴儿的外周血单核白细胞中检测到RSV抗原。
下呼吸道的症状常在流涕发生后1~3天出现,这反映了病毒播散到支气管和毛细支气管所需要的时间。病毒在下呼吸道的滴度不清楚。但一些尸检的资料显示在因肺炎死亡的病例中检测到大量的抗原,而因毛细支气管炎死亡的病例中只检测到少量RSV抗原;在所有这些报告中,RSV抗原仅限于呼吸道上皮的表层。在一些免疫功能严重受损的婴儿或成人中,RSV感染可以造成患者死亡,这些患者的RSV感染播散至呼吸道以外的器官,包括肾脏、肝脏和心肌。
有些研究显示,尽管临床症状已经恢复,病毒还继续从上呼吸道排出;然而还有一些研究指出,当分泌性抗体出现时排毒现象即终止,这种排毒现象的终止正好和临床症状的恢复吻合。完好的细胞免疫在RSV感染的终止方面起了主要的作用。免疫系统严重受损的患者,RSV感染后会转变为持续性感染,如先天性免疫缺损、获得性免疫缺损(艾滋病)或用免疫抑制药物的患者。
病毒特异性IgE可能加重RSV感染,RSV感染伴哮喘和喘息的患儿游离IgE的水平增加,并与低氧血症相关。另外认为感染时局部形成的RSV抗原-抗体复合物可能加重病毒感染造成的损伤,病毒感染的细胞本身和病毒感染细胞与抗体的复合物可能激活补体或补体旁路。有研究发现RSV感染时从呼吸道脱落的RSV感染细胞表面有补体成分。
婴幼儿严重RSV感染的病理学改变与其他呼吸道病毒引起的肺炎和毛细支气管炎相似。发生毛细支气管炎时,毛细支气管上皮有坏死,偶见有增生或纤毛上皮细胞的破坏。淋巴细胞、浆细胞和巨噬细胞在毛细支气管周围浸润,淋巴细胞在黏膜上皮细胞间聚集,黏膜下和黏膜组织水肿,黏液过量渗出,这一过程导致小细支气管的阻塞,进而使远端气道萎陷或形成气肿。发生肺炎时,单核细胞的浸润使得肺泡间壁增厚,肺泡内有液体渗出。尽管这些病变可能很广泛,但病理改变往往呈斑点状。
关于RSV感染引起的较轻的肺炎和毛细支气管炎的显微镜下病理改变资料很少。推测在大部分病例中,感染集中在小细支气管,表现为毛细支气管周围组织或间质的炎性改变。必须强调的是,虽然在RSV肺炎和毛细支气管炎的发病机制中有免疫成分的参与,但主要还在于直接的细胞病理学改变。另外,毛细支气管炎特殊的临床表现可能是许多因素的综合作用:如免疫作用,RSV对毛细支气管上皮的亲嗜性,小婴儿毛细支气管的解剖特征等。
近十多年来,支持疗法还是治疗RSV感染最主要的方法,有效地降低了重症毛细支气管炎和肺炎的病死率。目前能有效地治疗RSV感染的药物很少,通过美国食品和药物管理局(FDA)批准用于治疗RSV的药物只有两种:利巴韦林(三氮唑核苷或病毒唑,ribavirin)雾化吸入和呼吸道合胞病毒免疫球蛋白(respiratory syncytial virus immune globulin,RSVIG)。
1.利巴韦林是一种合成的核苷酸类似物,具有广谱的抗RNA和DNA病毒活性。其确切的机制不详。在细胞培养中加入利巴韦林,可使RSV的复制明显降低。但利巴韦林在棉鼠体内的抗RSV作用则较体外低得多。对于利巴韦林临床效果的研究并未取得明确的结论。用利巴韦林治疗RSV感染早期的研究结论证明用利巴韦林气溶胶治疗(2次/日,连续3天)对因RSV感染所致成人急性呼吸道感染有效,可以降低鼻内分泌物的排毒期,减少发热及全身症状。对婴幼儿的治疗研究同样显示具有快速改善下呼吸道感染症状、提高动脉氧水平的结论。但近期的研究似乎对其疗效提出了质疑,因此,目前对于利巴韦林的临床治疗效果并未取得非常明确的结论。
2.RSV免疫球蛋白Prince和Suffin等首先证明给生后3天的雪貂被动免疫可以保护RSV的攻击。此后用棉鼠证明血清中和抗体同肺内的RSV滴度具有直接的相关性。在人体首先是应用静脉注射免疫球蛋白(IVIG)给易感婴幼儿,以观察其对RSV的保护作用。由于IVIG的RSV中和抗体滴度变化较大,后改用静脉注射纯化的特异性RSVIG。对高危婴幼儿的治疗结果显示,每月静脉注射RSVIG可明显减少伴有支气管发育不良的小于35周早产住院患儿因RSV所致下呼吸道感染。对无其他危险因素的RSV下呼吸道感染婴幼儿应用静脉注射RSVIG具有很好的耐受性,并可减少住院天数和ICU监护时间,但与对照组相比,未达到显著的统计学意义(P=0.06)。由于RSVIG在预防RSV感染中有一定效果,AAP在1997年4月的儿科杂志上就应用RSVIG预防RSV感染的建议中写道:“对于①伴有肺支气管发育不良的小于2岁的婴幼儿;②目前正在给氧或6个月内接受过给氧;③小于32周的早产儿,在RSV流行季节前可以考虑给予RSVIG免疫预防。”
由于RSV对婴幼儿健康造成极大的威胁,世界卫生组织将RSV疫苗的研究列为首要发展的疫苗之一。但是尽管发达国家对RSV疫苗的研制投入了巨大的人力物力,由于病毒本身的特点和RSV感染人群的特点,目前尚未见有效的疫苗被批准应用。
RSV疫苗除有其他疫苗所面临的共同问题外,还有本身特有的问题:①因RSV常常引起生后2个月婴儿的严重感染,如果需要在生后2个月时体内产生有效的保护性免疫,就意味着要在生后一个月时进行初次免疫,而此时婴儿体内存在着的较高水平的母传RSV抗体可能会降低疫苗的免疫原性;②由于一生中可多次感染RSV,虽然感染后可在下呼吸道产生保护性免疫,但因RSV自然感染刺激机体免疫是不完全免疫,需再次或多次的RSV感染才能完善。因此RSV疫苗需多次给药才能达到可以保护严重下呼吸道感染的免疫水平;③由于RSV A、B两个亚型间的交叉中和活性只有25%,因此RSV疫苗应对两个亚型都具有保护作用;④由于1960年甲醛溶液(福尔马林)灭活疫苗免疫后再次感染使病情更加严重这一事故,需要在研制RSV疫苗时更加小心。
已经尝试过的RSV疫苗有:福尔马林灭活疫苗、亚单位疫苗(F和G蛋白疫苗)、活病毒疫苗(表达RSV F和G蛋白的重组痘苗病毒、温度敏感减毒活疫苗)等,虽然各有优点,但因为各自明显的缺点而尚不能应用于临床。
如上文所提到的,RSVIG在预防RSV感染中具有一定效果,目前在美国已有商品化的RSVIG上市,用于在高危人群中预防RSV感染。这是一种肌内注射制剂,商品名为“Synagis”,又称为Palivizumab(中文称为帕利珠)是用DNA重组技术研制成的人源化抗F蛋白的单克隆抗体。在RSV感染的流行季节,每隔28~30天给易感或高危人群注射一次,可以在这些人群中预防由RSV感染引起的严重呼吸道疾病。













