英文名称 :pathological jaundice
中文别名 :非生理性高胆红素血症
病理性黄疸(pathological jaundice)或称为非生理性高胆红素血症(non-physiological hyperbilirubinemia)。相对生理性黄疸而言,病理性黄疸是指血清胆红素水平异常增高或胆红素增高性质的改变,某些增高属于生理性黄疸的延续或加深,而更重要的是要积极寻找引起其增高的原发病因。下列情况应该引起注意:①生后24小时内出现黄疸;②血清总胆红素值已达到相应日龄及相应危险因素下的光疗干预标准,或超过小时胆红素列线图的第95百分位,或每日上升超过85µmol/L(5mg/dl),或每小时>0.5mg/dl;③黄疸持续时间长,足月儿>2周,早产儿>4周;④黄疸退而复现;⑤血清结合胆红素>34µmol/L(2mg/dl)。
新生儿病理性黄疸的病因较多,并常有多种病因同时存在。
1.胆红素生成过多
由于红细胞破坏增多,胆红素生成过多,引起未结合胆红素增高。
(1)同族免疫性溶血:如Rh血型不合、ABO血型不合、其他血型不合。
(2)红细胞酶缺陷:如葡萄糖‐6‐磷酸脱氢酶(G6PD)缺陷、丙酮酸激酶缺陷、己糖激酶缺陷。由于红细胞酶的缺陷影响红细胞的正常代谢,使红细胞膜僵硬,变形能力减弱,易于在网状内皮系统滞留破坏。
(3)红细胞形态异常:如遗传性球形红细胞增多症、遗传性椭圆形红细胞增多症、遗传性口形红细胞增多症、婴儿固缩红细胞增多症,由于细胞膜结构异常使红细胞过早被脾脏破坏。
(4)血红蛋白病:如地中海贫血、血红蛋白F‐Poole和血红蛋白Hasharon,均可在新生儿期出现溶血和贫血。
(5)红细胞增多症:如母‐胎、胎‐胎之间输血,脐带延迟结扎,宫内发育迟缓,先天性青紫型心脏病,糖尿病母亲的新生儿等,可致红细胞增多,破坏也增多。
(6)体内出血:如头颅血肿、皮下血肿、颅内出血、肺出血或其他部位出血(肝脾破裂),引起血管外溶血,使胆红素产生过多。
(7)感染:细菌和病毒感染皆可致溶血,常见的宫内感染如CMV(部分病例可表现为溶血性黄疸),EB病毒,人细小病毒B19等均可引起溶血。细菌感染如金黄色葡萄球菌,大肠杆菌等引起的败血症,肺炎,脑膜炎等重症感染。
(8)维生素E缺乏和微量元素缺乏:早产儿维生素E水平较低,可影响红细胞膜的功能,易引起溶血,使黄疸加重。新生儿低锌可使红细胞膜结构有缺陷而致溶血。镁缺乏可影响肝葡萄糖醛酰转移酶的生成。
(9)药物:可诱发红细胞膜的缺陷而发生溶血性贫血,如磺胺、呋喃妥因、呋喃唑酮、水杨酸盐、维生素K3、樟脑、黄连等,可使有G6PD缺乏的新生儿诱发溶血,使血胆红素升高。药物或其毒素也可致免疫性溶血,药物作为抗原与红细胞膜上的蛋白质结合成免疫复合物与新生儿体内由药物产生的抗体或通过胎盘由母体产生的抗体相结合,发生溶血,亦可使血胆红素升高。孕母分娩前静点催产素(超过5U)和(或)不含电解质的葡萄糖溶液可使胎儿处于低渗状态,导致红细胞通透性及脆性增加而致溶血。
2.肝细胞摄取和结合胆红素能力低下
(1)感染:感染因素除可致溶血外,同时又可抑制肝酶活力,致使肝细胞结合胆红素能力下降,而致高未结合胆红素血症。
(2)窒息、缺氧、酸中毒:孕母有妊娠期高血压疾病、慢性心肾病、贫血等;或有胎位、胎盘、脐带异常;或为非自然分娩(胎吸、产钳助产)、产前用过镇静剂等,均可导致宫内窘迫或生后窒息,易并发羊水或胎粪吸入,加重缺氧和酸中毒。缺氧使肝酶活力受抑制。酸中毒可影响未结合胆红素与白蛋白的结合而加重黄疸。近年来有学者提出胆红素为氧自由基清除剂,缺氧时氧自由基增加,可消耗胆红素而使黄疸减轻或不引起高胆红素血症。
(3)低体温、低血糖、低蛋白血症:为早产儿或VL BW儿常易发生的并发症,体温不升、低血糖可影响肝酶活性,低蛋白血症可影响与胆红素的结合,而使黄疸加重。
(4)药物:某些药物如磺胺、水杨酸盐、维生素K3、吲哚美辛、毛花苷丙等与胆红素竞争和Y、Z蛋白的结合位点,噻唑类利尿药可使胆红素与白蛋白分离,均可使血胆红素增加。酚类清洁剂(phenolic detergents)能抑制葡萄糖醛酰转移酶的活性,有报告婴儿室用此类清洁剂消毒后使高胆红素血症发生率增加。
(5)先天性非溶血性高胆红素血症:如先天性葡萄糖醛酰转移酶缺乏即Criger‐Najjar综合征Ⅰ型、Ⅱ型和Gilbert综合征。
(6)家族性暂时性新生儿高胆红素血症:即Lucey‐Driscoll综合征。
(7)其他:甲状腺功能低下、脑垂体功能低下、先天愚型、幽门狹窄、肠梗阻常伴有血胆红素升高或黄疸延迟消退。肥厚性幽门狭窄伴有高胆红素血症者约占10%~25%,肝细胞UGT活性明显受抑;而无黄疸者则UGT未见影响,机制尚不清楚。约10%甲状腺低下新生儿有迁延性高未结合胆红素血症,由于甲状腺素缺乏,可能影响肝细胞UGT的发育,从而影响UGT的活性下降,使黄疸加重或迁延不退,可达数周或数月。十二指肠和空肠有狭窄或闭锁、巨结肠均可伴有高未结合性胆红素血症,手术后2~3天,TSB值很快下降到正常,推测系肠梗阻时未结合胆红素在肠道内再吸收增加。脑垂体功能低下时主要表现为迁延性高结合胆红素血症,但也可同时有未结合胆红素升高,发病机制不清楚。
3.胆红素排泄异常
肝细胞排泄功能障碍或胆管受阻,可发生胆汁淤积性黄疸,结合胆红素增高。如同时有肝细胞功能障碍,也可伴有未结合胆红素增高,而致混合性高胆红素血症。
(1)肝细胞对胆红素排泄功能障碍
1)新生儿肝炎综合征:多数由病毒引起,常见有乙型肝炎病毒、巨细胞病毒、风疹病毒、单纯疱疹病毒、肠道病毒、EB病毒等,多为宫内感染。细菌感染如B组溶血性链球菌、金黄色葡萄球菌,大肠埃希菌等引起的肝炎称中毒性肝炎。其他,如李斯特菌、梅毒螺旋体、钩端螺旋体、弓形虫等也可引起肝炎。
2)先天性代谢缺陷病:如α1‐抗胰蛋白酶缺乏症、半乳糖血症、果糖不耐受症、酪氨酸血症、糖原累积病Ⅳ型、脂质累积病(尼曼匹克病、戈谢病)。
3)先天性遗传性疾病:如脑肝肾综合征(Zell weger syndrome),家族性进行性肝内胆汁淤积症(Byler dis ease)、先天性非溶血性黄疸(结合胆红素增高型)即Du bin‐Johnson综合征、先天性纤维囊肿病等。
(2)胆管排泄胆红素障碍
1)先天性胆管闭锁:可发生在肝外(胆总管、肝胆管)或肝内胆管。
2)先天性胆总管囊肿。
3)胆汁黏稠综合征:可由于新生儿溶血病、新生儿肝炎、肝内小胆管发育不全和药物等原因引起,胆汁淤积在小胆管中。
4)其他:肝和胆道肿瘤、胆道周围淋巴结病等。
4.肠肝循环增加
如先天性肠道闭锁、幽门肥大、巨结肠、胎粪性肠梗阻、饥饿、喂养延迟、药物所致肠麻痹等均可使胎粪排出延迟,增加胆红素的回吸收。母乳喂养儿可能由于肠道内β‐葡萄糖苷酸酶(β‐glucuronidase)含量及活性增高,促使胆红素肠肝循环增加,导致高胆红素血症。
新生儿病理性黄疸分类与儿童及成人相同。按其发病机制可分为红细胞破坏增多(溶血性、肝前性)、肝脏胆红素代谢功能低下(肝细胞性)和胆汁排出障碍(梗阻性、肝后性)三大类。按实验室测定TSB和结合胆红素浓度的增高分为高未结合胆红素血症(高间接胆红素血症)和高结合胆红素血症(高直接胆红素血症),如两者同时存在则称混合性高胆红素血症。
1.测总胆红素、间接和直接胆红素。
2.直接胆红素增高为主的应查肝功、腹部B超等。
3.怀疑新生儿溶血症者做母子交叉试验。
4.感染性:疑为败血症做血培养;疑宫内感染做TORCH特异性检查;考虑肝炎做有关血清学检查,如HBsAg、抗-HCV等。
5.先天性代谢缺陷:怀疑甲低功做甲功检查;怀疑α1-抗胰蛋白酶缺乏,可做蛋白电泳,如α1球蛋白定量<2g/L可初步诊断;半乳糖血症测尿及血中乳糖含量。
采取措施降低血清胆红素,以防止胆红素脑病的发生。可采用光疗、换血、输注白蛋白及其他药物治疗。同时要针对不同的病因进行治疗。
2004年美国儿科学会对≥35周重症高胆红素血症的高危因素分析,针对高危因素进行预防(表1)。
表1 不同出生时龄的足月新生儿黄疸干预推荐标准
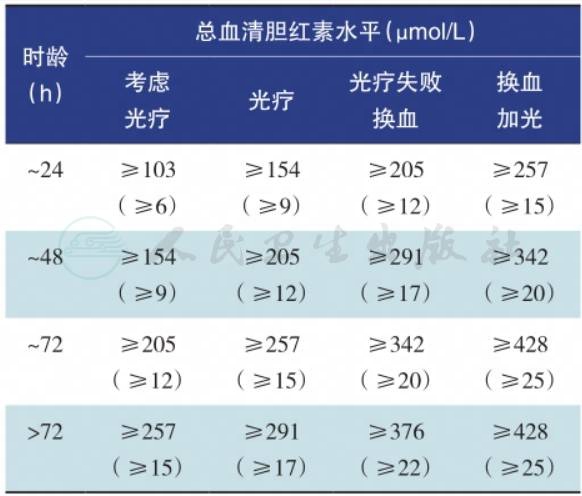
注:括号内数值为mg/dl值,1mg/dl=17.1µmol/L
其发生的高危因素包括头颅血肿、小胎龄、不充分的母乳喂养(尤其伴体重下降8%~10%者)、免疫性溶血或者贫血。此外,小胎龄、溶血、脓毒症、低出生体重均与黄疸发展呈正相关。表2是黄疸高危因素评分。
表2 新生儿高胆红素血症高危评分
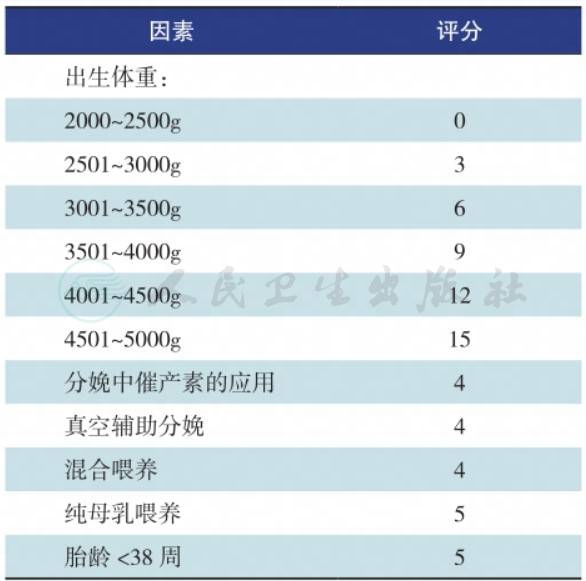
黄疸的高危因素包括:纯母乳喂养、家族的既往黄疸史、外伤、头颅血肿、种族、母亲怀孕年龄(>25岁),男性、G-6-PD缺乏、胎龄<38周。
对于早产儿,其黄疸指数有所不同,应该按不同胎龄、不同出生体重进行处理。2006年,Maisels推荐“高胆红素血症”适用大于第95百分位的小时-胆红素值,总胆红素值>342μmol/ L(20mg/dl)为 重 度 高 胆 红 素 血 症,>428μmol/ L(25mg/dl)或513μmol/L(30mg/dl)为极重度高胆红素血症;342μmol/L(20mg/dl)成为一条红线、一个尽量不要超过的指标,但是对于足月新生儿中总胆红素大于342μmol/L会不会发生急性胆红素脑病问题,目前看法不一致。美国2004年方案发表的光疗小时列线图与换血小时列线图,一小时胆红素列线图为基础,将风险管理与干预标准结合在一起,制定不同风险程度时的光疗换血标准,更为合适。













