英文名称 :hyaline membrane disease,HMD
中文别名 :肺透明膜病
新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome,RDS)为肺表面活性物质缺乏所致,多见于早产儿和择期剖宫产新生儿,生后数小时出现进行性呼吸困难、青紫和呼吸衰竭。病理上出现肺透明膜,又称肺透明膜病(hyaline membrane disease,HMD)。早产儿RDS发病率约5%~10%,胎龄越小发病率越高,择期剖宫产新生儿 RDS发生率约0.9%~3.7%。
1959年Avery和Mead首次发现 RDS为 肺表面活性物质(pulmonary surfactant,PS)缺乏所致,导致PS缺乏的因素都可能促使发生RDS,其中早产和剖宫产是RDS的主要病因和危险因素。
1.早产
RDS主要发生在早产儿,这与早产儿肺发育未成熟,PS合成分泌不足直接有关。胎龄15周时,可在细支气管测得肺表面活性物质蛋白B(SPB)和C(SP-C)的mRNA,胎龄24~25周开始合成磷脂和活性SP-B,以后PS合成量逐渐增多,但直到胎龄35周左右PS量才迅速增多。因此,胎龄小于35周的早产儿易发生 RDS,并且,胎龄越小发生率越高。
2.剖宫产
在分娩未发动之前行择期剖宫产,因未经过正常宫缩,儿茶酚胺和肾上腺皮质激素的应激反应较弱,PS合成分泌较少。同时,剖宫产新生儿肺液转运障碍,影响PS功能。近年社会因素或产科问题择期剖宫产较多,一些足月儿或晚期早产儿也发生RDS。
3.糖尿病母亲
母亲患糖尿病时,胎儿血糖增高,胰岛素分泌相应增加,胰岛素可抑制糖皮质激素,而糖皮质激素能刺激PS的合成分泌。因此,糖尿病母亲新生儿PS合成分泌受影响,即使为足月儿或巨大儿,仍可发生RDS。
4.围产期窒息
缺氧、酸中毒、低灌注可导致急性肺损伤,抑制肺Ⅱ型上皮细胞产生PS。
5.重度Rh溶血病
患儿胰岛细胞代偿性增生,胰岛素分泌过多抑制PS分泌。
6.SP-A基因变异
为什么有些早产儿易发生RDS,而有些早产儿不易发病?可能与SP-A等位基因变异有关,SP-A等位基因6A2和1A是RDS的易感基因,等位基因6A3和1A5为保护基因。RDS患儿6A2和1A基因过度表达,6A3和1A5基因表达下调。
7.SP-B基因缺陷
已有报道因患儿SP-B基因缺陷,不能表达SP-B,PS不能发挥作用,这些患儿不管足月或早产,易发生RDS。
肺表面活性物质缺乏时肺泡壁表面张力增高,肺泡逐渐萎陷,进行性肺不张,发生缺氧、酸中毒,肺小动脉痉挛,肺动脉高压,导致动脉导管和卵圆孔开放,右向左分流,缺氧加重,肺毛细血管通透性增高,血浆纤维蛋白渗出,形成肺透明膜,使缺氧酸中毒更加严重,造成恶性循环。
RDS患儿肺呈暗红色,质韧,在水中下沉。光镜下见广泛的肺泡萎陷,肺泡壁附一层嗜伊红的透明膜,气道上皮水肿、坏死、脱落和断裂。电镜下肺Ⅱ型细胞中的板层小体成为空泡。
RDS肺部X线检查有特征性表现,多次床旁摄片可观察动态变化。按病情程度可将胸片改变分为4级:Ⅰ级:两肺野普遍透亮度降低(充气减少),可见均匀散在的细小颗粒(肺泡萎陷)和网状阴影(细支气管过度充气);Ⅱ级:除Ⅰ级变化加重外,可见支气管充气征(支气管过度充气),延伸至肺野中外带;Ⅲ级:病变加重,肺野透亮度更加降低,心缘、膈缘模糊;Ⅳ级:整个肺野呈白肺,支气管充气征更加明显,似秃叶树支(图13-3)。胸廓扩张良好,横膈位置正常。
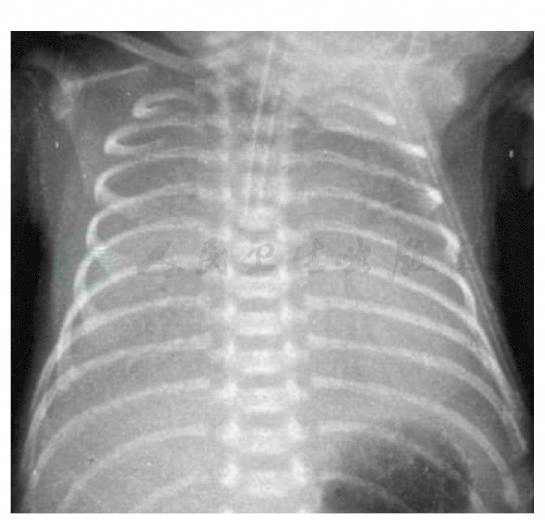
图13-3 新生儿呼吸窘迫综合征肺部X线变化
整个肺野充气不良,肺不张,呈白肺,可见支气管充气征,肺与膈缘、心脏边缘界线不清
1.肺表面活性物质(PS)治疗
目前PS已成为RDS的首选常规治疗,国际上已有7~8种PS药品,国内有两种PS药品可供选用。使用PS治疗RDS需注意以下问题。
(1)药品选择:
PS药品分为天然型和合成型,天然型PS从牛或猪肺提取,合成型PS为人工合成。天然型PS疗效明显优于合成型PS,合成型PS多用于预防或轻症病例。
(2)给药时机:
PS给药时机分为产房预防、早期治疗和抢救性治疗。产房预防:是指在产房复苏后立即给药,一般为生后15~30分钟,给1次。预防指征不同国家不一样,欧洲新生儿RDS防治指南建议:对胎龄<26周,产前未使用激素者考虑在产房使用PS预防,预防给药可使 RDS发生率减少1/3~1/2。早期治疗:是指生后2小时内,出现呼吸困难、呻吟,胸片显示两肺透亮度下降,颗粒网状影,立即给药。抢救性治疗:是指病情非常严重,X线出现典型RDS改变才给药。根据疗效-费用分析,应该提倡早期治疗。
(3)给药剂量:
PS剂量范围比较宽,迄今为止国际报道最大剂量范围为每次50~200mg/kg。但每种PS药品各自有推荐剂量,且各不相同,多数为每次100~200mg/kg,也有用70~100mg/kg。总体而言,剂量大效果好,重症病例需用较大剂量,轻症病例和预防用药剂量可以偏小,也有报道首剂用200mg/kg,续剂用100mg/kg。
(4)给药次数:
对轻症病例一般给1次即可,对重症病例需要多次给药,现主张按需给药,如呼吸机参数吸入氧浓度(FiO2)>0.4或平均气道压(MAP)>8cmH2O,应重复给药。根据国内外经验总结,严重病例需给2~3次,但一般最多给4次,间隔时间根据需要而定,一般为6~12小时。
(5)给药方法:
PS有2种剂型,须冷冻保存。干粉剂用前加生理盐水摇匀,混悬剂用前解冻摇匀,使用前将药瓶置于37℃预热数分钟,使PS磷脂更好地分散。用PS前先给患儿充分吸痰,清理呼吸道,然后将PS经气管插管缓慢注入肺内,仰卧位给药。
2.无创呼吸支持
近年提倡使用无创呼吸支持治疗新生儿 RDS,包括经鼻持续气道正压通气(CPAP)、双水平气道正压通气(BiPAP和SiPAP)和经鼻间隙正压通气(NIPPV)。CPAP能使肺泡在呼气末保持正压,防止肺泡萎陷,并有助于萎陷的肺泡重新张开。对轻中度RDS,通常使用INSURE技术(气管插管-给PS治疗-拔管-CPAP),主要方法是:一旦出现呻吟,给予气管插管(IN)使用 PS治疗(SUR),然后拔管(E),使用 CPAP维持,压力5cmH2O。及时使用无创呼吸支持可减少机械通气的使用,降低 BPD发生率。NIPPV的治疗效力比CPAP好。如使用无创呼吸支持后出现反复呼吸暂停、PaCO2升高、PaO2下降,应改用机械通气。
3.机械通气
对严重RDS或无创呼吸支持效果不理想者,应采用机械通气,一般先使用常频机械通气,呼吸频率40~50次/分,吸气峰压15~20cmH2O,PEEP 5~6cmH2O。如常频机械通气参数比较高,效果不理想,可改用高频机械通气,减少常频正压通气所致的肺损伤等不良反应。使用机械通气病情改善者应尽早撤离机械通气,在撤离机械通气过程中使用咖啡因,可以加速撤机,减少再次气管插管和机械通气。撤机后再改用无创呼吸支持。
4.体外膜肺
对少数非常严重的RDS患儿,高频机械通气效果仍然比较差,可使用体外膜肺(ECMO)。目前我国能开展ECMO的单位很少,有待今后逐渐发展。
5.支持治疗
RDS因缺氧、高碳酸血症导致酸碱、水电解质、循环功能失衡,应予及时纠正,使患儿度过疾病极期。液体量不宜过多,以免造成肺水肿,生后第1、2天控制在60~80ml/kg,第3~5天80~100ml/kg;代谢性酸中毒可给5%NaHCO3,所需量(ml)=BE×kg体重×0.5,先给半量,稀释2~3倍,静脉滴注;血压低可用多巴胺3~10μg/(kg·min)。
6.并发症治疗
并发PDA时先使用药物关闭。吲哚美辛:首剂0.2mg/kg,第2、3剂:日龄<7天且出生体重<1250g者0.1mg/(kg·次),日龄>7天或出生体重>1250g者0.2mg/(kg·次),每剂间隔24小时,口服或静脉滴注。日龄小于7天者疗效较好,吲哚美辛副作用有肾功能损害、尿量减少、出血倾向、血钠降低、血钾升高,停药后可恢复。或使用布洛芬:首剂10mg/kg,第2、3剂5mg/kg,间隔时间24小时,口服或静脉滴注。若药物不能关闭动脉导管,并严重影响心肺功能时,应行手术结扎。并发持续肺动脉高压时,使用吸入一氧化氮(NO)治疗(详见相关章节内容)。
1.产前预防
对胎龄<34周,可能发生早产的产妇静脉或肌内注射倍他米松或地塞米松,预防早产儿发生RDS。倍他米松:每次12mg,间隔24小时,一个疗程2次,肌内注射;或地塞米松:每次6mg,间隔12小时,一个疗程4次,肌肉注射。一般使用1个疗程即可,使用多疗程者,增加不良反应。应在分娩前24小时~7天给药。产前使用激素预防早产儿RDS效果肯定,研究显示,未用激素预防的对照组,早产儿RDS发生率为31%,而预防组为17%,即使发生RDS,病情也明显较轻,病死率下降38%。
2.出生后预防
早产儿出生后再给激素预防,时间已来不及,可使用PS预防。













