英文名称 :acromegaly
肢端肥大症(acromegaly)是垂体持续分泌过多生长激素,导致软组织、骨骼及内脏的增生肥大、代谢紊乱等的综合征。95%以上由垂体生长激素腺瘤导致。临床上表现为嘴唇增厚、鼻翼增大、手脚增粗、头痛等。文献报道肢端肥大症患病率为28/100万~134/100万,发病年龄以31~50岁多见。导致肢端肥大症的罕见病因包括下丘脑或异位GHRH过度分泌、异位垂体腺瘤、分泌生长激素的其他肿瘤、纤维性骨营养不良综合征(McCune-Albright综合征)及多发性内分泌腺瘤病1型。在混合性垂体瘤中,GH与PRL的混合瘤最常见。
约30%的家族性肢端肥大症与AIP基因的生殖系突变有关,在散发的肢端肥大症中,AIP基因突变的比例为5%~10%。
持续高生长激素与肝脏上的生长激素受体(growth hormone receptor,GHR)结合,促进胰岛素样生长因子-1(IGF-1)合成,因此肢端肥大症患者血浆中GH和IGF-1水平都显著高于正常同龄人。GH作为影响代谢的重要激素,对脂肪、葡萄糖和蛋白质代谢都有诸多影响。GH促进脂肪动员分解和脂肪酸氧化,促进LDL的清除;肢端肥大症患者甘油三酯升高,其他血脂谱的变化报道不一。GH可直接或通过拮抗胰岛素的作用而影响葡萄糖的代谢,包括抑制葡萄糖的氧化和利用、促进肝脏葡萄糖的合成,因此肢端肥大症患者易合并高血糖。GH促进氨基酸的摄取和蛋白质的合成代谢,减少蛋白质的氧化分解。
部分肢端肥大症患者可合并高催乳素血症,以及肿瘤的占位效应导致性腺轴、甲状腺轴、肾上腺轴功能低下,患者可有相应的临床表现。
起病多数隐匿,病程长。从发病到确诊往往滞后5~6年。临床表现可分为两组,一组由肿瘤局部的占位效应导致,另一组与长期高GH和IGF-1有关。
1.肿瘤占位相关表现
头痛是肢端肥大症患者常见的就诊原因,以前额部及双侧颞部为主。其原因复杂,多数在药物或手术治疗后缓解。视力下降、视野缺损是肢端肥大症患者另一常见就诊原因,复旦大学附属华山医院634例肢端肥大症分析发现,30%患者就诊时有视力下降,与肿瘤压迫视交叉有关。大腺瘤可压迫正常垂体,导致腺垂体功能低下。因垂体周围组织受压引起的症群少见,包括下丘脑综合征、海绵窦综合征、脑脊液鼻漏等。
2.面容与软组织、骨骼改变
多数患者有手脚变大、手指增粗、足部肥厚,患者常诉鞋帽、手套变小,常年佩戴的戒指无法脱下。由于软组织增生,头皮及面部皮肤粗厚,额部多皱褶,皮肤油腻多汗。嘴唇增厚,鼻翼增宽,舌大而厚,音调低沉。因头部骨骼变化,有脸部增长、增宽,下颌增大,眼眶上嵴、前额骨、颧骨及颧骨弓均增大、突出,牙齿稀疏,有时下切牙处于上切牙前,容貌变丑陋(图1)。椎骨易因骨质疏松发生压缩性骨折,导致背部佝偻后凸、腰部前凸的畸形,患者常诉腰背部疼痛。约30%患者因软组织肿胀,压迫正中神经,引起腕管综合征。
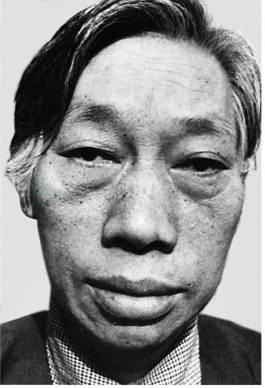
图1 肢端肥大症面容
3.心血管系统
心血管系统疾病是肢端肥大症患者的首位死因,可有高血压、心脏肥大、左心室功能不全、心力衰竭、冠状动脉硬化性心脏病、心律不齐等。复旦大学附属华山医院的数据显示,肢端肥大症患者中合并高血压的比例高达38%,多数在生化缓解后好转。病程较短的患者中即可出现心室肥厚,而心力衰竭见于病程较长的患者。
4.内分泌与代谢系统
糖代谢异常是肢端肥大症常见的合并症,部分患者因糖尿病就诊而发现肢端肥大症。复旦大学附属华山医院的数据显示约30%的患者合并糖尿病,另有约30%的患者合并糖尿病前期。血甘油三酯、游离脂肪酸常较高。血磷于活动期偏高,大多为1.45~1.78mmol/L,与生长激素加强肾小管对磷的重吸收有关。甲状腺呈弥漫性或结节性增大,但甲状腺功能大多正常。基础代谢率可增高达20%~40%,可能与高生长激素促进代谢有关。
5.呼吸系统
多数患者合并程度不等的睡眠呼吸暂停综合征,患者白天嗜睡、头晕,夜间打鼾明显。
6.生殖系统
肿瘤的占位效应导致性腺轴受损,另约30%同时伴有催乳素升高,可导致女性月经紊乱或者闭经、溢乳,男性则出现性欲减退、勃起功能障碍,少数男性也可有溢乳。
7.其他
肝、脾、肾等内脏体积增大,肠道息肉、肠癌发生率增加。增强磁共振示垂体瘤(图2),X线检查示颅骨蝶鞍扩大及指端丛毛状等病变(图3)。
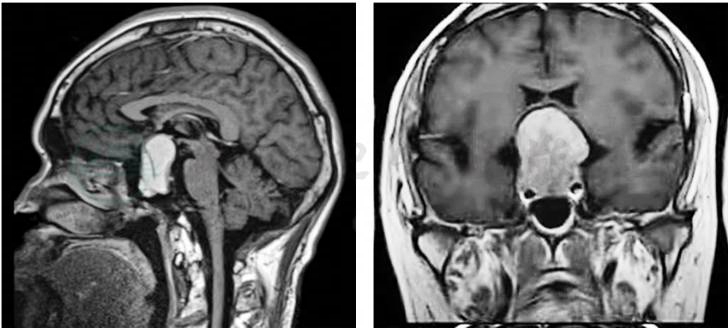
图2 肢端肥大症鞍区增强磁共振
鞍区可见异常信号占位,T1WI为等、低混杂信号,垂体柄左移,肿块向上生长压迫视交叉,向两侧侵及海绵窦,增强后扫描肿块呈不均匀强化。
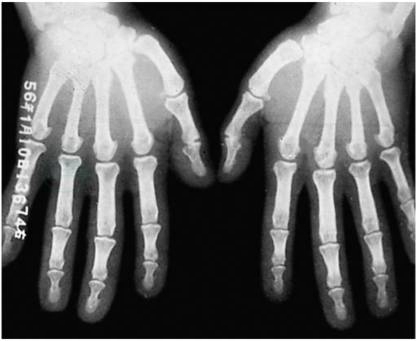
图3 肢端肥大症两手X线像
指端骨及软组织增生,指骨有骨质疏松。
治疗目标是要降低疾病相关的致残率,使死亡率恢复到正常人群水平。即通过安全的治疗手段,减轻肿瘤造成的不良影响或消除肿瘤,GH和IGF-1恢复至正常,并避免垂体功能减退。目前公认的治愈标准为:①口服葡萄糖抑制试验GH谷值<1.0μg/L;②IGF-1恢复到与年龄和性别相匹配的正常范围内;③影像学检查肿瘤消失,无复发。目前主要治疗手段包括手术治疗、药物治疗和放射治疗。
(一)手术治疗
外科切除腺瘤是多数患者的首选治疗,主要包括经蝶和经额两种入路的垂体瘤切除术。微腺瘤的治愈率约90%,大腺瘤的治愈率50%~60%。软组织肿胀在肿瘤切除后迅速得到改善。GH水平在术后1小时内即降到正常水平,IGF-1水平在3~4天内恢复正常。约10%的患者在手术全切后数年复发;垂体功能低下发生率达15%。术者的经验与手术疗效、并发症的发生直接相关。手术并发症包括尿崩、脑脊液鼻漏、出血、视神经损伤、脑膜炎及垂体功能减退。
(二)药物治疗
1.生长抑素类似物(SSA)
该类药物包括奥曲肽、长效奥曲肽、兰瑞肽及帕瑞肽。作用机制为结合生长抑素受体(SSTR,以SSTR2和SSTR5为主),抑制GH的分泌和细胞增殖。其临床疗效包括抑制GH和IGF-1水平,改善头痛和肢端肥大症状、缩小瘤体等。该类药物的生化达标率为50%~60%,部分患者对该类药物不敏感,年龄(<20岁)、肿瘤体积大、病理稀疏颗粒类型、肿瘤SSTR2低表达及AIP基因突变是SSA不敏感的相关因素。快速奥曲肽抑制试验能有效预测药物敏感性,患者在注射100μg奥曲肽后如GH下降超过90%,提示对药物敏感。
(1)奥曲肽长效制剂(octreotide LAR)
作用时间较长。每次肌内注射20mg,每28天注射1次。
(2)兰瑞肽
作用时间约为14天。每次40~60mg,每2周注射1次,如生化不达标,可将注射间期缩短至7~10天。
(3)帕瑞肽
是新一代的生长抑素类似物,有长效和短效制剂。其对SSTR1、SSTR2、SSTR3及SSTR5都有较强的结合力,因此对GH瘤的抑制作用比第一代奥曲肽更强。
多数患者对生长抑素类似物耐受性良好。不良反应多是短期的,且多数与生长抑素抑制胃肠活动和分泌相关。恶心、腹部不适、脂肪吸收不良、腹泻和肠胃胀气发生于1/3的患者,这些症状多在2周内缓解。奥曲肽抑制餐后胆囊的收缩,延缓胆囊的排空,高达20%的患者长期治疗后发生胆囊泥沙样回声或无症状的胆囊胆固醇结石。另有10%患者发生心动过缓。
2.GH受体拮抗剂
培维索孟(pegvisomant)是GH受体拮抗剂,能阻断GH受体二聚体的形成,从而阻止GH的外周作用,使IGF-1水平降至正常。但对肿瘤体积没有减少作用,应使用IGF-1作为评估疗效指标。该药可单用于对SSA类似物抵抗或不耐受者,以及单独使用SSA不能完全缓解的患者联合使用。
3.多巴胺激动剂
该类药物对于GH的分泌也有一定抑制作用,常用于GH和IGF-1轻度升高的患者,剂量较大,约20%患者可达到生化缓解。溴隐亭还可改善糖代谢,美国食品药品监督管理局(FDA)批准溴隐亭速释片治疗2型糖尿病。合并糖尿病的肢端肥大症患者口服溴隐亭后糖代谢可改善。
(三)放射治疗
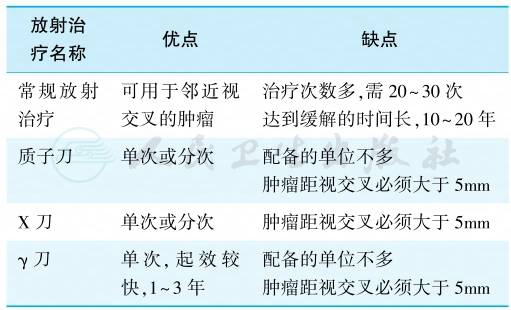
包括常规放射治疗、质子刀、X刀和γ刀,表1概括了不同方法的优缺点。放射治疗常作为辅助治疗手段。放射治疗起效慢,50%的患者需要至少8年才能使GH水平降到5μg/L以下;18年后有90%的患者能够抑制到此水平,但是GH抑制欠佳。在放射治疗效果达到最大之前,患者可能需要数年的药物治疗。多数患者还可发生下丘脑-垂体损害,在治疗后10年内发生促性腺激素,ACTH和/或TSH不足。有生育要求的患者不适合放射治疗。放射治疗的并发症主要包括脱发、脑神经麻痹、肿瘤坏死出血,垂体功能减退,偶尔可发生失明、垂体卒中和继发性肿瘤。
表1 几种不同的垂体放射治疗的比较
本症患者须长期随访。手术治疗后,患者应每3个月一次接受随访直到生化水平得到控制。其后,每半年进行一次激素评估。达到治愈标准的患者,每1~2年进行一次MRI检查。对于未能达到治愈标准的患者或需要激素替代治疗的患者,应每半年进行一次视野检查和垂体储备功能检查,每年进行一次MRI检查,并对临床表现、内分泌代谢表现进行评估。对年龄超过50岁的患者和患有息肉病的患者应进行乳房检查和结肠镜检查。













