英文名称 :aortic dissection
主动脉夹层(aortic dissection,AD)是指主动脉内膜破裂,血液从内膜破裂口进入血管中层,使主动脉管壁撕裂,形成真假两腔的一种病理改变。Morgani(1761)首次描述了主动脉夹层的特点,Lacnnce(1820)命名为主动脉夹层动脉瘤(aortic dissection aneurysm)。随后研究发现,动脉瘤是部分夹层慢性期的表现,并非所有夹层都有动脉瘤变。虽然之后有胸主动脉夹层、主动脉夹层分离等命名,但都不能概括该疾病的全部,目前统一称为主动脉夹层。Shenan(1934)全面复习并分析了300例主动脉夹层的尸检结果,对主动脉夹层的概念做出了明确定义。Gurin等(1935)首次报道通过右髂动脉开窗治疗主动脉夹层。DeBakey等(1955)首次成功施行人工血管替换术治疗主动脉夹层。Wheat阐明了主动脉夹层发病的血流动力学机制,并建立了将抗高血压药物和β-受体阻滞剂用于主动脉夹层的治疗学模式。Dake等(1994)首先尝试用支架型人工血管腔内修复主动脉夹层,目前已经在全世界范围广泛开展,革新了主动脉夹层的治疗方法。
主动脉夹层起病与多种因素有关,从作用时间来说包括先天性与后天性两类因素。从作用性质来说包括内因与外因两方面,内因导致主动脉壁结构强度降低,外因引起主动脉壁受力增加。
1.先天性因素
先天性因素主要对主动脉壁结构起作用,多种遗传性疾病导致其性质改变,强度降低。
(1)马方综合征(Marfan syndrome,MFS)
MFS是一种常染色体显性遗传病,可引起动脉扩张和主动脉夹层分离、晶体异位以及一系列的皮肤、肌肉、骨骼异常,大动脉异常是最常见的临床表现。MFS是由位于15号染色体上的原纤维蛋白1(fibrillin-1,FBN1)基因突变引起。FBN1是一个具有多个结构域的糖蛋白,是细胞外微纤维的主要成分。目前认为四种可能因素导致马方综合征发生:①正常的 FBN1表达下降;②FBN 1在保持弹性纤维稳定性上有重要作用,突变的蛋白破坏了组织弹性纤维的稳态;③FBN 1基因突变增加了FBN 1对蛋白水解酶的敏感性,使其变得易于被降解;④FBN1的缺欠可以造成TGF-β的过度激活和信号转导方面的调控失衡。
(2)埃勒斯-当洛综合征(Ehlers-Danlos syndrome,EDS)
EDS是一组以关节运动过度、皮肤伸展过度及组织脆性增加为特点的遗传性结缔组织疾病。它包括一系列综合征,但只有Ⅳ型EDS患者其未成年的死亡危险增加。EDS的血管表现是Ⅲ型前胶原基因(ProcollagenⅢ)发生突变造成的。动脉中Ⅲ型胶原整合成中膜的弹力层及外膜的胶原网,它的基因突变可引起动脉壁结构缺陷。
(3)主动脉瓣二叶畸形(bicuspid aortic valve,BAV)
BAV可能是引起动脉扩张的最常见的先天性异常,其发生率在0.9%~20%之间。在尸检发现的主动脉夹层患者中,8%的患者属于BAV。组织学研究发现瓣膜上动脉弹性蛋白退化。对此类患者进行超声心动图检查发现,即使在年轻人中主动脉根部的扩张也很常见。BAV呈家族聚集性并且在患者的一级亲属中有9%的发病率。BAV的基因定位还没确定。
(4)无症状性家族性胸主动脉瘤及主动脉夹层分离
研究表明大约19%的胸主动脉瘤或主动脉夹层患者有其他家族成员同时患病。在大多数家系中,表现为表型不同的显性遗传,尤其是发病年龄显著不同。这种家族性的动脉瘤及主动脉夹层已证实定位于5和11号染色体的长臂,具体位置尚未确定。
2.后天性因素
后天性因素主要以外因的形式起作用。
(1)高血压
高血压是最重要的后天性病因。高血压患者使胸主动脉滋养血管血流减少,可导致细胞外基质成分加速降解、凋亡,动脉壁弹性组织消退和胶原蛋白变形。血压突然增高可增加血管内膜切应力,导致血管内膜和中膜撕裂。
(2)动脉粥样硬化
动脉粥样硬化在夹层发生中的作用有争议,部分研究认为它可导致主动脉壁结构缺陷,发生内膜和壁间溃疡,促进夹层发生。但部分研究认为动脉粥样硬化的全层炎症反而使主动脉三层结构黏合成整体,可起到阻碍血管壁撕裂的作用。
(3)妊娠
年轻妇女发生夹层者,50%发生在妊娠过程中。妊娠本身并不会促进夹层发生的情况,妊娠发生夹层者多数存在主动脉根部增宽超过4cm,这提示这部分患者本身即存在主动脉壁结构的缺陷。妊娠过程中先兆子痫导致的高血压可能促进夹层发生。
(4)吸毒
吸毒是夹层发生的另一个危险因素。可卡因可提高血管的交感神经活性,引起血压升高,两者共同导致血管壁的剪切力加大。吸毒后血压急剧变化,长期作用引起内膜撕裂,发生夹层。
(5)外伤
车祸、高空坠落等外伤可造成主动脉夹层,发生部位多位于主动脉峡部,这与主动脉峡部较为固定,外伤时动脉剧烈牵拉有关。
(6)医源性损伤
医源性主动脉夹层通常与创伤性、逆行性介入手术有关,或发生于瓣膜、动脉的术中、术后,或亦与动脉内球囊反搏术有关。
流行病学调查显示,主动脉夹层的年发病率为2.9~3.5/10万。男女之间的发病率约为5∶1。发病年龄在50~60岁之间。约65%的夹层患者破口位于升主动脉,约25%的患者破口位于左锁骨下动脉以远,其余患者的破口位于主动脉弓。60%~70%的患者伴随有高血压。夹层的发病率呈昼夜和季节规律,寒冷季节清晨6~10点是高发时段。
1.分期
主动脉夹层按照距起病时间的长短分为急性期、亚急性期和慢性期,目前临床上定义发病2周内为急性期,发病2周~2个月为亚急性期,2月以上为慢性期。大部分危及生命的并发症发生在急性期。
2.分型
主动脉夹层在解剖上存在两种分型方法:即Debakey分型和Stanford分型(图1)。Debakey分型将主动脉夹层分为3型,主要用于描述夹层的累及范围:Ⅰ型夹层起自升主动脉,跨越主动脉弓,累及降主动脉或腹主动脉;Ⅱ型夹层起自并仅累及升主动脉;Ⅲ型夹层起自降主动脉并向下蔓延,仅累及降主动脉者为Ⅲa型,夹层超越肾动脉水平者为Ⅲb型。Stanford分型以近端破口发生位置作为依据,相对更为简单,分为A型和B型:Stanford A型,近端破口发生位置位于升主动脉,包括DebakeyⅠ型和DebakeyⅡ型;Stanford B型,夹层发生位置位于降主动脉,包括DebakeyⅢa型和DebakeyⅢb型。
由于Stanford A型夹层解剖位置上邻近心脏,容易并发症瓣膜和冠状动脉开口等并发症,因此传统上属于心脏外科范畴,本章节讲述的内容以Stanford B型为主。
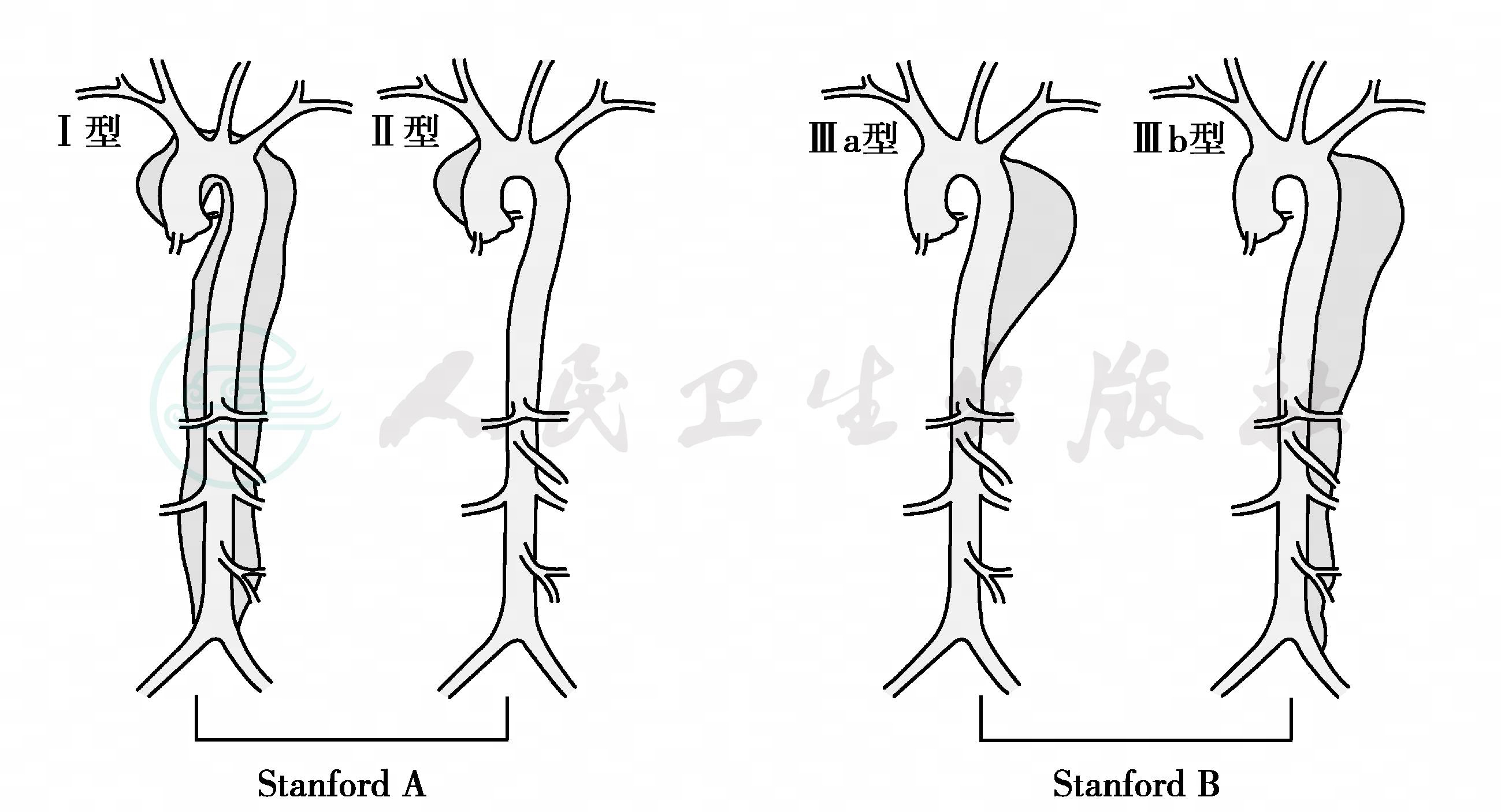
图1 夹层的两种分型:Stanford分型和Debakey分型
1.夹层的发生与进展
绝大多数夹层的起始过程是内膜的撕裂,该撕裂处即为破口(tear)。在血流冲击的作用下,血管在中膜之间形成分离,可向上或向下蔓延,血液灌注在血管的分离腔隙之间形成假腔。在血流的作用下,夹层可横向和纵向扩展,假腔扩大。假腔如果没有出口形成盲袋,压力不断升高,假腔和真腔之间的压力梯度可导致继发破口形成,这种自发的开窗(fenestration)通常发生在主动脉分支血管开口附近,如肠系膜上动脉或肾动脉。真假腔之间存在的由内膜和中膜构成的隔膜又称为内膜瓣(flap),是主动脉夹层最为特征性的结构。大部分的破口呈横向撕裂,一般只累及周径的部分。位于降主动脉的夹层,破口通常发生于左侧锁骨下动脉以远几厘米处。位于降主动脉的夹层,假腔一般往左后侧延伸,常见的情况是腹腔干动脉、肠系膜上动脉、右肾动脉起自于真腔,左肾动脉起自于假腔,但临床经常遇到各种情况的变异。大量的临床观察和动物实验显示:承受最大dP/dT(单位时间内血压的波动值,表示左心室收缩力)的主动脉段最易发生内膜撕裂。在缩舒周期内,心脏的收缩力产生的屈服应力在升主动脉和降主动脉近端处最大。收缩期血流的能量储存在主动脉壁(大部分位于以弹力纤维构成为主的升主动脉),以保证舒张期血流继续向前。这种力量的幅度主要与血压的绝对值和dP/dT相关。主动脉通过位移和弹性扩张对抗血压和dP/dT产生的作用力。这种血流的反复长期作用可导致内膜撕裂和夹层发生。
2.分支动脉灌注不良
分支动脉灌注不良是夹层发生后的常见并发症,可导致肠道、内脏和下肢缺血严重缺血,是夹层非破裂性死亡的重要原因。夹层所致的终末器官缺血即为灌注不良综合征(malperfusion syndrome)。多种原因可导致分支动脉灌注不良。值得重视的是这种灌注不良通常不是完全的,多种因素可以改变缺血程度,包括血压、夹层有无继续进展、有无继发破口形成,分支动脉内有无血栓形成等。分支动脉灌注不良有两种形式:
(1)静态阻塞(图2A):
夹层形成后,假腔在横向和纵向二维上扩展,当蔓延至分支动脉或超越分支动脉平面时,假腔即能压迫相应动脉开口。此时即可导致该动脉低灌注或者无灌注,而压迫远端的分支动脉内则因血流速度降低而极易形成血栓,堵塞血管。这种缺血很难自行缓解,除非夹层继发破口形成或分支动脉从根部撕裂(图45-17B);多数需通过手术解决。
(2)动态缺血(图2C):
部分夹层当假腔内压力较大时,真腔被压扁,无法给发自真腔的分支动脉提供足够血供;夹层隔膜甚至可被推至分支动脉开口内,从而导致分支动脉灌注不良。动态缺血是分支动脉灌注不良的主要原因,约占80%。动态缺血的严重程度与假腔径向累及范围、心搏输出量、血压、心律和外周动脉阻力等因素相关。此种缺血引起的分支动脉灌注不良常时轻时重,与假腔隔膜的移动相关。
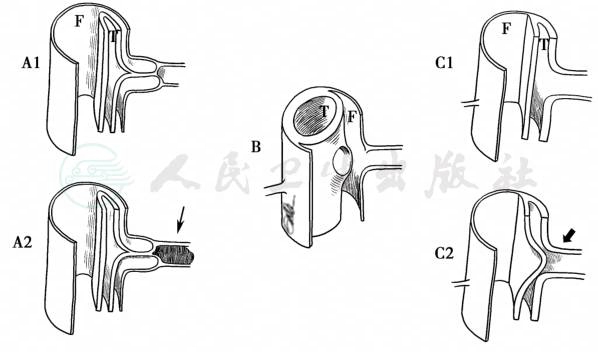
图2 分支动脉缺血示意图
A1,A2.静态缺血(箭头示分支动脉内血栓形成);B.分支动脉一旦从根部撕裂,缺血可能会缓解;C1,C2.动态缺血示意图(黑色短箭头示意收缩期分支动脉开口被隔膜堵塞)
夹层的辅助检查方法包括胸部X线片、螺旋CT、MRI、DSA、经胸超声和经食管超声等。
1.X线片
X线片对主动脉夹层的诊断价值有限。夹层在X线片的表现包括纵隔增宽、主动脉壁钙化移位和胸腔渗出等,其中纵隔增宽最为常见。胸腔渗出在B型夹层中多见,可能与出血和胸膜的炎症反应相关。在前后位的胸部X线摄片上,B型夹层主要表现为主动脉节的增大,主动脉内膜钙化斑的内移(距主动脉外缘>6mm),纵隔的增宽,左侧的胸腔积液以及左主支气管向下移位等。但仍有20%的B型主动脉夹层患者(尤其是无瘤样扩张者)无明显的X线检查异常。
2.经胸或经食管超声
包括经胸超声(transthoracic echocardiograph,TTE)和经食管超声(transesophageal echocardiography,TEE)。经胸、食管超声简单易操作,具有一定的敏感性和特异性,可作为夹层的筛查方法。但因为肋骨和胸腔内气体的干扰,诊断的准确性受到限制。经食管超声将探头放入食管直接观察,可以避免上述限制,诊断的特异性和敏感性显著升高。特别的优势是能准确地提供夹层破口的位置、真假腔、主动脉瓣有无反流等信息,可以在术中应用而不妨碍手术进行。缺点是患者有一定痛苦、费用较大。
3.CT和CTA
造影剂增强的螺旋CT是目前夹层的常规检查手段,超过半数的患者通过CT检查得到诊断。CT检查一般全天对急诊开放,检查方便迅速,敏感性和特异性能满足诊断的需要。薄层的CT扫描可以有效地鉴别真假腔、破口的位置和分支动脉受累情况等。CT三维重建能直观地提供夹层的整体形态,有助于治疗方法的选择(图3)。腔内修复(endovascular repair)时移植物尺寸的确定通常都是基于对CT扫描的测量。
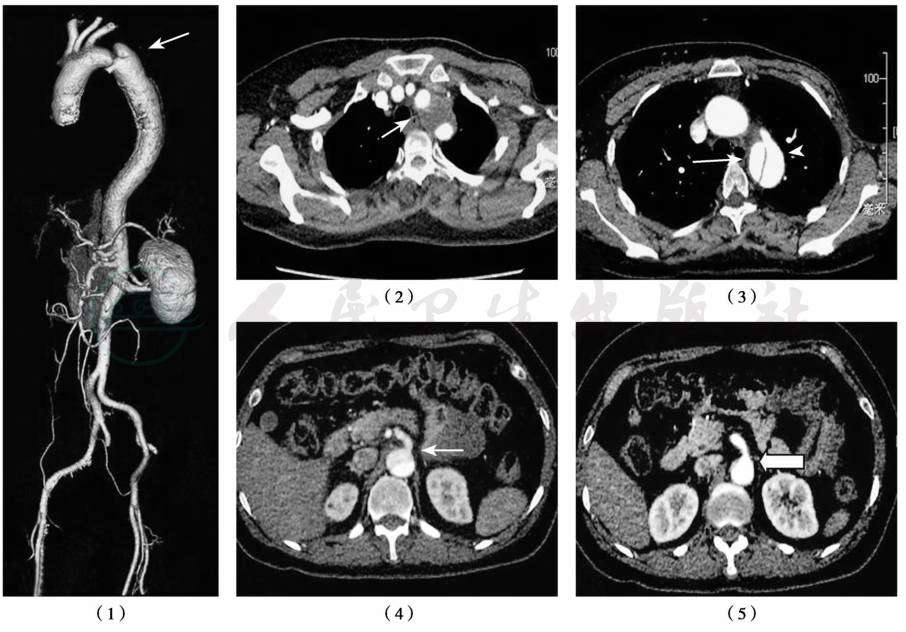
图3 术前CT检查
(1)三维重建图片(箭头示夹层);(2)主动脉弓水平横断面图像(箭头示此处假腔内有血栓形成);(3)近端破口位置(箭头示);(4)横断面示腹腔干动脉起自于真腔(箭头所示);(5)横断面示肠系膜上动脉水平见正常血管影像,假腔消失(箭头)
4.MRI和MRA
MRI诊断夹层敏感性和特异性在95%和100%之间。通过MRI检查可以明确夹层的破口、病变范围、分支动脉受累等情况,也可以准确的判别真假腔。缺点是体内置入金属物品的患者不能适用。MRI也可以通过注射显影剂获得更清晰的影像,也可以像CT一样通过三维重建获得直观的图像(MRA)。
5.DSA
CTA、MRA等检查已经能够满足常规诊断的目的,DSA造影主要应用于手术过程中。造影对于内膜撕裂部位的判断、真假腔的显示、有无夹层逆行扩展累及左锁骨下动脉,和了解内脏及肢体血供都相当理想,是夹层的腔内修复治疗必不可少的工具。
6.腔内超声(IVUS)
腔内超声常伴随DSA造影时应用,作为一种有创检查,虽然无法应用于常规诊断,但它在术前对于真假腔的判断,内膜撕裂点的确定以及了解主动脉分支动脉供血的受累情况有其独到的价值。而且在人造血管内支架置入术后即刻就可行血管内超声检查来判断疗效(图4)。
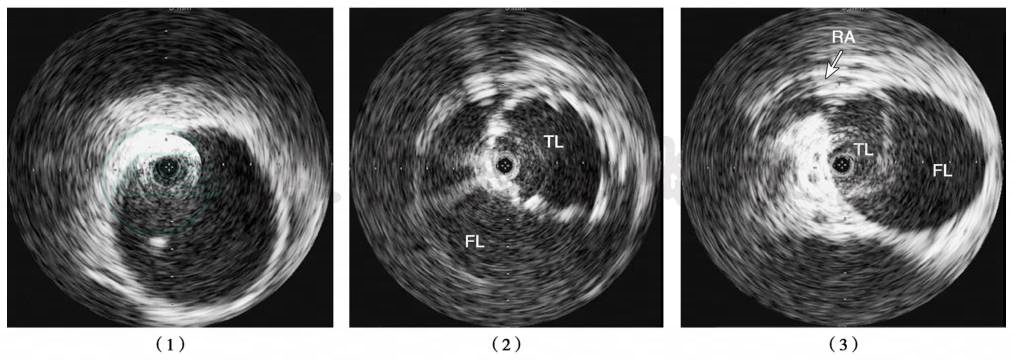
图4 IVUS检查图像
(1)升主动脉IVUS,管腔为一整体,未见假腔;(2)降主动脉图像,真腔较小(TL),位于外侧,假腔较大(FL),位于内侧;(3)内脏动脉水平影像,右肾动脉(RA)起自于真腔
1.药物治疗
药物治疗是任何夹层治疗的基础,以降压为主,镇痛、镇静等治疗为辅。
(1)降压:
最基本的治疗手段是通过药物降低体循环血压和dP/dT(反映左心室收缩力)。确切的降低体循血压和dP/dT能达到阻止夹层继续进展、减缓隔膜飘动、缓解分支动脉灌注不良和防止夹层破裂的目的。对怀疑夹层者伴有血压升高时,应迅速静脉给予降压药物。β受体阻滞剂和血管扩张药物(如硝普钠)是理想的降压组合。应在血管扩张药物之前给予β受体阻滞剂,否则血管扩张药物可引起反射性的交感神经反应,导致儿茶酚胺释放,加快心率,反而造成dP/dT升高。β受体阻滞剂可重复给药直到出现足够的β受体阻断作用(表现为心率降低至60~80次/min)。常用的β受体阻滞剂包括普萘洛尔、拉贝洛尔、艾斯洛尔、美脱洛尔等。普萘洛尔是一种非选择性β受体阻滞剂,可每5分钟静脉给药1mg(累积不超过10mg),直至起效,然后每24小时给药4~6次维持。拉贝洛尔是一种α、β受体阻滞剂,能同时达到降低dP/dT和体循环血压的作用。起始剂量是20mg,可每10分钟追加1次以达到作用,之后可用微泵维持在2~10mg/min,根据血压调整。艾斯洛尔一种短效β受体阻滞剂,半衰期只有9分钟。它的特殊作用在于可检测气道高反应性患者的β受体阻断耐受能力。美脱洛尔是一种心脏选择性β受体阻滞剂,造成气管、支气管痉挛的可能性较低,但对于有明确气道高反应患者仍需慎用。有β2受体阻滞剂禁忌证时,应考虑使用其他降低心肌收缩力的药物,如地尔硫䓬和维拉帕米。为有效降低体循环血压,可在β受体阻滞剂起效后静脉应用血管直接扩张剂硝普钠,起始剂量可为20μg/min,根据血压调整。推荐对初始治疗患者血压控制在120/80mmHg以下。有些作者甚至建议插入尿管同时监测尿量,在血容量充足尿量大于30ml/h的情况下,收缩压可控制在70~80mmHg。应当注意的是硝普钠不能长期应用,否则易致氰化物中毒。
(2)镇痛:
夹层患者常伴有剧烈疼痛,难以忍受。疼痛又可促进交感神经兴奋,导致血压升高,血压升高使夹层加快撕裂,疼痛加重,进入恶性循环。可使用阿片类强镇痛药镇痛,无效时甚至可选择冬眠疗法。但需要注意的是,给药前需要与急腹症引起的疼痛鉴别,排除肠梗阻等病变,以免掩盖症状,延误诊断与治疗。
(3)镇静:
烦躁与失眠亦可促进交感神经兴奋,血压升高。此时需注意为患者安排安静环境,防止受到刺激。必要时可给予地西泮等药物帮助睡眠。
2.腔内修复
治疗腔内修复通过将人工血管内支架(stent-graft,SG)跨越破口位置释放,封闭动脉内膜破裂、假腔内血流消失,达到假腔逐渐血栓形成夹层愈合的目的(图5),同时可解决大部分的分支动脉灌注不良。
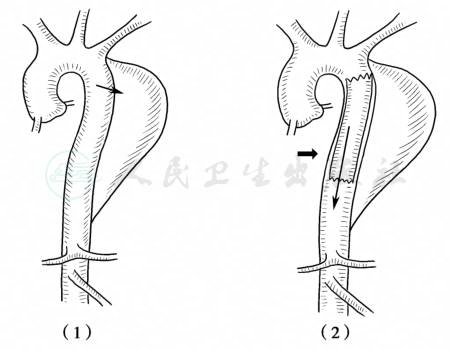
图5 夹层腔内修复示意图
(1)夹层腔内修复术前,血流经近端破口流入假腔;(2)置入人工血管内支架后(粗箭头),血流经由支架流向远端(细箭头),不再经破口冲击假腔,假腔内逐渐血栓形成
(1)适应证和禁忌证:
主动脉夹层是否适合行腔内修复应满足一定的解剖条件。传统意义上的主动脉夹层应符合下列解剖要求:①左锁骨下动脉和近端破口之间的距离即近端锚定区的长度大于15mm(如何拓展锚定区将在下面进行探讨);②有合适的入路动脉,理论上至少有一侧髂股动脉未被夹层累及,髂股动脉的直径至少大于7mm(新型人工血管内支架输送系统外径减小,股动脉最小直径可以放宽到6mm);③至少一侧肾动脉和肠系膜上动脉起自于真腔;④近端锚定区的血管直径在26~42mm之间(否则支架尺寸不匹配);⑤无严重的主动脉瓣反流。夹层根据发病时间的长段,分为急性期、亚急性期和慢性期,由于不同病期夹层的病理生理特点不同,因此腔内修复的适应证也有所区别。
急性期和亚急性期的适应证:①夹层破裂出血;②主动脉周围或纵隔血肿进行性增大;③夹层主动脉直径快速增大;④主动脉重要分支的严重缺血;⑤无法控制的疼痛和高血压。
慢性期适应证:①夹层破裂出血;②夹层主动脉直径快速增大(>10mm/年);③形成动脉瘤(直径>50mm);④主动脉重要分支严重缺血。
有这些情况者定义为不稳定的主动脉夹层或有并发症的主动脉夹层。对于稳定的Stanford B型主动脉夹层,是否需要行腔内修复治疗目前仍存在争议。近年来ISTEAD和ABSORB等前瞻性研究结果显示,对于稳定性的夹层,腔内修复治疗的突出优势是在远期随访时获得更好的假腔重塑效果。因此越来越多的专家学者支持对稳定性的夹层进行腔内修复治疗。
腔内修复治疗的禁忌证除解剖条件不满足外,其他的因素主要包括:①严重的造影剂过敏;严重的支架材料过敏;②系统性的感染(增加移植物感染的可能性)。
(2)硬件设备:
腔内修复除要求开展单位备有常规的血管外科手术器械、相应的介入器材外,主要的设备是DSA。腔内修复可在配备移动型小型DSA的手术室内进行,优点是一旦腔内修复手术失败,可立即行开胸治疗,同时也能进行杂交手术;缺点是移动式DSA的成像质量一般,同时最大视野较小。腔内修复也可在普通的安装固定式DSA的介入手术室进行,缺点是无菌标准较差,其他配备的辅助手术器械也较少。最理想的是在杂交手术进行(配备有大型固定式DSA的手术室),具有完全和常规手术室一致的无菌标准,常用手术器械配备完全;能同时进行外科手术,在单纯腔内修复无法解决问题,需要辅以外科手术(杂交手术)时尤为方便。
(3)腔内修复手术时机的选择:
腔内修复的理想手术时机是在夹层起病后2周左右。夹层急性期内血管壁水肿严重、结构脆弱,如此时置入支架,导致血管壁撕裂发生逆行A型夹层的风险较高。慢性期假腔已经瘤样扩张,动脉壁纤维化增厚,缺乏弹性,腔内修复术后假腔发生良性重构的可能性明显降低。对于有明显致死并发症出现的患者,如濒临破裂、内脏动脉严重缺血等,应当机立断进行急诊腔内修复治疗以挽救生命,而不必一味等待至发病满2周时。
(4)手术过程:
仰卧位,麻醉首选全麻麻醉。消毒的范围主要是双侧腹股沟区,对于术前考虑到股动脉细小有可能需要显露髂动脉时,扩大消毒范围至下腹部。根据术前CT检查确定腔内修复治疗的入路途径。可选用股动脉、髂动脉和甚至远端主动脉,以右侧股动脉为首选。如果股动脉的直径不到7mm,或髂动脉异常扭曲,则需要考虑经后腹膜途径直接手术暴露髂总动脉或远端腹主动脉,以建立手术的入路途经。常规途径是切开显露,直视下穿刺。切开可采用腹股沟皮纹下横行切口或者于股动脉走行上方做纵行切口。近年来,Peroglide等血管闭合装置的应用使得腔内修复治疗可在不借助外科切开的方式下进行,实现真正的完全经皮穿刺操作。在股动脉显露后或者Peroglide预置后,常规Seldinger法置入一5F血管鞘。经真腔将一5F猪尾巴导管升至内脏动脉水平进行造影,评估内脏动脉供血情况。然后将猪尾巴导管前送至升主动脉,做置入前的主动脉造影,测量主动脉直径等数据,并与术前通过CT测量的结果进行比较,确认人工血管内支架的尺寸;然后根据造影确认的分支动脉位置、大小弯位置并在屏幕上进行标记,也可以采用骨性标志作为标记。术中血液肝素化(150U/kg)使ACT保持在250~300秒之间。然后交换Lunderquist超硬导丝,经超硬导丝置换出5F血管鞘。接着将人工血管内支架输送系统顺着超硬导丝送入主动脉,在透视监视下小心地使支架前端跨越主动脉夹层近端破口。此时一手握稳外鞘,根据之前造影确认的解剖位置在透视下做释放前的最后调整,使人工血管内支架的近端位于最佳点(获得最大锚定区距离)。此时可给予静脉降压药物降低体循环血压,减少血流冲击引起的移位。然后后撤外鞘,释放支架。目前常见的人工血管内支架系统是支架与输送装置一体化的,通过不同方式后撤外鞘,简单如COOK公司的Zenith人工血管内支架是后拉式的,Medtronic公司的Captivia支架是通过旋转后侧外鞘,理论上释放更为精准。Gore公司的TAG支架和外鞘是分离式的,通过硬导丝先导入22F的外鞘,然后将人工血管内支架通过外鞘导入至目标位置,后撤外鞘,通过后拉支架上的释放线完全释放支架。人工血管内支架释放后膨胀并通过弹性扩张的力量固定在血管壁上。接下来将输送系统复位到释放前状态,整体后撤输送系统并将其完全退出体外。再次送入猪尾巴导管做置入后的主动脉造影了解支架定位情况和有无渗漏;后撤猪尾巴导管至内脏动脉水平再次造影,确认无明显内脏动脉供血障碍,撤出造影导管和动脉鞘,缝合股动脉;如果是完全经皮操作,此时收紧两把预置的Peroglide线进行止血。然后根据ACT时间判断是否需要使用鱼精蛋白中和肝素。
(5)腔内修复过程中遇到的问题与对策:
1)输送系统导入困难:
输送系统导入困难的常见原因是股动脉细小,此时可通过显露髂动脉甚至腹主动脉下端以获得足够粗的导入动脉。髂动脉钙化和狭窄也是输送系统导入困难的重要因素,可行的办法是通过球囊扩张改善入路,待手术完成后置入外周支架解决髂动脉狭窄的问题。当需要经后腹膜直接暴露髂总动脉或腹主动脉下端时,由于位置较深,直接动脉置管操作困难。可以在拟穿刺处缝上一段长20cm直径8mm的人工血管,将大大方便操作。
2)导丝无法选入真腔:
主动脉夹层腔内修复的最大难点是导丝无法通过真腔进入到升主动脉,可导致人工血管内支架远端释放入假腔的严重后果。解决的方法之一是通过CT获得详细的解剖信息,了解双侧股动脉哪一侧发自于真腔,哪些内脏动脉起自于真腔,了解假腔的走行,术中可借助这些信息判断导丝是否位于真腔。解决的方法之二是导管导丝进入腹主动脉后,不断地通过导管手推造影剂进行判断。通常假腔管腔较大,造影剂在大多数情况下流动速度较慢;真腔较为细小,有时呈一细线状,极端情况下甚至被压闭,真腔在通畅的情况下手推造影流速较快,在被假腔几乎压闭的情况下流速较慢甚至淤滞。方法三是使用腔内超声,根据腔内超声的横断面图像和显示的内脏动脉开口的位置来判断导丝是否位于真腔。其他可行的办法相对操作复杂,需要通过上肢入路来实现:①右桡动脉导入鹅颈圈套器,将由股动脉导入的导丝牵至真腔;②右桡动脉导入长导丝沿真腔至股动脉,由股动脉切口处牵出,逆行导入导管。
3)内脏动脉缺血:
动态缺血是可逆的,在人工血管内支架置入后能立即纠正。静态缺血无法在腔内修复术后得到改善。肾动脉和肠系膜上动脉缺血后果严重,在人工血管内支架置入后造影时如发现上述动脉仍未显影,需要通过置入外周金属支架加以开通。
4)内漏:
内漏是夹层腔内修复术后的常见并发症,以Ⅰ型内漏多见,其次是左锁骨下动脉反流等所致的Ⅱ型内漏。引起内漏的因素较多,常见的原因包括:①支架没有贴近左锁骨下动脉(或者左颈总动脉)释放,导致近端锚定距离不足,此时可以通过再置入一个长度较短的人工血管内支架(Cuff)在原支架近端释放。因此,通常需要备有一个以防紧急需要的Cuff。否则,这类情况一发生将会措手不及,无法一次成功完成手术。②人工血管内支架近端与主动脉的贴壁不良所致,特别是主动脉近端存在偏心性的斑块时。此时可采用球囊导管对局部做扩张,一般可以达到满意的结果。③涤纶编织的支架血管在置入后的初期对血液和造影剂仍有一定程度的通透性,不要将此误认为内漏。这种通透性可随着时间的延长、纤维的沉积而不断下降,与真正意义上的内漏较易鉴别。④左锁骨下动脉反流所致的Ⅱ型内漏,可以通过在左锁骨下根部置入封堵器或者弹簧圈进行栓塞的方式进行处理。明显的Ⅰ型内漏需要立即进行处理,内漏量较小时有自愈的可能,可随访观察内漏量的大小再决定下一步的治疗方案。
5)锚定区不足:
当夹层近端破口过于靠近左锁骨下动脉或者累及弓部时,导致近端锚定区不足,无法行常规的腔内修复治疗。可行的办法包括:①直接覆盖左锁骨下动脉:适用于近端破口距离左锁骨下动脉小于1.5cm而距离左侧颈总动脉长度大于1.5cm的情况。如果左侧椎动脉为非优势动脉且颅内Willis环完整时,可直接覆盖左侧锁骨下动脉,上肢血供丰富,可以周围侧支代偿,椎动脉可由颅内循环代偿,一般不出现缺血后果。②通过旁路术重建分支动脉血供:包括颈颈旁路和颈锁旁路。颈锁旁路适用于需要跨越左锁骨下动脉释放人工血管内支架而左椎动脉为优势动脉或者颅内Willis环不完整时。颈颈旁路适用于近端破口位于右颈总动脉和左颈总动脉之间,需要通过覆盖左颈总拓宽近端锚定区。③应用去分支技术(debranch):通过开胸重建弓上分支,适用于近端破口接近无名干动脉开口的夹层。④应用烟囱技术:其概念就是在TEVAR手术过程中,置入一端与人工血管内支架平行释放,另一端位于分支动脉内的带膜或者普通金属支架,这样人工血管内支架可以跨越分支动脉开口释放从而拓展锚定区,同时又保证了分支动脉的血供。主要适用于需要尽量往近心端释放人工血管内支架同时要保留左颈总和(或)左锁骨下动脉的情况。⑤应用原位开窗技术:就是将人工血管内支架跨越颈总动脉等弓上分支动脉释放,直接覆盖分支动脉开口,然后迅速通过预置在双侧颈动脉、左锁骨下动脉的装置在人工血管内支架上术中开窗,然后置入覆膜支架恢复弓上动脉血供,期间可以通过股动脉——颈动脉转流等方式保留头向供血。此方法适用于各种近端锚定区不足的情况,但是操作相对复杂,目前仅限于个案报道。⑥应用新型腔内修复移植物,这些移植材料的概念和设计已经提出多年,但是由于结构和操作的复杂性,目前这些移植物大都还在临床试验阶段,包括开窗支架和带分支支架。现阶段带单分支的人工血管内支架已经在国内完成了较大样本的临床试验,围术期和中短期的随访结果满意。
(6)手术相关的危险与预防措施:
1)血管损伤:
由于输送系统外径较大,而人工血管内支架本身有一定的硬度;加上动脉瘤患者多有血管扩张、扭曲,极易引起血管损伤,稍有不慎甚至可导致血管破裂。因此推送或者后撤输送系统时必须十分小心仔细。一旦发生破裂,需要根据临床情况迅速做出是继续腔内治疗还是终止手术的决定。
2)弓上分支动脉误覆盖:
为了获得足够的锚定区,有时需要紧贴左锁骨下动脉左缘甚至紧贴左颈总动脉左缘进行释放。由于支架在释放过程中主动脉移位、支架本身的跳动等因素可导致误覆盖弓上分支动脉。此时最迅速的办法是通过补救式的烟囱紧急开通弓上动脉。原位开窗也是一种可行的办法,但是操作上不如烟囱简单快捷。
3)逆行撕裂:
逆行撕裂是由于人工血管内支架向外膨胀的力量导致支架边缘受力处血管内膜撕裂,急性期常见的是近端撕裂,可逆行形成A型夹层。A型逆行撕裂多发生于手术后48小时以内,极少数病例可在支架置入后立即发生。一旦出现逆撕,即应开胸手术治疗。预防的方式是选择合适尺寸的支架,支架近端直径放大不能过多;同时尽量应该在夹层发生2周后手术,避开血管组织水肿高峰期。
3.手术治疗
近年来由于B型夹层腔内修复术广泛开展,传统手术在其治疗中的作用越来越为局限。外科手术的指征为:①夹层动脉瘤直径>6cm;②急性B型夹层病情进展或重要脏器受累;③慢性B型夹层出现血肿进展、夹层动脉渗血、有破裂出血可能、持续性疼痛和不能控制的高血压、分支动脉灌注不良慢性;④马方综合征引起的B型夹层患者。
手术治疗的禁忌证:合并恶性肿瘤或其他病变、预期寿命不超过1年、心功能衰竭、急性心肌梗死半年之内和全身感染等为手术的绝对禁忌证。
对于B型夹层,手术的主要目的:一是要消除近端破口,二是要切除瘤样病变的血管壁进行人工血管置换。对于急性期没有假腔瘤样扩张的病变,主要以近端破口位置附近的自体血管切除加人工血管置换,远端可以进行将隔膜片缝合至外膜,然后再与人工血管行端-端吻合;如果远端真假腔难以分辨,可以将隔膜片剪除部分,保证真假腔同时有血供,远端再与人工血管端-端吻合。对于慢性期有瘤样扩张的患者,主要目的是切除扩张的血管壁,可以行胸降主动脉替换+远端血管成形术或者全降主动脉人工血管置换术。总的来说,传统手术需要体外循环、手术时间长、创伤大,并发症发生率高。目前对于有解剖条件者,首选的治疗是腔内修复;在无法行腔内治疗情况下,才考虑进行外科手术治疗。













